Эффективная фармакотерапия в восстановительном периоде после ишемического инсульта
- Аннотация
- Статья
- Ссылки
- English
Введение
Цереброваскулярные заболевания представляют собой актуальную медико-социальную проблему современной медицины вследствие широкой распространенности, высокого риска смертности и глубокой инвалидизации лиц трудоспособного возраста, а также значительного экономического ущерба, который эти заболевания наносят экономикам большинства развитых стран мира [1–3]. Только в России цереброваскулярные заболевания отмечаются у 5,4 млн человек [4] и находятся на втором месте после сердечно-сосудистых болезней среди всех причин смерти населения [5].
Ишемический инсульт, на долю которого приходится около 80% всех видов острого нарушения мозгового кровообращения, – одна из ведущих причин смертности, инвалидизации и выраженной дезадаптации пациентов. При этом примерно у 2/3 [6] или 75% [7] больных обнаруживаются остаточные явления нарушений мозгового кровообращения различной степени выраженности. По данным Национального регистра инсульта, в России ежегодно регистрируется около 450 тыс. случаев заболевания, летальность достигает 35% [5], и только около 20% выживших больных могут вернуться к прежней работе [8].
Проблеме ишемического инсульта в настоящее время уделяется огромное внимание. Так, разработаны международные и отечественные рекомендации по профилактике инсульта, лечению и реабилитации больных, перенесших инсульт. В неврологических стационарах внедрены высокотехнологичные методы восстановительного лечения, значительно снижающие постинсультную летальность и улучшающие функциональные исходы, организована Национальная ассоциация по борьбе с инсультом [2, 5, 8]. Вместе с тем в последние годы наблюдается неуклонный рост числа пациентов как с острыми нарушениями мозгового кровообращения, так и с хронической цереброваскулярной патологией, причем все чаще это лица молодого и среднего возраста. В этой связи приоритетной задачей современной ангионеврологии в частности и всей системы здравоохранения в целом считается поиск оптимальных и высокоэффективных методов лечения и нейрореабилитации больных цереброваскулярными заболеваниями. Эти методы должны быть направлены не только на восстановление нарушенных функций, социальных контактов и профессиональных навыков, но и на предотвращение прогрессирования неврологических и психических нарушений [2, 8].
Основные принципы комплексного лечения ишемического инсульта включают базисную (коррекцию основных жизненно важных функций), реперфузионную (применение антикоагулянтов, антиагрегантов и тканевых активаторов плазминогена) и нейропротективную (предупреждение, прерывание и уменьшение патологического воздействия на головной мозг) терапию, нейрореабилитацию и вторичную профилактику [9].
В патогенезе сосудистых поражений головного мозга ведущая роль отводится процессам ишемии, эксайтотоксичности, апоптозу и разнонаправленному медиаторному дисбалансу: избыточной активации глутаматергической системы, с одной стороны, и недостаточной активности холинергической и ГАМКергической систем – с другой [8, 10]. С учетом указанных особенностей патогенеза в терапии больных цереброваскулярными заболеваниями активно применяются фармакологические средства, влияющие на нейромедиаторные системы. Следует заметить, что холинергическая система, широко представленная в различных отделах центральной нервной системы (ЦНС), эволюционно ограждает нейроны головного мозга от избыточных катехоламиновых воздействий, поддерживая функционирование нейрональных популяций, тесно взаимодействует с дофамин-, ГАМК- и глутаматергической системой, обеспечивая эмоциональное поведение, память и волевые акты [5, 11]. В связи с этим целесообразность влияния на холинергический аппарат ЦНС при лечении пациентов с цереброваскулярными заболеваниями не вызывает сомнений.
Ведущее значение в поддержании функционирования нейрональных структур и систем в норме и при поражении ЦНС имеет феномен нейропластичности – способность клеток нервной системы изменять как структурную, так и функциональную организацию под влиянием внешних и внутренних факторов [1, 11]. Это фундаментальное понятие также подразумевает анатомо-функциональные количественные и качественные изменения на уровне нейрональных связей и глиальных элементов, развитие новых сенсомоторных путей и интеграций в ЦНС в процессе восстановления [12, 13]. Одними из патогенетических механизмов, реализующих или тормозящих процессы нейропластичности, являются функциональные изменения нейромедиаторных систем и последующие разнонаправленные изменения активности нейрональных систем. Так, в восстановительном периоде после поражения ЦНС интенсивность нейропластических процессов возрастает при активации глутаматергических NMDA-рецепторов, норадренергических, допаминергических и серотонинергических рецепторов и, напротив, снижается или замедляется при стимуляции тормозящих ГАМКА-рецепторов [14]. Указанные патофизиологические особенности объясняют отсутствие ожидаемого улучшения нарушенных функций у больных, перенесших инсульт, после избыточно активной и ранней реабилитации [14].
Таким образом, терапевтическая стратегия в целом и выбор препарата в частности при проведении восстановительного лечения у постинсультных больных определяются благоприятным влиянием на процессы нейропластичности в церебральных нейрональных системах [1]. Широкий спектр лекарственных средств оказывает стимулирующее или ингибирующее влияние на процессы пластичности в головном мозге сразу после нарушения кровообращения и в дальнейшем на протяжении всего восстановительного периода. Эффективность препарата определяется как распространенностью и локализацией очага поражения, так и сроками проводимой терапии, ее взаимодействием с другими лечебными мероприятиями [12].
Нейропротекция в постинсультном периоде
В современной медицинской практике единственным критерием, позволяющим аргументировать назначение тех или иных препаратов, становятся данные клинических исследований, выполненных в соответствии с принципами Надлежащей клинической практики (Good Clinical Practice) [15]. В частности, рациональное лечение, эффективность которого подтверждена в ходе таких исследований, включает проведение тромболизиса и антиагрегантной терапии [16]. Наиболее перспективным направлением, которое активно разрабатывается в последние годы отечественными исследователями, можно назвать нейроцитопротекцию. Это система мероприятий, повышающих резистентность организма к экстремальному воздействию и положительно влияющих на функциональную активность клеток головного мозга, что имеет не только терапевтическое, но и профилактическое значение у пациентов с цереброваскулярной патологией [16].
Нейропротекция – стратегически важное и патогенетическое направление в лечении пациентов с нарушением мозгового кровообращения с первых часов инсульта и на протяжении всего восстановительного периода [1]. Накоплен значительный опыт применения препаратов различных фармакологических групп с потенциальными цитопротективными свойствами, влияющими на дофаминергическую, глутаматергическую, ГАМКергическую и холинергическую систему. Среди средств холинотропного ряда наиболее фармакологически эффективными и востребованными в терапии цереброваскулярных заболеваний считаются препараты, точка приложения которых локализована на пресинаптическом уровне или уровне холинэстераз [15]. Этим требованиям отвечает препарат Церепро (холина альфосцерат), хорошо зарекомендовавший себя на нейрофармакологическом рынке.
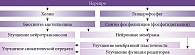
Препарат Церепро – холиномиметик центрального действия, содержит 40,5% метаболически защищенного холина, в организме под действием ферментов расщепляется на холин и глицерофосфат (рисунок). Холин участвует в биосинтезе ацетилхолина в пресинаптических мембранах холинергических нейронов, основная масса которых сосредоточена в коре головного мозга, мозжечке, базальных ганглиях, таламусе и гиппокампе. Глицерофосфат является предшественником фосфолипидов (фосфатидилхолина) нейронной мембраны и миелина. Таким образом, холина альфосцерат (Церепро), участвуя в анаболических процессах фосфолипидного и глицеролипидного синтеза, оказывает положительное влияние на функциональную активность мембранных структур клеток, обеспечивая их матричные функции за счет увеличения массы органелл (рибосом и митохондрий) и улучшая мембранную пластичность (см. рисунок) [16, 17].
Следует заметить, что резкое снижение метаболизма фосфолипидов и соответственно их пула с последующим повреждением мембран нейронов наблюдается при многих патологических состояниях ЦНС, играет ключевую роль в формировании разнообразных патофизиологических реакций. В частности, в возникновении эксайтотоксического каскада и запуска механизмов программируемой гибели клеток (апоптоза), развитии ишемии, гипоксии и нейродегенерации, а также вазогенного и травматического отека головного мозга [18, 19]. В связи с этим использование лекарственных средств, способных восстанавливать мембрану церебральной клетки и ее компоненты, – одно из самых перспективных направлений цитопротекции при ишемическом инсульте. Важным преимуществом препарата Церепро (холина альфосцерата) по сравнению с другими пресинаптическими холинотропными средствами является прямое сохранение, а возможно, увеличение и депонирование эндогенного пула ацетилхолина, миелина и фосфолипидов [17]. Указанное свойство обусловливает целесообразность применения Церепро у больных после церебрального инсульта.
Клиническая эффективность и переносимость холина альфосцерата при лечении пациентов с цереброваскулярными заболеваниями активно изучаются отечественными исследователями [5, 15, 16, 17, 20]. Показано, что холина альфосцерат увеличивает резистентность нейронов к ишемическому воздействию, улучшает кровоток и усиливает метаболические и репаративные процессы в очаге ишемии, активирует структуры ретикулярной формации, оказывая положительное влияние на познавательные и поведенческие реакции, и нормализует баланс медиаторов в ЦНС [5, 17].
В многоцентровом двойном слепом рандомизированном плацебоконтролируемом исследовании была показана достоверная эффективность и безопасность применения препарата Церепро у 103 больных (средний возраст 61,17 ± 8,12 года) в остром периоде (в первые 48 часов) впервые возникшего в каротидном бассейне ишемического инсульта. Тяжесть неврологического дефицита составила от 10 до 20 баллов (включительно) по шкале тяжести инсульта Национального института здравоохранения США (National Institutes of Health Stroke Scale – NIHSS). Препарат Церепро назначался по схеме: первые десять дней внутривенно в дозе 2000 мг в сутки с последующим внутримышечным введением в дозе 1000 мг в сутки в течение десяти дней. У пациентов, получавших Церепро в сочетании с базисной терапией, отмечался более значимый регресс неврологической симптоматики (гемианопсии, пареза, атаксии и афазии) и бóльшая положительная динамика функционального исхода согласно индексу Бартел по сравнению с группой, получавшей плацебо вместе с базисным лечением [15].
В другом исследовании с участием 60 больных в раннем восстановительном периоде после ишемического инсульта в бассейне разных мозговых артерий был продемонстрирован хороший эффект восьминедельной терапии препаратом Церепро более чем у половины пациентов (65%), очень хороший – у 11,7% и удовлетворительный – у 23,3% больных. Оценка эффективности и безопасности лечения осуществлялась с помощью Краткой шкалы оценки психического статуса (Mini Mental State Examination – MMSE), индекса Бартел, шкалы общего клинического впечатления (Clinical Global Impression – CGI).
На фоне лечения препаратом Церепро уменьшилась выраженность пареза, координаторных и астенических нарушений, улучшились когнитивные функции, настроение, мобильность больных и их способность к самообслуживанию [20]. Препарат хорошо переносился.
Представляют интерес данные отечественного исследования эффективности, переносимости и безопасности применения препарата Церепро у пациентов, перенесших ишемический инсульт четыре – шесть месяцев назад (n = 60), и у больных с хронической ишемией головного мозга (n = 30) [5]. Прием Церепро осуществлялся в первые десять дней внутривенно капельно в дозе 1000 мг в сутки, далее на протяжении шести недель перорально в дозе 1200 мг в сутки. Все пациенты также получали базисную медикаментозную терапию по стандартам оказания медицинской помощи. Установлен достоверный ноотропный эффект препарата в виде улучшения познавательных функций (внимания, запоминания и воспроизведения информации), показано уменьшение выраженности астенического синдрома и улучшение фона настроения [5]. Результаты лечения оценивались до и после окончания внутривенного введения препарата, а также по завершении перорального приема Церепро с помощью известных клинических шкал MMSE, Гамильтона, CGI и методики оперативной оценки самочувствия, активности и настроения. Следует отметить бóльшую эффективность лечения в группе пациентов в раннем восстановительном постинсультном периоде за счет уменьшения когнитивных и координаторных нарушений при отсутствии серьезных нежелательных явлений, требовавших дополнительных мер [5].
Таким образом, безопасность, эффективность и хорошая переносимость препарата Церепро (холина альфосцерат) у больных острой и хронической недостаточностью кровообращения головного мозга были подтверждены в нескольких отечественных исследованиях [5, 15, 16, 20]. При этом показан достоверный эффект улучшения нарушенных функций не только у больных в остром и раннем восстановительном периодах после ишемического инсульта, но и у пациентов с хронической ишемией головного мозга.
Несмотря на существующее мнение о наиболее интенсивном восстановлении нарушенных функций в первые три – шесть месяцев после нарушения мозгового кровообращения, у значительной части пациентов положительная динамика процессов восстановления наблюдается на протяжении более длительного периода (в течение двух и более лет) [12, 21, 22]. Это происходит как вследствие спонтанного восстановления, так и на фоне проводимых в это время реабилитационных мероприятий [23], что позволяет осуществлять нейрореабилитацию постинсультных больных и в более поздние сроки [23, 24]. Вместе с тем процессы нейропластичности, характерные для раннего развития и для подострой фазы после инсульта, ограничены и со временем замедляются [1]. Поэтому важно искать пути расширения так называемого терапевтического окна и/или его удлинения с целью оптимизации восстановления после ишемического инсульта. Существенное влияние на степень восстановления нарушенных функций у пациентов после инсульта оказывают различные методы физической и нейропсихологической реабилитации, правильный уход и междисциплинарный принцип ведения. При этом важную роль в комплексной реабилитации больных после инсульта играет своевременное и адекватное медикаментозное лечение [2].
Можно заключить, что холина альфосцерат (Церепро) – эффективный нейропротектор, применение которого патогенетически оправданно не только у больных, перенесших острое нарушение мозгового кровообращения, на протяжении всего восстановительного периода, но и у пациентов с хронической ишемией головного мозга. Препарат может быть рекомендован для использования в комплексной терапии больных с цереброваскулярными заболеваниями на всех этапах стационарной и амбулаторной реабилитации.
Методы лечения постинсультной депрессии
Нейрореабилитация больных после нарушения мозгового кровообращения является одним из наиболее важных медицинских направлений современного здравоохранения. Вместе с тем к числу факторов, отрицательно влияющих на реабилитационный потенциал и дальнейшее восстановление нарушенных функций у больных с инсультом, относятся изменения в психоэмоциональной сфере и сфере высших психических функций: депрессия и деменция после инсульта [25].
Постинсультная депрессия была впервые описана в 1980 г. как одно из возможных осложнений инсульта [26]. До сегодняшнего дня депрессивные расстройства у больных после нарушения мозгового кровообращения представляют значительный интерес для исследователей в связи с высокой встречаемостью как самого инсульта, так и постинсультной депрессии, которая отмечается приблизительно у каждого третьего больного [27].
Депрессивные нарушения затрудняют оценку неврологического статуса у больных после инсульта, достоверно снижают эффективность реабилитационных мероприятий и значительно ухудшают качество жизни и социальную адаптацию [27, 28]. При выраженной депрессии после инсульта медленнее восстанавливаются нарушенные функции, у больных наблюдается больше осложнений, выше показатели смертности, пациенты хуже привержены профилактике повторных сосудистых эпизодов [28]. Именно поэтому важно диагностировать и своевременно начать соответствующее лечение психических нарушений.
Патофизиологические механизмы развития депрессии после нарушения мозгового кровообращения гетерогенны и до конца не изучены. Вместе с тем показано, что в основе постинсультной депрессии лежат дисбаланс функциональной активности нейромедиаторных систем и дефицит биогенных аминов [27]. В некоторых работах была продемонстрирована достоверная корреляция между развитием выраженной депрессии и снижением уровня серотонина. И напротив, коррекция содержания этого нейромедиатора у больных после инсульта вела к регрессу выраженности у них эмоциональных расстройств [27, 28]. Таким образом, применение препаратов, нормализующих обмен серотонина, у пациентов после инсульта патогенетически оправданно.
В клинической практике последние годы все чаще используются селективные ингибиторы обратного захвата серотонина (СИОЗС), поскольку они обладают широким спектром действия, высоким профилем безопасности и переносимости. Это делает предпочтительным их назначение при длительном курсовом лечении, наличии соматической патологии и пожилым пациентам. Один из препаратов группы СИОЗС – пароксетин (Адепресс) характеризуется безопасностью, хорошей переносимостью, высокой эффективностью и низкой частотой нежелательных явлений при длительном лечении, что связано с отсутствием взаимодействия с альфа-1-адренергическими, H1-гистаминовыми и мускариновыми рецепторами [29]. Следует отметить, что удобный режим приема препарата (один раз в сутки) и выраженный тимоаналептический эффект Адепресса способствуют приверженности пациентов после инсульта назначенной терапии. Это важно, поскольку длительность курса лечения постинсультной депрессии составляет не менее полугода. В основе благоприятного влияния СИОЗС на функциональную активность нейрональных систем головного мозга, вероятно, лежит их способность стимулировать выработку мозговых нейротрофических факторов и в конечном итоге усиливать процессы нейрональной пластичности [30].
Вместе с тем недостаточный клинический эффект применения патогенетически оправданных препаратов различных фармакологических групп или его отсутствие у больных после инсульта могут быть обусловлены рядом факторов: поздним назначением лекарственного средства, неадекватными дозами и/или длительностью его приема и отсутствием эффективной базисной и реперфузионной терапии [1]. Безусловно, одним из основных критериев выбора препарата при проведении восстановительного лечения у постинсультных больных считается благоприятное воздействие на процессы нейропластичности тканей головного мозга [15]. Сегодня ангионевролог должен хорошо знать не только показания и противопоказания к назначению различных лекарственных средств, но и фармакокинетику, фармакодинамику и особенности взаимодействия разных препаратов. С учетом высокой распространенности депрессии после инсульта, ее значения для прогноза и функционального восстановления рекомендуется проводить скрининг на наличие психоэмоциональных расстройств у всех пациентов, перенесших острое нарушение мозгового кровообращения, в случае необходимости им должна быть назначена антидепрессивная терапия.
Заключение
Медикаментозная поддержка восстановительного процесса после нарушения мозгового кровообращения – важное направление нейрореабилитации. Вместе с тем, несмотря на существование большого арсенала реабилитационных технологий, целый спектр разнообразных методик и лекарственных средств, процент инвалидизации и социальной дезадаптации пациентов после ишемического инсульта остается достаточно высоким [13]. Это обусловливает необходимость дальнейшего всестороннего изучения механизмов компенсаторных процессов в ЦНС после инсульта для создания новых препаратов и разработки новых методов, позволяющих улучшить эффективность реабилитационных мероприятий, снизить распространенность и выраженность постинсультной инвалидизации.
Е.V. Еkusheva
I.M. Sechenov First Moscow State Medical University
Contact person: Eugenia Viktorovna Ekusheva, ekushevaev@mail.ru
Here, basics of therapy for patients in rehabilitation period after ischemic stroke are discussed. The results of numerous clinical studies demonstrated efficacy, safety and good tolerability of Cerepro (Choline alfoscerate) in patients after impaired cerebral circulation. Such therapy is pathogenetically justified as it stimulates neuroplasticity processes. Importance of diagnostics and further correction of post-stroke depressive disorders for prognosis and functional recovery of post-stroke patients was shown. Use of Adepress (paroxetine) is pathogenetically justified and characterized by safety, good tolerability, high efficacy and low rate of side effects during long-term therapy of post-stroke depression.