Инфекционные осложнения у первичных больных лимфомой Ходжкина
- Аннотация
- Статья
- Ссылки







Многочисленные клинические исследования выявили наилучшие комбинации химиопрепаратов и оптимальное сочетание лучевой и химиотерапии для лечения этих больных. Современные программы лечения позволяют прожить без признаков возврата болезни 80% пациентам. Эффективность лечения определяется строгим выполнением лечебных протоколов. Однако это положение запланированного лечения порой вынужденно нарушается из-за развития осложнений, что влияет на непосредственные и отдаленные результаты. Частой причиной нарушения программы лечения является инфекция, которая нередко играет важную роль в прогнозе заболевания и определяет до настоящего времени одну из наиболее серьезных проблем для стационара любого профиля (1). Инфекции отягощают проведение противоопухолевой терапии более чем у половины больных и являются одной из основных причин смерти этих пациентов в профильных отделениях.
По публикациям крупных исследовательских центров, до 10% больных лимфомой Ходжкина умирают от инфекционных осложнений, которые занимают четвертое место среди причин смертности у этих пациентов (2, 3, 4, 5). Важной составляющей успеха лечения являются своевременная диагностика инфекционного осложнения и адекватно спланированная противовоспалительная терапия, благодаря чему могут быть улучшены результаты противоопухолевого лечения и снижена летальность.
Инфекции могут вызываться как облигатными патогенами, так и оппортунистическими возбудителями, а при нейтропении до 50% инфекций вызываются госпитальными штаммами микроорганизмов. Эти микроорганизмы являются более резистентными к большинству используемых антибиотиков. В разных стационарах в зависимости от проводимой терапии и основной патологии формируется своя экосистема, характеризующаяся преобладанием в разные периоды времени различных возбудителей (6). Это диктует необходимость изучения таксономической структуры внутрибольничных инфекций.
Данные о чувствительности и специфичности методов диагностики инфекций при болезни Ходжкина противоречивы. Результаты наблюдений, публикуемые зарубежными авторами, не отражают состояние проблемы в нашей стране, поскольку заболеваемость у нас и за рубежом определяется различной эпидемиологической обстановкой, диагностическими подходами и тактикой лечения. Поэтому поиск рациональных подходов к профилактике и лечению инфекционных осложнений у этих пациентов продолжает волновать врачей.
Цель исследования
Авторами проанализированы инфекционные осложнения и выявлены факторы риска их возникновения в группе первичных больных лимфомой Ходжкина. Эти результаты помогут решению нескольких задач:
- позволят оптимизировать мониторинг больных лимфомой Ходжкина, предрасположенных к развитию инфекции;
- создадут возможность разработки диагностического алгоритма инфекционных осложнений;
- использование этих критериев позволит прогнозировать течение и исход инфекционных осложнений как амбулаторно, так и в стационаре, что обеспечит проведение протоколов лечения. И в итоге можно надеяться на улучшение отдаленных результатов лечения и качества жизни пациентов.
Материалы и методы исследования
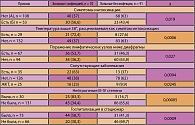
В исследование включены первичные больные лимфомой Ходжкина (161 пациент), получившие лечение под наблюдением РОНЦ с 1998 по 2006 гг. Мужчин было 66 (41%), женщин – 95 (59%). Для выбора адекватного объема лечения и в соответствии с рекомендациями GHSG (German Hodgkin’s lymphoma Study Group – Германская группа по изучению лимфомы Ходжкина) больные были разделены на три прогностические группы: благоприятную (21 больной), промежуточную (45 больных) и неблагоприятную (96 больных). При проведении анализа были выделены две подгруппы (таблица 1).
I подгруппу составили 70 (43,5%) больных лимфомой Ходжкина, у которых имели место инфекционные осложнения; II подгруппу составил 91 (56,5%) больной, у которого за весь период лечения и наблюдения эпизодов инфекции зафиксировано не было.
Для больных благоприятной прогностической группы запланированная программа лечения включала 4 цикла полихимиотерапии по схеме ABVD (адриамицин (доксорубицин) 25 мг/м2 в 1-й и 14-й дни в/в, блеомицин 10 мг/м2 в 1-й и 14-й дни в/в, винбластин 6 мг/м2 в 1-й и 14-й дни в/в, ДТИК – имидазол-карбоксамид, дакарбазин, детисен – 375 мг/м2 в 1-й и 14-й дни в/в. Перерыв между циклами 2 недели) или CVPP (циклофосфан 600 мг/м2 в 1-й и 8-й дни в/в, винбластин 6 мг/м2 в 1-й и 8-й дни в/в, прокарбазин 100 мг/м2 с 1-го по 14-й дни ежедневно внутрь, преднизолон 40 мг/м2 с 1-го по 14-й дни ежедневно внутрь). Перерыв между циклами 2 недели. Затем облучение зон исходного поражения в дозе 30-36 Гр.
Больным промежуточной прогностической группы было запланировано 6 циклов полихимиотерапии по схемам ABVD или CVPP и облучение зон исходного поражения в дозе 30-36 Гр.
У больных неблагоприятной прогностической группы план лечения включал 8 циклов полихимиотерапии по схеме ВЕАСОРР-базовый (циклофосфан 650 мг/м2 1-й день в/в, доксорубицин 25 мг/м2 1-й день в/в, этопозид 100 мг/м2 1-3-й дни в/в, прокарбазин 100 мг/м2 1-7-й дни внутрь или дакарбазин 375мг/ м2 1-й день в/в, преднизолон 40 мг/м2 1-14-й дни внутрь, винкристин 1,4 мг/м2 и блеомицин 10 мг/м2 8-й день в/в. При замене прокарбазина на дакарбазин схема получала название BEACODP) ± облучение зон исходно больших опухолевых массивов и/или остаточных опухолевых масс.
Непосредственные результаты противоопухолевого лечения анализировались в соответствии с дополнениями, принятыми в Cotswald и рекомендациями ВОЗ. Отдаленные результаты лечения оценивались по следующим критериям:
- Общая выживаемость (OS – overal survival) рассчитывалась от даты начала лечения до смерти от любой причины или до даты последней явки больного.
- Выживаемость, свободная от неудач лечения (FFTF – freedom from treatment failure) рассчитывалась от начала лечения до любой «неудачи» лечения или до даты последней явки больного.
Оценка непосредственных осложнений лечения проводилась в соответствии со шкалой токсичности по критериям CTC-NCIC (Common Toxicity Criteria NCIC) (7). Статистическая обработка материала производилась при помощи программ математической обработки данных Statistica, версия 6.0 на основе созданной базы данных. Оценка включала корреляционный анализ, построение кривых выживаемости по методике Kaplan-Meier и оценку достоверности различий выживаемости тестом log-rank.
Результаты
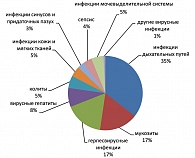
Анализ структуры инфекционных осложнений показал, что за период наблюдения с 1998 по 2006 гг. во всей группе больных лимфомой Ходжкина преобладали инфекции дыхательных путей, частота выявления которых составила 35,6%, мукозиты и герпетические инфекции наблюдались с одинаковой частотой – 16,7% наблюдений, вирусные гепатиты составили 8,3% случаев. Остальные инфекции (колиты, уроинфекции, инфекции кожи и мягких тканей, сепсис, инфекции синусов и придаточных пазух носа, паротит) выявлялись с меньшей частотой (от 3 до 6% наблюдений) (рисунок 1).
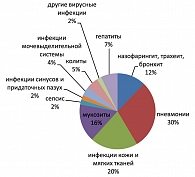
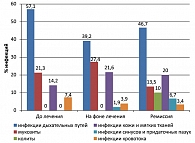
В структуре инфекционных осложнений у больных с неблагоприятным прогнозом также преобладали инфекции дыхательных путей, составляя 42% наблюдений, из них 30% составили пневмонии, 12% – инфекции верхних дыхательных путей. Мукозиты были выявлены у 16% пациентов, инфекции кожи и мягких тканей у 20% больных, герпетические инфекции – у 7%. Уроинфекции, вирусные гепатиты, инфекции синусов и придаточных пазух (СПП), колиты составили от 2 до 7% наблюдений на всех этапах течения заболевания (рисунок 2).
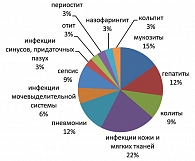
Частота инфекционных осложнений в благоприятной и промежуточной прогностических группах больных лимфомой Ходжкина оказалась одинакова (по 33,3%) (см. таблицу 1), что позволило объединить этих пациентов для последующего анализа. У 22% этих пациентов наблюдались инфекции кожи и мягких тканей, в 15% случаев имели место мукозиты, часто диагностировались гепатиты (12% наблюдений) и пневмонии (12% случаев). Другие инфекции (колиты, инфекции мочевыделительной системы, инфекции синусов и придаточных пазух) выявлены у 3-9% больных (рисунок 3).
Предрасполагающим фактором к развитию инфекции у больных лимфомой Ходжкина является значительный дефект функциональной активности иммунной системы. Нарушения иммунитета определяются еще до начала лечения, т.к. первичной и основной локализацией поражения являются лимфоидные органы (8, 9). Между тем к возникновению инфекций предрасполагает и наличие других факторов.
При анализе общей группы больных лимфомой Ходжкина инфекция была выявлена у 70 (43,5%) из 161 пациента. У 91 (56,4%) больного инфекционные осложнения не отмечались. При анализе были определены факторы риска развития инфекционных осложнений (таблица 2).
Из таблицы 2 видно, что инфекции при наличии симптомов интоксикации возникли у 56,6% больных и реже (37%) – в группе пациентов без симптомов интоксикации (р = 0,019). Необходимо отметить, что только лихорадка выше 38° С сочеталась с последующими эпизодами инфекции (у 72,4% против 37% больных, у которых этого симптома не было, р = 0,0006).
При анализе отмечено, что инфекционные эпизоды чаще выявлялись у больных при поражении лимфатических узлов ниже диафрагмы, по сравнению с пациентами при вовлечении в опухолевый процесс лимфатических коллекторов только выше диафрагмы, соответственно 53,7% и 36,2% наблюдений, р = 0,027.
Инфекции чаще наблюдались и у больных с сопутствующей патологией по сравнению с пациентами без таковых (соответственно 63% и 38%, р = 0,009). Особого внимания заслуживают сопутствующие заболевания желудочно-кишечного тракта (ЖКТ), которые имели место у 23% больных с инфекционными осложнениями и у 9,9% пациентов без инфекционных осложнений, р = 0,0245.
В исследуемой группе пациентов важным фактором риска развития инфекционных осложнений является нейтропения. У 161 больного лимфомой Ходжкина нейтропения III-IV степени развилась в 70 (5,7%) случаях, и в 26 из них (37,1%) выявлена инфекция, р = 0,00005.
Еще одним фактором риска развития инфекционных осложнений для этих больных явилось лечение в стационаре. Планово госпитализировались в стационар 75 больных, и инфекционные осложнения развились более чем у половины (58,7%) из них, в то время как из 66 больных, не лечившихся в стационаре, инфекция была диагностирована лишь у трети пациентов (30,3%), р = 0,0009.
При оценке непосредственного эффекта лечения выявлено, что полная ремиссия достигнута реже (72,9%) у пациентов с инфекционными осложнениями по сравнению с группой без инфекционных осложнений (91,2%), р = 0,0024. Неудачи лечения отмечены у 48,6% больных с инфекцией и лишь у 13,2% пациентов без инфекции, р = 0,00005 (таблица 3).
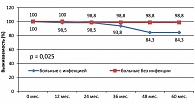
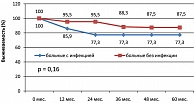
Отдаленные результаты лечения (рисунок 4) оказались хуже при развитии инфекционных осложнений: 4-летняя общая выживаемость (OS) в группе с инфекцией и без инфекции составила соответственно 84,3% и 98,8%
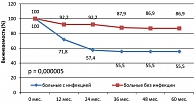
Также различалась и 4-летняя выживаемость, свободная от неудач лечения (FFTF) – 55,5% в группе больных с инфекцией и 86,9% в группе больных без инфекции, р = 0,000005 (рисунок 5).
Были проанализированы факторы риска инфекционных осложнений в группах с различным прогнозом. Важным фактором риска, предрасполагающим к возникновению инфекций в группе больных лимфомой Ходжкина с неблагоприятным прогнозом, остается нейтропения. Инфекционные осложнения, развившиеся в разные периоды лечения и наблюдения, были выявлены на фоне нейтропении III-IV степени, р = 0,0001 (таблица 4).
В нашем исследовании показано, что инфекции чаще наблюдались у больных и при наличии симптомов интоксикации. Из всех симптомов интоксикации наибольшего внимания заслуживает «повышение температуры выше 38°С». Наличие этого симптома в дебюте заболевания нередко ассоциировалось с возникновением инфекции. В группе с неблагоприятным прогнозом инфекции возникали в 70,8% у больных, имеющих лихорадку выше 38°С, расцениваемую как симптом интоксикации. В то же время у больных без данного симптома инфекции выявлялись в 43,7% наблюдений, р = 0,024 (таблица 4). Это обстоятельство является важным и предполагает тщательное обследование пациента до начала противоопухолевой терапии с целью раннего выявления инфекционного очага. А симптомы интоксикации, отмечающиеся у больных лимфомой Ходжкина, могут считаться фактором риска возникновения инфекционных осложнений.
Полученные результаты свидетельствуют о том, что больные с локализацией опухолевых лимфатических узлов ниже диафрагмы чаще инфицировались, чем пациенты с поражением лимфатических узлов выше диафрагмы, р = 0,048 (таблица 4). Выявленная закономерность диктует необходимость рассматривать этих больных в группе риска развития инфекции.
Фактором риска инфекционных осложнений у этих пациентов оказалось и стационарное лечение. Инфекционные осложнения развились у 86,5% больных, планово госпитализированных в стационар для проведения противоопухолевого лечения хотя бы однократно, и лишь у трети (13,5%) пациентов, ни разу не получавших лечения в стационаре.
Обращает на себя внимание и тот факт, что у первичных больных лимфомой Ходжкина с сопутствующей патологией органов ЖКТ вероятность развития инфекционного осложнения выше, чем у пациентов без таковой. Хочется отметить, что в проведенном исследовании патология органов ЖКТ чаще диагностирована на основании анамнеза при первичном обследовании пациентов и в меньшей степени подтверждалась применением инструментальных методов. Можно предположить, что количество больных с такой патологией было больше, чем о том свидетельствуют полученные результаты. На это обстоятельство указывает и тот факт, что заболевания органов ЖКТ могут быть без выраженных клинических симптомов, и больной не знает о наличии у него гастрита, язвенной болезни и т.д. Поэтому всем первичным больным лимфомой Ходжкина, помимо тщательного сбора анамнеза, целесообразно рекомендовать проведение исследования ЖКТ.
При оценке непосредственного эффекта лечения показано, что полная ремиссия достигнута у 70 (73,7%) из 95 больных, при этом чаще в группе без инфекции по сравнению с группой больных с инфекционными осложнениями – 85,1% и 62,5% соответственно, р = 0,01. Неудачи лечения констатированы в 37,9% наблюдений (у 36 из 95 больных). В группе больных с инфекцией неудачи лечения отмечены в 29 (60,4%) случаях, а в группе без инфекции – в 7 (14,9%) наблюдениях, р = 0,00001 (таблица 5).
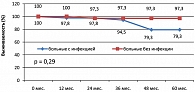
При анализе отдаленных результатов лечения выявлено, что четырехлетняя FFTF у больных с инфекцией составила 45,3%, без инфекции – 89%, р = 0,00005 (рисунок 6). Отмечена тенденция к снижению 4-летней OS у больных с инфекцией: OS в группе больных с инфекцией составила 79,3%, без инфекции – 97,3%, р = 0,29 (рисунок 7).
В группе больных лимфомой Ходжкина с благоприятным и промежуточным прогнозом факторами риска развития инфекционных осложнений оказались симптомы интоксикации, нейтропения III-IV степени и стационарное лечение (таблица 6).
При анализе выявлено, что инфекции при наличии симптомов интоксикации возникали у 66,7% больных, чаще, чем у пациентов без симптомов интоксикации (28%), р = 0,025. При этом наиболее важным оказалось только повышение температуры выше 38° С. Инфекционные осложнения развились и у 66,7% больных, лечение которых осложнилось нейтропенией III-IV степени, и лишь у 28% пациентов без нейтропении, р = 0,025 (таблица 6).
Сведения о стационарном или амбулаторном лечении имелись у 63 больных этих групп. Инфекции наблюдались у половины пациентов, госпитализировавшихся в стационар хотя бы один раз, и у 20,5% больных, получивших амбулаторное лечение, р = 0,018.
При оценке непосредственного эффекта лечения в этой группе больных выявлено, что полная ремиссия достигнута одинаково часто в группах с инфекцией и без инфекции – 95,5% и 97,7%, соответственно (р > 0,05). Также не получено различий в неудачах лечения (таблица 7). Отсутствие статистически значимого отличия в группе больных с ранними стадиями может быть объяснено небольшим числом пациентов и короткими сроками наблюдений во всех группах.
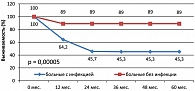
При анализе отдаленных результатов лечения, как 4-летняя OS, так и FFTF (рисунки 8 и 9), при наличии инфекции оказались хуже (92,9% и 77,3% соответственно) по сравнению с группой больных без инфекции (100% и 87,5% соответственно).
Обсуждение
По литературным данным, у первичных больных лимфомой Ходжкина к возникновению частых инфекций предрасполагает наличие многих факторов риска, таких как нейтропения (10, 11), нарушение клеточного иммунитета (10), нарушение гуморального иммунитета (10), повреждение физических барьеров, различные медицинские манипуляции.
Различные нарушения иммунитета у этих больных определяются уже до начала лечения. Наиболее часто выявляется лимфоцитопения, которая обусловлена в основном уменьшением числа CD4+ Т-лимфоцитов, сопровождающимся к тому же снижением их функциональной активности. Повышенной восприимчивости больного к инфекции способствуют дефекты мононуклеарно-фагоцитарной системы или Т-лимфоцитов. Нарушения Т-клеточного иммунитета повышают предрасположенность пациентов к грибковым, вирусным (вирус герпеса, цитомегаловирус) и внутриклеточным (листерия, сальмонелла) патогенам, к пневмоцистным пневмониям (8, 12).
В противоположность угнетению Т-клеточного иммунитета, функция В-лимфоцитов и гуморальный иммунитет до начала лечения не страдают. Однако у больных с большой массой опухоли и выраженными симптомами интоксикации нарушение способности генерировать специфические антитела, нейтрализующие патогены, встречается чаще (8, 9). Пациенты с подобными дефектами гуморального иммунитета склонны к инфекциям даже при нормальном числе нейтрофилов. Чаще всего у них бывают инфекции, вызванные инкапсулированными патогенами (стрептококки, гемофильная палочка, нейссерия).
Химиотерапия и облучение способны дополнительно повреждать функции Т- и В-лимфоцитов, что приводит к снижению их опсонизирующей активности, способности лизировать бактерии и нейтрализовать бактериальные токсины. Обычно при цитостатической терапии имеет место снижение содержания хелперных Т-лимфоцитов, и нередко лимфопения регистрируется в течение нескольких месяцев после окончания химиотерапии, в то время как показатели нейтрофилов, моноцитов и тромбоцитов восстанавливаются значительно быстрее. Длительная деплеция Т-лимфоцитов также обуславливает повышенный риск развития многих инфекций. Угнетение как Т-, так и В-клеточного иммунитета сохраняется длительное время после окончания лечения лимфомы Ходжкина, по данным Van Rijswijk с соавторами – в течение 2-3 и более лет (5). Продукция IgA, IgG и IgE снижается незначительно и кратковременно. Показатель сывороточного IgM остается длительное время существенно низким (5, 9).
Другим важным фактором, предрасполагающим к развитию инфекционных осложнений у больных лимфомой Ходжкина, является нейтропения. Кроме количественного уменьшения имеют место и качественные изменения функций нейтрофилов – нарушение хемотаксиса, фагоцитоза и реализации бактерицидных свойств. В некоторых случаях, при сохранении нормального фагоцитоза, наблюдается дефект миграционных свойств лейкоцитов и хемотаксиса, в том числе и до начала специфического лечения (13, 14, 15). Активированные тканевые макрофаги представляют важный элемент защиты от таких внутриклеточных микроорганизмов, как микобактерии, листерии, бруцеллы и токсоплазмы. В случае повреждения функции макрофагов, фагоцитарной и миграционной функций нейтрофилов, процессов хемотаксиса, что наблюдается при проведении лучевой терапии и при лечении кортикостероидами, первичная резистентность организма в отношении многих патогенов значительно снижается (16).
К факторам риска возникновения инфекционных осложнений относятся и симптомы интоксикации, нередко отмечающиеся у больных лимфомой Ходжкина. Особое внимание следует обратить на наличие у больного в дебюте заболевания повышения температуры, особенно выше 38° С, расцениваемого как симптом интоксикации. Наличие этого симптома чаще других ассоциируется с возникновением инфекции или может быть одним из симптомов инфекции. В этой ситуации необходимо проводить дифференциальную диагностику и дообследовать пациента для исключения инфекционной природы лихорадки. В клинических ситуациях, когда единственным симптомом является фебрильная лихорадка, необходимо провести весь комплекс обследования с целью поиска очага инфекции, включая микробиологическое исследование подозрительных на инфекцию участков. У больных с нейтропенией в подобных ситуациях необходимо начать эмпирическую противомикробную терапию, не дожидаясь результатов микробиологического исследования. После получения результатов при необходимости модифицировать проводимую терапию. Наличие инфекции уже до начала лечения особенно характерно для больных с распространенными стадиями заболевания (неблагоприятной прогностической группы) и прогрессирующим течением болезни после многократных курсов химио- и лучевого лечения (8, 9).
Большая роль в возникновении инфекционного осложнения отводится объему и локализации опухоли. Многофакторный анализ причин частоты инфекционных осложнений, проведенный в ГУ РОНЦ им. Н.Н. Блохина у больных лимфомой Ходжкина, показал, что инфекции чаще возникают у больных с распространенными III-IV стадиями заболевания (р = 0,001), с массивным поражением средостения (р = 0,00001) и с симптомами интоксикации (р = 0,004), т.е. у пациентов неблагоприятной прогностической группы по критериям GHSG (р = 0,03), которые получили бóльший объем полихимиотерапии (1). Частота бактериальных инфекций увеличивается с увеличением объема опухолевой массы: р = 0,8 при сравнении благоприятной и промежуточной прогностических групп, р = 0,004 для промежуточной и неблагоприятной групп, р = 0,002 для благоприятной и неблагоприятной групп, но р = 0,00015 при объединении благоприятной и промежуточной прогностических групп и при сравнении с неблагоприятной группой (1).
Поврежденная слизистая оболочка может стать входными воротами для микроорганизмов, обычно вегетирующих в полости рта, в частности, для представителей группы зеленящих стрептококков, Capnocytophaga spp. и др. Литературный поиск показал, что имеются серьезные расхождения между специалистами по вопросу о том, полезны ли «рутинно» выделяемые культуры для клиницистов. По сути, эти культуры демонстрируют лишь колонизацию больных. В то же время присутствие золотистых стафилококков или Aspergillus spp. в носовых ходах, резистентных грамотрицательных палочек в зеве или области ануса, массивная колонизация Candida spp. в зеве или прямой кишке, должны быть ориентиром для врача при выборе терапии у больных с фебрильной нейтропенией.
Применение препаратов, снижающих секрецию в желудке (блокаторов Н2-рецепторов гистамина) и нарушающих «колонизационную резистентность» (антибиотиков широкого спектра действия), ведет к культивированию госпитальных патогенов. Примером могут служить диагностируемые штаммы резистентных грамотрицательных палочек, энтерококков или грибов. Кишечная проницаемость может значительно усиливаться при назначении цитостатиков или при вирусном поражении кишечника.
В последние 40 лет появилась новая группа инфекций – внутрибольничные или нозокомиальные инфекции. Они могут вызываться как облигатными патогенами, так и оппортунистическими возбудителями, а при нейтропении до 50% инфекционных осложнений вызываются госпитальными штаммами микроорганизмов. При этом важную роль играют глубина и длительность нейтропении (17). Риск возникновения нозокомиальной инфекции резко возрастает при нарушении нормальных анатомических барьеров, включающих неповрежденные кожные покровы, ротоглотку, респираторный тракт, ЖКТ и мочеполовые пути. Международные исследования по состоянию резистентности к антибиотикам в Европе указывают на тенденцию роста резистентных штаммов микроорганизмов, что нередко обусловлено непродуманной политикой использования антибиотиков (18, 19). Изучение микробного пейзажа возбудителей инфекций у больных гематологического отделения при разных нозологических формах, знание характера и уровня резистентности микроорганизмов к антибиотикам, применение результатов доказательных исследований по сравнительной оценке эффективности антимикробных препаратов представляют важнейшие составные части успеха лечения (20).
Данные, представленные в литературе, в отношении частоты и структуры инфекционных осложнений при лечении пациентов лимфомой Ходжкина разноречивы. В исследованиях разных авторов показано, что основными видами осложнений являются инфекции дыхательных путей (бронхиты, трахеиты, трахеобронхиты, пневмонии), ангиогенные инфекции, инфекции мочевых путей, кожи и мягких тканей. В наших наблюдениях отмечена подобная структура локальных очагов инфекции (рисунок 10 ).
Литературные данные и наши наблюдения свидетельствуют о том, что в условиях значительного прогресса в лечении лимфомы Ходжкина стала актуальной проблема инфекционных гепатитов. Распространенность гепатитов В и С среди пациентов с онкогематологическими заболеваниями варьирует в широких пределах: гепатита В – от 0 до 47,4%, гепатита С – от 1 до 43% (21). С одной стороны, необходимость проведения полихимиотерапии и гормонотерапии резко повышают риск развития у них инфекционных осложнений. В результате возникает необходимость в прерывании лечения пациентов этой категории. Это снижает эффективность терапии, приводя к повышению частоты рецидива. С другой – вирусный гепатит в ремиссии лимфомы Ходжкина может представлять угрозу здоровью пациента, приводя в дальнейшем к формированию у него цирроза печени и гепатоцеллюлярной карциномы (22). Гепатиты у больных лимфомой Ходжкина могут быть обусловлены широким спектром иных инфекционных агентов, среди них:
- неспецифические поражения при генерализованных инфекциях (23); грибковые заболевания (24, 25) и вирусные инфекции, в том числе ЦМВ (26);
- вирусы простого и опоясывающего герпеса (26, 27);
- аденовирусы (28).
У 5% пациентов наблюдается сочетание лимфомы Ходжкина с туберкулезом, однако туберкулиновая реакция (реакция Манту) часто бывает отрицательной (1). Учитывая выше изложенное, исследование показателей функции печени было включено в обязательный диагностический алгоритм. Эти мероприятия должны выполняться как до начала противоопухолевого лечения, так и на всех этапах ПХТ. При выявлении повышенных печеночных ферментов в сыворотке крови необходимо провести дифференциальную диагностику токсических и вирусных гепатитов методом ПЦР.
Таким образом, представленные результаты анализа свидетельствуют о том, что инфекции часто наблюдаются у первичных больных лимфомой Ходжкина. Показано, что важен анализ структуры инфекционных осложнений не только в общей популяции больных гематологических стационаров, но и при различных нозологических формах, в частности, при лимфоме Ходжкина, а также на различных этапах лечения болезни и дальнейшего наблюдения за больным.
Опыт работы клиники показал, что изучение динамики спектра основных возбудителей, структуры и частоты инфекционных осложнений помогает определить профилактику, стратегию и тактику их своевременного и адекватного лечения, что позволяет сократить количество вынужденных изменений протоколов полихимиотерапии.
Рациональные подходы к выделению факторов риска инфекционных осложнений, разработка, внедрение методов диагностики обеспечивают своевременное начало терапии инфекций – это реальный путь к повышению эффективности лечения и улучшению качества жизни первичных больных лимфомой Ходжкина (29).
