Клинические возможности мультипробиотиков в практике педиатра. V Всероссийская научно-практическая конференция по детской гастроэнтерологии и нутрициологии. Сателлитный симпозиум компании «Фармамед»
- Аннотация
- Статья
- Ссылки


Дисбиоз кишечника: смена устоявшегося общепринятого взгляда
В 1681 г. Антони ван Левенгук, обнаружив микроорганизмы в фекалиях, выдвинул гипотезу о совместном существовании различных видов микроорганизмов в желудочно-кишечном тракте (ЖКТ). Вторая половина XIX в. ознаменовалась развитием новой отрасли естествознания и медицины – микробиологии. Ее научные основы были заложены Л. Пастером, Р. Кохом, И.И. Мечниковым и др. На современном этапе широкое распространение получили серологические методы, в основе которых лежит изучение антител и антигенов с помощью реакций «антиген – антитело», определяемых в сыворотке крови, а также тканях организма. Развитие молекулярно-генетических методов исследования, основанных на изучении метагеномики и анализе ДНК, ознаменовало начало новой эпохи в изучении кишечной микробиоты. Интерес к данной теме не ослабевает и сегодня. Подтверждение тому – множество научных исследований и публикаций в мире.
В начале 2000-х гг. произошли изменения в терминологии: привычный термин «микрофлора» заменили термином «микробиом» для обозначения коллективных геномов микробиоты. Внедрение в 1999 г. метода секвенирования ДНК (определения нуклеотидной последовательности) генов 16S РНК позволило установить, что только 10% микрофлоры кишечника культивируется. Данные международных исследований изменили прежние представления о микробиоте человека. Ее стали рассматривать как сообщество разных микроорганизмов. В настоящее время считается, что, чем разнообразнее представительство микроорганизмов, тем более здоровый организм.
В последние годы в лабораторную диагностику были внедрены новые высокоэффективные гибридизационные технологии и физические методы исследования: метод газовой хроматографии с масс-спектрометрией, молекулярно-генетические методы на основе мультипраймерной полимеразной цепной реакции (ПЦР), биочипные технологии, ПЦР-гель электрофореза в градиенте денатурации, основанный на сиквенс-специфическом разделении полученных методом ПЦР ампликонов гена рРНК.
Бактериологический метод исследования кала на дисбактериоз, до сих пор широко применяемый в отечественной клинической практике, не дает даже приблизительного представления о действительном разнообразии кишечной микробиоты. Возможности культурального метода исследования кишечного содержимого в отношении оценки состояния микробиоты крайне ограниченны. Не случайно в большинстве стран культуральные исследования микробиома не проводят с 2007 г.
Микробиом кишечника участвует в формировании как местного (активация продукции иммуноглобулинов класса A, фагоцитарной активности), так и системного иммунитета. Наличие бактерий в кишечнике обеспечивает постоянный антигенный тренирующий эффект. Микробиом человека представлен бактериями, вирусами, грибами, простейшими. Расшифровкой генома бактерий, населяющих ЖКТ, занимается Европейский консорциум MetaHIT. Уже расшифровано около 3 млн генов, что примерно в 150 раз превышает набор генов человека.
Согласно данным Национального института здоровья США (National Institutes of Health – NIH), только 10% клеток, входящих в состав организма человека, являются собственно человеческими клетками, остальные 90% принадлежат бактериям, населяющим разные биотопы человека. На питание микрофлоры расходуется около 20% питательных веществ, поступающих в кишечник, и 10% энергии.
Результаты исследований показали, что по составу микрофлоры людей можно разделить на три энтеротипа, каждый из которых включает множество видов бактерий, независимо от места проживания, состояния здоровья или возраста. Ученые объединили популяции бактерий в кластеры и назвали их по доминирующему роду. Bacteroides превалируют у первого энтеротипа, Prevotella – у второго, Ruminococcus – у третьего.
Представители кластеров характеризуются определенными функциональными особенностями. Энтеротип Bacteroides отличается активностью в отношении гидролиза углеводов и белков. Можно предположить, что лица, относящиеся к первому энтеротипу, реже страдают атеросклерозом (либо его начало приходится на более старший возраст). Условно патогенные бактерии рода Prevotella в процессе жизнедеятельности разрушают защитный слизистый покров, что скорее всего приводит к дефектам слизистой оболочки кишечника. Ruminococcus, наоборот, улучшают всасывание углеводов и повышают уровень сахара в крови. Они синтезируют фолиевую кислоту и витамин B11.
Таким образом, знание энтеротипа позволит прогнозировать особенности обмена веществ и предрасположенность к конкретным заболеваниям.
Докладчик отметила, что у каждого человека кишечная микробиота – динамически меняющееся сообщество микробов. Смена энтеротипа способна приводить к развитию разных заболеваний. Раньше считалось, что микробы, населяющие организм человека, в большинстве своем враги. Сегодня доказано, что человек и микробы – партнеры.
Много лет дисбактериоз кишечника был одним из самых популярных диагнозов, особенно среди педиатров. Емкая по своей сути концепция дисбактериоза претендует на одну из базисных позиций в эволюции представлений о микробном симбиозе и его болезнетворном потенциале. Проблема обросла множеством иллюзий и требует осмысления.
Особенно важным в педиатрической практике представляется вопрос сохранения естественной микробиоты новорожденного. Раннее необоснованное назначение антибиотикотерапии, применение бактериофагов значительно травмируют состояние микробиома ребенка, вызывая трудно корректируемые нарушения и осложнения в более старшем возрасте. Так, использование антибиотиков у ребенка в возрасте до двух лет повышает риск развития ожирения начиная с пяти-шестилетнего возраста, а также воспалительных заболеваний кишечника. В большинстве случаев нарушения микрофлоры и пищеварительная дисфункция у детей раннего возраста обусловлены начальными проявлениями пищевой аллергии, в частности на молоко, и не требуют коррекции антибиотиками и бактериофагами. Нарушения купируются при изменении пищевого поведения кормящей матери или замене молочной смеси гидролизатом.
Сегодня в медицинском сообществе продолжаются дискуссии по поводу формирования кишечной микробиоты, первоначального заселения микрофлоры кишечника. Обсуждаются вопросы стерильности ЖКТ при рождении, контакта с микробиотой матери при родах, формирования микробиоты на фоне операции кесарева сечения, внутриутробного контакта с полезной микробиотой, возможности попадания бактерий из кишечника матери в грудное молоко.
В российском исследовании (2004 г.) в качестве материала бактериологического исследования использовали ткани ЖКТ и брыжеечных лимфатических узлов плодов на 22-й и 24-й неделе гестации. Анализ данных продемонстрировал, что до 22-й недели гестации ткани плода стерильны, а с 24-й недели в желудке, тонкой и толстой кишках появляются кишечная палочка и бифидобактерии. Ученые сделали вывод, что микрофлора плода формируется во второй половине гестации вследствие бактериальной транслокации2.
Таким образом, к факторам, влияющим на становление кишечной микробиоты у младенцев, относятся микрофлора матери (вагинальная, кишечная, кожная), окружающая среда, способ родоразрешения, гестационный возраст, антибиотикотерапия матери и ребенка, характер вскармливания. Так, при оперативном родоразрешении (кесарево сечение) значительно изменяются характер и качество первичной микробной колонизации и впоследствии нарушается формирование микробиоценоза кишечника, что повышает риск развития аллергии у ребенка. Родоразрешение путем кесарева сечения приводит к необратимым изменениям в иммунной системе, поскольку ребенок, не проходя через родовые пути матери, не получает «микробного удара», активизирующего иммунную систему. Задержка микробной колонизации кишечника вызывает необратимые изменения иммунной системы.
Как правило, на третьей-четвертой неделе жизни отмечаются минимальные пищеварительные дисфункции. Одним из потенциальных маркеров воспаления кишечника может служить уровень фекального кальпротектина. Кальпротектин – воспалительный белок, который отражает степень гранулоцитарной инфильтрации слизистой оболочки, свойственной воспалению. В первые три месяца жизни у детей уровень фекального кальпротектина повышен. Результаты исследования у детей первых месяцев жизни с младенческими кишечными коликами и без них показали повышенный уровень кальпротектина у всех детей без исключения, что косвенно подтверждает наличие слабой степени воспаления слизистой оболочки кишечника в этом возрасте. Однако уровень кальпротектина у детей с кишечными коликами более чем в два раза превышал таковой у детей контрольной группы. С помощью молекулярно-генетического метода авторы установили, что у всех детей с коликами имеют место дисбиотические изменения, в частности чаще присутствует Klebsiella. На основании полученных данных был сделан вывод о важной роли альтерации кишечной микробиоты и связанного с ней воспаления слизистой оболочки кишечника в генезе кишечных колик у младенцев3.
Следовательно, дисбиоз кишечника у детей может быть обусловлен агрессией условно патогенной флоры, снижением микробного разнообразия и утратой полезных микроорганизмов.
Результаты исследований последнего десятилетия изменили представления и о стерильности грудного молока. В грудном молоке обнаружено свыше 700 видов микроорганизмов, включая вирусы, а также некоторые макромолекулы окружающей среды, попадающие в молоко путем бактериальной транслокации. При этом микробиом грудного молока изменяется в разные сроки лактации. При снижении микробного разнообразия грудного молока один из микроорганизмов начинает превалировать, что способствует развитию воспаления4.
Микробиота грудного молока у женщин, перенесших операцию кесарева сечения, менее разнообразна, чем у женщин после естественных родов, – стафилококки преобладают над бифидобактериями. Уровни иммуноглобулина A в молозиве у женщин после кесарева сечения значительно ниже, чем у женщин после естественных родов. Следовательно, родоразрешение путем кесарева сечения не только нарушает микробный состав кишечной микробиоты младенцев, но и непосредственно влияет на обеспечение жизненно важного иммунитета детей, находящихся на грудном вскармливании5.
Микробиота реализует свои функции в составе микробно-тканевого комплекса. Бактерии содержат на своей поверхности лектины, ответственные за специфическую адгезию к эпителию. Своеобразие рецепторов генетически детерминировано у каждого индивидуума. В пределах микробно-тканевого комплекса между микроорганизмами и эпителием кишечника происходит постоянный обмен генетическим материалом, регуляторными молекулами, фрагментами структурных генов, плазмидами6.
Установлена связь между нарушением микробиома и аллергией, аутоиммунными, сердечно-сосудистыми, метаболическими, неврологическими и психиатрическими заболеваниями. Снижению риска нарушений кишечной микробиоты у детей способствует применение пребиотической и пробиотической терапии. Известно, что нарушение ранней колонизации кишечника и снижение разнообразия микрофлоры предшествуют развитию аллергии. По данным разных авторов, взаимодействие микробиоты кишечника с пре- или пробиотиками эффективно в профилактике атопического дерматита у детей.
Эксперты Всемирной аллергологической организации (World Allergy Organization – WAO) рекомендуют матерям и новорожденным в дородовой и послеродовой периоды при высоком риске развития аллергии использовать пробиотики. Необходимо определить, какие отклонения в колонизации кишечника новорожденного или в функции микробиоты важны в этиологии аллергических заболеваний7.
В последнее время наблюдается огромный рост числа детей, страдающих аллергией. У детей с IgЕ-ассоциированной экземой фекальная микробиота в первый месяц жизни менее разнообразна, чем у детей без аллергии8. Кроме того, снижение микробного разнообразия кишечника является типичным признаком развития воспалительных заболеваний кишечника (язвенный колит, болезнь Крона) у взрослых и детей9.
Профессор И.Н. Захарова отметила, что использовать пробиотики у детей раннего возраста можно только при соблюдении ряда требований. Применяемые в педиатрической практике производственные штаммы должны характеризоваться:
- отсутствием патогенности, человеческим происхождением;
- антагонистической активностью по отношению к патогенным и условно патогенным микроорганизмам;
- жизнеспособностью, обусловленной устойчивостью к воздействию кислот и ферментов ЖКТ;
- способностью прочно адгезироваться на слизистой оболочке толстой кишки;
- стабильными генетическими данными, в частности отсутствием R-плазмид (внехромосомных генетических элементов, детерминирующих множественную устойчивость к антибиотикам). Плазмидные фрагменты ДНК, содержащие R-гены, опасны из-за их вероятного распространения на другие микроорганизмы в нормальной флоре.
В клинической практике, как правило, используются три группы пробиотиков: бифидобактерии, лактобациллы и Saccharomyces boulardii. Они оказывают трехуровневый эффект – люминальный, эпителиальный и иммунный. Люминальный эффект предполагает конкурентное ингибирование адгезии патогенов, антимикробный эффект, продукцию органических кислот, синтез перекиси водорода, продукцию бактериоцинов, влияние на уровень pH кишечного содержимого. Эпителиальный эффект обеспечивают барьерная функция, синтез муцина, секреция секреторного IgA, инактивация токсинов к рецепторам. Иммунный эффект достигается за счет модуляции выработки цитокинов (фактора некроза опухоли альфа (ФНО-альфа), интерферона гамма, интерлейкина (ИЛ) 12 и нормативных ИЛ-4, ИЛ-10), стимуляции врожденного иммунитета, модуляции дендритных клеток и моноцитов, повышенной экспрессии Fox3 + T-регуляторных клеток10.
На фоне приема пробиотиков улучшается Т- и В-клеточный иммунитет, увеличивается авидность антител крови к связыванию антигенов патогенных микробов и их токсинов, устраняется дисбаланс синтеза провоспалительных (ИЛ-1b, ИЛ-6, ИЛ-8, ФНО-альфа) и противовоспалительных (ИЛ-4, ИЛ-10) цитокинов. Различные штаммы отличаются по своим свойствам. Lactobacillus casei стимулирует синтез ИЛ-12, ФНО-бета, L. rhamnosus GG – синтез ИЛ-10 и снижает концентрацию ФНО-альфа в кале у больных атопическим дерматитом и аллергией к коровьему молоку. Bifidobacterium longum снижает синтез IgE. Наиболее доказанной клинической эффективностью и безопасностью обладает Bifidobacterium BB-12, которая положительно влияет на иммунную систему ребенка, состав кишечной микрофлоры, развитие ребенка в целом, а также демонстрирует высокую эффективность в лечении и профилактике диареи и аллергии.
Профессор И.Н. Захарова подчеркнула, что антибиотикотерапия при патологических состояниях ЖКТ в детском возрасте вызывает долгосрочные нежелательные последствия нарушения баланса микробиоты. Мультиштаммовые пробиотические препараты, оказывающие комплексное воздействие, считаются препаратами выбора при функциональных нарушениях ЖКТ у детей раннего возраста. Одним из представителей мультиштаммовых пробиотиков является Бак-Сет Беби. Это пробиотик нового поколения, созданный в Великобритании и зарегистрированный в России. В его состав входят L. casei, L. rhamnosus, L. acidophilus, B. breve, B. infantis, B. longum, S. thermophilus, а также фруктоолигосахариды в качестве пребиотиков. Все штаммы имеют оригинальное происхождение, хранятся в банке культур Соединенного Королевства.
Бак-Сет – новый мультиштаммовый мультивидовый пробиотик: данные клинических наблюдений
Перечисленных недостатков лишены мультиштаммовые пробиотики, содержащие более десяти штаммов пробиотических бактерий, устойчивых в кислой среде желудка, усиливающих и дополняющих действие друг друга.
На амбулаторной клинической базе кафедры педиатрии РМАПО было проведено рандомизированное плацебоконтролируемое исследование клинической эффективности мультиштаммового пробиотика Бак-Сет Беби (Probiotics International Ltd., Великобритания) при функциональных нарушениях ЖКТ и его влияния на метаболическую активность кишечной микрофлоры у детей раннего возраста.
В исследование были включены 45 детей в возрасте от рождения до года с функциональными нарушениями ЖКТ, возникшими при переходе на искусственное вскармливание или введении прикорма. После подписания информированного согласия родителями пациенты были рандомизированы случайным образом в основную и контрольную группы. Основную группу составили 30 детей, контрольную – 15 детей. Пациенты основной группы получали пробиотик Бак-Сет Беби по одному саше один раз в день за 15 минут до еды в течение 14 дней, а пациенты контрольной группы – плацебо (мальтодекстрин) по аналогичной схеме. Длительность наблюдения составила 21–30 дней11.
Эффективность мультиштаммового пробиотика оценивали на основании анализа динамики клинической симптоматики функциональных нарушений ЖКТ и показателей метаболической активности кишечной микрофлоры с учетом результатов газожидкостной хроматографии кала. Этот метод оценки состояния микробиоты кишечника основан на изучении метаболитов микроорганизмов, в частности короткоцепочечных жирных кислот (КЖК). По мере усиления выраженности нарушений кишечного микробиоценоза в кале снижается концентрация уксусной и повышается содержание масляной и пропионовой кислот, отклоняется анаэробный индекс в резко отрицательную область, повышается соотношение содержания изомеров кислот и кислот с неразветвленной цепью.
У новорожденных концентрация КЖК крайне низка, что связано с отсутствием или неактивностью микрофлоры. Впоследствии, при формировании кишечной микрофлоры, концентрация КЖК увеличивается. У здорового ребенка к 20–30-му дню жизни она резко возрастает до 70–80 ммоль/л. К двум годам концентрация КЖК достигает значений взрослого человека: в проксимальных отделах толстой кишки – 70–140 ммоль/л, в дистальных – 20–70 ммоль/л.
Результаты исследования показали хорошую клиническую эффективность мультиштаммового пробиотика Бак-Сет Беби в купировании функциональных нарушений ЖКТ у детей раннего возраста. Оценка состояния микробиоты кишечника, динамики лабораторных показателей на основании общего содержания КЖК продемонстрировала наличие резкой активизации анаэробных микроорганизмов, продуцирующих пропионовую и масляную кислоты (1-й тип), активизацию аэробных микроорганизмов, продуцирующих в основном уксусную кислоту, представителей факультативной микрофлоры (2-й тип). После курса лечения в группе плацебо положительных изменений не наблюдалось, а в группе пробиотика Бак-Сет Беби восстановилась метаболическая активность кишечной микрофлоры, уровень КЖК приблизился к норме.
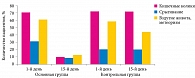
Оценка динамики симптомов функциональных нарушений ЖКТ до и после коррекции препаратом Бак-Сет Беби показала, что в основной группе проявления кишечных колик были купированы у 86% детей, срыгивания – у 70%, метеоризм – у 78%. В то же время в группе плацебо положительная динамика в отношении срыгивания, вздутия и колик была выражена незначительно (рис. 1).
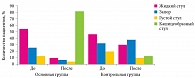
Изучены характерные особенности стула в группах до и после коррекции функциональных нарушений ЖКТ. В начале наблюдения у половины детей основной группы стул был жидкий. У 26% детей самостоятельный стул отсутствовал. Через две недели от начала приема пробиотика Бак-Сет Беби у детей основной группы отмечалась выраженная положительная динамика – у 80% детей стул стал кашицеобразным. У большинства детей группы плацебо нарушения характера стула сохранялись (рис. 2).
Таким образом, мультиштаммовый пробиотик Бак-Сет Беби характеризуется высокой клинической эффективностью, безопасностью и хорошей переносимостью. Препарат может быть рекомендован для коррекции функциональных нарушений ЖКТ у детей первого года жизни (нарушения характера и частоты стула, кишечные колики, срыгивания, метеоризм), возникающих на фоне введения прикорма, перевода ребенка на искусственное или смешанное вскармливание.
Подводя итог, Н.Г. Сугян отметила, что в отличие от отдельных штаммов мультиштаммовые пробиотики характеризуются более высокой антимикробной активностью12, поэтому успешно применяются для нормализации состояния микробиоты детей с функциональными нарушениями ЖКТ. Высокая терапевтическая эффективность, благоприятные фармакокинетические свойства, возможность использования вместе с другими лекарствами, высокий профиль безопасности, удобный режим приема делают Бак-Сет одним из наиболее оптимальных и перспективных пробиотиков в педиатрической практике.
Заключение
Мультипробиотик характеризуется высокой клинической эффективностью, безопасностью и хорошей переносимостью.
При использовании пробиотика Бак-Сет Беби не зарегистрировано нежелательных явлений или признаков непереносимости.
