Клинико-гормональные особенности синдрома поликистозных яичников при патологии щитовидной железы
- Аннотация
- Статья
- Ссылки
- English
В статье проанализирован гормональный, метаболический и репродуктивный статус пациенток с СПКЯ и сопутствующей тиреоидной патологией (гипотиреозом, диффузным зобом).
В статье проанализирован гормональный, метаболический и репродуктивный статус пациенток с СПКЯ и сопутствующей тиреоидной патологией (гипотиреозом, диффузным зобом).




В настоящее время в связи с возрастанием потребления различных химических веществ, многие из которых являются эндокринными дизрапторами, то есть обладают гормоноподобным действием, увеличивается распространенность эндокринных нарушений [1].
К наиболее часто встречающейся эндокринопатии у женщин репродуктивного возраста относится синдром поликистозных яичников (СПКЯ). Частота его встречаемости варьируется от 8 до 13% в зависимости от популяции и используемых критериев диагностики. В то же время считается, что у 70% женщин диагноз остается неустановленным.
В последние годы появились данные о связи СПКЯ с тиреоидной патологией. Аутоиммунные заболевания щитовидной железы отмечаются у 4% женщин. При высоких титрах антител к ткани щитовидной железы их распространенность повышается до 15% [2, 3]. Известно, что антитела к тиреопероксидазе (АТ-ТПО) и антитела к тиреоглобулину являются фундаментальными маркерами аутоиммунных процессов щитовидной железы.
Нарушение метаболизма половых гормонов, менструального цикла и бесплодие могут быть вызваны как тиреоидной патологией, так и аутоиммунными процессами [4–8].
Сочетание овариальной гиперандрогении с патологией щитовидной железы может приводить к ухудшению репродуктивного здоровья и снижению фертильности.
Материал и методы
Обследованы 154 пациентки с СПКЯ в возрасте от 18 до 40 лет. Их рандомизировали на три группы в зависимости от наличия/отсутствия тиреоидной патологии. Первую группу составили женщины без сопутствующей патологии щитовидной железы, вторую – с диффузным эутиреоидным зобом (ДЭЗ), третью – с гипотиреозом (рис. 1).
Для диагностики СПКЯ использовали как традиционные методы, так и специальные. В частности, определяли уровни тиреотропного гормона (ТТГ), свободного тироксина (св. T4), свободного трийодтиронина (св. T3), АТ-ТПО, антител к рецептору ТТГ, проводили ультразвуковое исследование щитовидной железы. У женщин с бесплодием состояние репродуктивной системы оценивали с учетом выявленной патологии щитовидной железы.
Полученные данные обрабатывали с использованием пакета программ SPSS 15. Для их описания применяли методы дескриптивной статистики. При сравнении результатов между группами использовали t-критерий Стьюдента, U-критерий Манна – Уитни. Значимость влияния разных патологий на характер основного заболевания определяли с помощью дисперсионного анализа ANOVA. При сравнении патологий применяли критерий Пирсона. Различия считали статистически значимыми при p < 0,05.
Результаты и их обсуждение
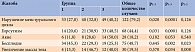
Чаще всего пациентки жаловались на нарушение менструального цикла, избыточный рост волос, бесплодие, гиперандрогению, дермопатию, ожирение (табл. 1). Женщины с гипотиреозом также указывали на сонливость (n = 26), снижение памяти (n = 31), запоры (n = 16), сухость кожных покровов (n = 33).
Установлено, что гиперандрогения может проявляться в виде дермопатий – акне или гирсутизма. Анализ данных литературы свидетельствует, что частота встречаемости акне у пациенток с СПКЯ в три раза выше, чем у женщин в отсутствие указанной патологии, – от 10 до 34% случаев. Высыпания локализуются преимущественно на лице, груди и спине [9]. Распространенность гирсутизма в рассматриваемой популяции достигает 70% [10]. Избыточный рост волос часто становится причиной снижения качества жизни, раздражительности, повышенной возбудимости, депрессивных расстройств.
Акне выявлено у 18,2% пациенток, включенных в исследование, гирсутизм – у 44%. При этом статистически значимо чаще избыточный рост волос отмечали в третьей группе.
Полученные нами данные согласуются с данными других авторов.
Среди участниц исследования 69,5% жили в городе,30,5% – в районах. 49,4% пациенток охарактеризовали свои социально-бытовые условия как удовлетворительные, 30,5% – как хорошие, 20,1% – как неудовлетворительные (туалетная комната во дворе, централизованное водоснабжение и отопление отсутствуют). Кроме того, последние имели низкий достаток.
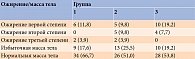
У пациенток с СПКЯ и ДЭЗ отмечалась отягощенная наследственность в отношении эндокринопатий по материнской линии (р < 0,05) (табл. 2). У них же статистически значимо чаще фиксировали нарушение менструального цикла и эндокринопатии. Необходимо отметить, что вторая и третья группы не различались по частоте заболеваний щитовидной железы. Статистически значимой разницы между группами в отношении семейного анамнеза по ожирению не обнаружено. Полученные результаты свидетельствуют в пользу генетической этиологии синдрома и его ассоциации с аутоиммунными процессами.
Менархе у обследованных женщин приходилось на возраст от 11 до 18 лет. В 36,4% случаев оно наступало в 13–14 лет. В отношении данного показателя значимой статистической разницы между группами не получено. В то же время в первой группе наступление менархе отмечалось чуть позже – в 14,7 ± 1,2 года. Доля таких пациенток составила 37,5% (р < 0,05) (табл. 3).
В отношении жалоб на увеличение массы тела статистически значимой разницы между группами не выявлено (р ≤ 0,05). Наиболее часто таковое наблюдалось у пациенток с СПКЯ и ДЭЗ.
У 40% обследованных женщин излишняя масса тела отмечалась с детства. 60% пациенток указали на увеличение массы тела с возрастом.
В первой группе индекс массы тела в среднем составил 28,90 ± 0,70 кг/м² при максимальном значении 40,00 кг/м², во второй – 28,00 ± 0,02 кг/м² при максимальном значении 41,00 кг/м², в третьей – 30,20 ± 0,10 кг/м² при максимальном значении 38,60 кг/м². Частота встречаемости нормальной и избыточной массы тела, а также ожирения представлена в табл. 4.
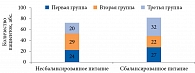
При выяснении характера питания установлено, что 81 женщина питалась сбалансированно, 73 – высококалорийными продуктами. В рационе последних отмечался избыток жареных и острых блюд, продуктов, содержащих легкоусвояемые углеводы [11–13]. Таких пациенток было больше во второй группе (рис. 2).
Данные литературы свидетельствуют о положительной корреляции между ожирением и уровнями ТТГ и Т3 у эутиреоидных пациентов. Это указывает на связь избыточной массы тела, функционирования гипоталамо-гипофизарно-тиреоидной оси, активности дейодиназ и хронического воспаления при аутоиммунных процессах и объясняет прибавку массы тела у пациенток с сочетанной патологией [14].
Важно отметить, что продолжающееся увеличение массы тела могло быть обусловлено особенностями питания.
Результаты проведенного нами дисперсионного анализа подтвердили наличие связи между характером питания и степенью ожирения, индексом массы тела и массой тела.
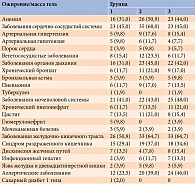
Несмотря на молодой возраст пациенток, среди сопутствующей соматической патологии наиболее часто обнаруживали заболевания сердечно-сосудистой системы и желудочно-кишечного тракта. При этом их распространенность во второй группе была выше, чем в первой и третьей группах (р ≤ 0,05).
Состояние сердечно-сосудистой системы оценивали по характеру электрокардиограммы, жалобам, динамике пульса и артериального давления.
На сердцебиение жаловались 20% участниц исследования, боль в области сердца преходящего характера – 14%, преимущественно пациентки с СПКЯ и гипотиреозом. При аускультации у них выявлены приглушенность сердечных тонов (3,1%), акцент второго тона над аортой и систолический шум в области верхушки (3,9%). Изменения на электрокардиограмме отмечались у 42 (27,3%) женщин: у 11 (21,5%) в первой группе, у 17 (33,3%) во второй, у 14 (26,9%) в третьей группе.
В третьей группе статистически значимо чаще, чем в двух других группах, отмечались заболевания гепатобилиарной системы – синдром раздраженного кишечника, гепатит, дискинезия желчных путей (р ≤ 0,05).
Анемия чаще встречалась у пациенток с СПКЯ и ДЭЗ (р ≤ 0,05).
Данные об экстрагенитальной патологии участниц исследования представлены в табл. 5.
Высокую отягощенность соматической патологией можно объяснить как худшим метаболическим профилем, так и активностью аутоиммунных процессов, нарушающих защитные механизмы иммунной системы [15].
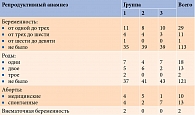
Из 154 участниц 106 (69,3%) состояли в браке, 100 (94,3%) из них жили регулярной половой жизнью. У 65 (42,5%) пациенток из 100 было диагностировано первичное бесплодие, у 35 (22,7%) – вторичное. В первой группе первичное бесплодие диагностировано у 17 (26,2%) женщин, во второй – у 22 (33,8%), в третьей группе – у 26 (40%) пациенток. Частота встречаемости вторичного бесплодия во всех группах была практически одинаковой – 13 (37,1%), 11 (31,4%) и 11 (31,4%) случаев соответственно. Первичное бесплодие чаще отмечалось у городских жительниц (р = 0,006), вторичное – у живущих в районах (р = 0,016).
В первой группе пациенток с беременностями и родами в анамнезе было больше, чем во второй и третьей (табл. 6).
Пациентки первой группы чаще страдали инфекциями, передаваемыми половым путем, и патологией шейки матки (р ≤ 0,05) (табл. 7).
Общий акушерский анамнез оказался наиболее благоприятным у женщин с СПКЯ. При сочетанной патологии репродуктивный прогноз более тяжелый [16, 17].
Согласно результатам нашего исследования, для прогноза в отношении репродуктивной функции у пациенток с бесплодием наиболее значимыми являются возраст, социально-бытовой и акушерско-гинекологический анамнез, клинические проявления гиперандрогении (гирсутное число), а также наличие сопутствующей патологии.
Результаты биохимического исследования крови пациенток согласуются с данными других авторов: для больных СПКЯ характерны метаболические нарушения – дислипидемия и гиперинсулинемия [18, 19].
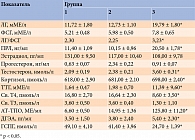
Анализ гормонального профиля свидетельствует, что самый высокий показатель соотношения «лютеинизирующий гормон/фолликулостимулирующий гормон» (ЛГ/ФСГ) был в третьей группе. Это указывает на более глубокие изменения в деятельности гонадотропных гормонов у женщин с СПКЯ и гипотиреозом. Скорее всего, изменение данных показателей в большей степени связано с гипофункцией щитовидной железы, чем с яичниковой гиперандрогенией. Подтверждением тому служит более высокая частота указанных нарушений у пациенток с гипотиреозом, чем у женщин с СПКЯ и нормальной функцией щитовидной железы. Гипотиреоидное состояние усиливает гормональный дисбаланс, что приводит к существенному повышению средних уровней кортизола и дегидроэпиандростерона (ДГЭА) и снижению уровня глобулина, связывающего половые гормоны (ГСПГ). Как следствие, увеличивается выраженность андрогенизации, усугубляются метаболические нарушения. Чрезмерная концентрация андрогенов в яичниках может способствовать преждевременной лютеинизации клеток гранулезы и препятствовать созреванию ооцитов. Аномально высокая концентрация ЛГ во время менструального цикла оказывает дополнительное негативное воздействие. Предполагают, что данный гормон обусловливает неполное созревание яичников в первой фазе цикла и слабую восприимчивость эндометрия в лютеиновой фазе [20].
Увеличение концентрации ТТГ более чем в полтора раза у пациенток третьей группы по сравнению с пациентками двух других групп и сопутствующее уменьшение уровней св. T3 и св. Т4 подтверждает вовлеченность в патологический процесс гипофиза. Гипотиреоидное состояние, по-видимому, усиливает гормональный дисбаланс. Установлено, что наиболее часто у больных гипотиреозом повышен уровень пролактина (ПРЛ), что отражает стимулирующее влияние дефицита гормонов щитовидной железы на его секрецию [21].
Механизм нарушения репродуктивной функции при сочетании СПКЯ и гипотиреоза достаточно сложный: увеличивается концентрация ПРЛ, который блокирует действие гонадотропных гормонов на яичники, уменьшается синтез эстрадиола, увеличивается соотношение ЛГ/ФСГ, что приводит к недостаточности второй фазы менструального цикла или его однофазности, снижается синтез прогестерона, следствием чего может стать невынашивание беременности или бесплодие.
Нарушение функции щитовидной железы усугубляет выраженность метаболических и гормональных нарушений у пациенток с СПКЯ. В частности, значительно снижается уровень ГСПГ, закономерно повышаются свободные фракции андрогенов яичников, концентрации ДГЭА, что в свою очередь увеличивает степень выраженности андрогенизации и потенцирует развитие инсулинорезистентности, а также дислипидемии.
Поэтому целесообразно подразделять СПКЯ на два клинико-патогенетических варианта. Первый в большей степени характерен для больных с нормальной функцией щитовидной железы. Данный вариант СПКЯ протекает на фоне яичниковой гиперандрогении. Второй вариант СПКЯ более характерен для больных с гипотиреозом. К его особенностям следует отнести не только более выраженную яичниковую гиперандрогению, но и повышенную выработку гормонов надпочечниками.
Различие гормональных и метаболических нарушений указанных вариантов СПКЯ обусловливает необходимость дифференцированного подхода к терапии.
Результаты гормонального профиля участниц исследования представлены в табл. 8. У пациенток с СПКЯ и гипотиреозом значения ЛГ, ПРЛ, тестостерона, кортизола и ДГЭА оказались значительно выше, уровень ГСПГ – самым низким. Данные показатели у женщин с СПКЯ, а также с СПКЯ и ДЭЗ статистически значимо не различались. Кроме того, в силу аутоиммунного генеза гипотиреоидного состояния пациенток третьей группы уровень АТ-ТПО у них был самым высоким.
Вывод
В отличие от женщин с СПКЯ для пациенток с сочетанной патологией характерны отягощенная наследственность в отношении эндокринопатий, неблагоприятный соматический и акушерско-гинекологический анамнез. Сочетание СПКЯ и гипотиреоза ассоциируется с более выраженной андрогенизацией. При СПКЯ и тиреоидной патологии в большей степени выражены гиперандрогения и инсулинорезистентность на фоне чрезмерной прибавки массы тела.
Отягощенный анамнез в отношении заболеваний щитовидной железы обусловливает такие поликистозные изменения яичников, как больший овариальный объем и повышенное число антральных фолликулов, что, однако, является благоприятным прогностическим критерием при оценке овариального резерва.
Ye.A. Azizova, Ye.N. Andreyeva, DM, PhD, Prof., A.M. Mkrtumyan, DM, PhD, Prof.
Dagestan State Medical University
City Clinical Hospital № 1, Makhachkala
National Medical Research Center for Endocrinology
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Yekaterina Abdulazizovna Azizova, katrin_1101@mail.ru
Year after year, the issue of infertility associated with PCOS does not lose its relevance. It is believed that he is the cause of more than half of all cases of endocrine sterility. The most important problem is the development of personalized therapy with regard to various comorbidities. The article analyzes the hormonal, metabolic and reproductive status in patients with PCOS and concomitant thyroid pathology (hypothyroidism, diffuse goiter).
