Нейрофизиологические механизмы хронизации болевых синдромов и стратегические направления их коррекции
- Аннотация
- Статья
- Ссылки
- English

Боль – это не только «неприятное сенсорное и эмоциональное переживание, связанное с существующими или возможными повреждениями ткани или описываемое в терминах такого повреждения» [1], но и «мультисистемная реакция организма, протекающая в рамках физиологических (защитный рефлекс) или патофизиологических (один из синдромов какого-либо заболевания) процессов и направленная на восстановление гомеостаза или реализацию патологической доминанты» [2]. Так же как страх вынуждает человека обороняться или спасаться бегством, боль сигнализирует о необходимости что-то предпринять для прекращения контакта с вредоносным объектом. Если повреждение какой-либо части тела уже произошло, боль запускает компенсаторные реакции за счет интегрирующего действия. Врожденная (редкая наследственная аутосомно-рецессивная болезнь) или приобретенная (например, при сирингомиелии) нечувствительность к боли, как правило, является признаком какого-либо заболевания и приводит к частым серьезным травмам, а нередко и к гибели [2].
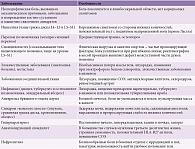
С одной стороны, необходимо различать боль физиологическую (спасительную, сигнализирующую об опасных для жизни повреждениях организма, как правило, острую боль) и патологическую (преимущественно хроническую боль, дестабилизирующую организм). С другой стороны, следует правильно интерпретировать болевые ощущения в рамках конкретных нозологических форм. Эти ощущения – обязательный ориентир для эффективной помощи пострадавшим. По принципу причинно-следственной обусловленности целесообразно лечить не боль, а заболевание, приведшее к ее возникновению. Поэтому в соответствии с требованиями классической неврологии хронические болевые синдромы (ХБС) так же, как и другие неврологические синдромы, подлежат стандартному клиническому анализу, который позволяет осуществлять топическую и нозологическую диагностику (табл. 1). Тем более что болевые синдромы отличаются крайним разнообразием и сугубо индивидуальны, следовательно, необходимо учитывать не только локализацию боли и предполагаемый уровень поражения нервной системы, но и психоэмоциональный компонент.
По нашим данным, в структуре ХБС преобладают дорсопатии (78%). Второе место по частоте встречаемости занимают дисметаболические полиневропатии (алкогольные, диабетические и др.) – 10%. Третье – моно- и мультиневропатии, вызванные инфекционными заболеваниями (постгерпетической невропатией и др.) и травмами периферической нервной системы, – 8%. Четвертое место – боли, обусловленные заболеваниями центральной нервной системы (последствия острых нарушений мозгового кровообращения, сирингомиелия и др.), травмы головного и спинного мозга – 4% [2]. Только в США ХБС затрагивает около 30% населения и оценивается в 650 млрд дол. в год в медицинских расходах и потерянной производительности [3].
Преобладание болей периферического генеза в структуре ХБС косвенно указывает на ведущую роль сегментарного аппарата спинного мозга в патогенезе болевых синдромов и согласуется с основными положениями теории воротного контроля боли. Тем не менее идентификация патофизиологических механизмов боли в каждом конкретном случае затруднительна. Поэтому для дифференциации болевых синдромов и совершенствования тактики патогенетической терапии во врачебной практике целесообразно использовать клинико-функциональные критерии (локализацию, характер, продолжительность, сопутствующие симптомы) (табл. 2). Соответственно в неврологии различают следующие ХБС: корешковые, костно-мышечные, миофасциальные, спинальные, таламические, невропатические и головные.
Ведущую роль в инициации ХБС играют воспалительные и нейрофизиологические механизмы – реакции на повреждение тканей. Эти патофизиологические механизмы инициируются в течение нескольких минут, но могут сохраняться от нескольких часов до нескольких дней. Изменения тканей после воспаления обратимы, если происходит разрешение воспалительного процесса и снижается периферическая сенситизация. При хроническом воспалении ноцицептивная импульсация сохраняется длительно [3]. Невзирая на различные этиологические факторы и уровень повреждения, ХБС во многом схожи и характеризуются продолжительной спонтанной (стимулонезависимой) болью в области измененной тактильной, температурной и болевой чувствительности и стимулозависимыми болезненными проявлениями – гиперпатией, гипералгезией, аллодинией, а также трофическими расстройствами. Стимулонезависимая боль может быть постоянной или пароксизмальной. Характер болевых ощущений в каждом конкретном случае может различаться и включать стреляющую боль, сдавливающую, сжимающую или жгучую боль. Эпизодическая пароксизмальная боль длится несколько секунд и часто похожа на удар током. Наиболее типичный пример – боли у пациентов с невралгией тройничного нерва. Другой тип боли (стимулозависимая) вызывается движением, прикосновением, теплом или холодом и может проявляться в парадоксальной форме, например как «обжигающий лед» при комплексном регионарном болевом синдроме [2].
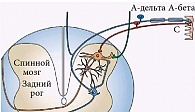
Первичный анализ и «фиксация» болевой импульсации происходят в спинном мозге (рис. 1). Нейроны спинного мозга представляют собой «модуль первичного рефлекторного анализа» ноцицептивной импульсации, где, с одной стороны, возникает двигательная, висцеральная и вазомоторная реакция на боль, а с другой – формируются периферическая сенситизация и восходящие пути болевой импульсации. Особенности строения этого модуля связаны с тем, что моносинаптические контакты с первичными афферентами имеют нейроны только I–III пластин, тогда как нейроны последующих слоев получают импульсацию уже после данного переключения. При этом ноцицептивные нейроны подразделяются на специфические, реагирующие только на ноцицептивные раздражители, и так называемые широко динамичные нейроны. Последние составляют треть всех нейронов, реагируют также на низкопороговые механические стимулы, но максимально – на ноцицептивные раздражители [1, 2].
Далее ноцицептивная афферентация проецируется в головной мозг по функционально различным системам. Одна из них – традиционный боковой спиноталамический тракт, состоящий из миелинизированных быстропроводящих толстых волокон, активация которых обеспечивает ощущение острой боли. Волокна «быстрого» пути имеют относительно небольшое число коллатералей, и приблизительно 30% из них заканчиваются моносинаптически в таламусе. Эта система позволяет точно различать, где и в какой момент времени произошло повреждение, насколько оно опасно для организма. Другая система (мультисинаптическая восходящая, или спиноретикулодиэнцефальная) формирует «медленный» путь болевой импульсации и состоит из безмиелиновых медленно проводящих волокон, при возбуждении которых возникает разлитая ноющая боль. Эта система отличается диффузностью, большим количеством синапсов и коллатералей к различным образованиям спинного мозга и ствола головного мозга (ретикулярной формации, клеткам и центрам продолговатого и среднего мозга, моста, серому веществу около сильвиева водопровода, гипоталамусу и таламусу). Одни волокна образуют синапсы на нейронах, связанных с гипоталамусом и миндалиной в лимбической системе, другие – на клетках диффузных нервных сетей, соединенных с многочисленными образованиями головного мозга, что определяет «облачность» ХБС [1–3].
Обе вышеуказанные системы имеют различные проекционные зоны в таламусе – конечной станции переключения болевой импульсации. «Быстрый» путь заканчивается в релейных нейронах так называемого вентробазального комплекса, а «медленный» – в интраламинарном и медиальном ядрах. Волокна вентробазального комплекса заканчиваются в постцентральной извилине, островковой коре (теменная доля) и височной доле, где происходит осознание локализации боли, оценка ее типа и вероятной причины. Данная болевая регистрация имеет незначительный эмоциональный компонент и названа первичной болью острого повреждения, которая предшествует тревожно ожидаемой вторичной боли, имеющей значительную эмоциональную окраску. В островковой коре устанавливаются локализация, тип и вероятная причина боли, а теменная доля обеспечивает мнемонический анализ для определения, является ли данная боль новой или повторяет предыдущий болевой опыт в подобных обстоятельствах [3, 4].
Спиноретикулодиэнцефальный путь, переключаясь в таламусе, заканчивается в лимбической системе и лобных долях. Центр лимбической системы – гипоталамус имеет четко организованную систему выходных волокон к исполнительным механизмам вегетативной системы, формирует вегетативные болевые комплексы и эмоционально-мотивационное поведение. Кроме гипоталамуса в данную систему входят гиппокамп, миндалевидный комплекс, лимбическая кора, передняя группа ядер таламуса, дорсомедиальное таламическое ядро, а также прозрачная перегородка. Поэтому ноцицептивное возбуждение лимбической системы формирует эмоциональную составляющую боли – сознательно переживаемое болевое ощущение от умеренно сильного до агонирующего и вызывает системные висцеральные реакции (тошноту, рвоту, непроизвольное испражнение или мочеиспускание и др.) [2, 4]. При этом участие кортикальных ассоциативных связей в паттерне болевой активации лимбической системы позволяет сознательно регулировать эмоциональную составляющую боли и центральную сенситизацию. Поэтому восприятие боли различно не только у разных людей, но и у одного и того же человека. Это связано с тем, что болевое ощущение зависит отчасти от физиологического состояния организма и прошлого опыта, от того, какие культурные традиции человек перенял у окружающих и членов семьи, от значения, которое человек придает воздействию, вызывающему боль, а также от расовых и психологических факторов, таких как тревожность, внушаемость и т.д. Этнические группы, проживающие в северных регионах планеты, легче переносят боль по сравнению с южанами [1].
Лобные доли, особенно префронтальная кора, генерируют предупреждающую тревогу и страх в отношении возможного повторения боли. Поэтому больные, перенесшие фронтальную лоботомию, редко жалуются на сильную боль или просят дать им болеутоляющее средство. Экспериментальные исследования ученых из Оксфордского университета показали, что новорожденные дети реагируют на боль так же, как и взрослые, только их болевые ощущения намного сильнее. 18 из 20 областей головного мозга, активировавшихся у взрослых при болевой стимуляции, были активны и у младенцев [4].
У животных отношение к боли тоже может видоизменяться, например в результате тренировки. В серии опытов И.П. Павлов обнаружил, что собаки, постоянно получавшие пищу сразу после удара электрическим током, переставали проявлять признаки ощущаемой боли по мере выработки условного рефлекса. G.K. Beecher, изучавший восприятие боли во время Второй мировой войны, обнаружил, что солдатам, раненным в бою, значительно реже требовался морфин, чем гражданским лицам в послеоперационном периоде. Раненый солдат испытывал облегчение, благодарность судьбе и эйфорию, потому что ему удалось уйти живым с поля боя. Простое внушение может изменить восприятие боли. У некоторых людей боль действительно уменьшится даже при приеме плацебо. Другой пример возможности модуляции ноцицепции – значительное повышение толерантности к боли под влиянием гипноза [2].
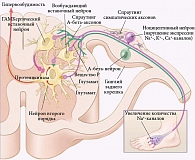
При заболеваниях периферических и центральных образований нервной системы (наследственных – например, болезни Фабри; метаболических – например, болевых формах диабетических полиневропатий; травматических; сосудистых – например, постинсультных таламических болях; неопластических; иммунологических – например, синдроме Гиенна –Барре; инфекционных – например, нейроборрелиозе; токсических и др.) происходят типовые патофизиологические изменения на различных «этажах» нервной системы. Это активация «молчащих» ноцицепторов, ускорение синтеза мембранных каналов в ноцицептивных нейронах, расположенных в ганглиях заднего корешка, увеличение количества внутримембранных Nа+-каналов на протяжении поврежденного нервного волокна. Последнее способствует развитию центральной сенситизации вследствие долговременной потенциации, усиления афферентной периферической импульсации и спраутинга симпатических эфферентов, которые формируют синаптическую сеть вокруг тел нейронов, увеличивая влияние на ноцицепторы, тем самым вызывая развитие нейрогенного воспаления и усиление болевого импульса. В свою очередь спраутинг центральных терминалей неноцицептивных нейронов (А-бета-аксоны), локализованных в ганглиях заднего корешка, способствует высвобождению алгогенных веществ в заднем роге спинного мозга, что проявляется гипералгезией и аллодинией (рис. 2).
Подавление острой и хронической боли опирается на определенные физиологические (биохимические) механизмы – элементы антиноцицептивной системы. Главной теорией механизма регуляции болевой чувствительности является теория воротного контроля, предложенная R. Melzack и P.D. Wall (1965, 1980). Согласно этой теории, болевая импульсация, идущая по первичным афферентам, может тормозиться или амплифицироваться на уровне нейронов заднего рога спинного мозга за счет механизма пресинаптического торможения или облегчения. В 1998 г. R. Melzack предложил нейроматриксную теорию боли, согласно которой болевое ощущение формируется паттерном нервных импульсов в нейрональных сетях центральной нервной системы (преимущественно в лимбической системе). Нейроматрикс представляет собой обширную ассоциацию нейронов, образующих функциональные связи таламуса и коры, коры и лимбической системы. Нейронные петли дивергируют, то есть расходятся в пространстве, и формируют три основных компонента нейроматрикса – «нейромодули». В них ведется одновременная параллельная обработка афферентных импульсов по трем главным доменам болевого ощущения: сенсорно-дискриминативному, аффективно-мотивационному и оценочно-познавательному. При сбоях в работе антиноцицептивной системы развиваются идиопатические ХБС, например миофасциальный болевой синдром [2].
Деятельность антиноцицептивной системы препятствует хронизации боли и опосредуется различными нейрохимическими механизмами. Среди них ведущую роль играет опиоидная регуляция болевой чувствительности. Эндогенная опиоидная система имеет два механизма влияния на опиатные рецепторы. Первый – активация гипоталамических эндорфинов с последующим выделением гипофизарных эндорфинов и их системным влиянием на опиатные рецепторы через кровь и спинномозговую жидкость. Второй – активация терминалей, содержащих энкефалины и эндорфины, непосредственно влияющих на опиатные рецепторы. Эндогенные опиоиды, а также морфин и морфиноподобные вещества при системном введении угнетают действие алгогенных веществ типа брадикинина и простагландинов уже на уровне периферических ноцицепторов. Увеличение их концентрации в области переключательных станций ноцицептивной импульсации, в частности в области заднего рога спинного мозга, вызывает снижение активности С-волокон, угнетает спонтанную и вызванную активность нейронов в ответ на ноцицептивную импульсацию, формируя состояние аналгезии. При этом угнетается выделение вещества Р-модулятора, усиливающего возбуждение ноцицептивных интернейронов [1, 2].
Кроме опиоидов обезболивающим эффектом обладают нейротензин, окситоцин, ангиотензин, серотонин. Нейротензин локализуется преимущественно в студенистом веществе, вентральной покрышке и парабрахиальных ядрах, оказывая как окситоцин-, так и ангиотензинугнетающее влияние на нейроны заднего рога. Большинство нейронов ядер шва – серотонинергические. При их активации происходит выделение серотонина в терминалях волокон нисходящего пути, идущего через дорсолатеральный канатик к нейронам заднего рога спинного мозга, в результате повышается порог ноцицепции. Выключение серотонинергического механизма приводит к гипералгезии вплоть до спонтанных болевых ощущений [2].
Помимо вышеуказанных механизмов есть самостоятельный эндогенный адренергический механизм антиноцицепции – активация отрицательных эмоциогенных зон мозга. Этот механизм имеет приспособительное значение, так как позволяет организму в стрессовых ситуациях пренебрегать воздействием ноцицептивных раздражителей и бороться за сохранение жизни: испытывая страх – спасаться бегством, испытывая гнев – отвечать агрессией [4].
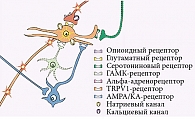
Совокупность влияний антиноцицептивных механизмов определяется их сложной интеграцией, как синергичной, так и антагонистичной, на различных уровнях центральной нервной системы. Опиоидный и серотонинергический механизмы находятся в синергических отношениях, свидетельствующих о тесных взаимосвязях между гипоталамусом, центральным околоводопроводным серым веществом и ядрами шва. Более сложные взаимосвязи обнаружены между опиоидным, серотонинергическим и катехоламинным механизмами, так как действие последнего на болевую импульсацию может быть разнонаправленным (рис. 3).
В связи с этим большинство болевых синдромов, независимо от причины возникновения, имеет ряд общих признаков: усиление боли в ответ на слабые раздражители, распространение боли за пределы «пострадавшей территории» («болевое облако»), сохранение боли после прекращения действия раздражителя и увеличение интенсивности боли при повторяющихся раздражениях (феномен взвинчивания). Вышеуказанные клинико-патофизиологические проявления ХБС отражают периферическую и центральную сенситизацию, основанную на повышении нейрональной активности. Несмотря на то что центральная сенситизация зависит от периферической ноцицептивной афферентации, она может стать самостоятельной после формирования застойных очагов возбуждения в центральной нервной системе (маладаптивная нейропластичность) [2].
Некоторые виды ХБС имеют специфические механизмы формирования. Так, стреляющая пароксизмальная боль (например, при невралгии тройничного нерва) обусловлена эктопическими разрядами, генерируемыми в поврежденных нервных волокнах. Возникновение эктопических разрядов связано с повышенной плотностью каналов для ионов Na+ в поврежденном нерве. Следовательно, при данной симптоматике оправданно использование блокаторов ионных каналов (карбамазепина, нейромидина), стабилизирующих возбудимые мембраны. Постоянная жгучая боль возникает вследствие нарушения центрального торможения ноцицептивных нейронов, опосредуемого как спинальными, так и супраспинальными механизмами. В спинном мозге контроль за возбудимостью ноцицептивных нейронов осуществляют ГАМК и глицин. Нисходящее супраспинальное торможение реализуется серотонин-, норадреналин- и опиоидергическими нейротрансмиттерными системами. В связи с этим назначение трициклических антидепрессантов, блокирующих обратный захват серотонина и норадреналина, будет эффективно подавлять жгучую постоянную боль. Аналогичный результат отмечается и у габапентина, который увеличивает синтез и концентрацию ГАМК в спинном мозге. Парестезия и дизестезия также во многом обусловлены эктопическими разрядами в поврежденных нервных волокнах, следовательно, правомерно назначение мексилетина – блокатора натриевых каналов [4].
Механическая аллодиния – частый симптом у неврологических пациентов. Главный механизм развития аллодинии – нарушение ГАМК- и глицинергического торможения ноцицептивных нейронов в дорзальных рогах спинного мозга с одновременным усилением NMDA-опосредованного возбуждения. Поэтому препараты, усиливающие ГАМКергическое торможение (габапентин) и подавляющие активность NMDA-рецепторов (кетамин), демонстрируют высокую эффективность при устранении аллодинии. Вторичная гипералгезия (снижение порогов болевой чувствительности вне зоны повреждения) возникает в результате центральной сенситизации из-за усиления ноцицептивного афферентного потока, и, следовательно, торможение эктопических разрядов при помощи местных анестетиков вполне обоснованно [5].
Принимая во внимание гетерогенность ХБС, обследование пациентов с болью наряду с балльными оценками интенсивности болевого ощущения (опросник DN4, болевая шкала LANSS, шкала NTSS9 и др.) обязательно включает в себя исследование тактильной, вибрационной, температурной и болевой чувствительности, а также проведение всего диагностического комплекса, предписанного для предполагаемого заболевания [2].
С учетом всего вышесказанного, купирование боли (клинически значимым считается снижение боли минимум на 30%) практически всегда представляет значительные трудности как для пострадавшего, так и для медицинского персонала, поскольку интенсивность болевого синдрома зависит от большого числа взаимосвязанных факторов. В соответствии с пунктом 4 части 5 статьи 19 Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», каждый «имеет право на облегчение боли, связанной с заболеванием и (или) медицинским вмешательством, доступными методами и лекарственными препаратами». По рекомендации ВОЗ (и так принято во всем мире), человек, испытывающий нестерпимую боль, должен быть обезболен в течение двух-трех часов вне зависимости от времени суток, дня недели, диагноза, возраста и прочих факторов [6]. В России, находящейся по доступности обезболивания на 38-м из 42 мест в Европе, у пациента или его родственников на борьбу за право быть обезболенным уходит до трех суток, а у ребенка – до 12 дней (если не попасть в праздники). В связи с этим оптимизация медицинской помощи пациентам с ХБС нуждается в решении организационных вопросов [2].
Кроме того, лечение боли необходимо рассматривать в аспекте неотложной помощи и проведения профилактики. Ситуация осложняется тем, что на сегодняшний день фармацевтический рынок перенасыщен препаратами, претендующими на роль «идеальных убийц боли». Только критический анализ терапевтических возможностей и рисков от использования того или иного лечебного средства относительно точек его приложения к болевому трафику может упорядочить хаотический выбор лекарств и будет адекватным противовесом рекламно-инициируемой мотивации.
Линейка обезболивающих средств представлена следующими группами препаратов.
Наркотические анальгетики оказывают угнетающее действие на центральную нервную систему, не вызывая нарушения сознания или расстройства чувствительности. Типичный представитель данной группы – морфин. Его анальгезирующее действие обусловлено активацией энкефалинергических нейронов на уровне желатинозной субстанции нисходящего корешка тройничного нерва, задних рогов спинного мозга, в антиноцицептивной системе ствола головного мозга и гипоталамических образований. Анальгетическим эффектом обладает Омнопон, представляющий смесь алкалоидов опия. Некоторые наркотические анальгетики морфинного ряда (трамадол, кодеин, гидрокодон и др.) в отличие от морфина достаточно эффективны при приеме внутрь. К наркотическим агонистам относятся также тримеперидин, фентанил и препараты группы метадона. Обезболивающее действие тримеперидина в 2–4 раза ниже, чем у морфина, но препарат вызывает существенно меньше побочных явлений, действует 3–4 часа. Фентанил в 100–400 раз эффективнее морфина, но длительность его анальгетического действия составляет 20–30 минут. Одно из главных осложнений наркотических анальгетиков – развитие толерантности (снижение эффекта) и зависимости (привыкания), которые могут появиться уже в первые дни при повторном введении препаратов.
Частичные наркотические агонисты (средства со смешанными свойствами агонистов и антагонистов опиатных рецепторов) разделяют на морфиноподобные и налорфиноподобные. Морфиноподобные (например, бупренорфин) при парентеральном введении действуют в 20–30 раз сильнее, а при приеме внутрь (сублингвально) – в 10 раз сильнее морфия, толерантность и привыкание к ним очень низкие, но эти препараты пока не получили широкого распространения. Болеутоляющее действие налорфиноподобных агонистов (пентазоцина, буторфанола) продолжительнее, чем у агонистов, побочные действия выражены меньше, к ним реже развивается толерантность и физическая зависимость [7].
В России наркотические средства используются главным образом для купирования боли у онкологических больных или в виде комбинированных лекарственных средств (Залдиар – аналог викодина) [8, 9].
Нестероидные противовоспалительные средства (НПВС) представляют собой обширную и разнообразную по химическому строению группу лекарственных препаратов, получивших широкое распространение в неврологической практике для лечения болевых синдромов. Более 30 млн человек в мире ежедневно принимают НПВС, причем 40% этих пациентов в возрасте старше 60 лет. По данным ВОЗ, по массовости применения НПВС занимают второе место после антибиотиков [10].
Эффективность НПВС обусловлена их способностью:
- осуществлять цитопротекцию, уменьшать проницаемость капилляров, ограничивающую воспалительный отек;
- угнетать синтез или инактивировать медиаторы воспаления (гистамин, серотонин, брадикинин, лимфокины, простагландины, факторы комплемента и др.);
- тормозить пролиферативную фазу воспаления за счет цитостатического действия;
- подавлять болевую афферентацию в спинном мозге;
- ингибировать гемокоагуляцию.
НПВС разделяют на четыре группы (деление на преимущественные и специфические ингибиторы циклооксигеназы (ЦОГ) 2 условно) [10]:
- селективные ингибиторы ЦОГ-1 (низкие дозы аспирина);
- неселективные ингибиторы ЦОГ (большинство стандартных НПВС);
- преимущественно селективные ингибиторы ЦОГ-2 (мелоксикам, ацеклофенак);
- специфические (высокоселективные) ингибиторы ЦОГ-2 (коксибы).
В соответствии с Европейскими рекомендациями по лечению болевых синдромов, НПВС обладают сопоставимым обезболивающим действием независимо от принадлежности к той или иной группе. Выбор препарата определяется рисками его побочного действия: у неселективных – это в основном поражение желудочно-кишечного тракта (ЖКТ) и печени, у селективных – сердечно-сосудистые осложнения. В один из последних метаанализов были включены в общей сложности 58 556 пациентов, которые принимали семь различных НПВС, парацетамол или плацебо для купирования боли при остеоартрите [11]. Все препараты независимо от дозы эффективно уменьшали боль по сравнению с плацебо. Наибольшую эффективность продемонстрировали диклофенак 150 мг/сут (размер эффекта 0,57, 95% доверительный интервал (ДИ) от -0,69 до -0,46) и эторикоксиб 60 мг/сут (размер эффекта 0,58, 95% ДИ от -0,73 до -0,43). Однако, с одной стороны, вследствие недавнего «кризиса коксибов» медицинская общественность с большой настороженностью относится к высокоселективным ЦОГ-2-ингибиторам. С другой стороны, диклофенак – в прошлом золотой стандарт анальгетической терапии (так его называли в 1980-х и начале 1990-х гг.), к сожалению, уже не соответствует высоким требованиям по безопасному использованию НПВС.
В связи с этим более привлекательным выглядит ближайший «родственник» диклофенака – ацеклофенак, производное фенилацетиловой кислоты. По данным S. Saraf [12], соотношение ингибирующих концентраций ЦОГ-1/ЦОГ-2 для ацеклофенака составляет 26, поэтому он может считаться более селективным в отношении ЦОГ-2, чем целекоксиб и нимесулид, у которых это соотношение составляет 7. Ацеклофенак оказывает влияние на синтез важнейших цитокинов, таких как интерлейкин 1 и фактор некроза опухоли альфа. Кроме того, ацеклофенак подавляет процесс ассоциированной с интерлейкином 1 активации металлопротеиназ. Это одна из причин положительного воздействия ацеклофенака на синтез протеогликанов суставного хряща. Данное свойство относится к числу преимуществ ацеклофенака перед другими НПВС и является веским доводом в пользу его назначения при дорсопатиях. Не случайно, по данным на 2004 г., во всем мире лечение этим препаратом получили более 75 млн пациентов [13]. В нашей стране оригинальный ацеклофенак, известный под торговой маркой Аэртал, используется с 2008 г. M. Schattenkirchner и K. Milachowski сравнивали действие ацеклофенака 200 мг/сут и диклофенака 150 мг/сут у 227 больных с острой люмбалгией и выявили, что через десять дней терапии уровень боли снизился примерно одинаково: на 61,6 и 57,3 мм по Визуальной аналоговой шкале [14]. Полное купирование боли отмечалось у шести пациентов, принимавших ацеклофенак, и только у одного больного, получавшего диклофенак. Побочные эффекты встречались чаще у больных, принимавших диклофенак (14,9 и 15,9% соответственно).
В масштабном 12-месячном исследовании SAMM ацеклофенак в дозе 200 мг/сут (7890 пациентов с различным ревматоидным поражением суставов) сравнивался с диклофенаком в дозе 150 мг/сут (2252 пациента с аналогичной патологией). Средняя длительность приема НПВС составила около полугода. Исследование завершили 27,9 и 27,0% больных. Суммарное число осложнений составило 22,4 и 27,1% (р < 0,001). Отмена терапии из-за нежелательных побочных эффектов достоверно реже наблюдалась на фоне приема ацеклофенака – 14,1 и 18,7% соответственно (р < 0,001) [15].
В метаанализе 28 эпидемиологических исследований J. Castellsague и соавт. оценивали относительный риск развития ЖКТ-осложнений при использовании различных НПВС [16]. Наименьший относительный риск отмечался на фоне применения ацеклофенака (отношение шансов (ОШ) 1,43, 95% ДИ 0,65–3,15) и селективного ЦОГ-2-ингибитора целекоксиба (ОШ 1,45, 95% ДИ 1,17–1,81). Риск развития ЖКТ-осложнений был отчетливо выше при приеме ибупрофена (ОШ 1,84, 95% ДИ 1,54–2,20), диклофенака (ОШ 3,34, 95% ДИ 2,79–3,99), мелоксикама (ОШ 3,47, 95% ДИ 2,19–5,50), нимесулида (ОШ 3,83, 95% ДИ 3,2–4,6), кетопрофена (ОШ 3,92, 95% ДИ 2,70–5,69), напроксена (ОШ 4,1, 95% ДИ 3,22–5,23) и индометацина (ОШ 4,14, 95% ДИ 2,19–5,90).
A. Helin-Salmivaara и соавт. оценивали относительный риск сердечно-сосудистых событий на фоне использования различных НПВС (33 309 случаев развития инфаркта миокарда и 138 949 лиц в группе контроля, соответствующей по полу и возрасту) [17]. Авторы выявили, что ацеклофенак продемонстрировал более низкий относительный риск развития инфаркта миокарда – 1,23 (95% ДИ 0,97–1,62), чем индометацин – 1,56 (95% ДИ 1,21–2,03), ибупрофен – 1,41 (95% ДИ 1,28–1,55) и диклофенак – 1,35 (95% ДИ 1,18–1,54).
Психотропные препараты прочно занимают ведущее место в комбинированной терапии ХБС, что обусловлено их анальгезирующей активностью и способностью потенцировать действие обезболивающих средств. Сочетая психотропные средства с анальгетиками, можно добиться адекватного обезболивания у 80% больных. Анальгетическое действие нейролептиков обусловлено сродством к серотониновым С2-рецепторам. Наиболее выраженным обезболивающим эффектом обладают левомепромазин, галоперидол и в меньшей степени хлорпромазин [9].
Антидепрессанты оказывают обезболивающее действие по трем основным механизмам:
- купирование тревоги, страха и психовегетативных компонентов болевого синдрома;
- потенцирование действия анальгетиков или эндогенных опиатных пептидов;
- пролонгация синаптической активности норадреналина и серотонина.
Для лечения болевых синдромов в неврологии чаще всего применяются ингибиторы нейронального захвата нейромедиаторов: неселективные и селективные. К первой группе относятся трициклические и четырехциклические антидепрессанты. Основные представители трициклических антидепрессантов – амитриптилин, имипрамин и кломипрамин. Одним из основных представителей четырехциклических антидепрессантов является миансерин, который преимущественно действует на норадренергическую трансмиттерную систему. Препарат назначается при болевых синдромах в дозе от 10 до 30 мг в сутки.
К селективным ингибиторам обратного захвата серотонина относятся флуоксетин, венлафаксин, сертралин, пароксетин и др. Они обладают минимальной антихолинергической и альфа-адренергической блокирующей активностью и потому характеризуются минимальными побочными эффектами (тошнота, рвота, тревожность и беспокойство, сексуальная дисфункция, головные боли, возбуждение). Однако антидепрессанты могут ухудшить подвижность пациента и его способность выполнять упражнения, которые имеют решающее значение для успешной реабилитации [3].
Антиконвульсанты в зависимости от механизма действия разделяются на три класса:
- блокаторы потенциалзависимых натриевых каналов (фенитоин, вальпроат натрия, карбамазепин, ламотриджин);
- препараты, усиливающие ГАМКергическую нейромедиацию (бензодиазепины, барбитураты, вальпроат натрия, габапентин, оксибутират натрия);
- препараты, блокирующие выделение возбуждающих аминокислот (ламотриджин).
Анальгетический эффект антиконвульсантов, осуществляющих преимущественно блокаду потенциалзависимых натриевых каналов (фенитоин, карбамазепин), достигается за счет торможения эктопических разрядов, возникающих в поврежденном нерве, и снижения возбудимости центральных нейронов. Эффективность карбамазепина доказана при тригеминальной невралгии, диабетической полиневропатии, фантомно-болевом синдроме. Фенитоин также устраняет боль у пациентов с невралгией тройничного нерва и диабетической полиневропатией, однако он менее эффективен, чем карбамазепин, и в большей степени вызывает сонливость и двигательные расстройства [3].
Ламотриджин, ингибируя потенциалзависимые натриевые каналы, блокирует выделение возбуждающих аминокислот из центральных терминалей ноцицепторов и тем самым снижает сенситизацию ноцицептивных нейронов. Его терапевтическая эффективность доказана у пациентов с невралгией тройничного нерва, диабетической полиневропатией, таламическими болями. Некоторые антидепрессанты (дулоксетин) увеличивают эффективность действия антиконвульсантов (например, габапентина), а низкие дозы габапентина с морфином, который изолированно дает слабый эффект, обеспечивают существенную антиноцицепцию [3].
Обобщая фармакотерапию ХБС, следует отметить, что эффективность отдельных препаратов ограниченна (менее чем у трети пациентов отмечается лишь умеренное облегчение боли). В связи с этим существует необходимость либо разработать новые и более эффективные лекарственные средства, либо оптимизировать комбинации уже имеющихся лекарственных средств. Лучше всего обосновывает целесообразность комбинированной терапии представленная выше нейрофизиологическая составляющая ХБС, которая позволяет установить мишени для терапевтических воздействий [3].
Современные исследования, обобщенные в Кохрейновском обзоре в 2012 г., показывают, что свыше половины пациентов с ХБС получают два и больше различных анальгетиков одновременно, поскольку комбинации лекарственных средств эффективнее монотерапии [3]. Однако некоторые комбинации не дают дополнительных преимуществ или, что еще хуже, увеличивают побочные эффекты. Так, лечение больных с пояснично-крестцовыми радикулопатиями нортриптилином или морфином в виде монотерапии оказалось так же неэффективным, как и сочетание из двух препаратов. При фантомных болях в конечностях кетамин оказался эффективнее кальцитонина, а их комбинация была не лучше, чем монотерапия кетамином. Наконец, при постгерпетической невралгии комбинация нейролептика флуфеназина с амитриптилином не усиливала обезболивание по сравнению с монотерапией амитриптилином. Эти и другие примеры подчеркивают необходимость расширения клинических исследований о принципах комбинированной фармакотерапии ХБС.
В целом комбинирование лекарственных средств преследует несколько задач: усиление обезболивающего эффекта, улучшение профиля безопасности основного анальгетика или коррекцию психоневрологических и вегетативных нарушений, сопутствующих ХБС. Поэтому принято выделять препараты первой, второй, третьей и четвертой линии при лечении различных нозологических форм, сопровождающихся ХБС. Например, при дорсопатиях препаратами первой линии являются НПВС и витамины группы В, второй – наркотические анальгетики, третьей – антидепрессанты, четвертой – антиконвульсанты. При этом бензодиазепины и системные глюкокортикостероиды не рекомендуются [2]. Совмещать препараты из разных групп следует осторожно. Например, комбинация НПВС и антидепрессантов (амитриптилина, венлафаксина) увеличивает риски гастроинтестинального кровотечения. Как показало двойное слепое исследование C.L. Romanò и соавт. с участием 36 пациентов с дорсопатией поясничного отдела, комбинация прегабалина и целекоксиба более эффективна, чем их изолированное применение [7].
Однако в некоторых случаях пациенты с ХБС нуждаются в специфической терапии. Например, постгерпетическая невралгия, как правило, не поддается обычной обезболивающей терапии, если своевременно не назначить противовирусное лечение (ацикловир, меглюмина акридонацетат). Вирус варицелла-зостер способен к репликации даже в латентную фазу опоясывающего лишая с последующей продукцией особых гликопротеинов. По этой причине клинические проявления постгерпетической невралгии обусловлены повреждениями, вызываемыми иммунными реакциями в периферических нервных волокнах, нейронах дорзальных ганглиев и дорзальных корешках. Повреждение нервных структур приводит к возникновению в них эктопических разрядов и сенситизации ноцицепторов [2].
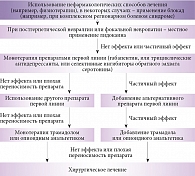
Учитывая огромное количество препаратов, оказывающих обезболивающее действие, наибольшие трудности при лечении пациентов с болевыми синдромами вызывает выбор стратегии или алгоритма терапии. По этой причине разработка стандартизированных схем для лечения различных болевых синдромов имеет огромное значение не только для неврологов, но и для врачей других специальностей (рис. 4).
Существенную роль при лечении болевых синдромов играют физиотерапевтические методы и блокады. Различные модальности воздействия и приемы физических и бальнеологических лечебных факторов селективно активизируют периферические и/или центральные нисходящие звенья антиноцицептивной системы. Нарушение пропорциональности болевых ощущений и ноцицептивного входного потока позволяет уменьшить восходящую болевую импульсацию [2].
Снижает выраженность болевого синдрома электрофорез 5–10%-ного раствора новокаина, который проводится по продольной методике по ходу нервов верхних или нижних конечностей. Целесообразно проводить электрофорез новокаина после ультравысокочастотной терапии на область шейных или поясничных симпатических узлов, так как она создает лучшие условия для последующего проникновения в организм ионов различных лекарственных веществ. При ХБС целесообразно назначать трансцеребральный бром-электрофорез по Бургиньону или электросон [2].
Широкое применение в лечении боли получили грязевые аппликации невысокой температуры на пораженную конечность и по внеочаговой методике на шейную или поясничную часть спинного мозга и соответствующие узлы пограничного симпатического ствола. Весьма эффективна в лечении болевых синдромов рентгенотерапия: прямое воздействие на пораженную зону, непрямое воздействие (облучение соответствующих сегментов спинного мозга и пограничного симпатического ствола) и комбинированный метод [2].
Один из качественно новых перспективных подходов к решению проблемы ХБС в настоящее время – нейромодуляция. Это малоинвазивные методы оперативных вмешательств, связанные с электрической или медиаторной стимуляцией различных отделов нервной системы. Все методы противоболевой электростимуляции можно разделить на несколько типов [18]:
- хроническая чрескожная стимуляция периферических нервных стволов и спинного мозга;
- хроническая эпидуральная электростимуляция задних столбов спинного мозга с применением экстракорпоральных генераторов или полностью имплантируемых систем;
- хроническая эпидуральная электростимуляция коры головного мозга;
- хроническая электростимуляция глубоких антиноцицептивных структур головного мозга (периакведуктальное, перивентрикулярное серое вещество, срединный центр – парафасцикулярное ядро, задне-нижнее серое вещество гипоталамуса и др.).
Дозированное автоматическое подоболочечное введение анальгетиков и анестетиков может обеспечить длительное обезболивание при минимуме побочных эффектов. Так, интраспинальное введение морфина позволяет значительно снизить его дозу, что дает возможность избежать наркотической зависимости и нивелировать нежелательные явления, связанные с длительным применением морфина.
В последние годы в практической медицине большое внимание уделяется нетрадиционным методам обезболивания. Одни из них (акупунктура) известны в народной медицине с давних времен, но не получили должного официального признания, так как не имели общепризнанного научного объяснения. Другие, например сенсорная стимуляция (вибрация, электростимуляция спинного мозга и др.), использовались лишь эпизодически и также не имели достаточного научного обоснования. Наконец, третьи, в частности чрескожная электро- и магнитонейростимуляция (транскраниальная магнитная симуляция), стали применяться недавно на основе концепции модуляции антиноцицептивной системы [2].
Таким образом, лечение больных с ХБС должно быть, во-первых, максимально индивидуализированным, во-вторых, комплексным, в-третьих, патогенетическим, в-четвертых, этапным и преемственным. В основе оптимизации лечения лежит:
- целенаправленное контролируемое воздействие на нейрофизиологические и нейрохимические механизмы боли;
- дифференциальная диагностика болевых синдромов по топико‑нозологическому принципу;
- комбинированная терапия, направленная на оптимизацию терапевтического профиля и базирующаяся на ответственном учете клинической значимости анальгетического эффекта и рисков осложнений.
Ye.R. Barantsevich, S.A. Zhivolupov, I.N. Samartsev
Academician I.P. Pavlov First St. Petersburg State Medical University
Military Medical Academy named after S.M. Kirov, Saint Petersburg
Contact person: Sergey Anatolyevich Zhivolupov, peroslava@yandex.ru
Chronic pain syndromes occupy a central place in the structure of the clinical symptom of various diseases and injuries of the nervous system. The modern doctrine of pain therapy is based on fundamental research information dedicated neurophysiological mechanisms of pain and focused on the need to create a disease-modifying therapeutic complexes. In this regard, optimization of medical care to patients with CPS involves an in-depth analysis of a topic-nosological pain using the latest diagnostic systems. A significant proportion of medicines intended for the pharmacotherapy of chronic pain syndromes, take non-steroidal anti-inflammatory drugs and anticonvulsants. This review presents the basic guidelines for the mechanisms of chronic pain and the prerequisites for a rational combination of drugs from different pharmacological groups.
