Особенности ведения пациентов с наследственным ангиоотеком в амбулаторной практике: от сотрудничества до делегирования принятия решений
- Аннотация
- Статья
- Ссылки
- English





Рецидивирующие ангиоотеки (РА) – проблема, с которой часто приходится сталкиваться врачам различных специальностей – аллергологам, реаниматологам, отоларингологам, врачам скорой помощи. РА характеризуются периодически возникающим внезапным и неожиданным отеком глубоких слоев кожи и слизистых тканей. РA могут быть проявлением хронической спонтанной крапивницы, наследственной недостаточности C1-ингибитора или другими вариантами брадикининовых ангиоотеков (например, ангиоотеки на фоне применения ингибиторов ангиотензинпревращающего фермента) [1]. Все типы РА могут иметь различную локализацию: лицо, язык, верхние дыхательные пути и желудочно-кишечный тракт [2]. В зависимости от масштаба, длительности и локализации сосудистый отек способен вызывать боль, приводить к обезображиванию и даже (в случае отека верхних дыхательных путей) угрожать жизни пациента [3].
К редким вариантам ангиоотеков относится наследственный ангиоотек (НАО) – одно из орфанных заболеваний, представленных в соответствующем регистре как дефект системы комплемента (D 84.1). НАО – это аутосомно-доминантное заболевание, характеризующееся эпизодами рецидивирующих отеков различной локализации. Атаки могут быть спровоцированы триггерами, такими как хирургическое вмешательство, стоматологические манипуляции, стресс, различные ушибы. Основной причиной заболевания является снижение функции белка, ингибирующего С1-эстеразу. Как следствие – неконтролируемая активация ряда белковых каскадов в сыворотке крови, главным образом классический путь активации комплемента и брадикининового каскада. Симптомы заболевания обычно дебютируют в первые два десятилетия жизни. Несмотря на ранний дебют заболевания, у многих пациентов оно остается нераспознанным на протяжении десятков лет. Типичными ошибочными диагнозами считаются аллергический или идиопатический ангиоотек и анафилаксия. Подробный сбор семейного анамнеза служит основным критерием успеха в своевременной постановке диагноза и позволяет избежать тяжелых проявлений болезни, в 35% случаев приводящих к летальному исходу.
При опросе пациенты указывают на неэффективность системных глюкокортикостероидов (ГКС) и антигистаминных препаратов для купирования отека. Пациенты с НАО требуют дифференцированного индивидуального подхода. Своевременная и правильно подобранная терапия НАО – залог благоприятного течения болезни. При ведении данной группы пациентов врачу нужно учитывать многочисленные нюансы проявления заболевания, его постоянное влияние на физическое и психическое состояние. Бремя болезни значительно снижает качество жизни пациентов: ожидание новой атаки мешает им строить жизненные планы и реализовать уже имеющиеся, зачастую приходится отказываться от путешествий, увлечений и социальных перспектив, страдают межличностные отношения. К сказанному следует добавить отсутствие информации о заболевании и несвоевременное обеспечение необходимыми лекарственными препаратами для купирования отеков. В итоге пациент, страдающий тяжелым, жизнеугрожающим заболеванием, часто остается один на один со своим недугом.
Наблюдая пациента с НАО, врач должен помнить, что первым и обязательным условием эффективного контроля заболевания и улучшения качества жизни является сотрудничество с пациентом. Основным мероприятием после подтверждения диагноза НАО должно быть консультирование пациента или его родителей, если речь идет о ребенке, по вопросам механизмов, лежащих в основе заболевания, правильной интерпретации предвестников обострения, необходимой помощи себе или своим близким.
Около 50% пациентов отмечают появление первых симптомов в детстве, поэтому работе с детьми должно уделяться особое внимание [4]. Пациентам с подозрением на НАО (и в целом с неаллергическими изолированными отеками) объясняют необходимость вести дневник и отмечать в нем любые ситуации, способные влиять на течение болезни, даже если, по мнению пациентов, они не имеют отношения к обострению. Понятно, что тщательное и систематическое заполнение дневника повышает вероятность своевременного выявления и пациентом, и его лечащим врачом начала атаки НАО (определение предвестников) и принятия необходимых мер.
Каждый больной с установленным диагнозом должен иметь паспорт пациента, в котором фиксируются диагноз, форма заболевания, эффективные лекарственные средства. У пациента на руках должна быть подробная выписка-инструкция, в которой максимально полно отражены все варианты медицинской помощи при неотложно возникающих ситуациях и описана краткосрочная и длительная профилактика заболевания. Этот документ больной должен всегда носить с собой, чтобы врач неотложной помощи, которому придется оказывать помощь, понимал, что имеет дело с орфанным заболеванием, лечение которого требует особого подхода. Это крайне важно, поскольку при НАО традиционно применяемые для лечения аллергического ангиоотека медикаменты (Н1-блокаторы, ГКС) неэффективны.
Конечные цели лечения пациентов с НАО можно сформулировать следующим образом:
- достижение удовлетворительного качества жизни;
- минимизация риска летального исхода вследствие обострения заболевания [4].
При ведении пациента с НАО лечащему врачу рекомендовано использовать дополнительные инструменты для оценки активности заболевания: пациент ведет дневник, врач оценивает активность заболевания. Представляется важной и оценка в динамике качества жизни пациентов с ангиоотеками, позволяющая и врачу, и пациенту составить полную индивидуальную картину заболевания, определить возможные триггеры, предвестники заболевания и тем самым избежать тяжелых приступов ангиоотеков.
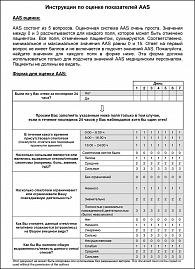
Для определения активности ангиоотеков используют индекс активности ангиоотека (AAS) (приложение 1).
Для оценки качества жизни рекомендован опросник AE-QoL (Angioedema Quality of Life Questionnaire) (сильная рекомендация/клинический консенсус) (документы в настоящее время находятся в стадии валидации в России) [5]. Этот опросник (приложение 2) стал первым специальным инструментом для оценки нарушения качества жизни (QoL) больных РA по заполненным ими отчетам (PRO) [6]. Опросник можно использовать для всех случаев РА, то есть РA, опосредованного гистамином (например, РA при хронической спонтанной крапивнице), и РA, опосредованного брадикинином (например, НАО). Опросник AE-QoL состоит из 17 вопросов, на каждый из которых предлагается пять вариантов ответов. Опросники заполняются каждые четыре недели. Затем врач рассчитывает общий балл по всем вопросам. Вместе с тем AE-QoL можно применять и в качестве инструмента для определения профиля пациента, группируя вопросы по четырем областям («Функционирование», «Чувство усталости/плохое настроение», «Страхи/чувство стыда» и «Питание»), и затем рассчитывать баллы для каждой области. После предварительного подсчета баллов их представляют в виде точек на шкале из 100 пунктов: чем выше балл, тем сильнее выражено нарушение качества жизни. Доступны локализованные валидизированные версии AE-QoL на нескольких языках (в том числе на русском, американском английском, канадском английском, канадском французском, датском, голландском, немецком, греческом, венгерском, итальянском, японском, мексиканском испанском, польском, португальском, румынском, шведском) [7]. Опросник AE-QoL демонстрирует высокий уровень непротиворечивости, конвергентности и валидности, воспроизводимости результатов [6]. Важным свойством инструментов PRO (то есть основанным на оценке результатов самими пациентами), каковым является опросник AE-QoL, следует считать их способность определять динамику изменений, например, до и после внесения корректив в схему лечения.
Интересным, на наш взгляд, представляется исследование W. Karsten и соавт., в котором протестирована чувствительность опросника AE-QoL при выявлении изменения показателя качества жизни и минимального клинически значимого изменения (MCID).
Материал и методы. Больным РА с диагнозом хронической спонтанной крапивницы или наследственного ангиоотека предлагалось во время плановых визитов в отделение дерматологии и аллергии в медицинском центре «Шарите» Берлинского университета или отделение дерматологии университетского медицинского центра в Майнце заполнить опросник AE-QoL (приложение 2), а также другие опросники (форму SF-12 валидизированный краткий опросник по оценке состояния здоровья (приложение 3)) с оценкой состояния. Всего в анализ вошло 278 пациентов (70,5% женщин). Средний возраст составил 47,8 ± 16,5 года (медиана – 48 лет). Отбор пациентов не проводился.
Чувствительность к изменению AE-QoL определяли по корреляции изменений показателей этого опросника с изменениями других используемых для определения данного параметра инструментов. Кроме того, MCID определяли с помощью анкер-подхода (с использованием независимой переменной – «якоря») или критериев распределения.
Статистический анализ. Статистический анализ выполняли с помощью программы SPSS (IBM SPSS Statistics, версия 22, IBM Corporation, Армонк, Нью-Йорк, США). В качестве критерия достоверности использовали значение p ≤ 0,05.
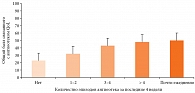
Результаты. Были проанализированы опросники за несколько последовательных визитов у 278 пациентов. Установлено, что исходные значения AE-QoL хорошо коррелируют с результатами опросника SF-12, а также с другими использованными в исследовании инструментами определения связанного с ангиоотеком ухудшения качества жизни (QoL) и активности заболевания (шкала AAS). Кроме того, оказалось, что значение общего балла AE-QoL достоверно коррелировало с частотой приступов ангиоотека (r = 0,52; p < 0,001), то есть общий балл был выше у пациентов с более высокой частотой приступов (рис. 1). Данные о частоте ангиоотеков, помимо сведений о значении общего балла AE-QoL, были проанализированы у 259 пациентов. За четырехнедельный период определения AE-QoL у 69 (27%) пациентов ангиоотеков не зафиксировано. У остальных 190 (73%) пациентов отмечался хотя бы один приступ ангиоотека.
Средняя величина общего балла AE-QoL ± SD составила 24,2 ± 16,2 в отсутствие отеков (n = 69), 34,4 ± 16,0 при одном-двух приступах (n = 58), 44,7 ± 20,7 при трех-четырех приступах (n = 50), 48,2 ± 18,1 при частоте приступов более четырех (n = 43) и 54,9 ± 21,4 при почти ежедневных приступах (n = 39).
Выраженность корреляции между изменением различных разделов опросника AE-QoL и изменением переменных-«якорей» (anchors) была различной. В разделе «Работа» AE-QoL показатели корреляции были большими (r > 0,5), в разделе «Усталость/плохое настроение» – умеренными, а в разделах «Страхи/стыд» и «Питание» – низкими (r < 0,3). Эти данные указывают на то, что раздел «Работа» наиболее чувствителен к изменениям, тогда как другие домены в меньшей степени реагируют на них. Динамика общего балла AE-QoL достоверно коррелирует с изменением общего рейтинга качества жизни (PGA-QoL) и общего показателя изменения активности болезни (PGA-disease activity). Примечательно, что корреляция между изменениями общего балла AE-QoL и изменениями PGA-QoL превышала корреляцию между изменением общего балла AE-QoL и изменениями активности болезни PGA-disease activity. Результаты прежних исследований показали, что активность болезни и нарушение качества жизни HRQoL могут лишь умеренно коррелировать друг с другом, поскольку отражают разные понятия [8, 9]. Хотя активность заболевания оказывает значительное влияние на ухудшение качества жизни, существуют дополнительные факторы, вызывающие ухудшение QoL у пациентов с РА, такие как страх перед грядущим приступом или боязнь, что дети унаследуют НАО. Это снижает корреляцию между активностью заболевания и нарушением качества жизни. Минимальное клинически значимое изменение (MCID) суммарного балла AE-QoL оказалось равным шести пунктам.
Таким образом, AE-QoL является важным инструментом для оценки динамики нарушения качества жизни пациентов, страдающих различными типами ангиоотеков. Данный опросник, равно как и другие перечисленные выше методы, существенно облегчают работу с пациентами, в том числе могут уберечь их от тяжелых, фатальных атак.
Лечение НАО можно разделить на лечение приступов (лечение по необходимости) и профилактическое лечение (краткосрочное и долгосрочное). У всех пациентов с недостаточностью С1-ингибитора должен быть составлен индивидуальный план в отношении методов купирования ангиоотеков и долгосрочной профилактики приступов [10]. К лекарственным средствам, применяемым для лечения ангиоотека, относятся:
- концентрат C1-ингибитора: нативный (выделенный из плазмы) С1-ингибитор – беринерт (зарегистрирован в РФ), синрайз, сетор; рекомбинантный С1-ингибитор (получаемый из молока генномодифицированных кроликов) – руцин, руконест;
- антагонисты B2-рецептора к брадикинину: икатибант (зарегистрирован в РФ);
- ингибитор калликреина: кальбитор (экаллантид);
- свежезамороженная или восстановленная после лиофилизации плазма;
- ингибиторы фибринолиза: аминокапроновая и транексамовая кислоты;
- 17-алкилированные анаболические андрогены: даназол, станозолол, оксандролон [4, 10].
Как уже отмечалось, данные лекарственные средства применяются и для терапии острых состояний, и для профилактики обострений.
Недавно проведенное исследование показало, что успешность лечения приступов HAО ограничивается не столько эффективностью препаратов, сколько своевременностью их применения [11]. Разработка схем лечения для пациентов в амбулаторных условиях, в том числе лечения, осуществляемого пациентом самостоятельно, позволит облегчить доступ к медицинской помощи [12], что отражено в недавно вышедших клинических рекомендациях, в которых настоятельно рекомендуется обучать пациентов самопомощи в случае необходимости [13].
Икатибант (Фиразир), В2-антагонист брадикинина, предназначен для подкожных инъекций, разрешен для симптоматического лечения приступов НАО типа I и типа II в 40 странах, в том числе в России. Как средство оказания самопомощи он был одобрен в 2011 г. Европейским агентством по лекарственным средствам и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration – FDA) США. На момент проведения настоящего исследования является единственным препаратом для лечения НАО, разрешенным для применения в порядке самопомощи.
Три исследования фазы III продемонстрировали безопасность и эффективность икатибанта, вводимого пациентам с НАО профессиональными медицинскими работниками [14, 15]. В ряде работ подтверждена эффективность лечения приступов НАО икатибантом, вводимым самостоятельно пациентами и профессиональным медперсоналом в домашних условиях [16].
В международном многоцентровом открытом клиническом исследовании фазы IIIb EASSI оценивали безопасность, удобство для пациентов и эффективность самолечения икатибантом взрослых больных НАО типа I и II при соответствующем обучении. Пациенты успешно распознавали приступ НАО и принимали решение о самостоятельной инъекции икатибанта, сообщая о высокой степени удовлетворения, удобства и легкости в применении. Это исследование продемонстрировало, что показатели безопасности, переносимости и эффективности при самостоятельном введении икатибанта сопоставимы с результатами введения икатибанта медперсоналом и в целом соответствуют результатам контролируемых клинических исследований фазы III [17]. Приведем некоторые данные этого клинического исследования.
В исследование был включен 151 пациент. У 104 из них был зафиксирован приступ НАО, потребовавший лечения, в период проведения исследования, 97 пациентов (из них 19 прежде не получали икатибант) составили группу самостоятельного лечения. Все они были обучены методике введения икатибанта для лечения приступа. Демографические характеристики и исходные показатели приведены в табл. 1.
Установлено, что естественное течение приступов НАО отличается разнообразием. Нередко на протяжении нескольких дней симптоматика заболевания то нарастает, то ослабевает. У некоторых пациентов (23–27%), по результатам EASSI, отмечалось утяжеление или рецидив симптомов либо появление новых симптомов уже после того, как пациенты сообщили об улучшении исходной симптоматики. Для таких пациентов эффективными оказались дополнительные инъекции икатибанта. В течение 24 часов при необходимости можно вводить до трех инъекций икатибанта (однако следует отметить, что ни одному пациенту по EASSI третья инъекция не понадобилась). Относительно короткий период полураспада икатибанта в плазме после подкожного введения – около одного-двух часов [18] потенциально способен обусловить ухудшение или рецидив симптоматики НАО. На практике оказалось, что инъекция икатибанта обеспечивает более длительный и стойкий лечебный эффект – до восьми часов [14, 15].
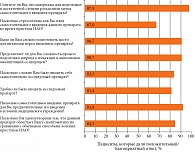
Любопытна оценка пациентами удобства и удовлетворенности самостоятельным выполнением инъекций икатибанта по пятибалльной шкале (от очень положительного/благоприятного, нейтрального до очень отрицательного/неблагоприятного) для каждого вопроса. На рисунке 2 показано, какая часть пациентов давала очень положительный/положительный или очень благоприятный/благоприятный (то есть в поддержку самостоятельного введения икатибанта) ответ на каждый из восьми вопросов.
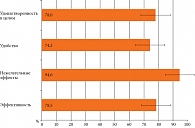
Вопросник об удовлетворенности проводимым лечением для данного препарата (TSQM) включал 14 вопросов, сгруппированных по категориям эффективности, наличию побочных эффектов, удобству и общей удовлетворенности (баллы для разных групп вопросов варьируются от 0 до 100: чем выше балл, тем выше удовлетворенность) (рис. 3). Все 97 пациентов, самостоятельно выполнивших инъекцию икатибанта, заполнили опросник по удовлетворенности лечением, 23 заполнили вопросник TSQM. На основании данных опросника по удовлетворенности лечением большинство пациентов были удовлетворены результатами самостоятельной инъекции икатибанта, простотой и удобством способа введения.
Результаты TSQM в целом соответствовали данным опросника по удовлетворенности лечением, имела место высокая степень удовлетворенности по всем четырем показателям.
Оценка эффективности лечения базировалась на оценке пациентов на протяжении всего периода, измеряемой по Визуальной аналоговой шкале (ВАШ) тяжести таких симптомов, как болезненность кожи, отек кожи и боль в животе. Баллы ВАШ (0 мм – реакция отсутствует, 100 мм – максимальная возможная тяжесть) регистрировались в дневнике пациента с установленной периодичностью в течение 48 часов. Пациенты также ставили отметку, считали ли они приступ разрешившимся через 48 часов. Тяжесть отека кожи, абдоминальные симптомы и приступы ларингеальной симптоматики (0 – отсутствует, 4 – очень тяжелый) оценивал исследователь в рамках определения общего состояния. Средний балл по ВАШ-3 как после выполнения инъекции медперсоналом, так и после самостоятельного введения икатибанта со временем уменьшался. Медиана времени до начала уменьшения выраженности симптомов составила 3,8 и 2,0 часа по шкалам ВАШ-3 и ВАШ основного симптома соответственно (табл. 2).
Трое пациентов самостоятельно вводили икатибант при приступе с ларингеальными симптомами. Все эти пациенты оказались в группе с удовлетворительным разрешением симптоматики в течение 48 часов.
Время до начала ослабления симптоматики определяли по времени первой из трех последовательных оценок измерения, выявивших такое ослабление.
Ослабление симптоматики определяли по шкале ВАШ-3 (≥ 50% снижение балла по ВАШ-3 от балла до введения дозы) и шкале ВАШ для основного симптома (балл по шкале ВАШ для основного симптома ≤ 6/7 после инъекции, балл по шкале ВАШ для основного симптома до инъекции – 16 мм).
Данные исследования EASSI относительно субъективного восприятия пациентами удобства и простоты самостоятельных инъекций икатибанта дополняют результаты более ранних наблюдений, в которых показано, что самостоятельное внутривенное введение концентрата C1-INH хорошо переносится, улучшает качество жизни, повышает независимость от медицинских услуг и пользуется популярностью среди пациентов [19, 20]. Для подтверждения этих данных требуются дальнейшие исследования по применению новых инструментов оценки активности болезненного процесса и качества жизни пациентов, страдающих НАО [6, 21]. При оценке эффективности надо учитывать, что данное исследование не являлось сравнительным, строго оценить показатели эффективности не представлялось возможным. Однако медиана времени до начала ослабления симптоматики в целом согласуется с результатами контролируемых исследований икатибанта FAST [14, 15]. Оценка состояния пациентом и исследователем через 48 часов подтверждает устойчивость реакции на икатибант в большинстве случаев.
В заключение отметим, что профиль безопасности и переносимости самостоятельно выполняемых пациентом инъекций икатибанта в исследовании EASSI, уровни удовлетворенности пациентов самостоятельным лечением и эффективность, аналогичная эффективности такой же инъекции, выполненной медперсоналом, свидетельствуют о правомерности применения самостоятельных инъекций икатибанта в клинической практике. Внедрение протоколов самолечения при острых приступах НАО позволяет делегировать принятие решения о проведении лечения от врача пациенту, что повышает автономность последнего и снижает его зависимость от медицинских учреждений.
O.S. Bodnya
Russian Medical Academy of Continuing Professional Education
Contact person: Olga Sergeyevna Bodnya, os.bodnya@yandex.ru
Нereditary angioedema (HAE) is autosomal dominant disease, characterized by the episodes of anticipate hydrops of different localization. To lead the patients with HAE, medical doctor is recommended to use additional tools to estimate activity of the disease: for patient it is recommended to keep a diary, a doctor should estimate an activity of the disease, also it is important to estimate the dynamics of patient's quality of life suffered from angioedema. It will help doctor and patient to make a full individual picture of the disease, define possible triggers and prodromes of the disease, which also may help to avoid strong accessions of angioedema. Implementation of self-treatment records during acute attacks of HAE allows to delegate the process of making decision about patient treatment from patient to the doctor, which improves the independence of the patient and decreases his dependence from medical institution.
