Особые показания к адъювантной лучевой терапии при раке молочной железы T2N1M0 после радикальной мастэктомии
- Аннотация
- Статья
- Ссылки
- English

От локального или локорегионарного рецидива рака молочной железы (РМЖ) не застрахованы ни радикально пролеченные больные с местнораспространенным процессом, прошедшие длительную комплексную терапию, ни пациентки с небольшими опухолями и достаточно благоприятным прогнозом. По данным разных авторов, частота развития изолированных рецидивов в области грудной стенки или сопровождающихся поражением зон регионарного лимфооттока у пациенток с инвазивным РМЖ стадий I–IIIA варьируется от 10 до 20% [1]. Такие больные заслуживают особого внимания, поскольку некоторым из них потребуется завершающая точка в виде послеоперационной лучевой терапии, направленной прежде всего на снижение риска рецидива и улучшение отдаленных результатов лечения. Несмотря на то что специалисты, занимающиеся данной проблемой, руководствуются рекомендациями крупных мировых сообществ, основанными на результатах большого количества исследований наивысшего уровня достоверности, в спорных ситуациях, к которым безусловно относится стадия T2N1M0 после радикальной мастэктомии, нередко звучат диаметрально противоположные мнения.
Показано ли облучение пациенткам с первичной опухолью размером менее 5 см и ограниченным количеством пораженных лимфоузлов (от одного до трех) после мастэктомии? Или такое лечение должны получать только больные с большим размером опухоли и более массивным метастатическим процессом в регионарных лимфоузлах? На какие факторы риска следует обращать более пристальное внимание при решении данного вопроса? Стоит ли в случае принятия положительного решения о лучевой терапии подвергать полномасштабному облучению все традиционно принятые зоны, или можно ограничиться отдельными? Специалисты достаточно часто задаются подобными вопросами.
Итак, РМЖ T2N1M0 после выполнения радикальной мастэктомии. 2007 г. стал переломным в плане отношения к адъювантному облучению для этой группы пациенток. Многие известные сообщества онкологов высказались в поддержку всестороннего рассмотрения возможности его назначения. С этим согласились и эксперты NCCN (National Comprehensive Cancer Network – Национальная всеобщая онкологическая сеть), проанализировав данные многочисленных рандомизированных исследований. Специалисты предложили при наличии от одного до трех пораженных лимфоузлов «серьезно рассмотреть проведение лучевой терапии на грудную стенку, надключичную и подключичную области» [2]. Как показал опубликованный в 2016 г. анализ L.L. Frasier и соавт. [3], основанный на данных SEER, за последующие четыре года ситуация действительно существенно изменилась. Авторы проанализировали почти 62,5 тысячи случаев РМЖ после мастэктомии. Все пациентки были разделены на три группы. В первую вошли больные с однозначным показанием к адъювантному облучению (опухоль ≥ 5 см, число пораженных лимфоузлов > 4), во вторую – пациентки без показаний (опухоль ≤ 5 см, отсутствие метастазов в лимфоузлах). Третью группу составили пациентки с опухолями ≤ 5 см и количеством выявленных метастатических лимфоузлов от одного до трех. Оказалось, что в этой когорте с 2007 по 2011 г. процент назначения послеоперационной лучевой терапии возрос с 26,9 до 40,5% (предположительно именно за счет больных со стадией T2N1M0). Ежегодный прирост составил от 2 до 9%. В двух других группах изменений не зафиксировано. Это говорит о том, что вопрос, не упускаем ли мы благополучную на первый взгляд группу пациенток после мастэктомии, вызывает обеспокоенность у специалистов во всем мире.
На какие же факторы риска следует обращать особое внимание, принимая решение о назначении адъювантной лучевой терапии для снижения риска рецидива в области грудной стенки? Такие факторы риска, как размер первичной опухоли менее 5 см, мультифокальность и наличие внутрипротокового компонента, не ассоциированы с повышенным риском локального рецидива, равно как и количество пораженных лимфоузлов (один, два или три). Однако последний фактор неразрывно связан с таким показателем, как количество исследованных лимфоузлов. R.V. Iyer и соавт. показали, что в соответствии со статистической моделью для достижения 90% вероятности аккуратности стадирования и подтверждения статуса N1 у больной с Т1 и пораженными одним, двумя или тремя лимфоузлами необходимо исследовать восемь, 15 или 20 лимфоузлов соответственно [4]. Если количество пораженных лимфоузлов менее восьми, то при обнаружении одного метастатического лимфоузла риск N2 составит 13%, двух – 55%, трех – до 93%. В подобных ситуациях следует задуматься об облучении подмышечной области. Как показали результаты недавних исследований, в отсутствие лимфодиссекции эффективность облучения подмышечной зоны сопоставима с эффективностью операции. Процент осложнений такой же или меньше [5].
О повышенном риске рецидива в области грудной стенки можно говорить при наличии следующих клинических, патоморфологических и иммуногистохимических факторов:
- молодой возраст. Еще в первой половине прошлого века многие исследователи отмечали: чем больная моложе, тем многократно выше риск развития рецидива. Так, D. Lewis и W.F.J. Rienhoff [6] установили, что в возрасте 20–29 лет риск составляет 67%, в возрасте 30–39 лет – 41%, в возрасте 40 лет и старше – 21–25%. Безусловно, возраст не всегда служит независимым предиктором повышенного риска рецидива в области грудной стенки, но в сочетании с другими факторами значительно увеличивает вероятность более раннего возвращения заболевания у определенной категории больных;
- экстракапсулярное распространение опухоли за пределы пораженного лимфатического узла. Его обнаружение повышает риск рецидива в области именно грудной стенки, но не подмышечной зоны. Значение имеет и количество лимфоузлов с зафиксированным экстранодальным распространением, хотя в целом его нельзя считать независимым предиктором локального рецидива. Необходимо сочетание этого фактора как минимум еще с одним, чтобы склонить чашу весов в сторону адъювантного облучения;
- край резекции. Обнаружение опухолевых клеток в линии резекции чревато локальной катастрофой при любой локализации опухоли, в том числе при РМЖ после радикальной мастэктомии, например при глубокой инвазии fascia pectoralis. P.T. Truong и соавт. [7] отмечали повышенный риск рецидива (20%) в области грудной стенки при позитивном крае именно у спорной категории больных с Т1–2 после радикальной мастэктомии. Сегодня понятие «близкий край резекции» уже практически не используется. Тем не менее утверждение «чем ближе края опухоли к краю резекции, тем выше риск локального рецидива» имеет место;
- низкая степень дифференцировки опухолевых клеток и наличие лимфоваскулярной инвазии. Достоверность этих двух факторов риска подтверждена при мультивариантном анализе [8]. Grade III опухоли служит независимым предиктором развития локального рецидива, а наличие лимфоваскулярной инвазии повышает этот риск в два раза (с 19% в ее отсутствие до 36%);
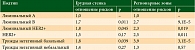
- молекулярный подтип опухоли. Возможно, он наиболее значим в плане вероятности локального или локорегионарного рецидива из всех перечисленных, хотя пока ни одни официальные рекомендации не предлагают его строго учитывать. K.D. Voduc и соавт. оценивали риск рецидива в зависимости от биологической природы опухоли [9] и установили следующее. Если принять риск рецидива для наиболее благоприятного в плане прогноза люминального А подтипа за единицу, то для других биологических вариантов опухоли молочной железы при T1–2N1M0 и G3 после радикальной мастэктомии риск развития рецидива как в области грудной стенки, так и в зонах регионарных лимфоузлов значительно возрастает (причем статистически достоверно для большинства из них) (табл. 1). В итоге это выражается в определенных показателях риска десятилетнего локального рецидива (табл. 2).
Маловероятно, что в случае HER2-позитивных опухолей лучевая терапия эффективно предотвратит рецидив в отсутствие таргетной терапии трастузумабом. По крайней мере при люминальном В подтипе (в сочетании с экспрессией HER2-neu или без нее) показано облучение грудной стенки, а при трижды негативном раке – возможно, всех зон регионарных лимфоузлов.
Итак, в случае T2N1M0 после радикальной мастэктомии при наличии как минимум двух из указанных выше факторов риска (возраст менее 40 лет, наличие позитивного или близкого (менее 1 мм) края резекции, экстранодального распространения опухоли, низкой степени ее дифференцировки и лимфоваскулярной инвазии, а также при обнаружении люминального В или трижды негативного молекулярного подтипа рака молочной железы) следует облучить хотя бы грудную стенку для снижения риска локального рецидива. Вероятно, в большинстве клинических ситуаций этой областью можно ограничиться.
Лучевая терапия на зоны регионарного лимфооттока чревата усугублением частоты и выраженности лимфостаза, развитием пневмофиброзов и сердечно-сосудистых осложнений. Подобный риск повышается при использовании 2-D-конвенционального облучения с более проблематичной стыковкой полей. Учитывая такую небезобидность лучевой терапии на регионарные зоны, при раннем раке подход к ее назначению должен быть максимально индивидуальным и взвешенным.
По мнению экспертов NCCN, если решение о лучевой терапии при Т1–2N1 принято, следует проводить облучение грудной стенки и надключичной области. С этим сложно не согласиться, особенно когда имеют место выявленная неадекватная подмышечная лимфодиссекция при количестве удаленных лимфоузлов менее восьми (необходимо рассмотреть возможность облучения подмышечной области), выраженная лимфоваскулярная инвазия, а также трижды негативный РМЖ.
Для подтверждения последнего предположения можно обратиться к результатам двух недавних работ. J. Wang и соавт. оценивали эффективность лечения 681 больной ранним тройным негативным РМЖ стадий I–II после радикальной мастэктомии и адъювантной химиотерапии в зависимости от добавления лучевой терапии в полном объеме (грудная стенка и зоны регионарного лимфооттока) либо без таковой. Причем основное внимание уделялось показателям пятилетней безрецидивной и пятилетней общей выживаемости. Средний период наблюдения при этом составил 86,5 месяца. Оказалось, что адъювантная лучевая терапия позволяет увеличить показатели безрецидивной выживаемости до 88,3% (против 74,6% в отсутствие таковой) и общей выживаемости до 90,4% (против 78,7%) без существенного увеличения токсичности [10].
T.J. Whelan и соавт. в подгруппе больных (как правило, с T1–2N1) после радикальной резекции с отрицательными рецепторами эстрогенов и прогестерона при облучении молочной железы и всех зон регионарных лимфоузлов установили тенденцию к лучшей общей выживаемости по сравнению с теми, у кого облучению подвергалась только молочная железа (81,3 против 73,9%) [11].
Вопрос о включении в облучаемые зоны парастернальной области остается одним из наиболее дискутабельных, несмотря на то что за последние три года появились результаты рандомизированных исследований, в частности EORTC 22922 и MA20, а также метаанализ 2013 г. Ни в одном из них не выявлено явных преимуществ добавления парастернального поля. Вероятно, поэтому рекомендации St. Gallen – 2015 не содержат прямых указаний на необходимость облучения данной зоны.
Наиболее подходящим для нашей клинической ситуации представляется исследование французских авторов [12]. Из 1334 больных после радикальной мастэктомии, включенных в исследование, почти 90% имели Т1–2. Больных с N1 насчитывалось более половины. Пациентки были рандомизированы на группы в соответствии с возрастом, рецепторным статусом и лекарственным лечением. В контрольной группе облучали грудную стенку и надподключичную зону. В экспериментальной группе лучевая терапия проводилась дополнительно на парастернальные лимфоузлы. Анализ десятилетней общей выживаемости продемонстрировал статистически недостоверное преимущество – 3,3%. Причина скорее всего в том, что изначально авторы предполагали более значительный выигрыш – 10%. При этом анализ по подгруппам в зависимости от локализации опухоли (медиальный/центральный или латеральный квадрант), наличия или отсутствия пораженных подмышечных лимфоузлов (N1 или N0), проведения адъювантной химиотерапии либо отказа от нее также не выявил достоверных преимуществ включения в зону облучения парастернального поля. Между тем при наличии медиальной или центральной локализации и N1 проведение парастернального облучения приводило к более существенной разнице в показателях выживаемости как среди тех, кто получал адъювантную химиотерапию, так и среди тех, кому она не проводилась.
Таким образом, расширение зон послеоперационного облучения с захватом надподключичной области в большей степени показано пациенткам с трижды негативным РМЖ, особенно при условии неадекватного исследования подмышечных лимфоузлов (когда необходимо облучение подмышечной зоны), а также больным с выраженной лимфоваскулярной инвазией, даже при стадии T3N0M0, как рекомендуют специалисты Американского колледжа радиологии (American College of Radiology). При локализации опухоли во внутреннем или центральном квадранте молочной железы и поражении подмышечных лимфоузлов, особенно в сочетании с другими факторами риска, необходимо рассмотреть возможность облучения парастернальной области.
Итак, больные РМЖ T2N1M0 после радикальной мастэктомии требуют индивидуального подхода. При наличии весомых факторов риска целесообразно облучение хотя бы грудной стенки, в ряде случаев надподключичных, а также парастернальных и подмышечных лимфоузлов. В некоторых ситуациях оставить данную категорию пациенток без облучения, не взвесив тщательно все аргументы «за» и «против», было бы опрометчиво.
N.V. Dengina
District Clinical Oncologic Dispensary, Ulyanovsk
Contact person: Natalya Vladimirovna Dengina, natalieden@hotbox.ru
The main goal of postoperative radiotherapy in breast cancer is the reducing of recurrence risk. The most controversial situation has always been with T2N1M0 patients after radical mastectomy. The following article is the review of studies performing the impact of various risk factors on choosing postoperative irradiation in such situations. Special consideration should be given to postmastectomy radiotherapy in the presence of at least two of the following risk factors: age less than 40 years, the presence of positive or close (less than 1 mm) margin, extranodal spread or lymphovascular invasion, G3 tumors, luminal B or, especially, triple negative subtype of breast cancer.
