Перспективы комплексной терапии больных алкогольной болезнью печени с выраженными стадиями фиброза
- Аннотация
- Статья
- Ссылки
Алкогольная болезнь печени (АБП), наряду с вирусными гепатитами, является одной из наиболее актуальных проблем современной гепатологии [1, 2]. Выделяют три формы АБП: жировой гепатоз (ЖГ), алкогольный гепатит (АГ) и цирроз печени (ЦП). По крайней мере, 80% лиц, употребляющих алкоголь в больших количествах, имеют ЖГ, у 35% развивается АГ и примерно у 10% – ЦП.
Алкогольная болезнь печени (АБП), наряду с вирусными гепатитами, является одной из наиболее актуальных проблем современной гепатологии [1, 2]. Выделяют три формы АБП: жировой гепатоз (ЖГ), алкогольный гепатит (АГ) и цирроз печени (ЦП). По крайней мере, 80% лиц, употребляющих алкоголь в больших количествах, имеют ЖГ, у 35% развивается АГ и примерно у 10% – ЦП.








В клинической практике наиболее распространенной формой АБП с неблагоприятным прогнозом является алкогольный гепатит с выраженными стадиями фиброза печени [3]. Развитие фиброза представляет собой результат двух процессов: постнекротического фиброгенеза вследствие атак АГ и фиброзирования, связанного с прогрессированием жирового перерождения гепатоцитов [4]. Пристальный интерес специалистов к АБП также связан не только с широкой распространенностью патологии в развитых странах, но и с отсутствием утвержденных схем медикаментозного лечения [5]. В статье анализируется эффективность препарата Фосфоглив в сравнении с другими ЭФЛ, не содержащими глицирризиновую кислоту, в комплексной терапии пациентов АГ с выраженными стадиями фиброза
Диагностика АБП
Алкогольная болезнь печени не имеет каких-либо специфических проявлений АБП, принципиально отличающих эту нозологическую форму от других заболеваний печени. Поэтому традиционно при оценке общих клинических характеристик обращают внимание на проявления холестатического, астеновегетативного, диспептического, геморрагического, интоксикационного синдромов и выраженность гепатоспленомегалии [6].
Лабораторные характеристики при АБП также не имеют специфичности. На практике активность заболевания, как правило, оценивают на основании динамики цитолитического синдрома (преобладание активности аспартатаминотрансферазы (АСТ) над аланинаминотрансферазой (АЛТ)), симптомов холестаза, признаков иммунного воспаления и печеночно-клеточной недостаточности [10].
Некоторые специфичные признаки могут быть выявлены при ультразвуковом исследовании (УЗИ). Звукопроводимость печени при АБП снижена за счет того, что жировые включения рассеивают, отражают и поглощают эхосигнал в большей степени, чем неизмененная печеночная ткань. Вследствие этого глубокие отделы печени и диафрагма визуализируются неотчетливо (синдром дистального затухания эхосигнала). Достоверно отмечается повышение эхогенности измененной паренхимы, выраженность которой коррелирует со степенью тяжести процесса.
Изменения печени при АГ, выявленные на УЗИ, напоминают ультразвуковую картину ЖГ, но имеют и некоторые отличия: значительное повышение эхогенности поверхностных участков паренхимы с выраженным затуханием в глубоких отделах вплоть до исчезновения изображения, появление неоднородности структуры паренхимы, обеднение сосудистого рисунка до отсутствия визуализации внутрипеченочных ветвей воротной вены. Такие проявления чаще встречаются при комбинации жировой инфильтрации печени с фиброзными изменениями [6, 17].
Наиболее достоверным диагностическим критерием АБП является морфологическое исследование. С.Д. Подымова предложила оценивать степень жировой дистрофии не только на основании интенсивности ожирения, величины жировых капель, но и выраженности воспалительных и склеротических изменений в портальных трактах.
Морфологическая характеристика жировой дистрофии (по С.Д. Подымовой):
- нулевая степень – наличие мелких капель жира в отдельных группах печеночных клеток;
- I степень – умеренное очаговое средне- и крупнокапельное ожирение гепатоцитов;
- II степень – умеренно выраженное диффузное мелко-, средне- и крупнокапельное ожирение, преимущественно внутриклеточное;
- III степень – выраженное диффузное крупнокапельное ожирение с внеклеточным накоплением жира и образованием жировых кист.
Характеристика воспалительных и склеротических изменений в соединительной ткани:
- нулевая степень — отсутствие воспалительных изменений внутри долек, интактные портальные тракты;
- I степень – очаговые лимфоидные и гистиоцитарные изменения в синусоидах, очаговая пролиферация звездчатых ретикулоэндотелиоцитов;
- II степень – не резко выраженное утолщение портальных трактов за счет склероза, очаговой гистиолимфоидной инфильтрации;
- III степень – выраженное утолщение отдельных портальных трактов, отдельные широкие прослойки соединительной ткани с тяжами фибробластов, очаговыми гистиоцитарными, лейкоцитарными инфильтратами.
Помимо признаков жировой дистрофии и фиброза, обнаруживаются также гепатоциты в состоянии баллонной дистрофии, выявляются гиалиновые тельца Мэллори.
Точность оценки основных гистологических характеристик при АБП зависит от методики получения морфологического материала – биопсии печени, которая имеет ряд недостатков: риск возникновения нежелательных явлений, ошибка выборки и патологическая вариабельность [9].
Среди альтернативных – неинвазивных – методов, подтвердивших диагностическую и прогностическую ценность сывороточных биохимических маркеров для оценки степени стеатоза, активности воспалительных изменений в печени и стадии фиброза, наиболее достоверным на сегодняшний день является тест ФиброМакс [8]. Он состоит из пяти расчетных алгоритмов и выполняется по результатам математической обработки десяти биохимических показателей крови: альфа-2-макроглобулин, гаптоглобин, аполипопротеин А1, гамма-глютамилтрансфераза (ГГТ), общий билирубин, АЛТ, АСТ, триглицериды, общий холестерин и глюкоза.
Лечение АБП
Основными составляющими лечения АБП, преимущественно на стадии ЖГ, помимо исключения алкоголя, являются режим, сбалансированная диета, отмена гепатотоксичных препаратов, коррекция метаболических нарушений, а также профилактика осложнений [16].
С учетом патогенеза АГ, направлениями терапии являются воздействие на гипериммунный ответ, оксидативный стресс и фиброгенез.
Препаратами выбора для коррекции гипериммунного ответа считаются глюкокортикостероиды (ГКС), хотя целесообразность их назначения при АГ до сих пор обсуждается. Применение ГКС при АГ обусловлено их блокирующим действием на цитотоксические и воспалительные механизмы развития заболевания. ГКС уменьшают уровень циркулирующих воспалительных цитокинов, таких как TNF-α, и приводят к гистологическому улучшению за короткий период [8].
К настоящему моменту проанализировано 12 рандомизированных исследований по изучению эффективности ГКС. В пяти из них было продемонстрировано уменьшение смертности больных АГ, а в семи – таких данных получено не было. Метаанализ проведенных научных изысканий подтвердил, что назначение ГКС пациентам с тяжелой формой АГ снижает смертность, независимо от наличия печеночной энцефалопатии. То есть применение ГКС целесообразно только у тяжелых больных АГ, при отсутствии рисков желудочно-кишечного кровотечения и инфекционных осложнений [4, 14].
Для терапии оксидативного стресса при атаке АГ используются препараты группы гепатопротекторов, наиболее известными из которых являются эссенциальные фосфолипиды (ЭФЛ). ЭФЛ представляют собой очищенную смесь полиненасыщенных фосфолипидов (преимущественно фосфатидилхолина), которые получают из бобов сои. Применение ЭФЛ восстанавливает дефицит фосфолипидов в организме, которые используются в качестве строительного материала клеточных мембран, а также являются мишенью для свободных радикалов, уменьшая проявления окислительного стресса [7, 15].
Вопрос об антифибротическом действии ЭФЛ на печень человека остается открытым до настоящего времени. При этом исследований с достоверным морфологическим контролем, доказывающих влияние фосфатидилхолина на фиброгенез, совсем немного. Есть в том числе и противоречивые данные, ограничивающие прием ЭФЛ, как малоэффективных в отношении печеночного фиброза фармакологических средств.
Поэтому поиск лекарственных препаратов с антифибротическим действием актуален до настоящего времени. Одним из наиболее известных и давно используемых в Юго-Восточной Азии лекарственных средств является вещество, получаемое из корня солодки, – глицирризиновая кислота [11].
Глицирризиновая кислота оказывает гепатопротекторное действие, усиливая фагоцитоз и активность естественных киллеров, а также благодаря выраженному антиоксидантному эффекту и ингибированию активности фосфопротеинкиназы С, которая в условиях патологии печени вызывает иммунную дисрегуляцию. Кроме того, глицирризиновая кислота является синергистом кортикостероидных гормонов, активирует макрофаги, обладает антиаллергическими, противовирусными свойствами и иммуномодулирующей активностью [12, 13].
Все это послужило предпосылкой для разработки комбинированного лекарственного средства – препарата Фосфоглив. Благодаря подобранному оптимальному сочетанию фосфолипидов и глицирризиновой кислоты, Фосфоглив является принципиально новым, не имеющим аналогов лекарственным препаратом, способным восстанавливать функции печени за счет комбинированного мембраностабилизирующего и антифибротического действия.
Препарат хорошо зарекомендовал себя в лечении вирусных гепатитов, но его эффективность при АБП и в особенности при АГ остается до конца не изученной.
Целью исследования явилось изучение эффективности препарата Фосфоглив в сравнении с другими ЭФЛ, не содержащими глицирризиновую кислоту, в комплексной терапии пациентов АГ с выраженными стадиями фиброза.
Материал и методы исследования
В состав анализируемой выборки было включено 82 больных АГ с выраженной стадией фиброза (F-3, F-4 по Metavir), средний возраст которых составил 42,1 ± 11,4 года. Соотношение полов в исследуемой группе составило: 63,4% мужчин (52 человека) и 36,6% женщин (30 человек).
Общее количество пациентов, которые на фоне комплексной терапии получали Фосфоглив (далее I, или опытная, группа), составило 39 человек, средний возраст 41,3 ± 9 лет, соотношение мужчин и женщин – 61,5 и 38,5% (24 и 15 человек соответственно).
Группа сравнения представляла собой выборку 43 больных, получавших стандартную комплексную терапию с использованием других ЭФЛ (группа сравнения, или II группа), средний возраст 48,4 ± 12,6 лет. Соотношение мужчин и женщин среди больных II группы составило 65,1 и 34,9% (28 и 15 человек соответственно).
Деление пациентов на группы было случайным и проводилось до начала их клинического обследования.
В исследование включались больные АГ, не нуждающиеся в назначении глюкокортикоидов, которым было проведено комплексное обследование, в том числе общепринятые клинические, инструментальные и лабораторные методы, а также гистологическое исследование печеночных биоптатов или фибротест.
Пациенты, не соблюдающие режим отказа от алкоголя, из исследования исключались.
Динамическая биопсия печени была проведена у 19 больных I группы и у 18 пациентов II группы. При гистологическом исследовании степень стеатоза оценивалась по классификации С. Подымовой. Оценка морфологической активности воспалительного процесса и стадии фиброзного процесса в печени проводилась по шкале Metavir.
Неинвазивная оценка фиброза в печени была проведена с помощью теста ФиброМакс у 20 больных АГ в I группе и у 25 – во II группе. Для унификации оценки гистологической картины, морфологические показатели, исследуемые при биопсии, были сопоставлены с результатами фибротеста.
Программа лечения пациентов I группы включала, помимо традиционной метаболической и инфузионной терапии, дополнительное назначение Фосфоглива. Фосфоглив применялся по 2 флакона (5,0) в 20 мл воды для инъекции внутривенно медленно 1 раз в сутки ежедневно в течение 28 дней, с переходом на пероральный прием в суточной дозе 6 капсул, разделенных на 3 приема, в течение 6 месяцев.
У больных II группы использовалась только стандартная метаболическая терапия, включающая ЭФЛ в эквивалентной по содержанию фосфатидилхолина дозировке. Контрольное обследование с морфологическим контролем или фибротестом проводилось через 6 месяцев (180 дней), с промежуточной точкой определения клинико-биохимической активности на 28-е сутки.
Результаты исследования
Динамика основных клинических проявлений у больных АГ на фоне терапии
Оценка выраженности клинической симптоматики у пациентов АГ производилась динамически, при этом длительность существования симптомов отличалась у больных I и II групп. Наиболее отчетливо это показал анализ клинической симптоматики на 28-й день исследования (окончание парентеральной терапии в I группе), выявивший различия между группой больных, получавших традиционную метаболическую терапию с ЭФЛ, и пациентами, принимавшими Фосфоглив (табл. 1).
Из таблицы 1 следует, что у больных I группы к моменту окончания парентеральной терапии значительно уменьшились проявления синдрома холестаза, в частности, частота желтухи – в 5 раз, иктеричности – в 2,5 раза, потемнения мочи – в 7 раз. В группе сравнения отмечалась аналогичная динамика изменений, но с менее значимым уменьшением частоты желтухи – в 2 раза, иктеричности – в 1,5 раза, потемнения мочи – в 2,5 раза. Частота таких клинических симптомов, как гепатомегалия, в I группе уменьшилась более чем в 2 раза, спленомегалия – более чем в 4 раза, тогда как в группе сравнения – всего на 6 и 5% соответственно.
Проявления диспепсии в I группе купировались, а астеновегетативного синдрома уменьшились более чем в 3 раза, тогда как во II группе диспепсия сохранялась более чем у 14%, а астеновегетативные проявления уменьшились менее чем в 1,5 раза.
Частота телеангиэктазий как проявления активности процесса в I группе снизилась в 4 раза, а в группе сравнения в 1,5 раза. Значимая динамика симптома пальмарной эритемы отсутствовала в обеих группах.
Анализ клинических данных на 180-й день исследования показал, что основные симптомы сохранялись в том же виде, что и на 28-й день, с умеренной тенденцией к уменьшению их удельного веса (табл. 2).
Как представлено в таблице 2, проявления желтухи купировались к концу периода наблюдения в обеих группах, тогда как потемнение мочи и диспепсия полностью регрессировали только в опытной группе. Другие клинические признаки поражения печени и астеновегетативного синдрома характеризовались однонаправленными, с динамикой на 28-е сутки, изменениями.
Динамика основных биохимических изменений у больных АГ на фоне терапии
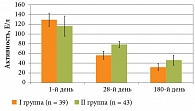
Исходная активность аминотрансаминаз (АЛТ, АСТ) у пациентов с АГ не имела существенных различий между сравниваемыми группами, однако в целом у больных опытной группы на старте отмечалась тенденция к более высокой активности трансаминаз, чем в группе сравнения. При этом динамика активности АЛТ имела различия между больными АГ, которые получали лечение Фосфогливом, по сравнению с пациентами, получавшими другие ЭФЛ (рис. 1).
Таким образом, средние показатели АЛТ у больных достоверно снижались на фоне проводимой терапии в 2,3 раза в I и в 1,5 раза во II группе (р = 0,001). К 180-му дню у пациентов опытной группы отмечалась полная нормализация показателя, а в группе сравнения наметилась значимая тенденция к этому.
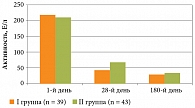
Аналогичная направленность, но с более выраженными различиями, у больных АГ наблюдалась при оценке динамики активности АСТ (рис. 2).
Выраженность цитолитического синдрома коррелировала с интенсивностью лабораторных проявлений синдрома холестаза, оценка которого производилась по уровню билирубина (табл. 3).
Из таблицы 3 следует, что оценка исходного уровня билирубина выявила его нормальные величины у 6 (15,4%) пациентов опытной группы и у 5 (11,6%) группы сравнения. На 28-й день лечения нормализация уровня билирубина произошла у 29 (74,4%) пациентов I группы и у 26 (60,4%) – II, а к 180-му дню показатели билирубина были нормальными у 38 (97,4%) больных, принимавших Фосфоглив, и у 36 (83,7%) пациентов группы сравнения (р = 0,05), что свидетельствовало о более затяжной динамике холестаза при проведении терапии другими ЭФЛ.
Не менее важным, чем билирубин, показателем, характеризующим синдром холестаза у больных АГ, являлась активность щелочной фосфатазы (ЩФ) (табл. 4).
Как следует из таблицы 4, в группе больных, дополнительно принимавших Фосфоглив, исходно нормальная величина ЩФ определялась у 5 (12,8%) человек, а из пациентов, получавших терапию ЭФЛ, – у 6 (13,9%) пациентов. На 28-е сутки у большинства пациентов I группы – 30 (76,9%) человек – были зарегистрированы нормальные показатели ЩФ. В то же время у многих пациентов II группы полная нормализация данного показателя не произошла даже на 180-й день – у 34 (79,0%) больных.
По аналогии с активностью ЩФ регистрировалось изменение активности гамма-глютамилтранспептидазы (ГГТП) (табл. 5).
Как следует из таблицы 5, среди пациентов обеих групп исходно преобладала высокая активность ГГТП. Однако уже к 28-му дню лечения у значительного числа пациентов I группы – 27 (69,2%) человек – величина ГГТП нормализовалась. В группе сравнения, в свою очередь, в течение 4 недель терапии отмечалась только умеренная положительная динамика снижения активности ГГТП. На 180-й день нормализация величины ГГТП регистрировалась у 32 (74,4%) пациентов, не получавших Фосфоглив.
Таким образом, использование в составе терапии препарата, содержащего глицирризиновую кислоту, достоверно способствовало более быстрой и значимой динамике лабораторных проявлений синдромов цитолиза (активности АЛТ, АСТ), холестаза (уровней общего билирубина, активности ЩФ, ГГТП) у больных АГ.
Динамика основных сонографических показателей у больных АГ на фоне терапии
В рамках симплексного плана диагностики всем пациентам АГ в динамике проводилось УЗИ. Прицельно с помощью сонографии у больных оценивалась степень ЖГ (табл. 6).
Как свидетельствуют данные, представленные в таблице 6, у пациентов, дополнительно получавших Фосфоглив, регистрировалось значимое уменьшение степени ЖГ. Так, к окончанию периода лечения количество больных с 3-й степенью уменьшилось более чем в 3,5 раза, тогда как в группе сравнения только в 1,5 раза (р < 0,05). Количество пациентов со 2-й степенью ЖГ значимо не менялось в связи с пополнением этой группы за счет больных, у которых степень ЖГ регрессировала с 3-й на 2-ю. При этом число пациентов с 1-й степенью ЖГ в опытной группе увеличилось в 8 раз, тогда как в группе сравнения только в 2 раза, что свидетельствовало о более выраженной эффективности лечения в регрессии жировой дистрофии на фоне приема Фосфоглива.
Динамика основных морфологических характеристик у больных АГ на фоне терапии
Результаты комплексного морфологического анализа, включающего данные фибротеста, также были проанализированы в зависимости от исследовательской группы. По аналогии с УЗИ, важным показателем, характеризующим течение заболевания, явилась степень тяжести ЖГ. При этом значимых различий в процентном отношении распределения больных между опытной группой и группой сравнения не регистрировалось.
Динамика морфологических показателей, так же как и при ультрасонографии, характеризовалась уменьшением степени ЖГ в обеих группах (табл. 7).
Как следует из таблицы 7, в группе больных, дополнительно получавших Фосфоглив, количество лиц с выраженной степенью ЖГ уменьшилось почти в 3 раза, тогда как в группе сравнения аналогичное уменьшение произошло менее чем в 1,5 раза (р < 0,05).
Достоверные различия по числу пациентов с умеренной степенью ЖГ в обеих группах не регистрировались. Данный факт был связан с количественным приростом группы за счет больных, у которых регрессировала более выраженная степень жировой дистрофии печени.
Анализ количества пациентов с минимальной выраженностью ЖГ свидетельствовал о значимом увеличении числа больных в опытной группе (более чем в 3 раза), тогда как в группе сравнения общее количество пациентов с минимальной степенью ЖГ возросло не более чем в 1,5 раза.
Оценка морфологической активности патологического процесса в печени у больных АГ на фоне проводимой терапии, аналогично оценке степени ЖГ, производилась суммарно путем динамической биопсии печени или ФиброМакс (табл. 8).
Как следует из таблицы 8, в I и II группах после проведенного лечения больных с выраженной активностью воспалительных изменений в печени выявлено не было, что в целом свидетельствовало об эффективности обоих вариантов терапии для данной морфологической характеристики.
Количество пациентов с умеренной активностью воспалительных изменений в опытной группе уменьшилось в 2 раза, тогда как в группе сравнения оно достоверно не изменилось. Число больных со слабой активностью в I группе увеличилось почти в 3 раза, тогда как во II группе – только на 30%.
В группе пациентов, не принимавших в комплексном лечении Фосфоглив, число больных с минимальной активностью значимо не изменилось, тогда как в опытной группе оно достоверно увеличилось в 8 раз, составив 9,7% против 3,6% в группе, где терапия проводилась другими ЭФЛ.
При этом собственно морфологическая картина на фоне терапии Фосфогливом характеризовалась уменьшением степени воспалительной инфильтрации, исчезновением из инфильтратов плазматических клеток и преобладанием лимфоцитарно-гистиоцитарных элементов, резорбцией мостовидных и мелкоочаговых ступенчатых некрозов и восстановлением целостности пограничной пластинки. В процентном отношении степень выраженности зернистой дистрофии и некробиоза в гепатоцитах снижалась.
Терапия другими ЭФЛ также способствовала обратному развитию ступенчатых некрозов и исчезновению телец Мэллори, однако при этом сохранялась высокая степень воспалительной инфильтрации и нарушение целостности пограничной пластинки.
Наиболее важным гистологическим показателем, характеризующим стадию заболевания, явилась оценка выраженности фиброзных процессов в печени. При этом интенсивность фиброгенеза у пациентов обеих групп характеризовалась в основном преобладанием порто-портального и порто-центрального фиброза, однако в обеих группах были зарегистрированы единичные случаи перипортального фиброза и уже сформировавшегося ЦП. В целом направленность изменений морфологической активности воспаления у больных АГ оказалась сопоставимой с динамикой стадии фиброза в печени (табл. 9).
Из таблицы 9 следует, что в I группе после проведенного лечения количество больных с 4-й стадией фиброза уменьшилось на 1 человека, то есть было зафиксировано обратное развитие ЦП. В свою очередь, во II группе количество больных с ЦП увеличилось на 1 человека.
Таким же образом, значимо, почти в 3 раза, в I группе уменьшилось количество пациентов с выраженным порто-портальным фиброзом в печени, в то время как в группе сравнения число больных с этой стадией фиброза – наиболее важной с прогностической точки зрения – изменилось в сторону увеличения.
Количество пациентов с 2-й стадией фиброзных изменений в печени значимо не менялось, но в I группе наблюдалась тенденция к увеличению, а во II – к уменьшению.
Наибольший прирост числа пациентов с перипортальным фиброзом отмечался в I группе больных, где их число возросло в 4 раза, составив более 20%, тогда как в группе сравнения их количество возросло в 3 раза, а фактический прирост составил всего 2 пациента.
Особый интерес вызвал факт появления больных без фиброзных изменений в печени, число которых в I группе составило 2 (5,1%), а во II – 1 (2,3%) человек. То есть у всех пациентов, имеющих исходно 1-ю стадию фиброзных изменений в печени, отмечалась его полная регрессия.
Таким образом, у больных I группы было отмечено значительное преобладание положительной динамики морфологических изменений в печени по сравнению со II группой – в виде уменьшения степени ЖГ, активности воспалительного процесса и, что наиболее важно, обратного развития фиброзных изменений.
Заключение
В целом к моменту окончания лечения на фоне лечения Фосфогливом, в сравнении с терапией другими ЭФЛ, не содержащими глицирризиновую кислоту, у большего числа пациентов отсутствовали клинические проявления диспепсического, холестатического и астеновегетативного синдромов, регрессировала гепатомегалия и печеночные знаки.
При оценке уровня билирубина, активности АСТ, АЛТ, ЩФ, ГГТП отмечалась более быстрая и значимая динамика нормализации исследуемых показателей на фоне опытного лечения.
Динамика морфологических изменений на фоне дополнения терапии больных АГ Фосфогливом характеризовалась значимым уменьшением жировой дистрофии гепатоцитов, выраженной и умеренной степеней воспалительных изменений в печени, что отражало снижение активности деструктивно-некротического процесса и способствовало более благоприятному течению заболевания.
Особое значение придавалось оценке фиброзных изменений в печени, как наиболее значимого показателя, отражающего динамику прогрессирования заболевания.
Так, в обеих группах у единичных пациентов, имевших 1-ю стадию фиброза печени, отмечалась его полная регрессия, что подтверждает антифибротический эффект обоих вариантов терапии в комбинации с исключением алкоголя. При этом в группе больных, принимавших Фосфоглив, значимо уменьшилась доля пациентов с наиболее важной с прогностической точки зрения стадией порто-портального фиброза. Лечение другими ЭФЛ, в свою очередь, не привело к существенным изменениям указанной и других стадий фиброзных изменений в печени.
Следует также заметить, что в группе, где лечение было усилено глицирризиновой кислотой, отмечалось достоверное увеличение количества больных с перипортальным фиброзом за счет уменьшения числа пациентов с более выраженными стадиями печеночного фиброза, тогда как при лечении другими ЭФЛ этот прирост был незначительным.
Таким образом, лечение больных АГ Фосфогливом в течение 6 месяцев следует рассматривать как основу базисной терапии пациентов с умеренной и выраженными стадиями фиброзных изменений в печени. Следует заметить, что значимых побочных эффектов на фоне проводимого лечения препаратом, содержащим глицирризиновую кислоту, выявлено не было. Традиционное лечение другими ЭФЛ, в свою очередь, хотя и способствует достижению клинико-биохимической ремиссии и снижению активности воспаления, не обладает значимым влиянием на выраженность морфологических и в особенности фиброзных изменений в печени.
