Первично-множественный метахронный рак молочной железы и рак яичников: диагностика и лечение
- Аннотация
- Статья
- Ссылки
- English
Введение
Последние годы в мире наблюдается тенденция к ежегодному увеличению числа больных как с впервые выявленными злокачественными новообразованиями (ЗНО), так и с первично-множественными (ПМ) ЗНО [1, 2]. В 2017 г. в России больных ЗНО насчитывалось 3 630 567, что составляло 2,5% населения страны. Среди впервые выявленных ЗНО в 2017 г. на долю первично-множественных опухолей приходилось 8,1% (34,2 на 100 тыс. населения), в 2016 г. – 7,5%, в 2015 г. – 6,7%. Из числа впервые выявленных ПМ ЗНО доля метахронного рака в 2017 г. достигла 73,6% (36 888 случаев) [3].
От числа больных ЗНО, состоявших на учете в России по состоянию на конец 2017 г. (3 630 567 пациентов), 5,3% (191 095 пациентов) имели ПМ ЗНО [3].
Изучение феномена первичной множественности опухолей приобретает все большую актуальность и значимость. Это прежде всего связано с повсеместным увеличением числа больных с данной патологией [3]. За последние десять лет заболеваемость ПМ ЗНО существенно возросла: если в 2008 г. данный показатель составлял 8,1 случая на 100 тыс. населения [4], то в 2017 г. – 34,2 [3].
По данным разных авторов, среди ПМ ЗНО наиболее распространен рак молочной железы (РМЖ) в сочетании с другими ЗНО (вторая молочная железа, тело матки, желудок, толстая кишка, кожа, яичники) [5–8].
Как известно, гормонозависимые варианты РМЖ ассоциированы с нарушением баланса эстрогенов и прогестеронов. Согласно данной теории, эстрогены и их рецепторы играют центральную роль в злокачественности процесса, поскольку повышенное содержание эстрогенов регулирует экспрессию генов, приводящих к развитию метахронного рака [6].
По данным мировой статистики, РМЖ, который нередко (15,46% случаев) метастазирует в яичники [9–11], занимает первое место как по заболеваемости, так и по смертности [3]. Из десяти наиболее распространенных онкологических заболеваний у женщин всего мира рак яичников находится на седьмом месте [3, 12–13].
В патогенезе РМЖ и рака яичников важную роль играют генетические факторы. Последнее время особое внимание уделяют наследственным синдромам, которые часто сопряжены с развитием ПМ ЗНО [9]. Генетически опосредованными факторами развития РМЖ принято считать мутации генов BRCA1 и BRCA2. При наличии BRCA-мутации повышается риск развития рака противоположной молочной железы [10] и рака яичников [11]. Из всех случаев РМЖ только 25% имеют наследственную природу [12]. У носительниц мутаций BRCA1 и BRCA2 риск развития рака яичников колеблется от 16 до 65%, в общей популяции – 1,5% [13].
ПМ ЗНО представляют сложную и многогранную проблему клинической онкологии. При генерализованных формах ПМ ЗНО возникают сложности с выбором системной лекарственной терапии, позволяющей воздействовать на все гистологические подтипы опухолевой ткани.
В настоящее время системная лекарственная терапия, увеличивающая общую выживаемость больных, признана основным методом лечения метастатического ПМ ЗНО РМЖ и рака яичников. Наиболее значимым показателем эффективности проводимой терапии служит статистически значимое увеличение общей выживаемости. Следует отметить, что далеко не каждый препарат, применяемый при метастатическом РМЖ (мРМЖ), обеспечивает статистически значимое увеличение общей выживаемости при метастатических ПМ ЗНО.
Клинический случай
Пациентка Г. 1958 года рождения в апреле 2006 г. с жалобами на наличие объемного образования в правой молочной железе обратилась в Республиканский клинический онкологический диспансер (РКОД) (Башкортостан). Семейный анамнез не отягощен. После обследования 20 апреля 2006 г. выполнена радикальная мастэктомия по Маддену слева. Диагностирован рак левой молочной железы, стадия IIА, T2N0M0. Гистология: инфильтрирующая протоковая карцинома, в лимфоузлах метастазы не выявлены. Иммуногистохимическое (ИГХ) исследование рецепторов к эстрогенам (ЭР) и прогестерону (ПР): ЭР +, Н = 80, ПР+++, Н = 220, Her2neu (+), Ki67 – 15%. По данным сцинтиграфии скелета от 27 июня 2006 г., метастазирования не выявлено.
В послеоперационном периоде пациентка в течение пяти лет (до 2011 г.) принимала тамоксифен (20 мг/сут, ежедневно). В ходе плановых обследований с 2006 по 2011 г. данных о рецидиве и метастазировании не получено.
В январе 2012 г. в возрасте 54 лет (безрецидивная выживаемость 5 лет 10 месяцев) пациентка обратилась в РКОД с жалобами на увеличение живота, боль в грудной клетке, кашель и головную боль. При объективном осмотре аускультативно выявлено ослабленное дыхание в правом легком. Данные рентгенографии органов грудной клетки (ОГК): правосторонний экссудативный плеврит. Компьютерная томография (КТ) органов малого таза (ОМТ) и органов брюшной полости (ОБП) от 3 февраля 2012 г.: объемное образование 15 × 12 см в малом тазу.
Как правило, опухолевые плевриты носят вторичный характер и встречаются у 30% онкологических больных [14]. Для проведения адекватного лечения необходима морфологическая верификация, что возможно при цитологическом исследовании плеврального выпота. Как известно, диагностическая эффективность цитологического исследования плеврального экссудата составляет от 15 до 50% [15, 16]. Для определения природы выпота выполнена пункция правой плевральной полости, получено 2 л экссудативной жидкости. Однако цитологическое заключение не содержало данных о метастазировании.
Необходимо отметить, что у пациентки Г. в течение первого года после завершения приема тамоксифена развились клинические и диагностические признаки, которые не исключали метастазирования РМЖ в яичники. Клиническая и диагностическая картина при метастазах РМЖ в яичниках схожа с таковой при раке яичников [17–19]. Это создает определенные проблемы при диагностике. В структуре всех ЗНО яичников метастатические опухоли яичников занимают от 14,7 до 21,1% [5, 12–13].
На момент проведения исследования уровень онкомаркеров находился в пределах нормы: СА 125 – 2 нг/мл, СА 15-3 – 22 нг/мл. После предоперационной подготовки 5 февраля 2012 г. пациентке выполнена экстирпация матки с придатками с резекцией большого сальника. Данные гистологического исследования: умеренно-дифференцированная цистаденокарцинома яичника. С февраля по июль 2012 г. проведено шесть курсов противоопухолевой лекарственной терапии: паклитаксел 175 мг/м² + карбоплатин AUC 6 один раз в 21 день.
Результаты контрольных КТ ОГК, ОБП и ОМТ от 28 июня 2012 г.: данных о метастазировании нет.
В декабре 2012 г. у пациентки появились жалобы на кашель и одышку, по поводу чего она обратилась в РКОД.
Ультразвуковое исследование ОБП и ОМТ от 2 декабря 2012 г.: данных о рецидиве и метастазах не получено. КТ ОГК, ОБП, ОМТ от 5 декабря 2012 г. показала прогрессирование заболевания – в обоих легких множественные метастазы диаметром до 1 см.
При генерализации ПМ ЗНО определить источник метастазирования без морфологической верификации трудно. Рентгенологическая симптоматика метастатических опухолей легких зависит от исходной локализации первичной опухоли и имеет характерные особенности, что при оценке легочных изменений позволяет предположить гистогенез опухоли, особенно в тех случаях, когда он неизвестен. Если для рака яичников характерны изолированное поражение плевры и картина плеврита без специфических рентгенологических признаков, то для РМЖ характерно диссеминированное поражение легочной ткани с очаговыми образованиями различных размеров с четкими контурами, которые хаотично расположены в легочной ткани [21–24]. По данным разных авторов, частота метастатического поражения легких при РМЖ составляет 15–29,4% [25–29]. При раке яичников в 52% случаев наблюдается изолированное поражение плевры с развитием плеврита [30–31].
С учетом наличия плеврита в анамнезе заболевания, а также давности развития РМЖ было принято решение о назначении первой линии системной противоопухолевой лекарственной терапии, применяемой при раке яичников.
С декабря 2012 г. по апрель 2013 г. проведено шесть курсов химиотерапии: паклитаксел 175 мг/м² + цисплатин 75 мг/м² один раз в 21 день.
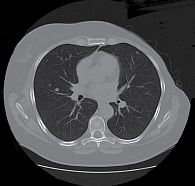
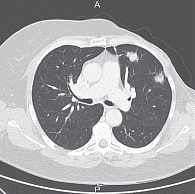
КТ ОГК и ОБП от 13 февраля 2013 г. показала стабилизацию заболевания: в легких множественные метастазы диаметром до 0,9 см, новые очаги не определены. При последующем проведении КТ ОГК от 1 апреля 2013 г. (рис. 1) отмечалась положительная динамика: размеры очагов в легких уменьшились до 0,3–0,8 см.
По завершении химиотерапии больная с мая по октябрь 2013 г. (семь месяцев) находилась под динамическим наблюдением.
При плановой КТ ОГК от 17 октября 2013 г. зафиксирована отрицательная динамика: в обоих легких множественные очаги диаметром от 0,3 до 1,5 см, новые метастатические очаги. Данные лабораторных исследований от 16 октября 2013 г.: уровень онкомаркеров в пределах нормы (СA 125 – 4,1 нг/мл, СA 15-3 – 27 нг/мл).
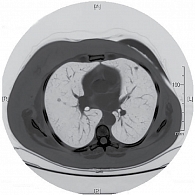
С октября 2013 г. по февраль 2014 г. проведено шесть курсов полихимиотерапии (винорелбин 25 мг/м² в первый и восьмой дни + цисплатин 75 мг/м² в первый день один раз в 21 день). При лабораторном исследовании от 4 февраля 2014 г. отрицательной динамики не наблюдалось: СА 125 – 3,5 нг/мл, СА 15-3 – 25 нг/мл. КТ ОГК от 10 февраля 2014 г. (рис. 2) показала стабилизацию заболевания: множественные метастазы в легких диаметром от 0,3 до 1,3 см.
С февраля по июнь 2014 г. пациентка находилась под динамическим наблюдением (пять месяцев).
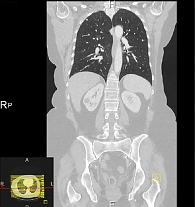
В июне 2014 г. больная по собственному желанию прошла обследование и лечение в клинике г. Мангейм. КТ ОГК и ОБП от 12 июня 2014 г. (клиника г. Мангейм) показала стабилизацию заболевания: известные пульмонологические очаги округлой формы от 0,3 до 1,2 см. Признаков новых метастатических очагов нет (рис. 3).
Очаги в легких расценивались как метастазирование рака яичника. С 25 июля 2014 г. по 3 июня 2015 г. проведена терапия пегилированным липосомальным доксорубицином 20 мг/м² в комбинации с бевацизумабом 10 мг/кг один раз в две недели. КТ ОГК и ОБП от 11 ноября 2014 г. (г. Мангейм): стабилизация заболевания – множественные метастазы в легких диаметром от 0,3 до 1,3 см. В ноябре 2014 г. (на четвертый месяц от начала приема липосомального доксорубицина и бевацизумаба) у пациентки развился ладонно-подошвенный синдром второй степени. Кроме того, она стала отмечать слабость и усталость. В связи с появлением указанных осложнений доза липосомального доксорубицина была снижена на 25% (30 мг внутривенно один раз в две недели + бевацизумаб 10 мг/кг один раз в две недели).
При плановом проведении КТ ОГК и ОБП от 12 февраля 2015 г. (г. Мангейм) отмечалась стабилизация заболевания: очаги диаметром от 0,3 до 1,4 см.
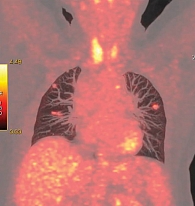
Данные позитронно-эмиссионной томографии (ПЭТ) КТ от 6 мая 2015 г. (рис. 4) показали в легких множественные очаги с увеличением размеров (10 × 15 мм, SUVmax – 2,5) и накоплением радиофармпрепарата.
ПЭТ КТ от 23 ноября 2014 г.: стабилизация заболевания.
В июне 2015 г. пациентка стала предъявлять жалобы на усталость, слабость, значительное покраснение ладоней и ступней с образованием пузырей, отечность слизистой оболочки полости рта и носа. Позднее из-за выраженного ладонно-подошвенного синдрома (волдыри, изъязвления, отеки, мешающие ходьбе, пациентка не могла носить обычную одежду и обувь) липосомальный доксорубицин был отменен (выживаемость без прогрессирования (ВБП) составила 12 месяцев), а внутривенное введение бевацизумаба 10 мг/кг с интервалом один раз в две недели продолжено. В июле 2015 г. выраженность ладонно-подошвенного синдрома уменьшилась.
В сентябре 2015 г. во время очередного контрольного обследования пациентка отмечала улучшение общего состояния при сохранявшейся боли в подошвах стоп при ходьбе, уменьшение симптомов воспаления слизистой оболочки носа. Стул и диурез были в норме, лабораторные анализы стабильны. На КТ ОГК и ОБП от 7 сентября 2015 г. (г. Мангейм) определялись множественные диссеминированные пульмональные очаги в динамике без изменений: стабилизация процесса (очаги диаметром от 0,3 до 1,4 см). Введение бевацизумаба 10 мг/кг один раз в две недели продолжилось.
КТ ОГК и ОБП от 21 марта 2016 г. (г. Мангейм) (спустя семь месяцев после предыдущего контрольного обследования): множественные диссеминированные пульмональные очаги в динамике без изменений (стабилизация процесса). Как следствие, пациентка продолжила лечение бевацизумабом 10 мг/кг один раз в две недели.
Контрольная КТ ОГК и ОБП от 27 июня 2016 г. (г. Мангейм) показала незначительное увеличение диссеминированных пульмональных очагов – на 5–10% (очаги диаметром от 0,4 до 1,6 см) (рис. 5).
В июне 2016 г. появилась одышка. По рекомендации специалистов до октября 2016 г. продолжалось введение бевацизумаба 10 мг/кг один раз в две недели (ВБП – 16 месяцев).
В октябре 2016 г. к жалобам на одышку (частота дыхательных движений около 23 в минуту) присоединились жалобы на выраженную боль в костях (позвоночнике). ECOG – 2. С целью купирования болевого синдрома назначена обезболивающая терапия трамадолом 100 мг внутримышечно три раза в день.
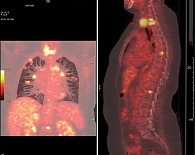
При проведении ПЭТ КТ 10 ноября 2016 г. в левой подмышечной области выявлены лимфоузлы размером до 12 мм, SUVmax – 2,86. В легких множественные метастатические очаги до 19 × 32 мм, SUVmax – 9,5. Метаболически активные очаги определены в С7-, Т1-позвонках (SUVmax – 7,99), в теле Т7-позвонка (SUVmax – 5,23), а также в теле L1-позвонка (SUVmax – 4,9). По данным ПЭТ КТ констатирована отрицательная динамика (рис. 6).
Как уже отмечалось, при РМЖ чаще наблюдается метастатическое поражение костей и легких [25–27, 32–34], при раке яичников – метастазирование в плевру и печень [31].
По данным различных авторов, метастазирование РМЖ имеет место в 70–85% случаев [32–36]. При раке яичников данный показатель значительно ниже – около 9% [35, 36]. Обычно при РМЖ поражаются поясничный и грудной отделы позвоночника – 59 и 57% случаев соответственно [25].
С 24 ноября по 7 декабря 2016 г. проведена дистанционная лучевая терапия в область метастатических очагов в кости средними фракциями (разовая очаговая доза 3 Гр) пять раз в неделю. В объем облучения включены тела позвонков Th1, С7 и Th7 (суммарная очаговая доза 30 Гр). Кроме того, с ноября 2016 г. начата терапия ингибиторами остеолиза – деносумаб 120 мг подкожно один раз в 28 дней. Отметим, что в данном случае знание гистогенеза метастазов не изменило бы подходы к применению дистанционной лучевой терапии и ингибиторов остеолиза.
В январе 2017 г. появилось нарастание одышки, сохранялась незначительная боль в грудном отделе позвоночника.
Для определения тканевой принадлежности метастатических очагов в легких 28 января 2017 г. выполнена трансторакальная биопсия метастатических очагов левого легкого (РКОД, Уфа). По результатам гистологического исследования определялась фиброзная ткань.
Метастатическое поражение легких и костей в большей степени характерно для рака молочной железы, чем для рака яичников. Но поскольку у данной пациентки не определен гистологический тип опухолевой ткани, при назначении последующей линии химиотерапии необходимо было учитывать возможность наличия как РМЖ, так и рака яичников.
На основании того что пациентка получала терапию препаратами как антрациклинового, так и таксанового ряда по поводу метастатической стадии заболевания, нами была рассмотрена возможность назначения терапии препаратом, относящимся к группе нетаксановых ингибиторов динамики микротрубочек. Эрибулина мезилат – ингибитор динамики микротрубочек, принадлежащий к галихондриновой группе противоопухолевых средств. Эрибулин является структурно упрощенным синтетическим аналогом галихондрина В, натурального вещества, выделенного из морской губки Halichondria okadai (-1, -2), который продемонстрировал достоверное увеличение общей выживаемости среди пациенток с диссеминированным РМЖ, получавших в анамнезе не менее одного режима химиотерапии по поводу распространенного заболевания, с включением антрациклинов и/или таксанов [37–40].
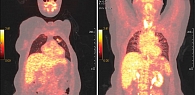
С 2 февраля 2017 г. больной была начата терапия эрибулином в четвертой линии системной химиотерапии (1,4 мг/м² в первый и восьмой дни каждого 21-дневного цикла), а также терапия деносумабом (120 мг подкожно один раз в 28 дней). В апреле 2017 г. отмечалась общая слабость, других жалоб не было. Лабораторные показатели – без значимых клинических отклонений. Терапия эрибулином, деносумабом была продолжена. При плановой ПЭТ КТ от 3 апреля 2017 г. зафиксирована положительная динамика: в левой подмышечной области лимфоузел до 6 мм (метаболически не активен), в легких очаги до 22 × 12 мм (SUVmax – 2). Кальцинация остеолитических очагов, очаги активные (рис. 7).
Терапия эрибулином была продолжена до октября 2017 г. По данным очередной контрольной ПЭТ КТ от 27 декабря 2017 г., выявлены метастатические очаги с разнонаправленной динамикой. В легких основное количество очагов с кистозной трансформацией, неактивных, в левом легком два очага, увеличенных в размере до 25 × 18 мм и метаболически активных – SUVmax – 4,95. В парамедиастинальных отделах и в базальных отделах легких постлучевой пневмонит (SUVmax – 1,6) (рис. 8).
Монотерапия эрибулином в прежней дозе продолжена.
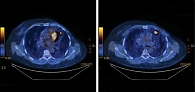
Во время очередного контрольного обследования в апреле 2018 г. какие-либо жалобы отсутствовали. Лабораторные анализы – без клинически значимых отклонений. ПЭТ КТ от 10 апреля 2018 г.: в легких множественные метаболически неактивные очаги с кистозной трансформацией. Определены два метаболически активных очага до 30 × 20 мм (SUVmax – 5,7) (ранее 25 × 18 мм, SUVmax – 4,95). В парамедиастинальных отделах и базальных отделах легких постлучевой пневмонит на момент контроля разрешился (рис. 9).
С учетом двух метаболически активных очагов, а также разрешившегося пневмонита было принято решение продолжить терапию эрибулином c добавлением эксеместана. C 15 апреля 2018 г. по настоящее время пациентка принимает эксеместан 25 мг/сут в комбинации с эрибулином. Состояние пациентки удовлетворительное. Показатели биохимического и общего анализа крови – в пределах нормы.
При осмотре в октябре 2018 г. жалобы отсутствовали. Лабораторные анализы – без клинически значимых отклонений. ПЭТ КТ от 5 октября 2018 г. показала положительную динамику с полной резорбцией опухолевой ткани (рис. 10). По состоянию на октябрь 2018 г. больная получила 29 курсов эрибулина. Лечение продолжается.
Таким образом, на фоне лечения отмечалось увеличение ВБП до 20 месяцев и общей выживаемости свыше 12 лет.
Заключение
Разнонаправленный ответ очагов в легких на режимы химиотерапии может быть обусловлен как гетерогенностью, так и гистогенезом метастатических очагов (метастазы РМЖ и рака яичников). В подобных ситуациях последовательное применение комбинаций и монотерапии цитостатиками, а также их сочетание с таргетными препаратами при метастазах различного гистогенеза позволяет обеспечивать адекватный контроль над опухолью и характеризуется умеренными проявлениями токсичности, что дает возможность продолжать противоопухолевую лекарственную терапию.
Применение эксеместана в комбинации с эрибулином позволило добиться полной резорбции опухолевой ткани, что обусловлено гетерогенностью гормоночувствительных метастатических очагов.
Наш опыт мультидисциплинарного подхода при ПМ ЗНО показал, что применение хирургических методов лечения, лучевой терапии и различных режимов противоопухолевой лекарственной терапии способно обеспечивать адекватный длительный контроль над опухолью.
В рассмотренном случае хорошую эффективность показал препарат эрибулин, который в четвертой линии терапии обеспечил длительный контроль над ростом опухоли, а через 18 месяцев терапии полный регресс метастатических очагов.
Следует также отметить, что проводимая эрибулином терапия сопровождалась управляемым уровнем токсичности и позволила пациентке сохранить качество жизни.
Публикация подготовлена при финансовой поддержке компании «Эйсай». Авторы несут полную ответственность за содержание публикации и редакционные решения.
D.D. Sakayeva, DM, Prof., A.V. Sultanbayev, Ye.V. Popova, N.I. Sultanbayeva
Republican Clinical Oncology Center (Ufa)
Contact person: Dina Damirovna Sakayeva, d_sakaeva@mail.ru
Two or more primary malignancies in one patient – such phenomenon in the general population is extremely rare. The clinical example demonstrated the complexity of diagnosis and selection of drug therapy in primary multiple metachronous breast cancer (BC) and ovarian cancer. In pretreated patients with primary multiple BC and ovarian cancer consequent use of chemotherapy significantly improves tumor response to therapy. In a patient with primary multiple BC and ovarian cancer, eribulin during long-term use demonstrated not only high efficacy, but also a controlled safety profile.
