Гистамин играет значительную роль в патогенезе аллергического ринита и бронхиальной астмы, поэтому применение антигистаминных препаратов 2-го поколения является стратегией первого выбора в фармакотерапии аллергического ринита. Эбастин – классический представитель 2-го поколения антигистаминных препаратов с высоким терапевтическим индексом.
Новая форма эбастина – лиофилизированная таблетка, которая рассасывается в полости рта без воды, – характеризуется быстрым наступлением эффекта, удобством и простотой применения, что повышает приверженность пациентов лечению.
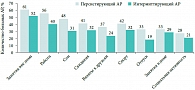
Рис. 1. Влияние аллергического ринита (АР) на различные аспекты жизни больных со среднетяжелым и тяжелым АР
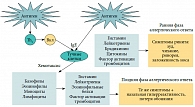
Рис. 2. Патогенез аллергического ринита
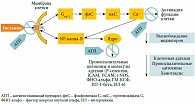
Рис. 3. Эффекты взаимодействия агониста (гистамин) и обратного агониста (антигистаминный препарат) с Н1-рецептором

Рис. 4. Ступенчатая терапия аллергического ринита*
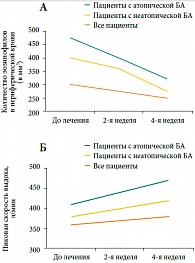
Рис. 5. Влияние эбастина на А: эозинофильное воспаление и Б: пиковую скорость выдоха у больных бронхиальной астмой (БА)*

Таблица. Антигистаминные препараты 1-го и 2-го поколения (в скобках указано торговое название)
Введение
В настоящее время распространенность аллергических заболеваний приобрела характер пандемии. Только в Европе около 150 млн человек имеют тот или иной вид аллергии. Приблизительно 30% европейцев больны аллергическим ринитом (АР) и конъюнктивитом, 20% имеют бронхиальную астму (БА), 15% страдают кожными аллергическими заболеваниями [1]. При этом от 15 до 20% больных аллергическими заболеваниями имеют высокий риск тяжелых угрожающих жизни обострений. По данным Европейской академии аллергологии и клинической иммунологии (ЕААСI – European Academy of Allergy and Clinical Immunology), через 15–20 лет половина населения Европы будет страдать от того или иного вида аллергии. Существует несколько гипотез, объясняющих рост распространенности аллергических заболеваний: экологическая, гигиеническая, генетическая. Суть наиболее распространенной, гигиенической, гипотезы заключается в том, что контакт с бактериальными агентами, наблюдающийся в период новорожденности, предупреждает последующее развитие аллергии, так как бактериальные токсины индуцируют Тh1-иммунный ответ. Ранняя иммунизация, широкое применение антибиотиков, высокий социальный уровень населения развитых стран привели к сокращению инфекционных контактов у детей, тем самым создавая условия для девиации в сторону Тh2-иммунного ответа, который определяет развитие аллергических реакций.
Аллергический ринит и бронхиальная астма – наиболее часто встречающиеся респираторные аллергические заболевания. Между ними установлена тесная взаимосвязь. Аллергический ринит не относится к числу тяжелых заболеваний, однако он является причиной существенного снижения качества жизни больных, нарушения сна, ограничений в обучении и профессиональной деятельности. В исследовании, проведенном ассоциациями пациентов с аллергическими заболеваниями различных европейских стран, более половины больных персистирующим АР и около 40% пациентов с интермиттирующим АР отметили существенное снижение качества жизни вследствие АР (рис. 1) [2]. Медицинская составляющая проблемы АР обусловлена его тесной связью с такими заболеваниями, как астма, острый и хронический риносинусит, аллергический конъюнктивит, эксcудативный средний отит. Конъюнктивит развивается у 81% пациентов с аллергией на пыльцу и у 58% пациентов с аллергией на аллергены клещей домашней пыли [3]. Распространенность АР у больных со средним экссудативным отитом варьирует от 24 до 89%, особенно часто АР является предрасполагающим фактором развития острого и хронического среднего отита у детей [4].
Взаимосвязь аллергического ринита и бронхиальной астмы
На основании эпидемиологических и клинических наблюдений установлено существование тесной связи между АР и БА. Более 80% больных БА имеют АР, и 10–40% пациентов с АР страдают БА [5, 6]. Улучшение симптомов ринита сопровождается улучшением симптомов сопутствующей БА, и наоборот – ухудшение симптомов ринита ассоциировано с утяжелением и персистенцией астматических симптомов. Эта взаимосвязь обусловлена единством триггерных факторов АР и БА, особенно при атопической природе болезни. Повышенный риск развития БА отмечается у пациентов со среднетяжелыми – тяжелыми персистирующими симптомами ринита и синусита. Многие больные АР имеют повышенную бронхиальную реактивность, что свидетельствует о том, что наличие АР является фактором риска развития БА. Пациенты, страдающие АР, имеют в несколько раз выше риск заболеть БА по сравнению со здоровыми лицами, и, как правило, АР предшествует формированию БА (у 32–49% больных) [7].
Существующая взаимосвязь «нос – легкие» в большой мере обусловлена функциональной комплементарностью этих органов. Нос и легкие являются анатомически тесно связанными органами, а патофизиологические механизмы, обусловливающие связь между АР и БА, заключаются в существовании нервно-рефлекторного механизма (назо-бронхиальный рефлекс) и единого аллергического воспаления в слизистой оболочке носа и бронхов. При этом одни и те же клетки (Т-лимфоциты, эозинофилы, тучные клетки, базофилы, эндотелиальные клетки) и одни и те же медиаторы (гистамин, цистеиниловые лейкотриены, Тh2-цитокины, хемокины и адгезионные молекулы) формируют это воспаление в слизистой оболочке носа и бронхов. На рисунке 2 представлен упрощенный механизм развития АР, в котором показана роль основных клеток и медиаторов, обусловливающих клинические проявления АР. Таким образом, верхние и нижние дыхательные пути являются единым целым, вовлекающимся в воспалительный процесс, который может поддерживаться или усиливаться с помощью механизмов внутренних связей, существующих между верхними и нижними дыхательными путями.
Роль антигистаминных препаратов в терапии аллергического ринита и бронхиальной астмы
Результаты исследований in vitro и in vivo свидетельствуют о значимой роли гистамина в патогенезе АР и БА [8–10]. Уровень гистамина в жидкости бронхоальвеолярного лаважа у больных аллергической БА коррелирует с выраженностью бронхиальной обструкции и бронхиальной гиперреактивности (БГР) [9], а в исследовании in vitro показана значимо более высокая концентрация гистамина в тучных клетках легочной ткани, полученных от пациентов с БА, по сравнению со здоровыми лицами [10]. Уровень гистамина в назальном секрете больных АР коррелирует с выраженностью симптомов ринита в ответ на провокацию аллергеном амброзии [8]. Гистамин является основным медиатором, высвобождающимся из тучных клеток в результате специфического связывания аллергена с IgE-антителами на мембране этих клеток. Основные фармакологические эффекты гистамина проявляются повышением проницаемости сосудов, отеком, гиперсекрецией и спазмом гладкой мускулатуры. Известны четыре типа гистаминовых рецепторов – Н1, Н2, Н3, Н4, которые относятся к группе рецепторов, связанных с G-белком.
Основные воспалительные эффекты гистамина обусловлены его связыванием с Н1-рецепторами, расположенными на нервных клетках, гладкомышечных и эндотелиальных клетках, гепатоцитах, нейтрофилах, эозинофилах, моноцитах, дендритных клетках, Т- и В-лимфоцитах, в желудочно-кишечном тракте, центральной нервной системе и мочевом пузыре. Н1-рецепторы в центральной нервной системе определяют такие физиологические эффекты гистамина, как регуляция цикла «сон – бодрствование». Гистамин также влияет на когнитивные способности, болевой порог, чувство насыщения.
Среди препаратов для лечения аллергического ринита наиболее широко используются пероральные антигистаминные средства. В цитировавшемся выше исследовании, в котором изучали влияние АР на качество жизни больных, отмечено, что большинство пациентов (66%) применяют именно антигистаминные препараты для контроля симптомов АР [2]. Применение антагонистов Н1-гистаминовых рецепторов блокирует эффекты гистамина и облегчает или полностью купирует проявления АР. Существуют две группы антигистаминных препаратов: 1-го поколения (седативные) и 2-го поколения (неседативные) (таблица). Использование антигистаминных препаратов 1-го поколения ограничивается их побочными эффектами: выраженным седативным действием, холинергическим, адренергическим эффектами, коротким периодом действия, быстрым развитием тахифилаксии. Антигистаминные препараты 2-го поколения являются высокоселективными блокаторами Н1-гистаминовых рецепторов. Противогистаминное действие этих препаратов проявляется быстро (в течение 1–2 часов) и длится до 12–24 часов. Применяются такие препараты однократно или максимум 2 раза в сутки.
Антигистаминные препараты 2-го поколения характеризуются незначительным седативным действием, которое, как правило, не отличается от эффекта плацебо, они также не влияют на холинергические и адренергические рецепторы. Эти препараты высокоэффективны в отношении купирования таких симптомов АР, как чихание, зуд, ринорея, и менее эффективны в отношении устранения заложенности носа и восстановления носового дыхания. При приеме per os антигистаминные препараты 2-го поколения эффективно влияют на сопутствующие проявления аллергии: симптомы конъюнктивита, атопического дерматита или крапивницы, облегчают течение БА. В экспериментальных исследованиях было показано, что спектр фармакологической активности этих препаратов не ограничивается лишь связыванием с H1-гистаминовыми рецепторами, с которыми они взаимодействуют по принципу обратных агонистов, стабилизируя Н1-рецептор в неактивном состоянии [11]. Антигистаминные препараты подавляют высвобождение провоспалительных медиаторов (гистамина, лейкотриенов), снижают экспрессию адгезионных молекул (фактора межклеточной адгезии 1 (ICAM-1) и Р-селектина) и некоторых цитокинов (ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-13, гранулоцит-макрофаг-колониестимулирующего фактора (ГМ-КСФ)). Все эти данные позволяют предполагать наличие у современных антигистаминных препаратов противовоспалительного эффекта, опосредованного даунрегуляцией, то есть снижением экспрессии транскрипционных факторов – ядерного фактора каппа B (NF-κB) и активирующего протеина 1 (АР-1), отвечающих за синтез провоспалительных цитокинов и адгезионных молекул [12] (рис. 3).
Согласно международным рекомендациям ARIA–2008 (Allergiс Rhinitis and its Impact on Asthma initiative – Инициатива «Аллергический ринит и его влияние на бронхиальную астму») [13], оральные и топические антигистаминные препараты 2-го поколения следует назначать на любой ступени терапии АР, что обусловлено их клинической эффективностью и хорошим профилем безопасности, а также противовоспалительной активностью, продемонстрированной некоторыми молекулами антигистаминных препаратов [14]. Опыт применения антигистаминных препаратов 2-го поколения при АР позволил определить основные требования к этой группе фармакологических средств: высокая клиническая эффективность в отношении симптомов интермиттирующего и персистирующего АР; способность подавлять глазные симптомы; эффективность у детей и пожилых лиц; отсутствие тахифилаксии при длительном применении; отсутствие нежелательных побочных эффектов; улучшение качества жизни больных.
Одним из препаратов, наиболее полно удовлетворяющих этим требованиям, является эбастин (торговое название – Кестин®). Эбастин – антигистаминный препарат 2-го поколения, назначаемый один раз в день и показанный для лечения АР, крапивницы и других аллергических заболеваний и состояний, обусловленных повышенным высвобождением гистамина. Основой эбастина является оксипиперидин, а фармакологически активен его метаболит каребастин. Эбастин быстро абсорбируется при применении per os, и прием пищи не влияет на его фармакокинетику. Максимальная концентрация препарата в крови после приема 10 мг достигается через 2,6–4 часа. Недавно появилась новая форма эбастина – быстрорастворимая таблетка (содержащая 20 мг препарата), которая рассасывается в полости рта без воды. Особенности этой лекарственной формы эбастина будут рассмотрены ниже.
Эритромицин и кетоконазол повышают концентрацию препарата в сыворотке крови, поэтому не следует назначать эти препараты совместно. 10 мг эбастина оказались столь же эффективны в отношении подавления кожной гистаминовой реакции, как и другие антигистаминные препараты 2-го поколения, включая лоратадин, цетиризин, фексофенадин и мизоластин [15]. Но эбастин разрешен к применению в дозе 20 мг, что закономерно обусловливает более высокую эффективность препарата в отношении подавления фармакологических эффектов гистамина при сохранении хорошего профиля безопасности. Помимо способности связываться с Н1-рецепторами было изучено влияние эбастина на другие медиаторы воспаления. Эбастин ингибирует анти-IgE-зависимое высвобождение простагландинов и лейкотриенов клетками назальных полипов, а также таких цитокинов, как ГМ-КСФ, фактор некроза опухоли (ФНО) и ИЛ-8 [16]. Эбастин также редуцирует высвобождение ГМ-КСФ в назальном секрете, уменьшает назальную эозинофилию, количество эозинофилов в крови и уровень эозинофильного катионного белка (eosinophil cationic protein, ЕСР) в плазме [16].
Влияние эбастина на воспаление в нижних дыхательных путях изучали T. Horiguchi и соавт. [17] в открытом исследовании, в которое было включено 23 больных астмой (13 – с атопической БА и 10 – с неатопической БА), получавших 10 мг эбастина в течение 4 недель. Исследовали уровень сывороточного ЕСР, эозинофилы крови, а также функциональные параметры – пиковую скорость выдоха (ПСВ) и степень БГР до начала и после окончания исследования. В результате лечения эбастином у пациентов с атопической БА было отмечено значимое снижение уровня ЕСР (с 25 ± 3 до 16,3 ± 2,4 мг/л, р < 0,0014) и числа эозинофилов в периферической крови (с 468,2 ± 44,4 до 417,3 ± 47,8 мм3, р < 0,0253) (рис. 5а). ПСВ значительно повысилась у больных атопической БА (с 410,9 ± 16,1 до 440 ± 19,1 л/мин, р < 0,0189) (рис. 5б). У пациентов с неатопической БА эти изменения были незначительными. Не было отмечено влияния эбастина на степень БГР. В этом небольшом пилотном исследовании была показана способность эбастина в некоторой степени редуцировать эозинофильное воспаление в нижних дыхательных путях у больных БА, особенно при атопической БА, что нашло отражение в увеличении функции дыхания.
Антигистаминные препараты эффективны в лечении АР, однако их польза при БА дискутабельна. Недавний обзор эффективности антигистаминных препаратов 2-го поколения у больных АР и сопутствующей БА, включивший 14 клинических исследований, показал позитивное влияние неседативных антигистаминных препаратов на симптомы БА и качество жизни больных [18]. Тем не менее в настоящее время антигистаминные препараты не рекомендуются международными руководствами для лечения БА, и ни один препарат из этой группы не имеет таких показаний. Вместе с тем неседативные антигистаминные препараты являются неотъемлемой частью комбинированной терапии ринита и астмы, и возможность использования Н1-антагонистов 2-го поколения при БА продолжает изучаться. Это обусловлено очевидной ролью гистамина в развитии воспаления и респираторных нарушений при БА. Кроме того, антигистаминные препараты 2-го поколения не обладают фармакологическими эффектами, ограничивающими их применение при сопутствующей БА, они не вызывают сухости слизистых оболочек и ухудшения отхождения вязкой мокроты.
Напротив, как уже упоминалось выше, спектр их фармакологической активности не ограничивается лишь связыванием с H1-гистаминовыми рецепторами, они подавляют высвобождение провоспалительных медиаторов, экспрессию адгезионных молекул и некоторых цитокинов, что может влиять на воспаление в нижних дыхательных путях при БА. Хорошо известно негативное влияние неконтролируемого АР на течение БА, поэтому закономерно, что улучшение симптомов АР с помощью антигистаминных препаратов 2-го поколения будет сопровождаться улучшением астматических проявлений. Эффективность эбастина при АР доказана многочисленными рандомизированными плацебоконтролируемыми исследованиями у подростков и взрослых, причем в дозе 20 мг эбастин оказался значимо эффективнее 10 мг лоратадина в отношении контроля всех симптомов сезонного АР [19]. Большинство пациентов с круглогодичным АР оценили эффект эбастина как «хороший» или «очень хороший» [20–22]. Лечение эбастином персистирующего АР значимо улучшило симптомы и назальную проходимость, оцениваемую с помощью риноманометрии [23].
Эбастин – быстрорастворимая таблетка
Эта форма эбастина с самым быстрым началом действия среди антигистаминных средств 2-го поколения была создана путем лиофилизации. Фармакокинетическая биоэквивалентность между обычной таблетированной формой эбастина и лиофилизированной формой была продемонстрирована на здоровых добровольцах, у которых диапазон эквивалентности составил 0,8–1,25 [24]. Лиофилизированная таблетка эбастина быстро растворяется в ротовой полости и не требует дополнительного употребления воды. Данная форма была создана для удобства пациентов и повышения приверженности лечению, что было продемонстрировано в трех клинических исследованиях [25–27]. В исследовании, включившем 420 пациентов с АР (70% – с интермиттирующим АР и 24% – с персистирующим АР) из Германии, Италии и Мексики, оценили предпочтения пациентов в отношении разных форм эбастина [25]. По мнению пациентов, лиофилизированные таблетки были лучше обычных по вкусовым ощущениям и текстуре. В целом 83% больных предпочли лиофилизированные таблетки обычным таблеткам эбастина.
В другом исследовании 100 пациентов с АР попросили оценить время наступления эффекта лиофилизированной таблетки эбастина по сравнению с другими ранее принимавшимися антигистаминными препаратами [26]. 85% больных оценили наступление действия лиофилизированного эбастина как «быстрое» или «очень быстрое», и 77% пациентов отметили, что эффект данной формы эбастина наступает быстрее, чем других антигистаминных препаратов, принимавшихся ими ранее. 96% больных были «удовлетворены» или «очень удовлетворены» лечением лиофилизированным эбастином, 98% хотели бы лечиться этой формой препарата снова. По мнению пациентов, лиофилизированная форма эбастина была значительно лучше (р < 0,001), чем обычные таблетки. В третьем международном многоцентровом обсервационном исследовании оценивали удовлетворенность пациентов лечением лиофилизированными таблетками эбастина с помощью специального вопросника для оценки удовлетворенности лечением [27].
В исследование включили 461 пациента с интермиттирующим или персистирующим АР, которые получали лиофилизированные таблетки эбастина 20 мг в предыдущие два месяца. Общая оценка эффективности, побочных эффектов, удобства применения и общего удовлетворения лечением была высокой для лиофилизированной таблетки эбастина. 79% больных отметили «быстрое» или «очень быстрое» наступление эффекта. 95% пациентов наблюдали «хорошую» или «очень хорошую» переносимость препарата. Существенное улучшение всех симптомов АР наблюдалось у всех пациентов. По сравнению с принимавшимися ранее антигистаминными препаратами 81% больных отметили более выраженную эффективность, 73% – лучшую переносимость, 79% – более быстрый эффект, 94% – более удобную форму лиофилизированной таблетки эбастина. Таким образом, лиофилизированные таблетки эбастина (20 мг) характеризуются быстрым наступлением эффекта, удобством и простотой применения, что повышает приверженность пациентов лечению. Эта форма препарата может быть особенно предпочтительна у больных, испытывающих трудности с глотанием, а также у пациентов с заболеваниями желудочно-кишечного тракта.






