Результаты клинического исследования российского рекомбинантного гранулоцитарного колониестимулирующего фактора Лейкостим
- Аннотация
- Статья
- Ссылки

Результаты исследования продемонстрировали высокую безопасность и хорошую переносимость препарата Лейкостим®. Частота возникновения побочных реакций, особенно возникновение костно-мышечных болей, при введении Лейкостима® была ниже в сравнении с препаратом Нейпоген®. Применение препарата Лейкостим® у больных с нейтропенией, ассоциированной с проводимой химиотерапией, позволило нормализовать число нейтрофилов в периферической крови у 100% больных. Эффект применения Лейкостима® был выраженным и стабильным, что дало возможность своевременно начать последующие курсы химиотерапии. Число введений препаратов Лейкостим® и Нейпоген®, необходимых для нормализации показателей нейтрофилов и лейкоцитов, не имело статистически значимых отличий. Применение препаратов Лейкостим® и Нейпоген® в целях первичной профилактики нейтропении позволило с примерно равной эффективностью достичь нормальных показателей числа нейтрофилов на +22 день цикла химиотерапии BEACOPP, усиленный у 100% больных. Таким образом, получены убедительные доказательства безопасности и клинической эффективности препарата Лейкостим®, что позволяет рекомендовать его для широкого применения в клинической практике при лечении нейтропении, ассоциированной с химиотерапией у больных злокачественными новообразованиями.
Результатом стремительного прогресса фундаментальной и клинической медицины стала разработка многокомпонентных протоколов химиотерапии, применение которых позволяет достичь высоких показателей выживаемости больных основными формами злокачественных новообразований. Прогресс в лечении большинства опухолей обусловлен как внедрением новых групп химиопрепаратов, так и увеличением интенсивности дозы существовавших цитостатиков (суммарной дозы химиопрепаратов, вводимых за определенное время). Одной из основных причин, ограничивающих применение высокоэффективных схем химиотерапии, является дозолимитирующая токсичность химиопрепаратов, прежде всего, их миелотоксичность. Известно, что применение большинства цитостатических препаратов приводит к развитию обратимого угнетения всего кроветворения в целом, но наибольшее клиническое значение имеет нейтропения – снижение в крови уровня гранулоцитов. Даже кратковременное падение количества гранулоцитов ниже порогового уровня – 500 мкл-1 (0,5×109/л) – может привести к развитию тяжелых инфекционных осложнений, в частности, сепсиса. Развитие инфекционных осложнений на фоне нейтропении (так называемой фебрильной нейтропении) диктует необходимость проведения дорогостоящей антибактериальной и противогрибковой терапии. Кроме того, инфекционные осложнения неизбежно увеличивают интервалы между курсами химиотерапии. Это приводит к уменьшению интенсивности дозы химиопрепаратов, что отрицательно сказывается на результатах лечения. Вследствие этого, необходимым условием проведения многих современных протоколов химиотерапии является включение в программу лечения рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора (Г-КСФ) (1-4).
Введение Г-КСФ ускоряет пролиферацию клеток-предшественников нейтрофильного ростка кроветворения (колониеобразующих единиц гранулоцитов, КОЕ-Г) и их дифференцировку в направлении зрелых нейтрофилов. Под действием Г-КСФ увеличивается выход нейтрофилов и кроветворных стволовых клеток из костного мозга в периферическую кровь. Кроме того, Г-КСФ повышает биохимическую, фагоцитарную и хемотаксическую активность нейтрофилов, усиливает синтез в организме других цитокинов (интерферонов, трансформирующего фактора роста β и др.). Тем самым, введение Г-КСФ активизирует различные неспецифические и специфические механизмы защиты организма от инфекции (5-7).
Препараты Г-КСФ могут применяться как для лечения уже развившейся нейтропении, так и для ее профилактики (8,9). Профилактическое введение Г-КСФ может носить характер первичной профилактики, при которой препарат вводится после первого же курса химиотерапии. Первичная профилактика обязательна при проведении схем химиотерапии, при которых без введения Г-КСФ частота развития фебрильной нейтропении превышает 40%. Примером таких режимов химиотерапии является протокол BEACOPP усиленный, применение которого высокоэффективно у больных с прогностически неблагоприятными формами лимфогранулематоза. Интенсивность дозы программы BEACOPP усиленный, по крайней мере, в 1,4 раза превосходит соответствующий показатель для базовой программы BEACOPP, которая у подавляющего большинства больных приводит к развитию нейтропении II-III степени. Поэтому из соображений безопасности в протокол лечения больных по программе BEACOPP усиленный в качестве средства первичной профилактики фебрильной нейтропении включен Г-КСФ. Первичная профилактика фебрильной нейтропении также может проводиться при наличии факторов, обуславливающих высокий риск ее развития – таких как исходная нейтропения, тяжелые сопутствующие заболевания, наличие очагов инфекции или раневых поверхностей, предшествующее облучение более 20% костного мозга и т.д. Назначение Г-КСФ в качестве вторичной профилактики осуществляется при наличии в анамнезе длительных эпизодов нейтропении или инфекционных осложнений на фоне нейтропении после курсов химиотерапии, аналогичных ранее проводимому (10-12). Другими важными показаниями к назначению Г-КСФ являются: мобилизация кроветворных стволовых клеток для последующей трансплантации, лечение хронических (в т.ч. врожденных) нейтропений, а также ВИЧ-ассоциированной нейтропении.
В настоящее время на рынке представлено несколько препаратов Г-КСФ. Это, прежде всего, Нейпоген® (филграстим, «Ф. Хоффманн-Ля Рош Лтд», Швейцария) и Граноцит® (ленограстим, «Авентис», Франция). Существенным фактором, ограничивающим широкое использование этих препаратов, и, соответственно, современных протоколов химиотерапии, является высокая стоимость импортных препаратов Г-КСФ. В связи с этим внедрение в клиническую практику высокоэффективных методов лечения онкологических заболеваний напрямую связано с появлением в России более доступных отечественных препаратов Г-КСФ.
В декабре 2005 года были завершены Государственные клинические испытания российского рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора Лейкостим® производства ЗАО «Биокад». В данной статье представлены и проанализированы результаты клинического исследования, целью которого являлась оценка переносимости, безопасности и терапевтической активности препарата Лейкостим®.
Материалы и методы
Исследуемый препарат
Получаемый методами генной инженерии, рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор Лейкостим® (ЗАО «Биокад», Россия) является аналогом широко используемого зарубежного препарата Г-КСФ Нейпоген® («Ф. Хоффманн-Ля Рош Лтд», Швейцария). Лейкостим® идентичен препарату Нейпоген® по физико-химическим характеристикам и специфической биологической активности. Ввиду идентичности препаратов показания, дозы и пути введения Лейкостима® аналогичны соответствующим характеристикам препарата Нейпоген®. Лейкостим® (МНН: филграстим) выпускается в форме раствора для подкожного и внутривенного введения в дозировках 150 мкг, 300 мкг и 480 мкг.
Дизайн исследования
Данное клиническое испытание являлось сравнительным рандомизированным проспективным исследованием. В соответствии с нормами GCP и этическими принципами, изложенными в Хельсинкской декларации (1964 г.), все пациенты до включения в исследование были ознакомлены с его сущностью и подписали форму добровольного информированного согласия.
Клиническими базами исследования были Гематологический научный центр Российской Академии медицинских наук, Московский научно-исследовательский онкологический институт им. П.А. Герцена и Московская городская онкологическая больница №62. Руководителем исследования являлся академик РАН и РАМН А.И.Воробьев.
На I этапе исследования из числа больных опухолями основной локализации, находившихся на стационарном лечении, была набрана группа из 10 пациентов, получавших химиотерапию, которая вызвала развитие нейтропении и/или лейкопении II-IV степени. В этой группе Лейкостим® вводился подкожно 1 раз в сутки в разовой дозе 2,5 мкг/кг (1/2 предполагаемой терапевтической дозы) до ликвидации нейтропении (до повышения содержания нейтрофилов в крови свыше 2×109/л-1). После окончания исследования в первой группе и промежуточной оценки переносимости и безопасности препарата, из аналогичного контингента пациентов была набрана вторая группа из 10 человек. Во второй группе пациенты получали Лейкостим® подкожно 1 раз в сутки в разовой дозе 5,0 мкг/кг (терапевтическая доза) до ликвидации нейтропении. После окончания исследования во второй группе проводилась оценка переносимости препарата в предполагаемой терапевтической дозе.
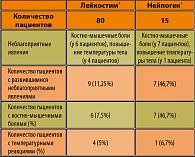
На II этапе исследования в группах больных, получавших Лейкостим®, изучалась не только переносимость, но и эффективность исследуемого препарата в полной терапевтической дозе 5,0 мкг/кг. В группе из 45 человек с развившейся после химиотерапии нейтропенией II-IV степени, Лейкостим® вводился подкожно 1 раз в сутки в разовой дозе 5,0 мкг/кг до ликвидации нейтропении (до повышения содержания нейтрофилов в крови свыше 2×109/л-1). В дополнительной группе больных лимфогранулематозом (15 человек), получавших химиотерапию по программе BEACOPP усиленный, введение Г-КСФ начинали на +9 день от начала курса полихимиотерапии (но не ранее, чем через 24 часа от последнего введения цитостатиков) и продолжали вводить один раз в день в течение 5 дней подряд в разовой дозе 5,0 мкг/кг. Больные из групп сравнения получали Нейпоген® в терапевтической дозе 5.0 мкг/кг (10 пациентов – для коррекции нейтропении, 5 пациентов – с целью ее первичной профилактики при проведении химиотерапии по программе BEACOPP усиленный). Группы пациентов, получавших исследуемый препарат и препарат сравнения, формировались методом случайной выборки и включали пациентов с близкой тяжестью заболевания. В общей сложности, в исследование было включено 95 пациентов, 80 из которых получали Лейкостим®, а 15 – Нейпоген®.
Критерии безопасности и эффективности
Безопасность оценивалась на основании анализа характера, частоты и тяжести возникавших в процессе исследования неблагоприятных явлений. Под неблагоприятными явлениями в данном исследовании понимали патологические состояния, обнаруженные или диагностированные после начала применения препарата Лейкостим®, а также обострения ранее существовавших заболеваний.
Применение препарата Лейкостим® рассматривали как эффективное, если оно привело к выходу пациентов из нейтропении, позволило избежать развития инфекционных осложнений и дало возможность выписать больного из стационара или начать следующий курс химиотерапии в запланированные сроки. Лечение рассматривали как неэффективное в случае отсутствия положительной динамики нейтропении, невозможности продолжения химиотерапии или невозможности выписки из стационара в запланированные сроки. Количественным показателем эффективности препарата Г-КСФ считали срок выхода из нейтропении (количество инъекций, понадобившихся для ликвидации нейтропении).
Результаты
Первый этап исследования
Ни у одного из 10 пациентов, которым вводился Лейкостим® в 1/2 предполагаемой терапевтической дозы (2,5 мкг/кг массы тела в сутки), не было отмечено развития местных или системных побочных реакций. Это позволило приступить к исследованию безопасности, переносимости и эффективности препарата в терапевтической дозе (5 мкг/кг массы тела в сутки) во второй группе больных. Несмотря на то, что оценка эффективности Лейкостима® не являлась первоочередной задачей на данном этапе исследования препарата, было отмечено, что у 9-ти из 10-ти пациентов после однократного введения Лейкостима® в дозе 2,5 мкг/кг массы тела происходила нормализация общего числа лейкоцитов и абсолютного числа нейтрофилов, которая позволила продолжить химиотерапию или выписать пациентов из стационара. Таким образом, подкожные инъекции Лейкостима® в 1/2 предполагаемой терапевтической дозе обладают значительной клинической эффективностью при лечении нейтропении, являющейся следствием химиотерапии онкологических больных.
После оценки результатов применения препарата Лейкостим® в первой группе, показавшей его хорошую переносимость и безопасность, было проведено исследование безопасности и эффективности Лейкостима® в полной терапевтической дозе (5 мкг/кг массы тела в сутки). Местные реакции (гиперемия, отек, гипертермия) в зоне инъекции не были отмечены ни у одного из 10 пациентов. У 1 из 10 пациентов после введения препарата было отмечено повышение температуры тела до 38,3°С, которое самостоятельно купировалось в течение 2 часов и не потребовало терапевтического вмешательства. У одной пациентки отмечалась оссалгия в вечерние часы после введения препарата, которая была снята приемом НПВП. У 7 из 10-ти пациентов после однократного введения предполагаемой терапевтической дозы Лейкостима® отмечена нормализация общего числа лейкоцитов и абсолютного числа нейтрофилов, которая позволила продолжить химиотерапию или выписать пациентов из стационара. У трех пациентов вышеуказанные показатели были восстановлены после 4-х инъекций. Таким образом, анализ результатов применения Лейкостима® во 2-ой группе больных показал, что ежедневные подкожные инъекции исследуемого препарата в полной предполагаемой терапевтической дозе безопасны, хорошо переносятся больными и обладают значительной клинической эффективностью. Это позволило приступить ко II этапу клинического испытания – исследованию эффективности препарата в терапевтической дозе (5 мкг/кг массы тела в сутки) в большей по численности группе больных.
Второй этап исследования
В группах больных, получавших Лейкостим® (общая численность – 60 человек) было проведено в общей сложности 200 инъекций препарата. Местные реакции в зоне инъекции не были отмечены ни у одного пациента. В трех случаях в первый день введения было отмечено повышение температуры тела до субфебрильных цифр, данные явления были купированы в течение дня на фоне приема НПВП или самостоятельно. Во время применения Лейкостима® 5 пациентов (один больной – дважды) отмечали типичные для препаратов цитокиновой группы миалгии и оссалгии через 6-8 часов после введения препарата. Эти симптомы были ожидаемы, имели слабую выраженность и малую продолжительность, и, как правило, не требовали лекарственной коррекции. Других общих токсических явлений или нарушений со стороны каких-либо органов и систем зарегистрировано не было. Не было отмечено ни одного неблагоприятного явления, которое обусловило бы необходимость отмены исследуемого препарата, ни одного случая возникновения побочных реакций, нетипичных для филграстима и не ожидавшихся в данном исследовании. Таким образом, результаты исследования продемонстрировали хорошую переносимость и высокую безопасность препарата Лейкостим®.
У всех включенных в исследова-ние пациентов после проведения курса инъекций препарата Лейкостим® в полной терапевтической дозе (5 мкг/кг/день) имела место нормализация общего числа лейкоцитов и абсолютного числа нейтрофилов, которая позволила продолжить химиотерапию или выписать пациентов из стационара. Таким образом, общая эффективность применения препарата Лейкостим® для лечения нейтропении после химиотерапии онкологических больных составила 100%. Примечательно, что у 16 пациентов нормализация общего числа лейкоцитов и абсолютного числа нейтрофилов наблюдалась уже после одной инъекции исследуемого препарата. Эффект Лейкостима® был стабильным, что подтверждается сохранением нормальных показателей нейтрофилов и лейкоцитов к моменту выписки больных из стационара или к началу следующего курса химиотерапии.
В группах больных, получавших Нейпоген® (общая численность – 15 человек) было проведено в общей сложности 43 инъекции препарата. Местные реакции в зоне инъекции не были отмечены ни у одного пациента. У одного пациента было зарегистрировано повышение температуры тела в первый день введения Нейпогена® через 4-6 часов поле инъекции, сопровождавшееся ознобом. В течение первых 3 дней применения препарата у больного, испытавшего эпизод лихорадки после введения Нейпогена®, отмечались кратковременные оссалгии. Еще в одном случае в течение всего срока применения Нейпогена® (2 суток) имели место умеренно выраженные миалгии, не потребовавшие никакого медицинского вмешательства и купировавшиеся самостоятельно. Еще в пяти случаях (у пяти различных пациентов) через 6-8 часов после введения Нейпогена® было отмечено развитие оссалгии и миалгии, на фоне приема НПВП данные явления были купированы. Других общих токсических явлений или нарушений со стороны каких-либо органов и систем зарегистрировано не было. Таким образом, побочные эффекты были отмечены после 10 введений препарата Нейпогена® у 7 из 15 пациентов.
У всех 15 пациентов, которым назначался Нейпоген®, количество нейтрофилов в периферической крови перед началом следующего курса химиотерапии или к моменту выписки из стационара было в пределах нормы, хотя у одного пациента отмечалась легкая лейкопения к началу следующего курса химиотерапии. Тем не менее, применение Нейпогена® позволило начать очередной курс полихимиотерапии в запланированный срок у всех больных. У 1 пациента нормализация общего числа лейкоцитов и абсолютного числа нейтрофилов наблюдалась после однократной инъекции препарата.
Обсуждение
Безопасность и переносимость Лейкостима®
Сравнительный анализ динамики лабораторных данных и изменений клинической симптоматики на фоне лечения свидетельствует о сходстве характера побочных эффектов, возникавших в процессе применения препаратов Лейкостим® и Нейпоген®.
Не было отмечено ни одного случая развития серьезных побочных эффектов, которые обусловили бы необходимость отмены какого-либо из этих препаратов. Также не было отмечено ни одного случая развития побочных реакций, которые не были бы описаны в качестве характерных при применении филграстима. В таблице 1 приведены данные о зарегистрированных в обеих группах неблагоприятных явлениях, связь которых с исследуемым препаратом или препаратом сравнения вероятна.
Несмотря на то, что корректное сравнение частоты побочных эффектов при применении Лейкостима® и Нейпогена® на основании данных этого исследования затруднительно в силу небольшого объема группы сравнения, следует отметить, что частота развития неблагоприятных явлений в группе пациентов, получавших Лейкостим®, была в 4,2 раза ниже, чем в группе больных, которым вводили Нейпоген®. При этом частота развития костно-мышечных болей в группе пациентов, получавших Лейкостим®, была ниже в 6,2 раза, а температурных реакций – в 1,3 раза.
По данным литературы, частота развития миалгий и оссалгий (обычно объединяемых как костно-мышечные боли) при применении Нейпогена® для лечения нейтропении, ассоциированной с химиотерапией, составляет 20%-40%, а в ряде исследований – до 50% (таблица 2) (13-16). В плацебо-контролируемых исследованиях частота развития данного явления в группах плацебо составляла около 5% (14). Столь высокая частота возникновения костно-мышечных болей в группе плацебо обусловлена возможным наличием метастатического поражения костей и тяжелым соматическим статусом пациентов.
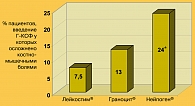
По результатам клинического исследования препарата Лейкостим®, костно-мышечные боли наблюдались у 6 из 80 пациентов, которым вводился Лейкостим® (7,5%), что не имеет существенных отличий от ретроспективных данных по группе плацебо (p=0,24). В группе Нейпогена® костно-мышечные боли были отмечены у 7 из 15 пациентов (46,7%), что соответствует литературным данным. Различия по частоте развития костно-мышечных болей при применении Нейпогена® в сравнении с аналогичным показателем в группе Лейкостима® и ретроспективными данными по применению плацебо являются статистически значимыми (p<0,001). Статистически достоверно также различие частоты развития костно-мышечных болей при применении Лейкостима® в сравнении с обобщенными ретроспективными данными по Нейпогену® (7,5% против 24%, p=0,0015) (рисунок 1).
Температурные реакции на введение препарата в данном клиническом исследовании наблюдались после введения Лейкостима® у 4 пациентов (5%), а после введения Нейпогена® – у 1 пациента (6,7%). По данным зарубежных плацебо-контролируемых исследований препаратов Г-КСФ, частота возникновения температурных реакций в группах Г-КСФ и плацебо не отличалась. Повышение температуры тела у данного контингента больных может быть обусловлено как субклиническим инфекционным процессом, протекающим на фоне нейтропении, так и опухолевым заболеванием.
Таким образом, учитывая данные литературы, можно утверждать, что в группе пациентов, которым вводился Лейкостим®, частота возникновения побочных эффектов не имела значительных отличий от ретроспективных данных по введению плацебо. Следовательно, миалгии и оссалгии, как и повышение температуры тела, могут не рассматриваться в качестве характерных осложнений применения Лейкостима®. В то же время, частота возникновения костно-мышечных болей при введении Лейкостима® значительно ниже таковой при введении других препаратов Г-КСФ.
Эффективность Лейкостима®
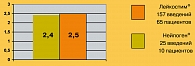
Применение обоих препаратов Г-КСФ – как Лейкостима®, так и Нейпогена®, позволило нормализовать показатели нейтрофилов и лейкоцитов у 100% больных. На рисунке 2 представлены данные о среднем количестве введений Лейкостима® и Нейпогена®, потребовавшемся для выхода из нейтропении. В данный анализ не включены пациенты, получавшие препараты Г-КСФ в качестве средства первичной профилактики нейтропении при проведении дозоинтенсивной химиотерапии по протоколу BEACOPP усиленный. Среднее число введений Лейкостима® и Нейпогена®, необходимых для коррекции нейтропении, примерно равно, что свидетельствует о сходной терапевтической эффективности данных препаратов.
Среднее число введений препарата, необходимое для коррекции нейтропении.
Следует отметить, что как в случае использования Лейкостима®, так и Нейпогена®, для первичной профилактики нейтропении, ее отсутствие к планируемому сроку начала следующего курса химиотерапии наблюдалось при применении обоих препаратов у всех пациентов, что также свидетельствует о сопоставимой терапевтической эффективности сравниваемых препаратов.
Выводы
Результаты клинического исследования рекомбинантного гранулоцитарного колониестимулирующего фактора Лейкостим® (ЗАО «Биокад», Россия) свидетельствуют о следующем:
- Российский препарат Лейкостим® безопасен и хорошо переносится при введении в полной терапевтической дозе (5 мкг/кг массы тела в сутки).
- В данном исследовании частота возникновения побочных эффектов при клиническом применении препарата Лейкостим® была ниже в сравнении с препаратом Нейпоген®.
- Применение препарата Лейкостим® у больных с нейтропенией, ассоциированной с химиотерапией, позволило нормализовать число нейтрофилов в периферической крови у 100% больных. Эффект применения Лейкостима® был выраженным и стабильным, что дало возможность своевременно начать последующие курсы химиотерапии.
- Лейкостим® обладает сопоставимой с препаратом Нейпоген® эффективностью при применении для лечения и профилактики нейтропении, ассоциированной с химиотерапией.
- Учитывая небольшое количество и малую выраженность побочных эффектов, Лейкостим® может использоваться как в стационарных, так и в амбулаторных условиях.
Данное клиническое исследование предоставило убедительные доказательства безопасности и клинической эффективности препарата Лейкостим® (ЗАО «Биокад», Россия), что позволяет рекомендовать его для широкого применения в клинической практике для лечения, а также для первичной и вторичной профилактики нейтропении, ассоциированной с химиотерапией у больных злокачественными новообразованиями. Внедрение отечественного препарата Г-КСФ в клиническую практику позволит существенно повысить доступность современных высокоэффективных методов лечения онкологических заболеваний для широкого круга российских пациентов.
