Сахарный диабет 2 типа: спорные вопросы клинической практики в дебатах экспертов. VIII Всероссийский диабетологический конгресс «Сахарный диабет – пандемия XXI века». Сателлитный симпозиум компании MSD
- Аннотация
- Статья
- Ссылки
Формат симпозиума (дебаты) должен был способствовать получению практикующими врачами более обширного представления о мировых тенденциях в терапии СД 2 типа и ситуации в реальной клинической практике. Эксперты-диабетологи поочередно обосновывали противоположные точки зрения на одну и ту же проблему. Один эксперт выступал с позиции новатора, второй – консерватора.
В рамках симпозиума обсуждались вопросы подхода к ведению больных СД 2 типа – использование патогенетической терапии или лечения «до цели», а также интенсификации терапии – всегда ли оправданна стратегия «чем раньше, тем лучше»?
Формат симпозиума (дебаты) должен был способствовать получению практикующими врачами более обширного представления о мировых тенденциях в терапии СД 2 типа и ситуации в реальной клинической практике. Эксперты-диабетологи поочередно обосновывали противоположные точки зрения на одну и ту же проблему. Один эксперт выступал с позиции новатора, второй – консерватора.
В рамках симпозиума обсуждались вопросы подхода к ведению больных СД 2 типа – использование патогенетической терапии или лечения «до цели», а также интенсификации терапии – всегда ли оправданна стратегия «чем раньше, тем лучше»?






Патогенетическая терапия СД 2 типа или лечим «до цели»?
Точка зрения новатора
Гомеостаз – способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций, направленных на поддержание динамического равновесия. Как отметил Александр Сергеевич АМЕТОВ, заведующий кафедрой эндокринологии и диабетологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования», заслуженный деятель науки РФ, д.м.н., профессор, лечение «до цели» означает достижение динамического равновесия, максимальное приближение к физиологическим условиям.
Контроль гомеостаза глюкозы представляет собой сложную, многофакторную и многоуровневую систему. Она практически исключает возможность колебаний гликемии.
Трудно представить, насколько сложна система регулирования 1 млн островковых клеток, функция которых – достижение гликемического контроля и в конечном итоге обеспечение органов и тканей важным энергетическим субстратом, в первую очередь в ответ на системный запрос энергии головным мозгом.
Перенос глюкозы через плазматическую мембрану клеток осуществляется глюкозными транспортерами. Следующая по значимости роль отводится лептину, который осуществляет информационную связь, но не в отношении глюкозы, а в отношении второго главного энергетического субстрата – жира. Далее подключаются глюкокортикостероиды и минералокортикостероиды.
В ответ на ожирение развивается инсулинорезистентность, для ее преодоления увеличивается масса функционирующих бета-клеток за счет регенерации, неогенеза и гипертрофии. Принципиально важно, что это тоже управляемые процессы. С течением времени масса бета-клеток уменьшается вследствие апоптоза и некроза и нарастает их дисфункция. Последняя является следствием совокупности факторов, прежде всего глюкозотоксичности и липотоксичности.
Избыточное количество жира в клетке опасно – длительно сохраняется положительный запас энергии. На фоне ожирения повышается уровень свободных жирных кислот, которые участвуют в развитии окислительного стресса.
Не вызывает сомнений и роль генетического фактора, запускающего нарушение системы множественного равновесия. Однако генетическая предрасположенность означает только вероятность истощения и повреждения бета-клеток. Необходимо также наличие внешних факторов – факторов-пертурбантов: особенности диеты во время беременности, внутриутробное артериальное лигирование, ожирение у матери, старение организма, сочетанные заболевания.
«Инсулинорезистентность, иммунная дисрегуляция, хроническое вялотекущее воспаление, ожирение, гипергликемия, глюкозотоксичность и липотоксичность, избыток внутриклеточного топлива создают условия для возникновения порочного круга, как следствие, ускоряется и углубляется системный дисбаланс, повреждение генетически восприимчивых клеток», – подчеркнул выступающий.
Роль эпигенетических факторов (сверх, в дополнение к генетическим) заключается в установке и снятии метаболической памяти. Эпигенетические модификации являются неотъемлемой частью процесса включения или выключения гипертрофии, пролиферации, ремоделирования и апоптоза бета-клеток1. Их влияние может сохраняться в течение длительного времени после восстановления гликемического контроля. В ряде случаев эпигенетические изменения могут быть необратимыми. Более 250 эпигенетически регулируемых генов, участвующих в метаболизме глюкозы и адаптивной выживаемости, были идентифицированы в поджелудочной железе с помощью методики профилирования метилирования ДНК2.
Однако недавно получены обнадеживающие данные: гипергликемия может не убивать бета-клетки, а делать их молчаливыми3.
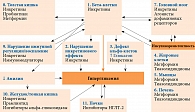
Бета-ориентированная модель патогенеза СД 2 типа включает 11 звеньев4, прежде всего это нарушение функции бета-клеток поджелудочной железы в отношении секреции инсулина, уменьшение их массы, снижение инкретинового эффекта, дефект альфа-клеток, развитие гипергликемии, инсулинорезистентность. Инсулинорезистентность жировых клеток проявляется повышением липолиза, мышечных клеток – снижением периферической утилизации глюкозы, клеток печени – повышением продукции глюкозы. Необходимо отметить, что СД 2 типа и его осложнения имеют общую этиопатофизиологию.
Универсальной терапевтической опцией являются препараты, влияющие на инкретины (рис. 1). Они воздействуют на большинство звеньев патогенеза СД 2 типа.
Инкретиновые гормоны – глюкагоноподобный пептид 1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП) – секретируются энтероэндокринными клетками и усиливают глюкозозависимую секрецию инсулина в ответ на прием пищи5. Это служит обоснованием инкретиннаправленной терапии СД 2 типа (рис. 2)6.
Инсулинотропный эффект инкретинов у пациентов с СД 2 типа снижен, в частности из-за уменьшения экспрессии инкретиновых рецепторов вследствие глюкозотоксичности. Необходимо отметить, что данный феномен наблюдается уже на стадии нарушения толерантности к глюкозе.
Препараты, обладающие инкретиновой активностью, подразделяются на две группы: ингибиторы дипептидилпептидазы 4 (ДПП-4) и агонисты рецепторов ГПП-1.
Механизм действия ингибиторов ДПП-4 направлен на предотвращение распада ГПП-1, что позволяет восстановить его физиологические концентрации и физиологические концентрации других пептидов.
Влияние ингибиторов ДПП-4 на секрецию инсулина и глюкагона носит глюкозозависимый характер. Препараты способствуют регенерации бета-клеток.
Ингибиторы ДПП-4 также оказывают негликемические эффекты, в частности положительно влияют на жировой обмен у больных с СД 2 типа и избыточной массой тела. Это продемонстрировано в исследовании Д.Г. Гусенбековой и соавт., выполненном на кафедре эндокринологии Российской медицинской академии непрерывного профессионального образования7. В исследование были включены пациенты с СД 2 типа, избыточной массой тела, нарушением липидного обмена, которые не достигали целевых уровней гликированного гемоглобина (HbA1c) на монотерапии метформином и диете.
В группе пациентов, получавших комбинированную терапию «ситаглиптин + метформин», по результатам магнитно-резонансной томографии, площадь висцерального жира через шесть месяцев снизилась на 20,62 см2 (-7,5%), подкожного – на 4,51 см2 (-1,69%).
Улучшение жирового обмена способствовало снижению уровня лептина на 7,37 нг/мл (-30,4%), увеличению уровня адипонектина на 1,95 мкг/мл (+27%).
Продемонстрирована также способность комбинации ситаглиптина с метформином улучшать функцию бета-клеток поджелудочной железы. Увеличились уровень С-пептида – на 55,8%, индекс НОМА-В – на 33,06%, индекс HOMA-IR снизился на 32%.
Далее профессор А.С. Аметов представил клинический случай, демонстрирующий эффективность комбинированной терапии ситаглиптином (препарат Янувия) и метформином.
Пациентка К., 65 лет. Длительность СД 2 типа – девять лет. Больная получала лечение метформином в дозе 1000 мг два раза в день. На фоне проводимой терапии уровень HbA1c – 8,9%, глюкозы плазмы натощак – 8,27 ммоль/л, постпрандиальной гликемии – 8,8 ммоль/л, масса тела – 77,5 кг, окружность талии – 79 см, общая антиоксидантная активность плазмы – 1,91 ммоль/л.
Результаты непрерывного мониторирования глюкозы в течение 72 часов свидетельствовали о том, что 60% времени пациентка находилась в состоянии гипергликемии.
Схема лечения была изменена. К терапии метформином (аналогичный режим применения) добавлен ситаглиптин (Янувия) в дозе 100 мг один раз в сутки.
Вследствие интенсификации лечения удалось добиться изменения структуры гликемического профиля в сторону динамического равновесия. Проведенное через месяц от начала терапии мониторирование глюкозы показало, что 88% времени пациентка находилась в состоянии нормогликемии.
Далее профессор А.С. Аметов представил участникам симпозиума новый препарат Янумет Лонг – фиксированную комбинацию метформина МВ 1000 мг и ситаглиптина 50 мг. Строение таблетки Янумет Лонг обеспечивает немедленное высвобождение ситаглиптина и постепенное, контролируемое высвобождение метформина в желудочно-кишечном тракте (ЖКТ).
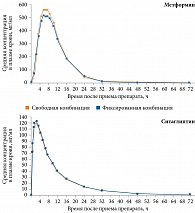
Биоэквивалентность фиксированной комбинации «метформин МВ + ситаглиптин» (препарат Янумет Лонг) оценивалась в исследовании с участием здоровых добровольцев (n = 88) (рис. 3).
Результаты исследования свидетельствуют, что препарат Янумет Лонг (метформин МВ и ситаглиптин) в дозах 500/50 и 1000/50 мг биоэквивалентен комбинации метформина МВ и ситаглиптина (Янувия) в соответствующих дозах. Была также продемонстрирована биоэквивалентность двух таблеток Янумет Лонг 500/50 мг и одной таблетки Янумет Лонг 1000/100 мг.
Высокая сахароснижающая эффективность стартовой терапии фиксированной комбинацией «метформин + ситаглиптин» (Янумет) (1000/50 мг два раза в день) по сравнению с монотерапией метформином (1000 мг два раза в день) доказана в ряде исследований. Преимущество комбинированной терапии перед монотерапией метформином было продемонстрировано у пациентов с разным уровнем HbA1c – от < 8 до ≥ 11%. К 18-й неделе наблюдения зафиксировано максимальное снижение уровня HbA1c – на 3,6%8–10.
Бесспорно, терапия СД 2 типа должна быть направлена на преодоление известных патогенетических нарушений. Она должна быть начата как можно раньше, чтобы предотвратить прогрессирование повреждения бета-клеток. Но какой она должна быть – патогенетически обоснованной или лечением «до цели»?
В обоснование ответа профессор А.С. Аметов представил вниманию аудитории два примера из клинической практики.
Клинический случай 1. Пациент Г., 65 лет. Страдает СД 2 типа около десяти лет. Получает три препарата – метформин, производные сульфонилмочевины (ПСМ) и ингибитор ДПП-4 в адекватных дозах и адекватное время.
При проведении суточного мониторирования глюкозы большую часть времени фиксировалась выраженная гипергликемия.
Пациенту непонятен термин «управление гликемией», он не соглашается на интенсификацию терапии и не готов соблюдать рекомендации врача в отношении рационального питания.
Клинический случай 2. Пациентка Ж., 58 лет. Длительность СД 2 типа – около десяти лет. Имеет высокую степень мотивации к управлению гликемией. Больная получает ингибитор ДПП-4, метформин на ночь, ингибитор натрий-глюкозного котранспортера 2 типа (НГЛТ-2).
Данные непрерывного суточного мониторирования глюкозы свидетельствуют о реальном управлении СД с максимальным достижением физиологических параметров.
«Если пациент является полноправным участником нашей команды, то приверженность лечению – ключевой фактор для эффективного управления СД 2 типа», – констатировал профессор А.С. Аметов.
Точка зрения консерватора
По мнению Гагика Радиковича ГАЛСТЯНА, заведующего отделением терапевтических и хирургических методов лечения диабетической стопы ФГБУ «Национальный медицинский исследовательский центр эндокринологии», д.м.н., профессора, на сегодняшний день лечение «до цели» (treat to target) является основополагающей задачей терапии СД 2 типа, поскольку само стремление к цели наполовину предопределяет успех ее достижения.
Лечение пациентов с СД направлено на увеличение продолжительности жизни, повышение ее качества, предупреждение развития и прогрессирования осложнений11.
Концепция лечения «до цели» применяется во всех сравнительных исследованиях эффективности и безопасности препаратов инсулина. Как показывают их результаты, цели лечения удается достичь более чем 50% пациентов вне зависимости от назначенного инсулина. Однако в реальной клинической практике менее 20% больных достигают целевых значений гликемии на фоне инсулинотерапии.
Результаты ключевых исследований UKPDS, ACCORD, ADVANCE, VADT расширили представление об эволюции, последствиях СД 2 типа и внесли серьезный вклад в решение проблемы контроля гликемии12, 13. Во всех перечисленных исследованиях изначально были определены цели по достижению непрерывного гликемического контроля. Во всех из них, за исключением исследования ACCORD, это позволяло в долгосрочной перспективе снизить смертность.
В исследовании ACCORD риск летального исхода оказался более высоким у тех пациентов, у которых уровень HbA1c не снижался после начала интенсивной терапии или сохранялся на уровне > 7,5%14. Низкий уровень HbA1c не ассоциировался с увеличением смертности.
Оценивалось также влияние гипогликемии на сердечно-сосудистые исходы и смертность. Было показано, что эпизоды тяжелой гипогликемии повышают риск летального исхода, но в группе интенсивной терапии он был наиболее низким15.
В исследовании Steno продемонстрировано преимущество раннего начала интенсивной многокомпонентной терапии перед стандартной терапией в отношении значительного уменьшения частоты cердечно-сосудистых событий и риска смерти16.
В работе S. Stark Casagrande и соавт. сравнивались эффективность и безопасность интенсивной и стандартной терапии в достижении гликемического контроля, нормализации уровня липидов и артериального давления у 120 больных СД 2 типа. Основная задача исследования состояла в том, чтобы добиться многофакторного управления диабетом. Период наблюдения продолжался с 1988 по 2010 г. Установлено, что комбинированной цели достигали преимущественно пациенты группы интенсивной терапии17.
Важно понимать, что в рутинной клинической практике лишь часть пациентов достигают контроля гликемии и отсутствие установленной цели по достижению гликемического контроля может приводить к декомпенсации диабета. «Цель важна и с точки зрения возможности достижения успеха, и с точки зрения приближения к вероятности достижения успеха», – уточнил профессор Г.Р. Галстян.
Позволит ли патогенетическая терапия СД 2 типа решить проблему достижения целей?
Поскольку СД 2 типа считается гетерогенным заболеванием и в патологический процесс вовлечены почти все органы и ткани, для изменения течения заболевания необходимо воздействовать одновременно на многие патогенетические звенья. Поэтому в современных отечественных и зарубежных алгоритмах по ведению больных СД акцент сделан на применении комбинированной сахароснижающей терапии.
В то же время при оценке эффективности сахароснижающей терапии агонистами рецепторов ГПП-1 и ингибиторами ДПП-4 (сравнительный анализ результатов 11 рандомизированных клинических исследований (РКИ) и данных реальной клинической практики (Optum Humedica database)) в условиях реальной клинической практики по сравнению с РКИ установлена так называемая нереализованная эффективность18, что объясняется преимущественно низким уровнем приверженности пациентов терапии.
Анализ швейцарской базы данных (n = 26 713) показал, что низкая приверженность лечению среди пациентов с СД 2 типа повышает риск последующей госпитализации и смерти независимо от тяжести заболевания. Так, среди приверженных лечению пациентов (42%) риск госпитализаций был ниже на 7%, смертность – на 10%19.
Таким образом, отсутствие у больного приверженности лечению, несоблюдение элементарных правил и врачебных рекомендаций являются очень важными препятствиями в достижении результата.
Еще в 1990-х гг. международными экспертами в области обучения больных диабетом (DESG) было опубликовано информационное письмо, посвященное правилам назначения пероральных сахароснижающих препаратов (ПССП). Акцент был сделан на необходимости обсуждения с пациентом назначенной терапии и обоснования ее регулярного применения.
В 2012 г. в совместном руководстве Американской диабетической ассоциации (American Diabetes Association – ADA) и Европейской ассоциации по изучению диабета (European Association for the Study of Diabetes – EASD) первым пунктом значился пациент-центрированный подход. Это означает, что необходимо оценивать предпочтительный уровень вовлечения пациента в процесс лечения, разделять с ним принятие решений, в том числе по изменению образа жизни20.
Безусловно, наряду с регулярным приемом сахароснижающих препаратов большое значение имеют меры, направленные на модификацию образа жизни, в особенности соблюдение больным диеты и повышение физической активности.
Результаты российской программы «Жизнь легка» свидетельствуют о том, что только при объединении усилий пациентов и лечащих врачей можно достичь существенных результатов. В рамках программы через 12 месяцев наблюдения было продемонстрировано среднее снижение массы тела на 5 кг у 50% больных активной группы.
Есть ли альтернатива используемым сегодня инструментам для достижения целей лечения?
По словам профессора Г.Р. Галстяна, среди факторов, влияющих на приверженность лечению, особое значение имеют безопасность и переносимость фармакотерапии. Парадокс заключается в том, что это относится и к препаратам первой линии. Так, примерно у 25% пациентов, принимающих метформин в дозах 500–2000 мг/сут, наблюдаются побочные эффекты со стороны ЖКТ21. Это приводит к прекращению приема препарата в 5–10% случаев.
Удачной альтернативой стандартному метформину стал метформин пролонгированного действия, или метформин МВ. При сопоставимой эффективности метформин пролонгированного действия характеризуется лучшей переносимостью.
Благоприятный эффект по снижению частоты развития нежелательных явлений со стороны ЖКТ получен при совместном использовании метформина и ситаглиптина по сравнению с монотерапией метформином в той же дозе.
Каковы потенциальные механизмы влияния на ЖКТ комбинации метформина и ситаглиптина? Метформин снижает абсорбцию желчных кислот и глюкозы, повышает концентрацию солей желчных кислот в кишечнике, что повышает осмотический градиент, вызывая диарею и вторично нарушая состав микробиоты22. Ситаглиптин в свою очередь оказывает протективное действие на микробиоту23. Это может объяснять лучшую переносимость метформина при совместном применении с ситаглиптином.
Фиксированная комбинация метформина МВ и ситаглиптина (препарат Янумет Лонг) потенциально может снижать частоту побочных эффектов со стороны ЖКТ и повышать приверженность пациентов лечению.
Следует также учитывать, что применение ингибиторов ДПП-4 ассоциировано с более низким риском макрососудистых осложнений.
«Получается, что от частной цели мы идем к цели глобальной, и нам удается достичь ее с учетом правильного выбора», – констатировал профессор Г.Р. Галстян в заключение своего выступления.
Точка зрения независимого эксперта
Подводя итог первой части дебатов, директор Института диабета, профессор, академик РАН М.В. Шестакова отметила: благодаря представленным точкам зрения экспертов становится очевидным, что в лечении сахарного диабета 2 типа не может быть однозначного выбора в сторону только патогенетического лечения или лечения «до цели», наиболее верной является тактика ведения пациентов «до цели», но с использованием лекарственных препаратов, влияющих на патогенез заболевания. К счастью, на сегодняшний день такие препараты присутствуют в арсенале практикующих эндокринологов.
СД 2 типа и подходы к интенсификации лечения: всегда ли «чем раньше, тем лучше?»
Точка зрения новатора
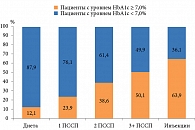
Как отметил Ашот Мусаелович МКРТУМЯН, заведующий кафедрой эндокринологии и диабетологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», руководитель отдела эндокринных и метаболических нарушений Московского клинического научного центра им. А.С. Логинова, заслуженный врач РФ, д.м.н., профессор, практически каждый второй пациент с СД 2 типа не достигает целевых значений HbA1c. Даже в развитых странах Европы доля больных СД 2 типа с уровнем HbA1c < 7,0% составляет 57,7–63,7%24.
Установлено, что контроль гликемии обусловлен видом проводимой терапии (рис. 4). Вопрос подбора адекватной терапии заболевания по-прежнему остается острым.
Монотерапия СД 2 типа, в том числе метформином, зачастую не позволяет достигать целевых значений гликемии. В исследовании UKPDS доказано, что из 44% пациентов, достигших в первые три года на фоне приема метформина уровня HbA1c < 7,0%, через шесть лет лечения только у 34% сохранялись эти показатели, а через девять лет – лишь у 13%25.
В исследовании ADOPT также продемонстрирована нарастающая с годами неэффективность монотерапии метформином, глибенкламидом, росиглитазоном.
Для удержания гликемического контроля требуется интенсификация терапии26. Несвоевременность таковой приводит к увеличению риска сердечно-сосудистых заболеваний, ранняя интенсификация терапии, наоборот, способствует профилактике их развития27–29.
Согласно результатам длительного наблюдения за пациентами с впервые выявленным диабетом, участвовавших в исследовании UKPDS, в группе лиц, изначально получавших интенсивную сахароснижающую терапию, отмечены лучший контроль гликемии и более низкая частота развития микро- и макрососудистых осложнений по сравнению с группой стандартного лечения.
В других исследованиях (ADVANCE, ACCORD, VADT) участвовали пациенты с СД длительностью от 8 до 11 лет. Результаты исследования ADVANCE продемонстрировали, что интенсивный контроль уровня глюкозы у больных со стажем диабета восемь лет и исходным уровнем HbA1c 7,5% снижает риск развития микрососудистых осложнений, но не оказывает значимого влияния на макрососудистые осложнения.
В исследовании ACCORD интенсивная терапия при средней продолжительности заболевания десять лет и исходном уровнем HbA1c 8,3% повышала риск развития макрососудистых осложнений. В исследовании VADT позднее начало интенсивной терапии при длительности диабета 11,5 года и уровне HbA1c 9,4% не оказывало значимого влияния ни на микро-, ни на макрососудистые осложнения.
В настоящее время установлено, что поэтапный подход к лечению пациентов с СД 2 типа нередко сопровождается длительными периодами гипергликемии и неспособностью достижения оптимального гликемического контроля. Поскольку СД 2 типа – сложное прогрессирующее заболевание, раннее назначение комбинированной терапии, воздействующей на разные звенья патогенеза, может способствовать более выраженному и стойкому эффекту без увеличения риска нежелательных явлений. А применение фиксированных комбинаций может повысить приверженность пациентов лечению30.
Добиться HbA1c < 6,5–7,0% у значимого числа больных при декомпенсации диабета на метформине удается за счет раннего назначения дополнительной терапии31, 32.
Какие группы препаратов можно комбинировать? Количество возможных комбинаций ограниченно из-за риска увеличения массы тела (ПСМ, тиазолидиндионы, инсулин) и гипогликемий (ПСМ и инсулин). Метформин можно комбинировать с инсулином или ПССП – ПСМ, ингибиторами ДПП-4, НГЛТ-2, агонистами рецепторов ГПП-1.
Предпочтительной может оказаться комбинация метформина с агонистами рецепторов ГПП-1 и ингибиторами ДПП-4.
Первым и наиболее изученным представителем класса ингибиторов ДПП-4 является ситаглиптин (препарат Янувия). Сравнительное исследование разных схем лечения: ситаглиптин (препарат Янувия) с метформином, ситаглиптин с ПСМ, ситаглиптин с пиоглитазоном (ПИО), метформин с ПСМ, ПСМ с ПИО, ПИО с метформином – доказало способность препарата Янувия эффективно контролировать гликемию в течение пяти лет. Так, по окончании исследования в группе «ситаглиптин + метформин» уровень HbA1c был достоверно ниже, чем в группе «ПСМ + метформин», и составил 6,4 против 7,8%33.
Назначение комбинированных препаратов, оказывающих сочетанное воздействие, способствует не только более эффективному снижению гликемии, удержанию гликемического контроля, но и уменьшению риска гипогликемий, массы тела, артериального давления и развития поздних осложнений32.
В обновленных алгоритмах Российской ассоциации эндокринологов 2017 г. указано, что стратификация лечебной тактики должна проводиться в зависимости от уровня HbA1c в дебюте заболевания, интенсификация терапии – через три месяца, но не позже шести месяцев32.
Тем не менее в рутинной клинической практике комбинация сахароснижающих препаратов зачастую назначается поздно. Данные крупного ретроспективного исследования (n = 81 573) свидетельствуют, что, несмотря на рекомендации ADA/EASD о необходимости интенсификации терапии через три месяца, в реальной клинической практике средняя продолжительность монотерапии у пациентов с HbA1c > 8,0% составляет 1,6 года, двойной комбинированной терапии – 6,9 года34.
Эффективность комбинации «метформин + ситаглиптин» (Янумет) изучалась в целом ряде исследований. Доказано, что стартовая терапия Януметом приводит к более значимому изменению уровня HbA1c к 18-й неделе терапии по сравнению с монотерапией метформином. В подгруппе пациентов с исходно высокими значениями HbA1c (> 11,0%) применение комбинации «метформин + ситаглиптин» (Янумет) способствовало его снижению на 3,6%.
Резюмируя сказанное, профессор А.М. Мкртумян сформулировал следующие выводы:
- при назначении сахароснижающей терапии необходим индивидуальный подход к выбору как препарата, так и целевых значений гликемического контроля;
- при ведении пациентов с СД 2 типа необходима своевременная интенсификация сахароснижающей терапии;
- в отсутствие противопоказаний метформин является препаратом первой линии для монотерапии;
- при выборе препарата в дополнение к метформину следует исходить из доминирующей клинической проблемы пациента;
- назначение сахароснижающего препарата должно быть согласовано с пациентом (учитываются его предпочтения, ожидания и потребности);
- наметилась тенденция к более раннему назначению комбинированной сахароснижающей терапии;
- приверженность лечению значимо выше при применении фиксированных комбинаций.
«Нет недостижимых целей, есть высокий коэффициент лени, недостаток смекалки и запас отговорок», – отметил А.М. Мкртумян в конце выступления.
Точка зрения консерватора
В начале своего выступления Нина Александровна ПЕТУНИНА, заведующая кафедрой эндокринологии Института профессионального образования ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова», д.м.н., профессор, процитировала положение Консенсуса ADA/EASD 2006 г.: «Поскольку диабет есть прогрессирующее заболевание с тенденцией к ухудшению гликемии, добавление медикаментозной терапии – это правило без исключений, если преследовать идею поддержания целей лечения на протяжении всего лечения».
В то же время результаты исследований ADVANCE, ACCORD и VADT продемонстрировали связь между усилением интенсивности терапии и частотой развития гипогликемий28, 35, 36. Так, в исследовании ACСORD в группе интенсивной терапии умерло 257 больных, из-за чего исследование было остановлено. За 3,5 года наблюдения отмечено, что интенсивная терапия увеличивает смертность и не влияет на сердечно-сосудистые исходы.
В свете сказанного не теряет актуальности и остается неизменным персонифицированный подход к управлению гипергликемией. Он предполагает постановку индивидуальных целей лечения (рекомендации ADA). В российских алгоритмах специализированной помощи больным диабетом 2017 г. также представлена четкая последовательность индивидуализированного выбора целей терапии32.
Индивидуализация терапевтических целей предусматривает менее строгий гликемический контроль для лиц с большой длительностью заболевания, потенциально высоким риском гипогликемий, высокой ожидаемой продолжительностью жизни, тяжелыми сопутствующими заболеваниями и сердечно-сосудистыми осложнениями. Безусловно, интенсификацию терапии следует исключить у пациентов 80 лет и старше, с индексом Чарлсона ≥ 3.
Конечно, интенсификация терапии позволяет достигать целей лечения, однако центральное место в этом подходе отводится приверженности лечению37. Интенсификация терапии не приверженных лечению пациентов представляет собой сложную задачу, для решения которой требуются определенные навыки.
Среди факторов, влияющих на приверженность лечению, следует выделить мотивацию больного, в повышении которой существенную роль играют взаимопонимание между доктором и пациентом, возраст пациента, длительность заболевания, безопасность и переносимость сахароснижающих препаратов, кратность приема и т.д.
Установлено, что низкая приверженность лечению вносит значимый вклад в формирование феномена клинической инертности. Клиническая инерция в свою очередь является критическим барьером для достижения гликемического контроля. R. Grant и соавт. установили, что у пациентов с высокой приверженностью лечению (> 90%) интенсификация терапии проводилась чаще, чем у пациентов со средней (50–90%) и низкой (50%) приверженностью38.
Систематический обзор четырех исследований по оценке влияния частоты приема препаратов на приверженность лечению больных СД 2 типа показал, что применение препарата один раз в сутки позволяет сохранять приверженность на уровне 79–94%, двукратный и трехкратный – на уровне 38–67%39.
Несоблюдение схемы лечения при комбинировании препаратов объясняется не только необходимостью принимать большое количество таблеток, но и развитием побочных эффектов. Одним из путей решения проблемы может стать применение фиксированных комбинаций. Установлено, что стартовая терапия фиксированной комбинацией «метформин + ситаглиптин» (Янумет) сопровождалась меньшей частотой развития нежелательных явлений со стороны ЖКТ по сравнению с монотерапией метформином8.
Эффекты метформина, как благоприятные, так и неблагоприятные, обусловлены в том числе влиянием на микробиоту. Метформин снижает абсорбцию желчных кислот и глюкозы, повышает концентрацию солей желчных кислот в кишечнике, что увеличивает осмотический градиент. Диарея приводит к вторичному нарушению состава микробиоты. Метформин по своей химической структуре сходен с селективными агонистами 5-НТ3-рецептора (серотонином, гистамином). Высвобождение серотонина вызывает диарею, рвоту, тошноту – симптомы, которые расцениваются как непереносимость метформина40. Добавление к метформину ситаглиптина, который оказывает протективное воздействие на микробиоту, позволяет повышать переносимость первого22, 23.
Результаты экспериментального исследования на моделях крыс свидетельствуют об изменении микробиоты после индукции ожирения и СД 2 типа. В рамках исследования также изучалось влияние ситаглиптина на кишечную микрофлору. Терапия ситаглиптином умеренно скорректировала дисбактериоз при СД 2 типа41.
Таким образом, фиксированная комбинация ситаглиптина и метформина позволит снизить риск побочных эффектов метформина и повысить приверженность терапии.
Безусловно, возраст пациента также влияет на соблюдение схем лечения. По мере увеличения возраста больных увеличивается и приверженность сахароснижающей терапии. Последняя наиболее высока у лиц старше 65 лет42.
Однако у пациентов с СД пожилого и старческого возраста нередко отмечаются гериатрические синдромы, имеющие психологический (депрессия, деменция, когнитивная дисфункция), социальный (изоляция, бездомность, необходимость в уходе), функциональный (отсутствие мобильности, работоспособности) и другие аспекты, которые оказывают негативное влияние на приверженность лечению43. В частности, СД 2 типа ассоциируется с повышенным риском развития деменции – в 1,5–2,5 раза44. Поэтому пациентам пожилого и старческого возраста необходимо назначать упрощенные режимы лечения (меньшая кратность приема) и использовать длительно действующие формы препаратов.
В связи со сказанным представляют интерес результаты исследования A.T. Isik и соавт., оценивавших влияние ситаглиптина на когнитивные функции пациентов с СД 2 типа и болезнью Альцгеймера или без таковой. У пациентов без болезни Альцгеймера через шесть месяцев терапии только ситаглиптином или только инсулином отмечены более высокие показатели по шкале оценки психического статуса (Mini Mental State Examination – MMSE) по сравнению с пациентами, получавшими метформин (р = 0,024). Более того, терапия ситаглиптином в течение шести месяцев способствовала улучшению когнитивных функций и у пациентов с болезнью Альцгеймера45.
В связи с высокой сердечно-сосудистой смертностью среди больных СД 2 типа особенно важна сердечно-сосудистая безопасность сахароснижающих препаратов.
Сердечно-сосудистые исходы при применении ситаглиптина оценивались в рандомизированном клиническом исследовании TECOS. Результаты исследования подтвердили профиль сердечно-сосудистой безопасности ситаглиптина46.
Завершая выступление, профессор Н.А. Петунина еще раз акцентировала внимание аудитории на том, что решение вопроса о назначении ранней интенсивной терапии больным СД 2 типа требует индивидуального подхода. Одним из важных факторов успешного управления СД 2 типа является приверженность лечению. Доказано, что более высокая приверженность лечению позволяет улучшить гликемический контроль – повышение приверженности на 10% приводит к снижению HbA1c на 0,1%47.
В заключение докладчик процитировала Френсиса Бекона, который утверждал, что «нет большей мудрости, чем своевременность».
Точка зрения независимого эксперта
По словам академика РАН М.В. Шестаковой, на сегодняшний день абсолютным приоритетом при выборе тактики ведения больного СД 2 типа на любом этапе остается индивидуальный подход. Это позволит обеспечить эффективность и безопасность сахароснижающей терапии и повысить приверженность лечению.
