Сравнительный анализ нежелательных явлений терапии ингибиторами тирозинкиназы EGFR при немелкоклеточном раке легкого
- Аннотация
- Статья
- Ссылки
- English


При выявлении активирующей мутации в гене эпидермального фактора роста (EGFR) у больных немелкоклеточным раком легкого (НМРЛ) наиболее рациональной тактикой лечения признано неотложное назначение ингибиторов тирозинкиназы (ИТК) EGFR первого или второго поколения. Такой подход, преимущество которого перед рутинными режимами химиотерапии доказано, является настоятельно рекомендуемой опцией всех международных и национальных руководств по лечению данной нозологии [1, 2]. В настоящее время в России в рутинной клинической практике используются два препарата первого поколения ИТК EGFR – эрлотиниб и гефитиниб и один второго – афатиниб. Кроме того, с учетом недавно опубликованных данных высокие шансы для применения в качестве инициирующего лечения НМРЛ EGFRm имеет осимертиниб [3]. Все три препарата, за исключением последнего, обладают сравнимой противоопухолевой эффективностью [1, 2] и в равной степени рекомендованы к применению [1, 2].
Одним из суррогатных критериев эффективности препаратов первой линии лечения рака легкого является выживаемость без прогрессирования (ВБП) болезни. При прочих равных условиях она зависит от ряда факторов. Ключевые из них – лечебный эффект и его длительность (зависит от скорости развития резистентности к препарату), переносимость терапии. Следовательно, если не принимать во внимание доступность лекарственного средства, проблема его выбора (при доказанной равной эффективности терапии разными ИТК EGFR первого и второго поколения) должна решаться с позиции именно переносимости лечения. В конечном итоге она определяется характером, частотой возникновения и длительностью побочных эффектов, возможностью их коррекции, частотой прекращения лечения из-за токсичности. Не исключено, что на лечебный эффект влияет редукция дозы и/или временная отмена лечения из-за развития нежелательных явлений. С этой точки зрения представляет интерес не только развитие токсичности 3-й степени выраженности и выше, но и 1–2-й степени, которая с учетом непрерывного и достаточно продолжительного периода приема препарата может также негативно влиять на его эффективность, особенно при необходимости отмены, а возможно, и при редукции дозы или прекращении лечения.
В ретроспективном анализе исследований LUX-Lung 3 (n = 229) и LUX-Lung 6 (n = 239) была выделена подгруппа, в которой нежелательные явления развились в течение первых шести месяцев применения афатиниба, причем значительная часть этих явлений потребовала снижения дозы препарата. Интересно, что у пациентов с площадью поверхности тела (ППТ) < 1,8 м2 снижение дозы требовалось в два раза чаще, чем у пациентов с ППТ ≥ 1,8 м2: 59 против 27% [4].
Способность сохранять прием запланированной дозы препарата отражает общую переносимость терапии.
На основании доступных данных литературы мы попытались сравнить побочные эффекты ИТК EGFR и установить различия. Для этого были использованы не только результаты рандомизированных исследований, посвященных непосредственному сравнению препаратов, но и данные крупных метаанализов, максимально приближенные к рутинной клинической практике благодаря оценке большого числа пациентов.
В достаточно полной мере осложнения терапии ИТК EGFR первого и второго поколения были отражены в метаанализе 28 исследований [5], в которых 12 564 больных получали ИТК EGFR. Его основной целью была оценка осложнений 1–2-й степени, которые в ряде случаев игнорируются, поскольку основной акцент в исследованиях был сделан на эффективности лечения.
Несмотря на отсутствие исследований прямого сравнения осложнений эрлотиниба и гефитиниба, обсуждаемый метаанализ потенциально позволяет это сделать, поскольку исходные характеристики больных принципиально не различались. Сопоставимые частота и виды осложнений, в том числе в контрольных группах химиотерапии, лишний раз подтверждают адекватность сравнения. В целом профили токсичности гефитиниба и эрлотиниба были сопоставимы. Относительный риск развития диареи 1–2-й степени статистически значимо был выше на фоне применения гефитиниба, риск развития анорексии, зуда, слабости, анемии и тошноты – при использовании эрлотиниба. Из осложнений 3–4-й степени при использовании гефитиниба чаще отмечались повышение уровня трансаминаз и развитие анемии. На фоне применения эрлотиниба чаще регистрировалась тошнота.
Наиболее полный и статистически обоснованный обзор сравнительных эффектов гефитиниба, эрлотиниба и афатиниба представлен в крупном метаанализе восьми рандомизированных и 82 когортных исследований с участием 17 621 больного. Авторы поставили цель сравнить эффективность и безопасность трех препаратов [6].
Гефитиниб и эрлотиниб ожидаемо продемонстрировали сопоставимую противоопухолевую эффективность. Отсутствовали достоверные различия в ВБП (отношение рисков (ОР) 1,00; 95%-ный доверительный интервал (ДИ) 0,95–1,04), общей выживаемости (ОВ) (ОР 0,99; 95% ДИ 0,93–1,06), эффективности (ОР 1,05; 95% ДИ 1,00–1,11) и контроле болезни (ОР 0,98; 95% ДИ 0,96–1,01). Не отмечалось значимого влияния на различия в эффективности в зависимости от варианта мутации EGFR, этнической принадлежности, линии лечения и наличия метастазов в головном мозге.
Преимущества афатиниба перед гефитинибом и эрлотинибом в первой линии терапии не установлены. Между тем эффективность афатиниба превысила таковую эрлотиниба во второй линии при плоскоклеточном раке.
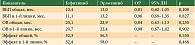
Выявлена тенденция к преимуществу гефитиниба по ряду показателей (табл. 1): реже наблюдались нежелательные явления не только 3–4-й, но и любой степени выраженности, ниже были смертность вследствие нежелательных явлений, частота редукции дозы и прекращения лечения. Однако статистически значимая разница выявлена только для частоты снижения дозы и возникновения побочных эффектов 3–4-й степени.
Что касается специфических осложнений (нежелательных явлений), за исключением нарушения функции печени 3–4-й степени, которые чаще отмечались при приеме гефитиниба (ОР 2,88; 95% ДИ 1,56–5,28; p = 0,0007), при использовании эрлотиниба чаще наблюдались кожная токсичность 3–4-й степени (ОР 0,43; 95% ДИ 0,27–0,70; p = 0,0005), диарея любой степени (ОР 0,83; 95% ДИ 0,75–0,93; p = 0,0007), тошнота/рвота любой степени (ОР 0,60; 95% ДИ 0,43–0,85; p = 0,003). У получавших гефитиниб реже развивались астенический синдром, язвенный стоматит, зуд, десквамация, запор. Однако по этим показателям данные были статистически незначимы. Не зафиксировано принципиальных различий в отношении частоты интерстициальных пульмонитов, нейтропении и анорексии.
Авторам указанного метаанализа были доступны данные четырех сравнительных исследований афатиниба с ИТК EGFR первого поколения, из них два наблюдательных, одно – прямое сравнение эффективности и безопасности афатиниба и гефитиниба, одно – сравнение эффективности и безопасности афатиниба и эрлотиниба.
В таргетной популяции больных афатиниб по сравнению с гефитинибом ассоциировался с большей продолжительностью ВБП в первой линии лечения, но различия в исследованиях варьировались (> 18 vs 11,4 месяца – в наблюдательном, 11,0 vs 10,9 месяца – в рандомизированном). Значимого влияния на ОВ не зафиксировано [7].
По сравнению с эрлотинибом в первой линии афатиниб демонстрировал схожую ВБП [8]. В свою очередь при плоскоклеточном раке во второй линии терапии ВБП и ОВ у получавших афатиниб были выше – 2,6 vs 1,9 месяца (ОР 0,81; 95% ДИ 0,69–0,96) и 7,9 vs 6,8 месяца (ОР 0,81; 95% ДИ 0,69–0,95) соответственно [9].
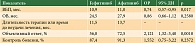
Побочные эффекты 3–4-й степени на фоне приема афатиниба и эрлотиниба принципиально не различались, но в целом превышали таковые при использовании гефитиниба [5, 7, 10]. По сравнению с гефитинибом афатиниб чаще вызывал диарею и кожную токсичность, реже – нарушение функции печени [5]. По сравнению с эрлотинибом чаще регистрировались диарея и стоматит, реже – кожная токсичность [7]. Нежелательные явления 3–4-й степени при приеме афатиниба были сравнимы с таковыми эрлотиниба, но отмечались чаще, чем на фоне применения гефитиниба.
Таким образом, при сравнимой эффективности гефитиниба и эрлотиниба последний по основным видам осложнений (за исключением нарушения функции печени) более токсичен. Чаще наблюдались побочные эффекты 3–4-й степени, требовавшие редукции дозы. Возможно, это следствие фармакокинетических особенностей препаратов. Биодоступность эрлотиниба в рекомендованной дозе 150 мг/сут (максимально допустимая доза) в три раза выше биодоступности гефитиниба 250 мг/сут (одна треть максимально допустимой дозы). В отличие от эрлотиниба накопление гефитиниба в опухолевой ткани было значительно выше, чем в плазме [11, 12], что, вероятно, объясняет меньшую системную токсичность гефитиниба.
Имеются данные, что после снижения дозы эффективность эрлотиниба сохраняется. Ретроспективные исследования показали, что больные, получавшие эрлотиниб в сниженной дозе (25 мг/сут), имели как минимум аналогичный прогноз по сравнению с теми, кто применял препарат в стандартной дозе [13–15]. Однако в этих исследованиях эффективность сниженных доз отмечалась у больных, ранее получавших стандартные дозы, с последующей редукцией вследствие развития побочных эффектов (аналогичные данные имеются и для гефитиниба [16, 17]). С учетом известных сроков развития побочных эффектов это были исходно чувствительные к эрлотинибу больные. Поэтому к данному предположению необходимо относиться с осторожностью.
Одно из двух прямых сравнений гефитиниба и эрлотиниба [18, 19] представлено исследованием СTONG0901, включавшим 256 (128/128) больных, применявших эрлотиниб или гефитиниб. Из них 64,8% получили лечение в первой линии. Остальным ранее назначалась химиотерапия.
Показатели ВБП и ОВ в группах гефитиниба и эрлотиниба не имели статистических различий как в группе в целом, так и у больных, получавших ИТК EGFR в первой линии. Не зафиксировано также значимых различий при оценке эффективности лечения (табл. 2).
Безопасность изучали у 256 больных. Частота осложнений 3–4-й степени значимо не различалась при приеме эрлотиниба и гефитиниба (5,4 vs 1,6% соответственно; р = 0,172).
Прямое сравнение гефитиниба и афатиниба также представлено одним исследованием первой линии лечения LUX-Lung 7 (фаза IIВ) с участием 319 (160/159) больных [5, 18].
При прямом сравнении обеих групп (табл. 3) не установлено значимых различий по медиане ОВ. При сравнении медиан ВБП получена крайне незначительная (11,0 vs 10,9 месяца), хотя и статистически достоверная разница в пользу афатиниба. Не выявлено и достоверных различий в контроле болезни в обеих группах. Время до неудачи лечения и частота объективного ответа были статистически значимо выше в группе афатиниба.
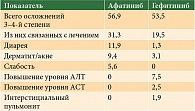
Частота осложнений 3–4-й степени в группах афатиниба и гефитиниба составила 56,9 и 53,5% соответственно, из них связанных с лечением – 31,3 и 19,5%. При использовании афатиниба чаще регистрировали диарею, дерматит/акне,
слабость. С гефитинибом были связаны такие осложнения 3–4-й степени, как повышение уровней аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), интерстициальный пульмонит (табл. 4).
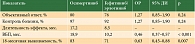
Частота коррекции дозы гефитиниба вследствие токсических реакций составила 2%, афатиниба – 42%. Частота прекращения лечения из-за осложнений была одинаковой – 6,3%.
Существенный прорыв в тактике лечения НМРЛ EGFRm обеспечило создание ИТК EGFR третьего поколения. В настоящее время его представителем является один зарегистрированный препарат осимертиниб – необратимый селективный ИТК EGFR, действующий на тирозинкиназу EGFR как при драйверных мутациях в гене EGFR (мутация L858R, делеция в 19-м экзоне), так и при мутации резистентности T790M. Изначально препарат был утвержден для терапии НМРЛ EGFRm при выявлении мутации T790M, примерно в 60% случаев ответственной за резистентность к ИТК EGFR первого и второго поколения [20]. В сравнении с принятой опцией лечения – платиносодержащей химиотерапией осимертиниб, согласно исследованию III фазы AURA3, во второй линии после прогрессирования НМРЛ EGFRm на ИТК EGFR первого и второго поколения значительно увеличил частоту объективного ответа, контроля болезни и ВБП (10,1 vs 4,4 месяца; ОР 0,30; 95% ДИ 0,23–0,41; p < 0,001) [3].
У пациентов, получавших осимертиниб, профиль безопасности закономерно был более благоприятный, чем в группе химиотерапии (пеметрексед в комбинации с препаратами платины). По косвенным данным, осимертиниб показал меньшую токсичность в сравнении с ИТК EGFR первого и второго поколения [21].
С учетом механизмов действия, в том числе блокады сигнальных путей EGFR при активирующих мутациях и мутации Т790М, ответственной за резистентность, представляет интерес противоопухолевый эффект осимертиниба в первой линии. При прямом сравнении с ИТК EGFR первого поколения лечебный эффект осимертиниба оказался выше, что с учетом достаточно благоприятного профиля безопасности позиционирует препарат как вариант первой линии терапии НМРЛ EGFRm независимо от статуса мутации Т790M. Учитывая возможные изменения терапевтических опций в ближайшем будущем, целесообразно рассмотреть данные исследования FLAURA [22] – прямого сравнения осимертиниба с гефитинибом и эрлотинибом в первой линии, обратив внимание на осложнения лечения.
Анализ эффективности осимертиниба (О) и гефитиниба/эрлотиниба (Г/Э) в первой линии представлен в табл. 5. На момент среза данных у 136 (49%) больных группы О и у 206 (74%) пациентов группы Г/Э были зафиксированы прогрессирование болезни или смерть.
Медиана ВБП в группе О была достоверно выше – 18,9 месяца. В группе Г/Э аналогичный показатель составил 10,2 месяца. На момент анализа данных для оценки ОВ было недостаточно. Однако ОВ в течение 18 месяцев была статистически выше на фоне применения О (83 vs 71%). Результаты промежуточного анализа ОВ указывают на положительную тенденцию в отношении осимертиниба по сравнению с современным стандартом терапии ИТК EGFR (ОР 0,63; 95% ДИ 0,45–0,88; р = 0,0068 (NS)). Частота достижения объективного ответа была сопоставима: в группе О – 80%, в группе Г/Э – 76%. Контроль болезни в группе О составил 97%, в группе Г/Э – 92%. Таким образом, с учетом длительности эффекта (О – 17,2 месяца, 95% ДИ 13,8–22,0; Г/Э – 8,5 месяца, 95% ДИ 7,3–9,8) и показателей ВБП преимущество имел осимертиниб.
Частота неблагоприятных событий, требовавших изменения режима (прерывание лечения или снижение дозы), отличалась незначительно в обеих группах. При этом отмена лечения реже имела место в группе О.
В целом у 70 (25%) больных группы О и 66 (24%) пациентов группы Г/Э наблюдались осложнения, приведшие к прерыванию лечения. Как правило, причинами прекращения лечения в группе О были удлинение интервала QT (8 (2,8%) больных), снижение аппетита (7 (2,5%) пациентов), диарея (7 (2,5%) больных) и пневмония (5 (1,7%) пациентов). В группе Г/Э прекращение лечения было обусловлено увеличением уровней АСТ (18 (6,5%) больных), АЛТ (12 (4,3%) пациентов), интервала QT (6 (2,2%) больных), развитием дерматита (5 (2,2%) пациентов).
В общей сложности 11 (4%) пациентов группы О и 15 (5%) группы Г/Э имели осложнения, приведшие к снижению дозы. Снижение дозы при использовании О обычно было связано с увеличением интервала QT (5 (1,7%) пациентов), Г/Э – развитием кожной токсичности (10 (3,6%) пациентов).
Неблагоприятные события, ставшие следствием прекращения лечения, в группе О наблюдались реже, чем в группе Г/Э, – 37 (13%) и 49 (18%) пациентов соответственно. Скорее всего это было обусловлено большей частотой печеночной токсичности в группе Г/Э – 38 (14%) больных (в группе О – 27 (10%) больных).
Осложнения 3–4-й степени реже отмечались в группе О – 34 vs 45% в группе Г/Э. Наиболее часто сообщаемыми нежелательными явлениями, связанными и не связанными с лечением, были сыпь/акне (58% в группе О и 78% в группе Г/Э), диарея (58 и 57% соответственно), сухость кожи (по 36% в каждой группе).
Серьезные побочные эффекты зарегистрированы у 60 (22%) больных группы О и 70 (25%) пациентов группы Г/Э. Один пациент из группы О имел серьезное неблагоприятное событие – увеличение интервала QT. Значимая интерстициальная болезнь легких зарегистрирована у шести больных группы О и четырех пациентов группы Г/Э.
Кардиологические осложнения – увеличение интервала QT зафикисированы у 29 (10%) пациентов группы О и 13 (5%) больных группы Г/Э, как правило 1-й или 2-й степени в обеих группах (табл. 6). В обеих группах максимальное изменение интервала QT по сравнению с исходным отмечалось на 12-й неделе (17,7 мсек в группе О и 10,0 мсек в группе Г/Э), затем этот показатель оставался стабильным в обеих группах.
Интерстициальный пульмонит диагностирован у 11 (4%) больных группы О и 6 (2%) больных группы Г/Э. В группе О при оценке исхода пульмонита семеро из 11 пациентов были охарактеризованы как «регрессировавшие» и четверо – как «восстанавливающиеся». В группе Г/Э «регрессировавшими» были названы четверо из шести больных, «восстанавливающимся» – один, «не восстановившимся» – один.
Осложнения, приведшие к смерти пациентов, имели место у 6 (2%) больных группы О (пневмония, респираторная инфекция, инсульт, инфаркт миокарда, тромбоэмболия легочной артерии и ишемия кишечника – по одному случаю), у 10 (4%) больных группы Г/Э (сепсис – два случая, пневмония – один, эндокардит – один, когнитивное расстройство и пневмония – один, окклюзия периферической артерии – один, одышка – один, кровохаркание – один, диарея, желудочно-кишечное кровотечение, дыхательная недостаточность и коллапс кровообращения – один, смерть без указания причины – один случай). Ни одно смертельное осложнение не расценивалось как следствие лечения О. Одно (диарея) характеризовалось как вероятно связанное с приемом Г/Э.
Таким образом, осимертиниб ассоциировался с более низкой частотой развития побочных эффектов, требовавших отмены препарата. В то же время частота прекращения лечения и частота снижения дозы из-за побочных эффектов были одинаковы в обеих группах.
Хотя статистического сравнения данных безопасности в исследовании не проводилось, профиль безопасности осимертиниба был аналогичен профилю безопасности гефитиниба/эрлотиниба, но с более низкими показателями нежелательных явлений ≥ 3-й степени. При этом необходимо отметить существенно больший период продолжительности лечения осимертинибом. Полученные данные свидетельствуют о том, что эффективность осимертиниба превосходит таковую стандартного лечения первой линии (гефитиниб/эрлотиниб).
Заключение
Настоятельно рекомендуемым лечением при НМРЛ с наличием активирующей мутации EGFR являются ИТК EGFR первого и второго поколения гефитиниб, эрлотиниб и афатиниб. Поскольку убедительных доказательств, что гефитиниб, эрлотиниб и афатиниб значимо отличаются по эффективности в первой линии лечения, нет, гефитиниб с учетом профиля безопасности, возможно, предпочтителен. В то же время эрлотиниб или афатиниб целесообразно назначать при нарушении функции печени. Имеющиеся данные свидетельствуют о том, что в силу более высокой эффективности афатиниб имеет преимущество перед эрлотинибом во второй линии при плоскоклеточном раке легкого.
Новый ИТК EGFR третьего поколения осимертиниб эффективен как при мутации T790M, ответственной за резистентность к ИТК EGFR первого и второго поколения, так и при активирующих мутациях в гене EGFR. Осимертиниб продемонстрировал значительное преимущество перед существующим стандартом лечения во второй линии после прогрессирования НМРЛ EGFRm на фоне терапии ИТК EGFR, более чем вдвое увеличив ВБП.
Получены первые обнадеживающие результаты применения осимертиниба в первой линии в сравнении с эрлотинибом/гефитинибом вне зависимости от наличия мутации T790M, что закономерно с учетом действия осимертиниба не только при мутации резистентности Т790М, но и при драйверных мутациях в гене EGFR. Значительное увеличение ВБП, а также длительности эффекта при использовании осимертиниба позволяет предположить, что препарат составит достойную конкуренцию ранее зарегистрированным ИТК EGFR в первой линии лечения. И хотя объем данных токсичности осимертиниба не так обширен, уже можно говорить о том, что новый ИТК EGFR как минимум не уступает препаратам первого и второго поколения.
Ye.I. Borisova, S.L. Gutorov
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Sergey Lvovich Gutorov, s1gutorov@gmail.com
On the basis of the available literature data, the side effects of EGFR tyrosine kinase inhibitors were compared. Used not only the results of randomized studies directly devoted to the comparison of drugs, but also the data of major meta-analyses, the most closed to routine clinical practice.
