Внутриполостная иммунотерапия опухолевых серозитов с использованием аллогенных лимфокин активированных киллеров
- Аннотация
- Статья
- Ссылки
Курс лечения в среднем продолжался 10 дней и состоял из ежедневных введений ИЛ-2 по 1 млн МЕ и ЛАК-клеток по 100-200 млн, полученных из лимфоцитов здоровых доноров. Для проведения иммунотерапии пораженная полость однократно дренировалась и осушалась перед каждым введением препаратов.
Полное прекращение экссудации при плевритах было отмечено у 77% больных, при асцитах – у 50% больных, при перикардитах – у 79,6% больных, продолжающееся в среднем от 6 до 8 месяцев. Всем больным проводился 3-х разовый цитологический контроль экссудата. Клинический эффект прямо коррелировал с отсутствием в экссудате опухолевых элементов и преобладания иммунокомпетентных клеток. Внутриполостная ИЛ-2\ЛАК-терапия была хорошо переносима больными, за исключением умеренной обратимой гипертермии и может быть рекомендована для купирования экссудации у больных с опухолевыми серозитами.
Проблема лечения больных с экссудативными формами (плевриты, асциты, перикардиты) злокачественных опухолей до настоящего времени остается весьма актуальной и до конца не решенной (6).
По характеру выпота опухолевые экссудативные серозиты подразделяются на серозные, геморрагические, гнойные, а также хилезные и смешанные. Серозные серозиты чаще выявляются в начальной стадии процесса. Затем характер выпота может меняться, отражая как прогрессирование болезни (в том числе – повреждение кровеносных и лимфатических сосудов), так и нередкое присоединение инфекции. Быстрое накопление экссудата после его удаления является обычно неблагоприятным фактором. Выявление изначально геморрагического характера экссудата свидетельствует о значительном повреждении опухолью сосудистой стенки, выраженном канцероматозе полости.
Длительная экссудация сопровождается значительными, в том числе невосполнимыми потерями с экссудатом белков, электролитов, других метаболитов. Кроме того, наличие выпота в полостях вызывает сдавление и смещение внутренних органов с нарушением их функций (сдавление легкого и смещения средостения при плеврите, смещение вверх диафрагмы и сдавление кишечной трубки и мочевого пузыря при асците). Поскольку злокачественный выпот является, как правило, проявлением распространенного опухолевого процесса, следует предполагать возможность двустороннего поражения плевры, а также перикарда и брюшины.
Удаленный экссудат должен быть направлен для обязательного цитологического исследования.
Длительная катетеризация полости должна предусматривать профилактику инфекции (обычно – внутриплевральным введением 20-40 мл диоксидина после эвакуации экссудата). Для суждения о выраженности воспалительных изменений в удаляемом экссудате целесообразно его микробиологическое исследование и определение в нем количества нейтрофильных лейкоцитов.
Лечение больных опухолевым серозитом заключается в осушении пораженной полости и подавлении экссудации в дальнейшем. Уменьшение или прекращение экссудации достигается как системной химиотерапией так внутриполостными введениями препаратов.
Опухолевый плеврит (злокачественный плевральный выпот) является частым осложнением, прежде всего, при раке легкого (24-50%), молочной железы (до 48%), яичников (10%), а также при лимфомах (до 26%)и других злокачественных опухолях (1-6%) (6, 8). Диссеминация по плевре приводит к изменению проницаемости плевральных листков, нарушению лимфатической, капиллярной циркуляции и резорбции, блоку путей лимфооттока, скоплению экссудата в плевральной полости. При канцероматозе плевры и вовлечения ее в воспалительный процесс, плевральная жидкость чаще всего представлена экссудатом. Системная химиотерапия проводится, прежде всего, при химиочувствительных опухолях – раке молочной железы, яичников, мелкоклеточном раке легкого, лимфомах – и назначается по стандартным схемам. Эффект системной химиотерапии проявляется в том числе и в подавлении (прекращении) плевральной экссудации. Это регистрируется в 70-80% случаев. Показателем эффективности лечения являются полные ремиссии (т. е. отсутствие плеврального выпота более месяца), которые достигаются, в среднем, в 40% случаев; а также частичные ремиссии (т. е. допускающие наличие экссудата в остаточных полостях в объеме, не требующем его удаления), достигаемые в 35-40% случаев.
Введение в плевральную полость склерозирующих агентов – предпочтителен тальк (10, 11), приводит к неспецифическому асептическому воспалению с последующим сращением плевральных листков. Клиническая эффективность составляет порядка 50%. Внутриплевральное введение талька болезненно и сопровождается выраженной гипертермией. При этом процедура приводит в течение нескольких недель к росту грануляций с их последующей организацией в грубую соединительную ткань. Очевидно, что проведение такого плевродеза не влияет на опухолевый рост. Сведения о продолжительности достигаемого эффекта противоречивы.
Внутриплевральное введение препаратов может дополнять системную химиотерапию. Наиболее часто для этой цели используются следующие цитостатики: тиофосамид, блеомицин, цисплатин, митоксатрон. (6, 8, 10, 11). Эффективность внутриплевральной химиотерапии оценивается в 30-40% полных и 60-80% частичных эффектов.
В исследованиях 80-х годов (1, 2, 3, 4) показана эффективность адоптивной иммунотерапии, при системном введении рекомбинантного интерлейкина-2 (ИЛ-2) и лимфокин активированных киллеров (ЛАК) больным с распространенными формами злокачественных опухолей. Клиническая эффективность этого метода оценивалась на уровне 30% (суммарная регрессия опухоли) у больных с диссеминированными формами рака почки, толстой кишки и меланомы. Курс лечения состоял из четырех введений ИЛ-2 в дозе 72 000 МЕ/кг и четырех введений ЛАК. Суммарная регрессия опухоли у данных больных составила 35%, 21% и 17% соответственно. При этом описаны случаи, когда длительность ремиссии превышала 5 лет. В 1990-х годах проведенное NCI рандомизированное исследование (181 больной диссеминированными формами опухолей) показало, что ИЛ-2/ЛАК-терапия оказалась более эффективной, чем лечение только ИЛ-2. В частности, полные регрессии при ИЛ-2/ЛАК-терапии составили 10%, в то время как введение высоких доз ИЛ-2 вызывало этот эффект у 3% пациентов, а актуариальная трехлетняя выживаемость больных была 37% и 21% соответственно (5). В литературе также встречаются сведения об эффективном применении ИЛ-2/ЛАК терапии у больных с другими локализациями (13-18).
Значительные возможности адоптивной иммунотерапии были продемонстрированы при лечении опухолевых плевритов. Это связано с тем, что при локальном введении ИЛ-2 в плевральную полость удавалось достичь эффективных концентраций данного лимфокина и ЛАК, полученных из аутологичных лимфоцитов экссудата больного, по своим свойствам квалифицированных как TIL. Полный эффект внутриплевральной монотерапии ИЛ-2 по 9 млн МЕ, в течение 3-х недель был отмечен у 33% больных, а частичный – у 29%, при среднем отсутствии экссудации 8 месяцев. Наиболее эффективной и хорошо переносимой оказалась внутриплевральная иммунотерапия с использованием малых доз ИЛ-2 (1 млн МЕ) и ЛАК, генерированных из лимфоцитов экссудата. В клиническом исследовании, включившем 121 больного раком легкого, данная комбинация приводила к полной регрессии экссудата у 58,6% больных, в 36,2% случаев наблюдалась частичная регрессия. Суммарный эффект лечения составил 94,8% с минимальным проявлением побочных эффектов (9). Также высокая эффективность данного лечения была продемонстрирована у больных экссудативными плевритами других локализаций злокачественных опухолей (5, 7, 13).
Материалы и методы
В исследование было включено 40 больных с экссудативными формами онкологических заболеваний. Из них 15 с плевритами только односторонние (немелкоклеточный рак легкого – 5, рак молочной железы – 6, меланома кожи – 2 , рак яичников – 2 ), 15 с асцитами (рак Фатерова сосочка – 1, рак тела матки –1, меланома кожи –1, рак желудка – 5, рак яичников – 7) и 10 с перикардитами (рак легкого – 5, рак молочной железы – 5). Во всех случаях диагноз был морфологически подтвержден. Все больные имели резистентность к химиотерапии. Объем экссудата при его первичной эвакуации составил при плеврите от 1,5 л до 5,5 л, при асците от 3,0 л до 10,0 л, а при перикардите от 100 мл до 600 мл. Полости дренировались по стандартным методикам с установкой в них дренажа на время проведения иммунотерапии. Перед началом внутриполостной иммунотерапии, а также в середине и по его окончании производился забор экссудата на цитологическое исследование для оценки регрессии опухолевого процесса и количества иммунокомпетентных клеток. Курс внутриполостной ИЛ-2/ЛАК иммунотерапии начинался из 5 ежедневных введений рекомбинантного интерлейкина-2 (ронколейкин или пролейкин) по 1 млн МЕ, а затем до получения положительного клинического результата дополнялся введением ЛАК, полученных из донорских лимфоцитов в суммарной дозе от 600 млн до 1,7 млрд клеток. Перед каждым введением компонента иммунотерапии производили осушение полостей от экссудата. Средняя продолжительность курса до достижения клинического эффекта составила 10 дней, который выражался в виде торможения или полного прекращения экссудации.
Источником получения ЛАК-клеток служили аллогенные лимфоциты, выделенные из мононуклеорных клеток (МНК) здоровых доноров. Взвесь клеток дважды отмывали культуральной средой на основе RPMI-1640 и наслаивали на фиколл-урографин (р=1,077) и центрифугировали при 1500 об/мин в течение 30 мин. Образовавшееся интерфазное кольцо отбирали и трижды отмывали в среде RPMI-1640. Полученные лимфоциты ресуспензировали в полной культуральной среде в концентрации 500 тыс/мл инкубировались с интерлейкином-2 1000 МЕ/мл в течение 48 часов для генерации ЛАК, далее полученные активированные лимфоциты передавались в клинику для внутриполостного введения.
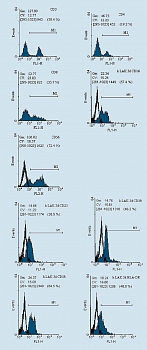
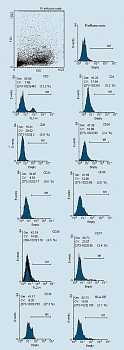
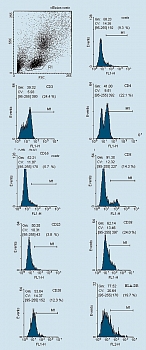
Анализ фенотипа. Фенотип генерированных клеток исследовали с использованием моноклональных антител (фирмы Caltag Laboratories, США) против соответствующих антигенов. Клетки отмывали холодным фосфатно-солевым буфером (ФСБ) и окрашивали FITC (флюоресциинизотиоционат) и PE (фикоэритрин) – мечеными антителами согласно инструкции производителя. Затем отмывали два раза холодным ФСБ. Результаты учитывали на проточном цитометре FacsCalibur (фирмы Becton Dickinson,США). На клетках, полученных из мононуклеаров периферической крови доноров, исследовали уровни экспрессии молекул СD3, CD4, CD8, CD16, CD25, CD38, CD56, CD57, CD58 и HLA-DR. Гейт (окно) популяции клеток устанавливали на основе комбинации прямого и бокового светорассеяния и размера клеток. При учете результатов подсчитывали 10000 клеток в гейте. Статистическая обработка материала проведена при помощи программного пакета WIN MDI 2.8 (рисунок 1).
Цитологическое исследование. На 3 сутки инкубирования ЛАК из культуральной взвеси были сделаны мазки, которые окрашивали гемотоксилин-эозином. Статистическая обработка данных проводилась с использованием программы «ИПСО» (Россия).
Результаты и обсуждение
До начала иммунотерапии: у 75% больных в удаленном экссудате обнаруживалось много опухолевых клеток, у 25% – единичные; у больных имелись единичные лимфоидные клетки 1-3 в поле зрения, а также мезателиоциты и гистиоидные клетки (цитограмма 1). При анализе иммунофенотипа МНК, выделенных из экссудата, определяется лишь небольшое количество CD3+Т-лимфоцитов (рисунок 2). ЛАК, генерированные из аллогенных МНК, были представлены клетками типа иммунобластом или пролимфоцитов и по своему фенотипу характеризовались высоким уровнем экспрессии активационных антигенов (СD25,CD38, HLADR), маркеров НК (CD16, CD56) и молекул адгезии (CD58) (см. рисунки).
В середине иммунотерапии в экссудате значительно уменьшалось количество опухолевых клеток, многие из которых были с явлениями деградации (вауколизация ядра и цитоплазмы). Лимфоидные элементы были представлены клетками типа иммунобластов или пролимфоцитов (15-20 в поле зрения), встречались единичные клетки мезотелия (цитограмма 2-3).
По окончании иммунотерапии в подавляющем большинстве случаев опухолевые клетки отсутствовали, по-прежнему преобладали лимфоидные клетки типа различной степени зрелости. Лимфоциты экссудата на этом этапе лечения экспрессировали, главным образом маркеры Т-клеток.
Цитологические показатели (отсутствие опухолевых клеток и наличие лимфоцитов в экссудате) по окончании иммунотерапии прямо корелировали с положительными клиническими эффектами (цитограмма 4).
При плевритах общая эффективность составила 88,8%, полное прекращение экссудации – у 77,7% больных, торможение экссудации – у 11,1%.
При асцитах общая эффективность составила 85,7%, полное прекращение эксудации – у 50% больных, торможение экссудации – у 35,7%.
При перикардитах общая эффективность составила 95%.
Внутриполостная иммунотерапия в основном была хорошо перенесена пациентами. В отличие от химиотерапии иммунотерапия имела гораздо меньше побочных эффектов, главным образом умеренную гипертермию. Субфебрильная температура до 37,5ºС была отмечена у 6 больных, фебрильная до 39,0ºС – у 2 больных, а у остальных 15 больных проведение иммунотерапии повышением температуры тела не сопровождалось. Как правило, реакция гипертермии у больных проявлялась после 1-2 введения ИЛ-2 и ЛАК-клеток, через 1-2 часа от начала иммунотерапии и наблюдалась в течение 3-4 часов, далее отмечалось постепенное снижение температуры до исходных значений без применения антипиретиков.
Вместе с тем гипертермию следует расценивать не только как побочную реакцию иммунотерапии, но и как проявление специфического действия ИЛ-2 и ЛАК – стимуляции системы иммунобиологического надзора, в том числе и его противоопухолевой составляющей.
Таким образом, предложенная иммунотерапия является эффективным методом лечения серозитов опухолевой этиологии, являющихся порой единственным проявлением прогрессирования болезни, улучшает качество жизни больных и может быть рекомендована для применения в онкологической практике.
Выводы
- Внутриполостная ИЛ-2/ЛАК-иммунотерапия с применением ал-логенных ЛАК-клеток высокоэффективна у больных с опухолевыми экссудативными процессами.
- Цитологическая картина экссудата в виде отсутствия в нем опухолевых элементов и преобладания иммунокомпетентных клеток прямо коррелирует с клиническим плевродезом.
- Аллогенные ЛАК-клетки по своим морфо-функциональным характеристикам соответствуют крупным лимфоцитам типа иммунобластов с экспрессией активационных молекул и высокой цитотоксической активностью.
- ИЛ-2/ЛАК-терапия хорошо переносится больными и практически не вызывает побочных эффектов, за исключением умеренной температурной реакции у некоторых пациентов.
- Внутриполостная иммунотерапия может быть рекомендована для купирования экссудации у больных с опухолевыми серозитами.
