Аберрантная поджелудочная железа: диагностика и терапевтическая тактика. Клиническое наблюдение
- Аннотация
- Статья
- Ссылки
- English
Введение
Аберрантная поджелудочная железа (ПЖ) является одним из редких пороков развития, выражается гетеротопией ткани ПЖ в другие органы, такие как желудок, двенадцатиперстная кишка (ДПК), тонкая и толстая кишка, печень, желчный пузырь [1].
ПЖ начинает формироваться на пятой неделе внутриутробного периода развития из дорсального и вентрального первичных выпячиваний, происходящих соответственно из ДПК и закладки печени [2]. К седьмой неделе оба зачатка сливаются. Из вентрального зачатка формируются нижняя часть головки ПЖ и ее крючковидный отросток, из дорсального – тело и верхняя часть головки железы [3]. Аберрантная железа не имеет анатомической или сосудистой связи с основной. В стенке желудка эктопия ПЖ встречается в 25–60% случаев, в стенке ДПК – в 25–35% случаев [4].
В 1970 г. французские ученые F. Potet и N. Duclert впервые описали аберрантную ПЖ [5]. Среди западного населения распространенность аберрантной ПЖ достигает 10%, у азиатов и африканцев частота меньше – 1–2% [6].
Клинически заболевание может проявиться при воспалительных и некротических изменениях в добавочной ПЖ и окружающих тканях. Аберрантная ПЖ может стать причиной кишечной непроходимости, панкреатита и панкреонекроза, язвы желудка, механической желтухи, развившейся вследствие сдавления желчных протоков.
Более 95% пациентов с аберрантной ПЖ не имеют симптомов. Выявление заболевания – случайная находка при проведении эзофагогастродуоденоскопии (ЭГДС), компьютерной томографии (КТ), магнитно-резонансной холангиопанкреатографии, эндоскопической ультрасонографии (ЭУС).
Патогенез до конца не ясен, однако считается, что из-за наличия дополнительного протока ПЖ с меньшим диаметром, чем обусловлено неадекватное дренирование сока ПЖ, вызывается обструкция потока. Повышенное внутрипротоковое давление и растяжение панкреатического протока способны привести к панкреатиту эктопированной ПЖ [6].
Дифференциальный диагноз сложен и является ключевым звеном, направленным на разработку адекватной тактики лечения пациентов. Проводится дифференциальная диагностика с новообразованиями органов гепатобилиарного тракта, врожденными аномалиями, воспалительными заболеваниями. К основным симптомам относятся боли в верхних отделах живота, тошнота, рвота, снижение массы тела, анемия, нарушение электролитного обмена [7]. Известно, что в эктопированной железе может развиться и рак, и нейроэндокринные опухоли [8, 9]. С помощью рентгенологических, ультразвуковых и эндоскопических методов исследования с высокой долей вероятности можно установить правильный диагноз.
Одним из важнейших методов диагностики является ЭУС, при необходимости используются эластография и контрастное усиление. Оценивается коэффициент эластичности, среднее значение которого может дифференцировать воспалительные и опухолевые поражения ПЖ. Использование ЭУС-контрастного усиления позволяет оценить стенку, перегородки и нодулярный компонент кистозных образований, что расширяет возможности дифференциальной диагностики кистозных образований ПЖ [10].
В отсутствие клинических проявлений данная патология требует только динамического наблюдения [3].
При наличии клинических проявлений рассматривают терапевтический и хирургический методы лечения. Терапевтическое лечение основано на отказе от алкоголя, табакокурения, а также на принципах, аналогичных принципам лечения хронического панкреатита. Применяется медикаментозная терапия анальгетиками, ингибиторами протонной помпы, нестероидными противовоспалительными препаратами, синтетическими аналогами соматостатина. При необходимости проводится нутритивная поддержка в виде парентерального и (или) зондового питания [11].
Если терапевтическое лечение не представляется возможным, основным методом является хирургический [12]. Однако вопрос выбора хирургического лечения сложен. В зависимости от болевого синдрома, степени сужения просвета ДПК и поражения ПЖ применяется определенный способ хирургического лечения: панкреатодуоденальная резекция, циркулярная резекция нисходящей части ДПК и резекция головки ПЖ, резекция нисходящей части ДПК с дуоденопластикой и реимплантацией большого сосочка ДПК, панкреассохраняющая субтотальная резекция двенадцатиперстной кишки, резекция головки ПЖ (операции Бегера, Фрея, бернский вариант резекции) и паллиативные операции [13]. Чаще методом выбора становится панкреатодуоденальная резекция. При эктопии в желудок и другие органы может также накладываться панкреато- или цистоэнтероанастомоз, выполняться резекция желудка [11]. Тем не менее в отсутствие клинических проявлений эктопии ПЖ в желудок рекомендуется динамическое наблюдение [3].
Клиническое наблюдение
В декабре 2018 г. в Московский клинический научно-практический центр (МКНЦ) им. А.С. Логинова был госпитализирован пациент Р. в возрасте 37 лет с жалобами на боли ноющего характера в эпигастрии и левом подреберье, усиливающиеся после приема пищи, чувство переполнения желудка, периодически – тошноту, рвоту съеденной пищей, постоянный кислый привкус во рту, общую слабость, шум в ушах, снижение массы тела на 10 кг за шесть месяцев.
Злоупотреблял легким алкоголем ежедневно в течение десяти лет. Последние шесть месяцев алкоголь не употреблял. Выкуривал пачку сигарет в день.
Из анамнеза известно, что в феврале 2010 г. на фоне погрешности в диете впервые появились интенсивные боли в верхних отделах живота, тошнота, рвота съеденной пищей. По СМП госпитализирован в стационар, где диагностирован острый флегмонозный калькулезный холецистит, панкреонекроз. Выполнена лапаротомия: холецистэктомия, дренирование брюшной полости. Проведена комплексная терапия, направленная на подавление патологических процессов и предупреждение осложнений.
Впоследствии отмечалось хорошее самочувствие. В октябре 2014 г. – закрытая травма живота с разрывом селезенки. Выполнены спленэктомия, дренирование поддиафрагмального абсцесса слева. Тогда же, по данным мультиспиральной компьютерной томографии (МСКТ) с контрастированием, выявлена постнекротическая киста тела – хвоста ПЖ размером 70 × 35 × 47 мм. В дальнейшем пациент отмечал периодические интенсивные боли в верхних отделах живота, в связи с чем неоднократно проходил стационарное лечение с диагнозом обострения хронического панкреатита. МСКТ с контрастированием от 2016 г. показала признаки псевдотуморозного панкреатита. Расширение вирсунгова протока до 6 мм, уменьшение размера кисты до 60 × 10 мм. С сентября 2018 г. беспокоили интенсивные боли в верхних отделах живота, тошнота, рвота. Дважды был госпитализирован в стационар по месту жительства. Последняя госпитализация – в октябре 2018 г.
В клиническом анализе крови отмечалась анемия – эритроциты – 3,54 × 106/мкл, гемоглобин – 101 г/л, лейкоцитоз – 13,6 × 109/л, тромбоцитоз – 636 × 103/мкл, гиперамилаземия – 452 ЕД/л, повышение креатинина до 127 мкмоль/л. По данным ультразвукового исследования (УЗИ), КТ без контрастирования, признаки острого панкреатита. После проведенного консервативного лечения пациент выписан с незначительной положительной динамикой: болевой синдром купирован, сохранялась тошнота. Однако в декабре 2018 г. вновь появились указанные выше симптомы, в связи с чем пациент был направлен на лечение в МКНЦ им. А.С. Логинова.
При объективном осмотре: состояние удовлетворительное, питание пониженное – индекс массы тела (ИМТ) – 16,7 кг/м2. При физикальном обследовании не выявлено значимых нарушений со стороны сердечно-сосудистой, дыхательной и мочевыделительной систем. Пульс 68 в минуту, удовлетворительного наполнения, ритм правильный, артериальное давление 110/70 мм рт. ст.
В клиническом анализе крови – признаки анемии (гемоглобин – 9,4 г/дл), тромбоцитоз (716 × 103 мкл).
Результаты биохимического анализа крови: гиперамилаземия (331 ЕД/л), гипоальбуминемия (27,3 г/л), электролитные нарушения (калий – 3,47 ммоль/л, хлор – 95,2 ммоль/л), железо – 2,7 мкмоль/л.
Кроме того, выявлены маркеры воспаления (С-реактивный белок – 78,7 мг/л, скорость оседания эритроцитов – 94 мм/ч, лейкоциты – 14,52 × 109/л, палочкоядерные нейтрофилы – 11%).
Диастаза мочи – 2701,1 ЕД/л.
Результаты УЗИ: гастростаз (объем примерно 200–300 мл), стенки желудка инфильтрированы, утолщены до 10 мм. Контуры ПЖ нечеткие, неровные, границы плохо дифференцируются от окружающих тканей. Выявлены внутри- и парапанкреатические жидкостные скопления размерами от 10 до 62 × 12 мм. Парапанкреатическая клетчатка инфильтрирована. Селезеночная вена тромбирована, кровоток не лоцирован. Тонкие прослойки жидкости в брюшной полости. Заключение: УЗ-признаки тромбоза селезеночной вены, реканализованного тромбоза воротной вены, выраженных изменений поджелудочной железы с формированием внутри- и парапанкреатических жидкостных скоплений, инфильтрации парапанкреатической клетчатки, незначительного выпота в брюшной полости, гастростаза, с утолщением стенок желудка.
Для визуальной оценки органов верхних отделов пищеварительного тракта, подтверждения гастростаза, оценки проходимости выполнена ЭГДС, по данным которой выявлены признаки эрозивного эзофагита, инфильтративного поражения желудка, деформация выходного отдела желудка, гастростаз, хронический дуоденит с выраженной лимфоидной инфильтрацией, в области бульбодуоденального перехода слизистая резко отечна с формированием циркулярного сужения, не препятствующего проведению эндоскопа диаметром 0,9 см, – признаки дуоденальной дистрофии.
Заключение на основании морфологического исследования: хронический неактивный гастрит с фовеолярной гиперплазией поверхностного эпителия.
С учетом тошноты, периодической рвоты съеденной пищей пациенту была выполнена установка назоинтестинального зонда для питания.
В результате проведенных исследований выявлены признаки перенесенного панкреонекроза, кист в проекции ПЖ, гастростаза с возможным инфильтративным поражением желудка, также косвенные признаки нарушения эвакуации из желудка.
В сложившейся ситуации возникла необходимость проведения дифференциального диагноза между воспалительным и опухолевым поражением гастропанкреатодуоденальной зоны.
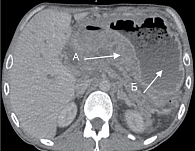
При проведении МСКТ с внутривенным болюсным контрастированием обращало на себя внимание наличие минимального количества жидкости поддиафрагмально слева и вдоль левой доли печени. Желудок заполнен жидкостью и содержимым, полностью не расправлен. От средней трети тела желудка с переходом на антральный и пилорический отделы отмечается неравномерное циркулярное утолщение стенки желудка до 42 мм. На этом фоне в стенках желудка и луковицы ДПК визуализируются жидкостные включения размерами до 18 × 62 мм и до 6 мм соответственно. Контуры желудка неровные, слабое накопление контрастного вещества, дифференцировка слоев нарушена. Образование инфильтрирует перешеек ПЖ, на этом уровне ее паренхима не прослеживается. Парагастральная клетчатка инфильтрирована на всем протяжении, инфильтрация прилежит к левой доле печени, распространяется на гепатодуоденальную связку и брыжейку тонкой кишки. Вдоль левой желудочной артерии и общей печеночной артерии – цепочка вторично измененных лимфоузлов до 20 мм, в гепатодуоденальной связке и воротах печени до 9 мм, мезентериальные до 9 мм. Воротная вена, верхняя брыжеечная вена и селезеночная вена компримированы на уровне конфлюенса. В большом сальнике визуализируются венозные коллатерали до 5 мм. Внутри- и внепеченочные желчные протоки расширены: долевые до 11 мм, секторальные до 9 мм, сегментарные до 7 мм, холедох до 13 мм, в интрапанкреатическом отделе компримирован инфильтратом. Поджелудочная железа дольчатого строения, правильно расположена. Размеры: головка – 30 мм, тело – 16 мм, хвост – 15 мм, плотность не изменена. Контуры железы четкие, неровные, на уровне инфильтрата перешейка железы контуры не прослеживаются. В головке ПЖ визуализируется кистозная структура размером 14 × 7 мм. Создается впечатление о наличии связи с главным панкреатическим протоком (ГПП). ГПП расширен до 7 мм с блоком на уровне перешейка ПЖ. Парапанкреатическая и парадуоденальная клетчатка отечна.
Заключение: утолщение стенок средней трети тела желудка с переходом на антральный и пилорический отделы (дифференцировать лимфому желудка и рак/новообразование, воспалительные изменения менее вероятны, рекомендовано дообследование), с выраженной инфильтрацией окружающей клетчатки и вовлечением перешейка ПЖ, развитием панкреатической и билиарной гипертензии, вторичной внутрибрюшной лимфаденопатии. Признаки перенесенного деструктивного панкреатита (кистозную структуру в головке ПЖ дифференцировать между псевдокистой и внутрипротоковой муцинозной неоплазией ПЖ бокового типа), дуоденальной дегенерации (рис. 1).
Для оценки слоев стенок пищевода, желудка, ДПК и получения цитологического материала проведена ЭУС.
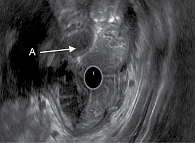
Результаты исследования показали, что стенка кардиального отдела желудка структурная, пятислойная, дифференциация слоев не нарушена. От средней трети тела желудка по малой кривизне, задней стенке, в антральном отделе циркулярно стенка желудка утолщена, максимально до 2,5 см. В антральном отделе отсутствует дифференциация слизистого и подслизистого слоев, внутренний контур ровный, мышечный слой прослеживается. В теле в структуре стенки определяются множественные кистозные новообразования с эхогенным содержимым, разделенные гиперэхогенными перегородками (рис. 2). Для исключения атипии проведена тонкоигольная пункция стенки, получено жидкое содержимое. Заключение: деформация просвета желудка за счет циркулярного утолщения стенки антрального отдела желудка, кистозной дегенерации стенки тела желудка.
Исследование содержимого кистозного образования стенки желудка: в препарате все поля зрения покрывают нейтрофилы, небольшое количество гистиоцитов и лимфоидных клеток, аморфный и клеточный детрит. Другого клеточного состава нет. Заключение: цитологическая картина воспалительных изменений. Элементов злокачественного новообразования в предоставленном материале не обнаружено.
В результате проведенных исследований был установлен диагноз:
- основной: хронический панкреатит первой стадии, средней степени тяжести по классификации M-ANNHEIM: C (13 баллов). Панкреонекроз в 2010 г.;
- осложнения: формирующиеся постнекротические кисты поджелудочной железы. Кистозная дегенерация стенок желудка. Дуоденальная дегенерация. Белково-энергетическая недостаточность 2-й степени. Дефицит циркулирующего белка 1-й степени. Гипохромная анемия среднетяжелой степени. Дефицит массы тела;
- сопутствующий: желчнокаменная болезнь. Холецистэктомия в 2010 г. Гастроэзофагеальная рефлюксная болезнь в стадии эрозивного эзофагита. Спленэктомия по поводу травмы в 2014 г.
В отделении пациенту проводилась противовоспалительная, ферментозаместительная, антисекреторная, инфузионная, антибактериальная терапия, нутритивная поддержка (Нутрикомп Пептид ликвид, альбумин, раствор Рингера, Аминостерил H-Гепа, липофундин) с положительным эффектом, зонд был удален на седьмые сутки от начала лечения. Пациент смог питаться самостоятельно, не испытывая тошноты и рвоты.
На фоне проведенного лечения вес пациента стабилизировался, боли уменьшились.
При контроле лабораторных показателей отмечалось повышение уровня гемоглобина до 11,1 г/дл, постепенное снижение уровня тромбоцитов (687 × 103 мкл). В биохимическом анализе крови – нормализация показателей электролитов (калий – 3,7 ммоль/л, хлор – 99,4 ммоль/л, железо – 16,4 мкмоль/л), сохранялась гиперамилаземия (497 ЕД/л).
Снизились маркеры воспаления (С-реактивный белок – 35,7 мг/л, скорость оседания эритроцитов – 84 мм/ч, лейкоциты – 10 × 109/л, палочкоядерные нейтрофилы – 6%).
Диастаза мочи уменьшилась до 1888,6 ЕД/л.
Пациент выписан на девятые сутки от начала консервативного лечения.
Больному рекомендовано продолжить лечение в амбулаторных условиях: прием полиферментных препаратов в минимикросферах или минитаблетках, пробиотиков (водорастворимые формы), ингибиторов протонной помпы, нестероидных противовоспалительных препаратов, препаратов, содержащих калий, препаратов железа. Диета с повышенным содержанием белка.
При контрольном обследовании в 2019 г. (через год) пациент предъявлял жалобы на ноющие боли в верхних отделах живота, тяжесть, усиливающуюся после приема пищи. Больной прибавил в весе, ИМТ нормализовался и составил 21,6 кг/м2.
Данные лабораторных исследований: гиперамилаземия (201 ЕД/л), диастаза мочи – 768 ЕД/мл. Остальные показатели в пределах нормы.
По данным УЗИ, отмечалось отсутствие жидкостных скоплений в проекции ПЖ и свободной жидкости в брюшной полости.
При проведении ЭГДС отсутствовали признаки инфильтративного поражения желудка, гастростаза не выявлено. Однако сохранялись косвенные эндоскопические признаки желудочной и дуоденальной дегенерации: начиная с нижней трети тела желудка и дистальнее циркулярно утолщенные складки, при инсуффляции воздухом расправляются не полностью. Просвет сужен, но свободно проходим для эндоскопа диаметром 9 мм. В области бульбодуоденального перехода также циркулярно утолщенные складки, суживающие просвет.
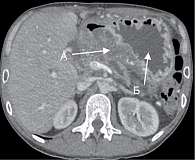
Данные МСКТ: отсутствие выпота в брюшной полости, плевральных полостях и полости перикарда, утолщенные стенки желудка, уменьшение в размерах кист ПЖ, уменьшение лимфаденопатии, частичное восстановление структуры ПЖ. Кистозные структуры в головке ПЖ, вероятно, связаны с постнекротическими изменениями. Признаки дуоденальной дегенерации (рис. 3).
Таким образом, зафиксирована положительная динамика в виде уменьшения выраженности воспаления, что свидетельствует об эффективности проведенного лечения.
В течение последующего года на фоне соблюдения диеты и консервативного лечения самочувствие пациента улучшилось, наладилось питание, повысилось качество жизни.
Больной продолжает динамическое наблюдение в консультативно-диагностическом отделении МКНЦ им. А.С. Логинова и проходит регулярные обследования в условиях отделения патологии поджелудочной железы и желчевыводящих путей МКНЦ им. А.С. Логинова.
Обсуждение
Описанная клиническая ситуация показывает сложности в постановке диагноза и определении лечебной тактики.
Пациент длительное время злоупотреблял алкоголем. Перенес острый панкреатит, панкреонекроз. Через четыре года выявлена постнекротическая киста ПЖ, впоследствии – регулярные обострения хронического панкреатита. Регулярные обострения привели к нарушению дуоденальной проходимости и, как следствие, нарушению пассажа пищи, тошноте, рвоте, снижению массы тела и электролитным расстройствам. Клиническая картина схожа с таковой при наличии злокачественного новообразования, которое могло развиться на фоне хронического панкреатита [14, 15]. Однако результаты проведенного обследования не подтвердили диагноз злокачественного новообразования. Выявленная патология компенсирована благодаря терапевтическому лечению, что позволило избежать операции. В данном случае пациенту требуются регулярное обследование, при необходимости – коррекция терапии.
Для рассмотренного случая характерна двойная локализация эктопированной ПЖ: в желудок и ДПК. Несмотря на достаточно большое количество описаний дуоденальной локализации эктопированной ПЖ [4, 11] и аберрантной ПЖ в желудке [1], нам не удалось найти в литературе описания двойной локализации.
I.V. Savina, K.A. Lesko, PhD, Ye.V. Bistrovskaya, PhD, M.A. Kiryukova, D.S. Bordin, PhD, Prof., Ye.A. Dubtsova, PhD
A.S. Loginov Moscow Clinical Research and Practical Center
Tver State Medical University
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Yelena A. Dubtsova, e.dubtsova@mknc.ru
Aberrant pancreas is a result of impaired embryogenesis. The clinical presentation varies and mimics different diseases. The diagnostics complexity makes specialists conduct the patients’ work-up more thoroughly. Chronic recurrent pancreatitis is one of pancreatic cancer risk factors. Tobacco and alcohol consumption significantly increases the risk of developing aberrant pancreas. The article presents a clinical case of a 37-year-old man with a 10-year history of chronic pancreatitis mainly highlighting the diagnostics of aberrant pancreas. The disease manifested with an episode of acute pancreatitis and pancreonecrosis treated in a hospital. Pancreatic pseudocysts were diagnosed four years later. However, only six years after, aberrant pancreas in stomach and cystic dystrophy of duodenal wall were diagnosed. Accurate diagnosis allowed tailored treatment and avoiding surgery.

