Амиодарон-индуцированный тиреотоксикоз 1 типа: особенности ведения пациентов
- Аннотация
- Статья
- Ссылки
- English


Введение
Амиодарон, синтезированный в 1960 г. в Бельгии, изначально применялся в качестве средства при стенокардии. Препарат приобрел мировую известность после обнаружения антиаритмических свойств [1]. Его использовали для лечения опасных для жизни аритмий в отсутствие эффекта от других антиаритмических препаратов [2].
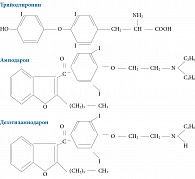
Уникальность амиодарона обусловлена его составом. Одна таблетка препарата содержит 74 мг йода, что обеспечивает структурную схожесть с гормонами щитовидной железы (рисунок) [3]. Именно благодаря йоду амиодарон оказывает противоаритмический эффект, который реализуется за счет связывания с рецепторами к трийодтиронину (Т3) в кардиомиоцитах. Более того, длительное применение амиодарона приводит к значительному снижению плотности бета-адренергических рецепторов и урежению частоты сердечных сокращений [4].
Амиодарон, положительно влияющий на сердечно-сосудистую систему, способен оказывать отрицательное воздействие на функцию щитовидной железы, что ограничивает его применение [5]. Известно, что при метаболизме амиодарона высвобождается 6–9 мг йода в сутки, что превышает суточную потребность в десятки раз. В случае длительного применения создается тканевое депо. Как следствие, период полувыведения составляет более 100 дней [6]. Именно поэтому важно оценивать функцию щитовидной железы перед назначением амиодарона, а также на протяжении всего периода лечения и после его отмены. Нарушение тиреоидного статуса, в частности тиреотоксикоз, способно оказывать проаритмогенное влияние, что может ухудшить течение аритмии и быть опасным для жизни пациента.
Необходимо отметить, что не все изменения уровня тиреоидных гормонов требуют вмешательства. Так, подавляя активность 5’-дейодиназы 1 в периферических тканях, амиодарон уменьшает конверсию тироксина (Т4) в трийодтиронин, что приводит к снижению сывороточного уровня свободного Т4 (св. Т4) (эутиреоидная гипертироксинемия). Данное состояние не требует лечения. Вследствие подавления активности 5’-дейодиназы 2 уменьшается образование Т3 в гипофизе. Это обусловливает клинически незначимое повышение тиреотропного гормона (ТТГ), что также не требует коррекции [7].
В то же время в результате нарушения ускользания от эффекта Вольфа – Чайкова блокируется органификация йода, что приводит к развитию амиодарон-индуцированного гипотиреоза [8]. Амиодарон-индуцированный тиреотоксикоз часто развивается у пациентов, проживающих в йододефицитных регионах. При исходной патологии щитовидной железы йод, высвобождаемый из препарата, вызывает увеличение синтеза тиреоидных гормонов в зонах автономии или запускает аутоиммунный процесс, вследствие чего развивается амиодарон-индуцированный тиреотоксикоз 1 типа. У пациентов с интактной щитовидной железой амиодарон, обладающий цитотоксическим влиянием на щитовидную железу, вызывает деструкцию железы, что приводит к развитию амиодарон-индуцированного тиреотоксикоза 2 типа и выходу ранее синтезированных тиреоидных гормонов в кровоток [9]. При наличии двух процессов развивается тиреотоксикоз смешанного типа.
Для определения типа тиреотоксикоза и выбора дальнейшей тактики ведения пациентов необходимо исследовать уровень ТТГ, Т3, св. Т4, антител к рецепторам ТТГ, провести сцинтиграфию щитовидной железы с Тс99-МИБИ [10]. Тиреотоксикоз 1 типа характеризуется повышенным захватом радиофармпрепарата, возможно также обнаружение антител к рецепторам ТТГ, тиреотоксикоз 2 типа – сниженным захватом радиофармпрепарата (табл. 1).
Для лечения амиодарон-индуцированного тиреотоксикоза 1 типа препаратами выбора являются тиреостатики, 2 типа – глюкокортикостероиды (ГКС) [11]. Если тип тиреотоксикоза неизвестен или обнаружены признаки обоих типов, возможно назначение комбинации тиреостатиков и ГКС. Оперативное лечение, как правило, проводится при невозможности компенсации заболевания после длительного (около шести месяцев) курса медикаментозной терапии или сочетании гипертиреоза с узловым зобом [12]. Пациентам с диффузным или узловым зобом при нормальном или повышенном поглощении радиоизотопа в отсутствие эффекта от консервативной терапии показано лечение радиоактивным йодом.
Трудность ведения пациентов с амиодарон-индуцированным тиреотоксикозом заключается в поздней диагностике патологии щитовидной железы. Увеличение частоты и тяжести аритмий у пациентов, получающих амиодарон, редко ассоциируется с заболеванием щитовидной железы.
Клинический случай
Пациентка Я., 63 лет. Поступила в отделение эндокринологии Московского клинического научного центра им. А.С. Логинова в сентябре 2018 г. с жалобами на перебои в работе сердца, слабость, повышенную потливость, дрожь в теле, потерю массы тела на 6 кг за последний месяц, выпадение волос, плохой сон.
Объективно: выраженный дефицит массы тела, индекс массы тела – 15 кг/м2. На ощупь повышенная влажность и температура кожных покровов. Тремор верхних конечностей. Перкуссия и аускультация без особенностей. Тоны сердца приглушенные, ритмичные. Частота сердечных сокращений – 70 уд/мин. Щитовидная железа при пальпации безболезненная, узловые образования не выявлены.
Из анамнеза: пароксизмы фибрилляции предсердий впервые отмечены в 2010 г., в связи с чем выполнено исследование тиреоидного статуса. Уровни Т3, св. Т4, ТТГ в норме. Назначена антиаритмическая терапия. Название препарата установить не удалось. Пациентка принимала препарат в течение семи лет. В связи с неэффективностью он был заменен на амиодарон в дозе 400 мг/сут. На момент назначения амиодарона также был исследован тиреоидный статус. Патологии не выявлено. Несмотря на прием амиодарона, пароксизмы фибрилляции предсердий сохранялись, и через год больную перевели на Аллапинин, который она получала в течение двух месяцев. Поскольку пароксизмы фибрилляции предсердий сохранялись, в августе 2018 г. Аллапинин был отменен, выполнена радиочастотная абляция с изоляцией устьев легочных вен. Однако пароксизмы фибрилляции предсердий сохранялись, поэтому врач заподозрил развитие патологии щитовидной железы. Обследование показало повышение уровня св. Т4 до 89 нг/мл (1145 пмоль/л) при значениях ТТГ на нижней границе нормы. Полученные результаты были расценены как эутиреоидная гипертироксинемия. Через месяц пациентка предъявляла жалобы на повышенную потливость, дрожь в теле, снижение массы тела. При повторном исследовании тиреоидного статуса зафиксировано повышение св. Т4 до 154,8 (норма – от 11,5 до 22,7) пмоль/л, св. Т3 до 12,15 (3,50–6,50) пмоль/л, снижение ТТГ до 0,01 (0,4–4,0) мЕд/л. Врач-эндокринолог расценил полученные результаты как доказательство наличия амиодарон-индуцированного тиреотоксикоза смешанного типа, в связи с чем была назначена комбинированная терапия тиреостатиком и ГКС.
На момент поступления в отделение эндокринологии пациентка получала Тирозол 30 мг/сут, преднизолон 20 мг/сут, бисопролол 5 мг/сут, Ксарелто 20 мг/сут. Из-за отсутствия на момент госпитализации результатов лабораторно-инструментальных исследований тип тиреотоксикоза определен не был, доза Тирозола увеличена до 40 мг/сут, преднизолона – до 30 мг/сут. Несмотря на увеличение дозы препаратов, на следующий день после поступления у пациентки зафиксирован пароксизм фибрилляции предсердий, поэтому она была переведена в отделение реанимации, синусовый ритм восстановился самостоятельно.
Согласно результатам ультразвукового исследования щитовидной железы, узловое образование левой доли.
Лабораторное исследование антител к рецепторам ТТГ (проведено впервые) – повышенный уровень антител (табл. 2).
Сцинтиграфию щитовидной железы не выполняли из-за снижения диагностической ценности результатов на фоне приема тиреостатиков.
На основании анализа полученных данных был сделан вывод о наличии у пациентки амиодарон-индуцированного тиреотоксикоза 1 типа. Доза Тирозола увеличена до 50 мг/сут, кроме того, рекомендована постепенная отмена преднизолона.
В ходе дальнейшего наблюдения отмечалась положительная динамика: отсутствие пароксизмов фибрилляции предсердий, нормализация уровня тиреоидных гормонов. Однако после отмены преднизолона у пациентки развилась аллергическая кожная реакция (по типу крапивницы) на Тирозол. Поэтому Тирозол заменили на пропилтиоурацил в дозе 800 мг/сут. На фоне такого лечения уровень тиреоидных гормонов также находился в пределах референсных значений. Ввиду сохраняющегося высокого титра антител к рецепторам ТТГ ожидать ремиссии заболевания у данной пациентки после отмены тиреостатиков не следует. Учитывая тяжелую сердечно-сосудистую патологию, больной показана радиойодтерапия.
Вывод
Для правильного ведения пациентов с амиодарон-индуцированным тиреотоксикозом принципиально важно определить тип тиреотоксикоза. На примере данного клинического случая продемонстрировано ошибочное ведение пациентки врачом амбулаторно-поликлинического звена – по типу тиреотоксикоза смешанного генеза. Более того, доза Тирозола, назначаемая для лечения амиодарон-индуцированного тиреотоксикоза 1 типа, должна составлять не менее 40 мг/сут и применяться длительно.
Важно также до назначения терапии тиреотоксикоза выполнять сцинтиграфию щитовидной железы с определением захвата радиофармпрепарата, а также исследовать уровень антител к рецепторам ТТГ. Последнее необходимо не только для проведения дифференциальной диагностики, но и для оценки ремиссии заболевания после отмены тиреостатика или принятия решения в пользу радикального лечения заболевания. Как правило, ремиссия заболевания достигается не более чем в 50% случаев. Необходим тщательный контроль за пациентами, принимающими амиодарон, оценка функционального состояния щитовидной железы, поскольку развившийся вторичный тиреотоксикоз ведет к рецидивам нарушения сердечного ритма.
A.M. Mkrtumyan, MD, PhD, Prof., Ye.V. Biryukova, MD, PhD, Prof., L.V. Yegshatyan, PhD, M.D. Lovanova, L.A. Zvenigorodskaya, MD, PhD, Prof.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Ashot M. Mkrtumyan, vagrashot@mail.ru
Currently, with the purpose of severe cardiac arrhythmias correction in the cardiology practice is widely used amiodarone. Such therapy often leads to a violation of the thyroid status. In turn, thyroid damage can worsen cardiac pathology, which is dangerous for the lives of patients. That is why, we consider it relevant to investigate the clinical case of amiodarone-induced thyrotoxicosis and the tactics of such a patient management.

