Диагностика и лечение острой неспецифической боли в шейном отделе у лиц молодого возраста
- Аннотация
- Статья
- Ссылки
- English
Рабочая группа Bone and Joint Decade 2000–2010 Task Force on Neck Pain and Its Associated Disorders описывает боль в шее как боль, локализующуюся в анатомической области шеи с или без вовлечения областей головы, туловища и верхних конечностей.
По данным исследований, распространенность боли в шее колеблется в пределах 15–50% [1–3]. В США боль в шее является четвертой по значимости причиной потери лет нетрудоспособности и уступает только поясничной боли, депрессии и суставным проблемам [4]. Пик заболеваемости приходится на средний возраст, несколько чаще страдают женщины [3]. В то же время проблема боли в шее актуальна и для лиц более молодого возраста. У подростков в возрасте от 15 до 19 лет боль в шейном отделе является одной из основных причин многолетней инвалидизации и встречается чаще, чем астма, алкоголизм и наркомания. В норвежском исследовании с участием 7373 подростков в возрасте 13–19 лет боль в шее и плече была самой распространенной среди всех вариантов скелетно-мышечной боли [5]. Боль в шее чаще встречается у детей и подростков, проживающих в развивающихся странах. Образ жизни, физические, психологические и социальные факторы, а также неправильная поза при использовании гаджетов считаются факторами риска, ассоциированными с болью в шее и плече, у студентов. Кроме того, боль в шее и плече у детей рассматривается как фактор риска возникновения проблем со здоровьем в зрелом возрасте. Тем не менее исследований, посвященных данной проблеме, недостаточно, а результаты противоречивы [6]. Часто развитие шейной боли, особенно у молодых пациентов, обусловлено спортивными и производственными травмами, включая хлыстовые. Наиболее высокий уровень заболеваемости отмечается среди автогонщиков, борцов и хоккеистов [3]. В молодежной среде пользуются популярностью высокоскоростные, плохо защищенные средства передвижения, например скутеры, электросамокаты. При недостаточной правовой и социальной регламентации можно спрогнозировать увеличение среди указанных лиц риска возникновения травм, в том числе шеи.
К факторам, предрасполагающим к развитию боли в шее, относят психологические проблемы, генетические факторы, нарушение сна, курение, ожирение, сидячий образ жизни, головную боль и боль в спине, соматическую патологию [7–11]. Болью в шее чаще страдают офисные работники (наибольшая распространенность до 63%), профессиональные водители, медики и представители профессий, связанных с тяжелым физическим трудом. Помимо физических существенным фактором, связанным с болью, является низкая удовлетворенность условиями труда [12].
Согласно данным системного обзора R. Kim и соавт., наиболее значимыми факторами риска возникновения первого эпизода боли в шее считаются психосоциальные факторы, в том числе депрессия, ролевые конфликты. В то же время физические факторы, в частности работа в неудобном положении, мышечное перенапряжение, менее значимы. К факторам, предотвращающим обострения, относят высокий уровень лидерства, хороший социальный климат, достаточную физическую активность в свободное время [13].
Шейный отдел позвоночника имеет ряд анатомических и функциональных особенностей. Костный канал для позвоночной артерии образован отверстиями в поперечных отростках шейных позвонков. Несмотря на укоренившиеся мифы, вертеброгенная компрессия позвоночной артерии – чрезвычайно редкий и недоказанный фактор развития ишемических повреждений головного мозга, в частности головокружения. Диагноз синдрома позвоночной артерии архаичен. Отмечаются особое строение межпозвонковых дисков в шейном отделе, их отсутствие в верхнем шейном отделе. В других сегментах имеет место слабая выраженность пульпозного ядра с его регрессом в большинстве случаев к 30 годам. В отличие от поясничного в шейном отделе диски больше похожи на связку, чем на амортизатор, и восприимчивы к травматическим нагрузкам, приводящим к растяжению связочного аппарата [14]. Строение первого и второго шейных позвонков отличается от строения других позвонков, что предопределяет особый характер травм в данном отделе. Не исключен вывих в атлантоаксиальном сочленении, особенно у детей и лиц с ревматическими заболеваниями. Спондилезные изменения в особых унковертебральных сочленениях могут быть причиной как скелетно-мышечной боли, так и радикулопатии. Для шейного отдела характерна особая биокинематика с преобладанием в верхнем шейном отделе вращательных, а в нижнем сгибательно-разгибательных движений. Позвоночный канал на шейном уровне относительно узкий. При этом в нем располагается спинной мозг с питающими его сосудами. Соотношение размеров фасеточных суставов и величины межпозвонковых дисков на шейном уровне больше, чем в других отделах позвоночника, соответственно нагрузка на них выше. Направление суставных отростков более фронтальное, что необходимо учитывать при манипуляциях в этом отделе [15].
Эксперты Рабочей группы по изучению боли в шее Канадского университета Британской Колумбии (The Neck Pain Task Force, NPTF), исходя из десятилетнего опыта изучения проблемы, советуют отказаться от диагноза, основанного на определении поражения конкретной анатомической структуры. В соответствии с классификацией боли в шее по степени тяжести, выделяют четыре класса, для каждого из которых определена тактика обследования и лечения [16]:
- боль в шее без явной патологии шейного отдела, незначительно влияющая на дневную активность;
- боль в шее без явной патологии, ограничивающая повседневную активность;
- боль в шее, сопровождающаяся клиническими проявлениями радикулопатии;
- боль в шее с признаками тяжелой патологии шейного отдела (травма, опухоль, цервикальная миелопатия и т.п.).
В отечественных классификациях боль в шее, обусловленная дегенеративными изменениями позвоночника, именуется вертеброгенной цервикалгией (М54.2), при иррадиации в голову – цервикокраниалгией (соответствует обычно классам 1 и 2 по классификации NPTF), при иррадиации боли в руку – цервикобрахиалгией (М.50.1) (класс 3 по классификации NPTF) и поражением спинного мозга (цервикальная миелопатия) (поражение межпозвоночного диска шейного отдела с миелопатией (G99.2*) – класс 4 по классификации NPTF).
Имеются и другие классификации шейной боли, в основе которых лежат различные критерии. Исходя из временного критерия, боль подразделяют на острую (до трех месяцев) и хроническую (свыше трех месяцев). В настоящее время разработаны рекомендации по лечению боли в зависимости от основного патофизиологического механизма. В связи с этим предлагается классификация, основанная на определении не анатомического источника, а главного механизма: ноцицептивная, невропатическая и дисфункциональная боль. Ноцицептивная (механическая) боль в большинстве случаев возникает в позвоночнике или поддерживающих его структурах – суставах, связках и мышцах. Обычные примеры механической боли – боль, возникающая при поражении фасеточных суставов, и миофасциальная боль. Нейропатическая боль отмечается в основном при поражении нервной системы. Наиболее распространенным примером периферической невропатической боли является корешковый синдром. Дисфункциональная боль – важный компонент любой хронической боли, особенно фибромиалгии. Классификация, основанная на феноменологии боли, а не на конкретном анатомическом субстрате, позволяет проводить дифференцированную терапию. С помощью ряда доступных инструментов можно отличить нейропатическую боль от ноцицептивной. Речь прежде всего идет об опросниках PainDETECT, DN-4 и шкале боли S-LANSS (самооценка Лидса для оценки нейропатических симптомов и признаков). Что касается хронической боли в пояснице, во многих исследованиях указан диапазон распространенности преимущественно невропатической боли в разных когортах от 17 до 55% с медианой 41%. Однако до настоящего времени исследований распространенности нейропатической боли в общей популяции пациентов с болью в шее не проводилось [15].
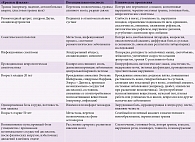
Согласно руководству OPTIMa, на первом этапе необходимо исключить серьезную патологию, классифицировать боль в шее по степени тяжести и оценить прогностические факторы, способные затянуть выздоровление [7]. Основной составляющей клинической оценки боли в области шеи является исключение серьезной патологии на основании «красных флажков» тревоги. Дифференциальный диагноз боли в шее включает травмы, опухолевые, воспалительные, инфекционные, сосудистые, эндокринологические и неврологические заболевания. В то же время в отличие от поясничной боли при боли в шее диагностическая точность «красных флажков» тревоги неизвестна [15, 17]. «Красные флажки» опасности представлены в таблице.
Подобно поясничной острая боль в шее в большинстве случаев регрессирует в течение нескольких дней/недель. Тем не менее в 60–80% случаев через год после первоначального эпизода наблюдается рецидив [18]. Нейровизуализационные изменения и лечение в остром периоде не влияют на хронизацию процесса. К факторам, способствующим хронизации, относят женский пол, пожилой возраст, высокую интенсивность боли, психосоциальные проблемы и корешковые симптомы [19, 20]. Депрессия и использование пассивных стратегий преодоления боли часто приводят к психологическим проблемам, способствующим хронизации боли. Среди прочих факторов – посттравматический стресс, кинезиофобия и тревожность [21].
Самым распространенным типом боли в шее считается неспецифическая (механическая, аксиальная) боль, или цервикалгия. Нередко точную причину или происхождение боли определить не удается: она может быть следствием незначительных деформаций, растяжения связок шеи, неправильной осанки и т.д. При неспецифической цервикалгии пациенты жалуются на боль в шейном отделе, обычно умеренной интенсивности, усиливающуюся при движениях или в определенном положении (первая и вторая степень тяжести по классификации NPTF). Нередко имеет место ограничение подвижности с вынужденным положением головы по типу острой кривошеи. Боль может иррадиировать в плечо, руку или основание черепа. Обычно боль провоцируется неловким движением, локальным переохлаждением, длительным вынужденным положением головы с перенапряжением шейных мышц и блокированием фасеточных суставов, что в большинстве случаев становится следствием повседневной деятельности (например, неудобное положение тела в процессе обучения или игры (студенты, школьники, геймеры), неудобная поза во время сна, неправильное размещение монитора компьютера) [22, 23].
Анатомические источники неспецифической боли определить сложно, и в большинстве случаев это не имеет значения для дальнейшего лечения. Вместе с тем наиболее частой (36–67% случаев) анатомической причиной неспецифической боли в шее является поражение межпозвонковых фасеточных суставов. Более высокая распространенность фасеточного синдрома в шее по сравнению с поясницей объясняется относительно большим размером суставов по сравнению с дисками на шейном уровне и функциональными различиями [24]. Другой важной причиной цервикалгии считается миофасциальный болевой синдром, который характеризуется наибольшей доказательностью именно при шейной локализации процесса.
Шейные межпозвонковые диски имеют ноцицептивную иннервацию. В экспериментальных исследованиях показано, что их раздражение различными стимулами способно вызывать боль в шее. В отличие от концепции поясничной боли концепция дискогенной боли на шейном уровне в настоящее время не имеет клинического применения. Показатели распространенности дискогенной боли в шее неизвестны, но скорее всего невысоки. Каких-либо клинических маркеров или тестов для определения дискогенного характера цервикалгии не существует. Провокационная дискография, разработанная в качестве наиболее информативного диагностического теста, редко используется в клинической практике. Кроме того, отсутствует доказанное лечение шейной боли дискогенной природы [14]. Распространена теория функционального блока с локальным ограничением подвижности сегмента, который служит основной точкой приложения мануальной терапии. Однако патоморфологический субстрат этого состояния неизвестен.
Обследование пациентов с первой и второй степенью тяжести может быть ограничено анализом жалоб и анамнеза для исключения серьезной патологии (скрининг на наличие «красных флажков»), физикальным обследованием, исследованием неврологического статуса (для исключения радикулопатии и миелопатии). В отсутствие «красных флажков» тревоги и отрицательных результатов неврологического обследования не требуется проведения нейровизуализации или лабораторных исследований. Следует оценить прогностические факторы хронизации, прежде всего интенсивность боли (свыше 5 баллов по цифровой рейтинговой шкале) и степень нарушения жизнедеятельности по опроснику NDI (Neck Disability Index, индекс нарушения жизнедеятельности при боли в шее). NDI, созданный на основе опросника Освестри и представляющий по сути его модификацию, включает десять пунктов, семь из которых относятся к повседневной двигательной активности, два – к боли, один – к концентрации. Каждый пункт оценивается в 5 баллов. Чем больше индекс, тем выше степень инвалидизации. Инвалидизация свыше 15 баллов ассоциируется с плохим прогнозом восстановления [25].
Основные элементы физического обследования шеи – осмотр, пальпация, оценка диапазона движений, состояния мышц и связок. Проводится осмотр мышц шеи, пояса верхних конечностей, а также пальпация мышц с определением болезненности и наличия миофасциальных триггерных точек (МТТ). Оценивают наличие вынужденного положения (кривошеи), кифоза или гиперлордоза, диапазон активных и пассивных движений при сгибании/разгибании, латерофлексии и повороте головы как всего шейного отдела, так и отдельных сегментов (методика мануального обследования). При нейроортопедическом обследовании определяют наличие вертебрального синдрома в виде изменения нормальной конфигурации позвоночника, ограничение подвижности в пораженных сегментах, болезненность при пальпации фасеточных суставов и связок.
Для диагностики фасеточного синдрома на шейном уровне могут быть информативными некоторые тесты. Как показали результаты исследования, при достаточной квалификации врача тест давления на проекцию фасеточных суставов характеризуется высокой чувствительностью (0,90) и специфичностью (0,74) при использовании в качестве эталона блокады медиальных ветвей [19]. Тест усиления боли при разгибании с дополнительной ротацией достаточно надежен и обоснован [26]. Данные нейроортопедического обследования подтверждаются диагностическими блокадами, а нейровизуализация не имеет значения для функциональной диагностики фасеточного синдрома.
По мнению экспертов Международной ассоциации по изучению боли (International Assosiation for the Study of Pain, IASP) (2017), для диагностики миофасциального болевого синдрома необходимы как минимум один из трех малых (1–3) и шесть больших (4–9) диагностических клинических критериев [27]:
- наличие пальпируемого тугого тяжа в мышце;
- наличие участков повышенной чувствительности в пределах тугого тяжа;
- воспроизведение отраженных болевых ощущений при стимуляции участков повышенной чувствительности;
- локальное мышечное сокращение при прерывистой пальпации или перкуссии мышечного тяжа;
- наличие «симптома прыжка»;
- узнаваемость пациентом боли при стимуляции активной МТТ;
- предсказуемость паттерна отраженной боли;
- слабость или напряженность вовлеченных мышц;
- боль при сжатии или растяжении вовлеченных мышц.
Предполагается, что активные МТТ связаны с развитием спонтанных болевых ощущений в окружающих тканях и иррадиацией в отдаленные анатомические области. У пациентов с болью в шее активные МТТ встречаются чаще, чем у тех, кто не предъявляет активных жалоб на боль. При пальпаторном исследовании активных МТТ пациенты отмечают обострение болевого феномена, что выражается болевой гримасой и жестами («симптом прыжка»). Один из симптомов, подтверждающих наличие активной MTТ, – локальная реакция вздрагивания (мышечное сокращение). Возникновение подобного феномена связывают с развитием периферической сенситизации в результате повышения чувствительности периферических механоноцицепторов. Кроме того, существуют латентные МТТ, не вызывающие спонтанных болевых ощущений. Тем не менее глубокая пальпация этих точек вызывает болезненность в месте узелка.
Обычно активные МТТ локализуются в нижней части трапециевидной мышцы, мышце, поднимающей лопатку, и затылочных мышцах. Латентные МТТ встречаются у здоровых людей. Различий в распространенности латентных МТТ среди пациентов с болью и здоровых добровольцев не прослеживается. Пальпация, хотя и признана золотым стандартом, обладает невысокой чувствительностью и специфичностью. Диагностика весьма субъективна и зависит от клинического опыта, уровня подготовки и навыков специалиста, выполняющего пальпацию. Отсутствие полного понимания патофизиологии миофасциального болевого синдрома, патогенеза и патофизиологии MTТ обусловлено ограниченностью объективных воспроизводимых исследований.
Хлыстовая травма (ХТ) возникает в результате передачи энергии ускорения/замедления на шейный отдел, при дорожно-транспортных происшествиях или занятиях спортом, особенно среди лиц молодого возраста. Распространенность ХТ в США составляет 3,8 на 1000 человек в год. В большинстве случаев симптомы ХТ возникают сразу после травмы. Но в 14–42% случаев они появляются спустя шесть месяцев после травмы шейного отдела позвоночника, в 10% из них имеет место постоянная сильная боль [28, 29].
По данным исследования «случай – контроль», значительная часть лиц с хронической болью в шее в общей популяции первоначально имела в анамнезе ХТ [30].
Согласно Квебекской классификации, выделяют четыре степени тяжести ХТ:
- общие, неспецифические жалобы на дискомфорт в области шеи, такие как боль, тугоподвижность;
- жалобы при первой степени плюс ограниченность движения;
- жалобы при первой и второй степени плюс неврологические знаки;
- жалобы при первой, второй и третьей степени плюс перелом или вывих (лечение ХТ этой степени находится в компетенции травматологов и нейрохирургов) [31].
Боль в шее является ведущим симптомом ХТ, реже встречаются головная боль, головокружение и радикулярная боль. Боль в шее, вероятно, является результатом растяжения шейных мышц и связок позвоночника. Переломы шейных позвонков могут возникнуть при ХТ, но обычно классифицируются в отдельной рубрике. Как правило, симптомы ХТ значительно уменьшаются в течение двух-трех месяцев после травмы. Прогноз зависит от степени тяжести. Предикторами плохого исхода служат высокоинтенсивная боль и значительная инвалидизация сразу после травмы, холодовая аллодиния, а также психосоциальные факторы (тревожность, катастрофизация, компенсационные и правовые аспекты). В то же время проведение магнитно-резонансной томографии в раннем периоде, результаты рентгенологического исследования, особенности автомобильной аварии (направление удара, использование ремней безопасности или подголовников, скорость движения автомобиля) не влияют на прогноз [32].
Основные рекомендации высокой степени доказательности при ХТ включают оценку целесообразности проведения нейровизуализации, использование активных стратегий лечения, сокращение пассивных методов лечения и повышение эффективности лечения [33].
Для решения вопроса о целесообразности проведения нейровизуализации при диагностике клинически значимой травмы применяют критерии Канадского протокола для шейного отдела C-spine rule (CCSR) или рекомендации Национального исследования по использованию экстренной рентгенографии (National Emergency X-Radiography Utilization, NEXUS) [16].
Согласно CCSR, оценивают три критерия:
- наличие факторов высокого риска серьезного повреждения: возраст старше 65 лет, опасный механизм травмы, парестезии;
- наличие факторов низкого риска: нетяжелое дорожно-транспортное происшествие, отсутствие необходимости в экстренной госпитализации с момента травмы, сидячее положение в отделении неотложной помощи, отсроченное начало боли в шее, отсутствие сильной боли по средней линии шейного отдела позвоночника;
- способность пациента активно двигать головой на 45° влево и вправо.
На основании NEXUS оценивают:
- отсутствие болезненности по задней срединной линии шеи;
- отсутствие признаков локального неврологического дефицита;
- нормальный уровень тревожности;
- отсутствие признаков интоксикации/опьянения;
- отсутствие других серьезных повреждений, маскирующих клиническую картину травмы шеи.
При наличии всех пяти критериев пациент не нуждается в рентгенологическом обследовании. Серьезные и тяжелые травмы требуют проведения неотложного рентгенологического исследования. Методом выбора является мультиспиральная компьютерная томография. Магнитно-резонансная томография позволяет визуализировать повреждения спинного мозга и мягкотканных структур позвоночника.
Рекомендации по лечению как острой, так и хронической шейной боли в значительной мере представляют экстраполяцию рекомендаций, касающихся лечения поясничной боли [34].
Необходимо информировать пациентов о доброкачественном характере процесса, успокоить и рекомендовать поддержание повседневной двигательной активности. Важно вовлекать их в процесс принятия решения. Получив научно обоснованную, понятную информацию об эффективных вариантах лечения, пациенты должны сделать осознанный выбор. При назначении схемы лечения учитываются предпочтения больных и их отношение к риску. Необходимо контролировать состояние пациентов: при ухудшении симптоматики, появлении новых физических или психологических симптомов показан визит к врачу для корректировки лечения [16].
При острой боли рекомендовано структурированное обучение пациентов в сочетании с комплексом двигательных упражнений, в частности в комбинации с мануальной терапией, использованием нестероидных противовоспалительных препаратов (НПВП) и миорелаксантов. Не следует применять массаж, шейные ортезы, электроакупунктуру, электротерапию, тепловые/холодовые процедуры [12].
Анализ 20 современных руководств по ведению неспецифической боли в шее показал эффективность таких методов, как лечебная физкультура, мануальная терапия, образовательные программы (только в рамках комплексного лечения). Наиболее эффективным считается сочетание этих методов. Уровень доказательности широко используемых в клинической практике методов, например электротерапии, вытяжения, лазеротерапии, иглоукалывания, тепловых или холодовых процедур, низкий. В большинстве руководств указано на применение лекарственной терапии как в монорежиме, так и в комбинации с другими методами лечения. Наибольшую распространенность получили неопиоидные анальгетики – НПВП. При этом подчеркивается целесообразность использования топических (трансдермальных) средств при боли в шее, реже опиоидов [21]. Золотым стандартом признан НПВП диклофенак (Вольтарен). Препарат обладает высокой противовоспалительной и анальгетической активностью. В то же время применение системных форм препарата у детей и подростков ограничено из-за риска развития нежелательных эффектов. Трансдермальные формы введения хорошо зарекомендовали себя в клинической практике. При контакте с кожей действующее лекарственное вещество вводится в организм неинвазивным путем, через кожу (через поры вещества попадают в кровеносные сосуды, впоследствии достигают органов-мишеней). Особенностью применения трансдермальных форм является достижение эффективных концентраций активного компонента в очаге воспаления (периартикулярные ткани, синовиальная ткань и синовиальная жидкость). Такие формы имеют преимущество перед системными формами: минимальная системная биодоступность в среднем не более 5–6%. Фармакокинетика зависит от физико-химических свойств и лекарственной формы (мазь, крем, гель, спрей, пластырь), которая определяет степень проникновения через кожу. Применение этих классов лекарственных средств в монотерапии наиболее оправданно в группах риска. Форма препарата Вольтарен Эмульгель обеспечивает лучшее проникновение через кожу: 1%-ный диклофенак в форме эмульгеля проникает в семь раз активнее, чем стандартная форма 5%-ного диклофенака в виде обычного гидрогеля. В результате создаются высокие концентрации препарата в суставно-связочных и мышечных структурах [35]. Благодаря специальному аппликатору пациенты могут наносить препарат Вольтарен Эмульгель 1% непосредственно на зону боли. Препарат оказывает успокаивающий и охлаждающий эффект, обладает легкой текстурой, быстро впитывается, не оставляет следов на ладонях и пальцах, не требует длительного втирания.
В исследовании высокого качества с участием пациентов с острой неспецифической болью в шее Вольтарен Эмульгель 1% продемонстрировал высокую эффективность. В отличие от плацебо на фоне применения препарата отмечалось быстрое и продолжительное снижение интенсивности боли, улучшение функционирования, сокращение срока восстановления [36]. В Кокрейновском обзоре показано, что трансдермальные формы НПВП высокоэффективны у пациентов с острой скелетно-мышечной болью: при использовании таких лекарственных форм выраженность боли снижалась более чем на 50% в период лечения от шести до 14 дней. Побочные эффекты регистрировались редко, не отличались от таковых плацебо, местное раздражающее действие на кожу было незначительным и быстро купировалось [37]. Диклофенак характеризовался наименьшим значением индекса количества больных, которых необходимо пролечить для достижения эффекта (ЧБНЛ/NNT), при степени обезболивания, сходной с таковой НПВП для приема внутрь [38]. Для снижения выраженности боли Вольтарен Эмульгель 2% 12 часов достаточно наносить один раз в течение 12 часов. Трансдермальный пластырь с диклофенаком (Вольтарен пластырь) имеет две дозировки – 15 и 30 мг, действует в течение 24 часов и имеет благоприятный профиль переносимости. Пластырь многослойный. Верхний слой, или мембрана, предохраняет лекарственное средство от испарения во внешнюю среду, следующий слой непосредственно содержит активный компонент, быстро проникающий через кожный барьер, и нетоксичный клеящий состав, предназначенный для оптимального закрепления системы на коже при надавливании. Трансдермальные формы имеют недостатки: потенциальный риск возникновения местных кожных реакций, более медленное по сравнению с инъекционным способом начало действия.
В большинстве рекомендаций указано на нецелесообразность использования шейных ортезов. Импульсная электромагнитная терапия рекомендована в пяти руководствах [21]. Гимнастика на рабочем месте может быть эффективной в целях лечения и профилактики неспецифической боли в шее у офисных работников. В то же время достаточных доказательств эффективности эргономической организации рабочего места нет. При этом подчеркивается, что клинические рекомендации основаны на фактических данных низкого или среднего качества, поэтому необходимы дальнейшие исследования высокого качества. Клиницистам следует учитывать индивидуальные особенности пациентов [28].
Данные умеренного качества свидетельствуют о том, что иглорефлексотерапия в отличие от фиктивного иглоукалывания или отсутствия лечения способствует лучшему обезболиванию и уменьшению степени нарушения жизнедеятельности в краткосрочном периоде [4]. Доказательства в поддержку инъекций в триггерные точки при миофасциальном болевом синдроме неоднозначны. Дело в том, что инъекция любого вещества (или сухого иглоукалывания) в мышечное уплотнение способна облегчить боль, что затрудняет проведение настоящих плацебоконтролируемых исследований. В систематическом обзоре N.A. Scott и соавт. по оценке инъекций триггерной точки при хронической боли не приведено убедительных доказательств ни за, ни против данной методики [39]. Что касается типа процедуры, доказательства, что инъекции с местными анестетиками могут быть более эффективными и менее болезненными, чем введение «сухой иглой», ограниченны [40].
Показана эффективность радиочастотной денервации и блокады медиальных ветвей в снижении боли при фасеточном синдроме на шейном уровне в долгосрочной перспективе. В меньшей степени доказано применение внутрисуставных инъекций. В то же время другие руководства не поддерживают применение интервенционных методов лечения, в том числе оперативное при цервикалгии [41].
Ключевой рекомендацией при острой ХТ является использование активных стратегий лечения, а также сокращение пассивных методов лечения, к которым относят покой, тепловые и холодовые процедуры, диатермию, гидротерапию, ультразвук, чрескожную электростимуляцию. Пациентам необходимо разъяснить отсутствие серьезной патологии и угрозы инвалидизации, содействовать своевременному возвращению к нормальной жизнедеятельности. Тренировка и/или мобилизация направлены на улучшение состояния в краткосрочной перспективе [16].
При острой ХТ эффективны консервативное вмешательство, включающее мультимодальный подход, адекватное обезболивание с использованием различных форм НПВП, применение физических и психологических методов лечения (активные упражнения, мануальная терапия, поведенческие подходы и обучение). Наибольшей доказательностью в уменьшении боли и увеличении подвижности характеризуются физическая активность (включая диапазон движений, мобилизационные упражнения и укрепление шеи и плечевого пояса) и поведенческая терапия (сохранение повседневной деятельности, обучение и самообслуживание, включая регулярные физические упражнения).
В отсутствие серьезной патологии прогноз при острой неспецифической боли в шее благоприятный: в большинстве случаев имеет место полное восстановление, которое иногда затягивается на несколько недель или месяцев. Лечение должно быть направлено на ускорение регресса симптомов, предупреждение хронизации болевого синдрома и дальнейших обострений [22].
A.I. Isaykin, PhD, Ye.A. Akarachkova, PhD, A.N. Akhunov
I.M. Sechenov First Moscow State Medical University
Contact person: Aleksey I. Isaykin, alexisa68@mail.ru
The cervical spine has a number of anatomical and functional features. Lifestyle, physical, psychological and social factors, as well as incorrect posture when using gadgets are considered risk factors. Often, the cause of the development of cervical pain, especially in young people, are sports and industrial injuries, including whiplash. Often (36–67% of cases) the anatomical cause of nonspecific neck pain is the lesion of the intervertebral facet joints. Examination of patients with acute nonspecific neck pain may be limited to the analysis of complaints and anamnesis to exclude serious pathology (screening for the presence of ‘red flags’), physical examination, neurological status study (to exclude radiculopathy and myelopathy). In the absence of ‘red flags’of anxiety and negative results of neurological examination, neuroimaging or laboratory methods of research are not required. The presence of neuro visualization changes and treatment in the acute period do not affect the chronization of the process. The article presents modern classifications, practical determination of chronization factors, methods of examination and treatment of patients with acute nonspecific neck pain and whiplash injuries. To decide on the feasibility of neuro visualization in the diagnosis of a clinically significant injury, the criteria of the Canadian Protocol for the Cervical C-spine Rule or the recommendations of the National Study on the Use of Emergency Radiography are applied. For acute nonspecific neck pain, structured training of patients in combination with a complex of motor exercises, possibly in combination with manual therapy, the use of non-steroidal anti-inflammatory drugs, including topical forms, is recommended. Voltaren Emulgel drug demonstrated high efficacy and safety in acute neck pain. It is indicated for use in groups at risk of developing side effects, including in young patients.