Длительное применение сартанов в амбулаторной практике: телмисартан и его возможности при лечении пациентов с сердечно-сосудистой патологией
- Аннотация
- Статья
- Ссылки
- English


В конце второго десятилетия XXI в. Европейское общество кардиологов (ЕОК, ESC – European Society of Cardiology) вынуждено признать печальную истину [1]: несмотря на то что «множество проверенных, высокоэффективных и хорошо переносимых мероприятий, направленных на изменение образа жизни и применение лекарственных препаратов, могут обеспечить снижение артериального давления… контроль артериального давления остается неадекватным во всем мире и далеко не удовлетворителен в европейских странах. Артериальная гипертензия остается основной модифицируемой причиной сердечно-сосудистой и общей смертности во всем мире».
В последних европейских рекомендациях ESC и Европейского общества по артериальной гипертензии (ЕОАГ, ESH – European Society of Hypertension) [1] названа причина сложившейся ситуации, а точнее две: «Все больше данных свидетельствует о том, что низкая приверженность лечению помимо врачебной инертности (отсутствие изменений в терапии при отсутствии контроля артериального давления) является важнейшей причиной неадекватного контроля артериального давления». Две обозначенные проблемы тесно взаимосвязаны.
Естественный стимул к приему препаратов – повышение качества жизни. Пациент чувствует недомогание или боль, принимает таблетку, его самочувствие улучшается, и он охотно, без внутреннего сопротивления продолжает лечение. Но проблема в том, что неосложненная артериальная гипертония (АГ) какой-то период времени не ухудшает качество жизни в отличие от принимаемых препаратов. Как иногда отмечают больные, пока не начал лечиться, был здоров. Пациентов, способных длительно принимать препараты, на фоне которых они чувствуют себя не лучше, а хуже, ради призрачного улучшения прогноза, обещанного врачом, немного. Поэтому любые, даже незначительные нежелательные эффекты гипотензивной либо гиполипидемической терапии могут вызвать у данной категории больных отказ от постоянного приема лекарственного средства.
Переносимость лечения – ведущая причина удержания на терапии или отказа от нее. Именно удержание пациентов на терапии вывело сартаны – блокаторы рецепторов к ангиотензину II (БРА) на первое место. Лидирующая позиция этих препаратов обусловлена не только их высокой эффективностью, но также удобством применения и благоприятным спектром побочных эффектов, сопоставимых с таковыми плацебо [2]. Сартаны снижают артериальное давление (АД) по меньшей мере в той же степени, что и ингибиторы ангиотензинпревращающего фермента (ИАПФ). Последние чаще вызывают побочные эффекты. Кроме того, в ряде исследований показан более мощный гипотензивный эффект БРА. Например, самое крупное проспективное рандомизированное исследование сравнительной безопасности и эффективности БРА и ИАПФ PRISMA (телмисартан против рамиприла) с участием 1600 пациентов продемонстрировало большее снижение амбулаторного АД в группе телмисартана [3, 4]. Особое внимание исследователи уделили динамике АД в последние шесть часов временного интервала дозирования препаратов, которые назначались один раз в сутки утром, и оценке их влияния на АД в ранние утренние часы. Подобный интерес не случаен. Предутреннее повышение ассоциируется с повышенным риском развития острых коронарных и цереброваскулярных осложнений [5]. У пациентов, получавших телмисартан, в последние шесть часов его действия выявлено более значимое снижение АД по сравнению с пациентами группы рамиприла (-12,7/-8,8 против -7,9/-5,4 мм рт. ст. соответственно; р < 0,05). Имеются данные о преимуществе телмисартана перед другими ИАПФ в обеспечении контроля АД в ранние утренние часы [6, 7].
В настоящее время группа БРА представлена восемью молекулами. Эти препараты, хотя и характеризуются множеством общих свойств («класс-эффекты»), но не идентичны. Каждый из них имеет индивидуальные свойства, которые могут стать дополнительным орудием в борьбе за достижение целевых значений АД и улучшение прогноза пациента. Однако, как уже отмечалось, существует еще один фактор – инертность врачей. Несмотря на богатство выбора, в реальной отечественной амбулаторной практике обычно используются два препарата, которые в числе первых были выведены на фармацевтический рынок: лозартан и валсартан. Не умаляя их несомненных преимуществ, следует отметить, что они эффективны не во всех клинических случаях и не всегда являются оптимальным выбором. Телмисартан – один из незаслуженно забытых препаратов. Это более чем странно, поскольку доказательная база, свидетельствующая о его высокой эффективности и безопасности, весьма обширна.
В рандомизированных клинических исследованиях (РКИ) этого препарата участвовало больше всего пациентов [8]. Кроме того, телмисартан – единственный БРА, который в исследовании ONTARGET продемонстрировал терапевтическую эквивалентность ИАПФ рамиприлу у пациентов с гипертонической болезнью при повышенном сосудистом риске [9].
Фармакодинамика и фармакокинетика
По фармакокинетическим свойствам все БРА можно разделить на две большие группы: активные лекарственные вещества и пролекарства [8, 10, 11]. К первым относятся телмисартан и валсартан. Лозартан и кандесартан представляют собой пролекарства, то есть становятся активными препаратами только после ряда метаболических превращений. Процесс превращения пролекарств в активные формы протекает в печени. Следовательно, у пациентов с заболеваниями печени их эффективность может снижаться. Причем степень такого снижения, к сожалению, непредсказуема. Эффективность же активных лекарственных веществ при заболеваниях печени не изменяется. Таким образом, у больных АГ с сопутствующими заболеваниями печени препаратами выбора должны стать телмисартан и валсартан, но не лозартан и кандесартан.
Препараты различаются и по длительности блокады АТ1-рецепторов. Структура телмисартана определяет его максимальную аффинность связывания с рецептором по сравнению с олмесартаном, кандесартаном, валсартаном и лозартаном [12]. Телмисартан обеспечивает высокоселективную и самую длительную блокаду AT1-рецепторов [10].
Телмисартан получен из активного метаболита лозартана (ЕХР-3174) путем замещения липофильной бензимидазольной группы на имидазольный компонент. Благодаря такому замещению телмисартан считается наиболее липофильным среди всех БРА и, следовательно, лучше проникает глубоко в ткани, обеспечивая как системную, так и местную (тканевую) блокаду ренин-ангиотензиновой системы. Объем распределения БРА в организме также различен: у телмисартана он значительно больше, чем у других блокаторов АТ1-рецепторов (таблица) [8, 10].
Путь выведения из организма – еще одно отличительное свойство представителей этого класса препаратов. Почки выводят только 1% телмисартана, в то время как при использовании других БРА через почки экскретируется до 50% введенной дозы. Таким образом, телмисартан не требует коррекции дозы ни при почечной, ни при печеночной недостаточности [8, 10, 11]. Кроме того, фармакокинетика телмисартана у пожилых и молодых пациентов не отличается. Концентрация препарата в плазме у женщин несколько выше, чем у мужчин, но это не влияет на его антигипертензивное действие. Телмисартан не метаболизируется цитохромом печени Р450, а следовательно, не взаимодействует с препаратами, для окислительного метаболизма которых необходим этот фермент. И это еще один пункт, определяющий безопасность телмисартана. Но самое важное с клинической точки зрения отличие телмисартана – продолжительность действия, на сегодняшний день рекордная для БРА. Наиболее высокая концентрация в плазме при пероральном приеме данного препарата достигается в течение одного часа, а период полувыведения (Т1/2) составляет приблизительно 24 часа. Для сравнения: Т1/2 валсартана – 6–7 часов, лозартана – 6–9, ирбесартана – 11–15 часов. Именно Т1/2 в первую очередь определяет длительность действия гипотензивного средства.
В клинической практике о длительности действия гипотензивного препарата судят по отношению остаточной активности (то есть через 24 часа после приема последней дозы) к пиковой (максимальное действие в момент максимальной концентрации препарата в крови) [9]. При использовании телмисартана один раз в сутки клинически значимое снижение остаточного АД сравнимо со снижением АД на пике действия. Сказанное означает, что препарат контролирует АД свыше 24 часов. Это крайне важно в аспекте проблемы приверженности терапии. Во-первых, доказано, что приверженность препарату, который следует принимать один раз, значительно выше, чем препарату, который принимают хотя бы дважды [13]. Во-вторых, многие пациенты строго не придерживаются времени приема лекарственных средств, а иногда и пропускают его. Поэтому востребованы те препараты, которые «прощают» такую небрежность. «Сверхдлительность» действия препаратов решает проблему утренних подъемов АД, ассоциируемых с ухудшением прогноза [5, 10].
Еще одна особенность телмисартана – самое высокое среди БРА сродство с рецепторами, активируемыми пролифераторами пероксисом (peroxisome proliferator-activated receptors – PPAR). PPAR относятся к суперсемейству ядерных гормональных рецепторов и являются факторами, регулирующими транскрипцию генов при их активации лигандами. Выделяют три типа PPAR: PPAR-альфа, PPAR-бета и PPAR-гамма – с разной локализацией в органах и тканях [14]. PPAR-гамма играет ключевую роль в дифференцировке жировой ткани и ее функционировании – создании запаса липидов в белой жировой ткани и усилении расхода энергии в буром жире. PPAR-гамма участвует также в дифференцировке адипоцитов и регуляции метаболизма глюкозы, повышая чувствительность к инсулину и играя роль связующего звена между метаболизмом липидов и углеводов [14]. Адипонектин – ключевой регулятор процессов, приводящих к развитию инсулинорезистентности и метаболического синдрома. Экспрессия и секреция адипонектина стимулируются селективными модуляторами рецепторов, активирующих PPAR-гамма.
В ряде клинических исследований наблюдалось положительное влияние телмисартана на уровень адипонектина у пациентов с АГ, инсулинорезистентностью, ожирением [15], сахарным диабетом (СД) 2-го типа [16]. В исследовании J. Janke и соавт. на модели адипоцитов человека показано, что телмисартан и ирбесартан (в меньшей степени лозартан) индуцировали адипогенез и активировали гены-мишени PPAR-гамма. Эпросартан не оказывал подобного эффекта [17]. Способность изученных сартанов активировать PPAR-гамма проявлялась при их использовании в различных дозах: низких (телмисартан), средних (ирбесартан) и очень высоких (лозартан). Авторы объяснили подобное явление различной липофильностью препаратов, которая в этом ряду сартанов распределяется следующим образом: телмисартан > ирбесартан > лозартан [14, 18]. Таким образом, телмисартан, будучи частичным агонистом рецепторов PPAR-гамма, обладает плейотропным эффектом и благотворно влияет на углеводный и жировой обмен при назначении в стандартных терапевтических дозах, рекомендуемых для лечения АГ [19].
Мощность и стабильность гипотензивного эффекта
В 2003 г. D.H. Smith и соавт. [20] провели метаанализ результатов двух независимых рандомизированных двойных слепых плацебоконтролируемых исследований с титрованием дозы до достижения эффекта. В них сравнивали эффективность телмисартана 40–80 мг, то есть не в максимальной дозе 160 мг, и лозартана 50–100 мг. Оценивалось снижение среднего уровня АД в течение последних шести часов 24-часового интервала дозирования при назначении один раз в день на протяжении восьми недель. В исследованиях принимали участие пациенты обоего пола старше 18 лет с АГ 1–2-й степени. В общей сложности в оба исследования было включено 720 пациентов (по 360 в группах телмисартана и лозартана). Через восемь недель на фоне терапии снижение диастолического артериального давления (ДАД) в последние шесть часов интервала дозирования в группе телмисартана составило в среднем 6,6 ± 0,4 мм рт. ст., в группе лозартана – 5,1 ± 0,4 мм рт. ст. Почасовое снижение ДАД и систолического АД (САД) в этот период также было более выраженным у пациентов, принимавших телмисартан. При определении вторичных конечных точек (снижение среднесуточного, утреннего, дневного, ночного ДАД и САД) зарегистрировано преимущество телмисартана в достижении устойчивого снижения АД.
Спустя десять лет, в 2013 г., в метаанализе H. Takagi и соавт. [21] были обобщены результаты девяти исследований (n = 2409), в которых сравнивали эффективность телмисартана и лозартана (в шести испытаниях – в монотерапии, в трех – в комбинации с гидрохлортиазидом 12,5 мг). В результате совокупного анализа данных оказалось, что телмисартан превосходит лозартан по всем изучаемым параметрам: АД суточное, в последние шесть часов интервала дозирования, утреннее, дневное, ночное (рис. 1) [21].
Представляет интерес сравнение гипотензивной эффективности телмисартана и валсартана. Согласно метаанализу [22], гипотензивное действие телмисартана сопоставимо с таковым валсартана в монотерапии и выше, чем у лозартана 100 мг и ирбесартана 150 мг. Аналогичные результаты получены в исследовании SMOOTH (2007) при оценке гипотензивного эффекта телмисартана и валсартана в сочетании с гидрохлортиазидом [23], а также в ряде других работ [24]. Участники исследования SMOOTH (n = 840) получали телмисартан 80 мг или валсартан 160 мг в комбинации с гидрохлортиазидом 12,5 мг в течение десяти недель. Первичной конечной точкой служила динамика среднего амбулаторного САД и ДАД в течение последних шести часов 24-часового интервала дозирования от исходного уровня. На основании полученных результатов авторы сделали вывод, что телмисартан в комбинации с гидрохлортиазидом обеспечивает значительно большее снижение уровня АД, чем валсартан в той же комбинации, в течение 24-часового интервала дозирования, особенно в утренние часы.
В 2013 г. H. Takagi и соавт. опубликовали систематический обзор [25], в который включили 17 проспективных РКИ (5422 больных), посвященных сравнительной оценке гипотензивной эффективности телмисартана (40 или 80 мг) и валсартана (80 или 160 мг). Метаанализ подтвердил преимущество телмисартана перед валсартаном в комбинации с гидрохлортиазидом (различие средних значений САД/ДАД -2,67/-1,40 мм рт. ст.). Введение поправки на возраст и пол не повлияло на результаты. Авторы уточнили: поскольку в анализируемых РКИ не оценивались частота сердечно-сосудистых или цереброваскулярных событий и смертность вследствие таких событий, при интерпретации полученных результатов необходимо проявлять осторожность.
Влияние телмисартана на прогноз больных высокого риска сердечно-сосудистых осложнений
Сегодня, выбирая препарат для гипотензивной терапии, мы ориентируемся не только на его гипотензивный эффект, но и на способность улучшать прогноз пациента, снижать риск сердечно-сосудистых осложнений (ССО). Прямых сравнительных РКИ различных БРА, посвященных оценке их влияния на снижение сердечно-сосудистого риска, не проводилось. Однако прямое сравнительное исследование ONTARGET признано самым большим на сегодняшний день исследованием эффективности БРА в мире. Ученые сравнивали влияние телмисартана и рамиприла – золотого стандарта в профилактике осложнений у пациентов группы высокого риска, а также их комбинацию. Телмисартан 80 мг не уступал рамиприлу 10 мг в предотвращении риска сердечно-сосудистой смерти, инфаркта миокарда, инсульта и госпитализации по поводу сердечной недостаточности. Эффект не зависел от степени снижения АД. Телмисартан показал лучший профиль переносимости, что отразилось на длительности приема препарата. В реальной клинической практике это означает лучшую приверженность терапии, а следовательно, более высокую эффективность и лучший прогноз для пациентов, получающих этот препарат. В исследовании ONTARGET также была доказана возможность профилактики развития новых эпизодов СД 2-го типа или нарушения толерантности к глюкозе на фоне лечения телмисартаном [8].
В исследовании TRANSCEND отмечалось снижение частоты ССО и сердечно-сосудистой смертности у пациентов с высоким риском, а также нефро- и кардиопротективный эффект по сравнению с группой плацебо [26]. Помимо снижения риска ССО на фоне терапии телмисартаном значительно уменьшался риск развития новых случаев СД 2-го типа на 16% (р < 0,05) [26].
В исследовании PRoFESS телмисартан также снижал риск развития СД 2-го типа на 16% у пациентов с высоким риском сердечно-сосудистых событий [27]. Результаты исследований ONTARGET и TRANSCEND послужили основанием для регистрации нового показания для телмисартана – снижение риска осложнений у пациентов с клиническими проявлениями атеросклероза.
Ситуации, в которых телмисартан – препарат выбора
Бесспорно, телмисартан должен стать препаратом выбора у пациентов с ожирением и АГ, особенно резистентной к терапии. Тот факт, что включение телмисартана в схему терапии таких больных значительно улучшает контроль АД, сомнений не вызывает. Особый интерес в этом аспекте представляет отечественное исследование с использованием дженерического телмисартана компании «Др. Редди’с Лабораторис» (Индия) с доказанной биоэквивалентностью оригинальному телмисартану [28]. Использование дженериков приблизило исследование к реальной амбулаторной практике. В проспективном открытом рандомизированном двухцентровом исследовании продолжительностью 20 недель участвовало 30 больных АГ, резистентной к медикаментозной терапии (АД ≥ 140/90 мм рт. ст., несмотря на прием трех и более препаратов, в том числе диуретика в адекватных дозах), и индексом массы тела > 30 кг/м2. Уровень АД определяли по результатам суточного мониторирования АД (СМАД). Пациентам основной группы вместо ранее принимаемого БРА или ИАПФ (валсартан 160 мг/сут, лозартан 100 мг/сут, эналаприл 20 мг/сут или периндоприл 10 мг/сут) назначали дженерический телмисартан 80 мг/сут (компания «Др. Редди’с Лабораторис», Индия) в свободной или фиксированной (Телсартан® АМ) комбинации с амлодипином. Дополнительно при необходимости больные принимали индапамид. В контрольной группе пациенты продолжали прием ранее назначенного БРА или ИАПФ в комбинации с амлодипином 10 мг и индапамидом 2,5 мг, то есть в тех же дозах, что и в основной группе. В группе телмисартана значимого снижения САД удалось добиться у 73% больных, снижения ДАД – у 65% (в среднем на 10,7 мм рт. ст.). Это расценивалось как преодоление резистентности к терапии, хотя целевой уровень АД был достигнут не у всех пациентов. Важнейшим результатом исследования, по мнению ученых, стало повышение уровня адипонектина в сыворотке крови и снижение концентрации высокочувствительного С-реактивного белка (вчСРБ) и интерлейкина 6 – маркеров воспаления, ассоциируемых с прогрессированием эндотелиальной дисфункции и повышением риска ССО.
Противовоспалительный эффект телмисартана подтвержден и в более ранних работах, как экспериментальных [28], так и клинических [29]. В частности, прием телмисартана способствовал стабилизации атеросклеротических бляшек в коронарных артериях [29] за счет увеличения фиброзного и уменьшения липидного объема, по данным внутрисосудистого ультразвукового исследования. При заборе крови из коронарного синуса отмечалось уменьшение провоспалительных цитокинов (MMP3, фактор некроза опухоли альфа, вчСРБ, MMP9), что указывало на уменьшение локального воспалительного ответа. В культуре микроваскулярных эндотелиальных клеток телмисартан снижал уровень СРБ за счет ослабления экспрессии рецептора к конечным продуктам гликации AGE (Аdvanced Glycation End products), опосредованного PPAR-гамма [14], что приводило к снижению аккумуляции AGE. Последние через систему растворимых рецепторов sRAGE (soluble form of RAGE) способствуют интенсификации процессов внеклеточного накопления коллагена, ремоделирования внеклеточного матрикса, фиброзирования клубочков нефрона, что в конечном итоге является интегральной причиной снижения глобальной почечной функции [30].
Плейотропные эффекты телмисартана делают его препаратом выбора и у больных СД 2-го типа. Особое внимание уделяется нефропротективным эффектам БРА у этих пациентов. При сочетании СД и АГ эффективность телмисартана в РКИ была сравнима с таковой эналаприла и валсартана и превышала эффективность лозартана [31–34]. Валсартан 160 мг/сут и телмисартан 80 мг/суд в равной степени снижали АД и уменьшали суточную протеинурию. Различий в уровне скорости клубочковой фильтрации (СКФ) не выявлено. Признано, что оба препарата характеризуются мощным нефропротективным эффектом у больных диабетом. Противовоспалительного эффекта эти препараты в выбранных дозах, к сожалению, не оказывали [31].
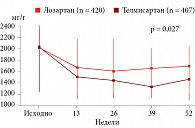
G. Bakris и соавт. (2008) [33] сравнивали нефропротективную эффективность наиболее липофильного БРА телмисартана и препарата с низкой липофильностью лозартана. В РКИ AMADEO принимало участие 860 больных диабетической нефропатией с АД около 130/80 мм рт. ст. или достижением целевого уровня на фоне гипотензивной терапии. Наблюдение продолжалось 52 недели. Первичной конечной точкой была динамика соотношения альбумина к креатинину в моче. Эффект телмисартана существенно превышал таковой лозартана при сопоставимой динамике АД (рис. 2) [33].
Большое практическое значение имеет то, что избыточное потребление соли может снижать нефропротективное действие телмисартана, в том числе при комбинированной терапии [35].
В литературе широко обсуждается способность БРА, в частности телмисартана, снижать риск развития и рецидивирования фибрилляции предсердий (ФП) у больных АГ. В метаанализ 2014 г. [36] вошло четыре РКИ (1050 пациентов, средний возраст – 63 года, среднее АД – 156/94 мм рт. ст.). Несмотря на сопоставимое снижение АД, частота рецидивирования ФП была статистически значимо ниже на фоне приема телмисартана по сравнению с другими гипотензивными препаратами (относительный риск 0,54; 95%-ный доверительный интервал 0,34–0,86; p < 0,05). Телмисартан эффективнее, чем рамиприл [37], амлодипин [38] и даже карведилол [39], снижал частоту рецидивирования ФП при сопоставимом гипотензивном эффекте.
В исследовании H. Du и соавт. (2013) [40] нифедипин так же эффективно, как телмисартан, снижал частоту пароксизмов, но телмисартан эффективнее предотвращал переход ФП в постоянную форму.
Таким образом, телмисартан в ряду сартанов занимает почетное место. Это эффективное и безопасное гипотензивное средство, характеризующееся рядом преимуществ перед другими представителями данного класса. Длительный Т1/2 (свыше 20 часов) обеспечивает гипотензивный эффект до 48 часов, что особенно важно для контроля АД в опасные утренние часы и в ситуациях со смещением приема очередной дозы лекарственного средства. У пациентов с АГ на фоне ожирения, метаболического синдрома, сахарного диабета телмисартан может превосходить другие гипотензивные препараты за счет плейотропного эффекта. Удобство приема и хорошая переносимость обеспечивают высокую приверженность терапии. Немаловажный фактор повышения приверженности терапии – ее доступность. Воспроизведенные препараты (дженерики) характеризуются доказанной биоэквивалентностью оригинальным препаратам и в то же время имеют более низкую стоимость. Использование дженерика телмисартана (например, препарата Телсартан®), а также фиксированных комбинаций с гидрохлортиазидом (Телсартан® Н) и амлодипином (Телсартан® АМ) расширяет возможности рутинной практики.
M.D. Smirnova, MD, PhD, T.V. Fofanova, MD, PhD
National Medical Research Center of Cardiology
Contact person: Mariya D. Smirnova, naliya1@yandex.ru
The features of pharmacokinetics and pharmacodynamics of angiotensin II receptor blocker (ARB) telmisartan, due to which it has a number of pre-properties compared with other drugs of the angiotensin II receptor blocker group and representatives of other classes of antihypertensive drugs. Comparative evaluation of the antihypertensive effectiveness of ARBs. Special attention is paid to the long half-life of telmisartan, which keeps its effect significant more than 24 hours, which is especially important for the control of blood pressure in the early morning hours. Pleiotropic effects of the drug, clinical situations when it is the drug of choice are also considered. The data on the protective effect of the drug on the state of target organs in arterial hypertension, the possibility of reducing the risk of cardiovascular complications. The advantages of telmisartan in terms of increasing adherence to antihypertensive therapy with long-term administration are considered.

