Введение
В развитии и исходах острого коронарного синдрома (ОКС) ведущая роль отводится острому тромбозу одной из ветвей коронарной артерии сердца. Участие тромбоцитов в образовании тромбоза предопределило достижения антитромбоцитарной терапии в улучшении исходов ОКС. Основу подобной терапии составляет ацетилсалициловая кислота (АСК). Ее подавляющее действие на активность тромбоцитов при ОКС считается недостаточным. Его усиливают, используя блокаду P2Y12- и/или GPIIb/IIIa-рецепторов тромбоцитов.
История вопроса
Двойная антитромбоцитарная терапия (ДАТТ), сочетающая в себе АСК и блокатор P2Y12-рецепторов тромбоцитов, считается обязательным компонентом лечения абсолютного большинства пациентов с любым вариантом ОКС [1–4]. Долгое время единственным вариантом ДАТТ при ОКС оставалось сочетание АСК и клопидогрела. Последний, имея серьезную доказательную базу при ОКС, стал мишенью для сравнения с новыми антиагрегантами в крупных исследованиях. Результаты этих исследований оказались во многом успешными для новых блокаторов P2Y12-рецепторов тромбоцитов, тикагрелора и прасугрела.
ДАТТ: балансирование между эффективным снижением риска ишемических событий и избытком кровотечений
В прошедшее десятилетие стало очевидно, что одним из важнейших условий для усиления антитромбоцитарной терапии является ее безопасность, прежде всего в отношении кровотечений. В XXI веке геморрагической безопасности любого антитромботического лечения придается особое значение. Выяснилось, что крупные кровотечения не только несут в себе непосредственную угрозу для жизни больных, но и способны многократно увеличивать риск развития ишемических событий и даже смерти от них [5–7]. В основе подобного влияния кровотечений на риск ишемических осложнений лежит целая цепь событий. Среди них вызванная кровопотерей артериальная гипотония с неизбежной гипоперфузией сердца и мозга, переливание препаратов крови, влекущее за собой активацию системы гемостаза, и, наконец, полная отмена антиагрегантов и антикоагулянтов. При неудачном соотношении эффективности и геморрагической безопасности антитромботическое лекарство может оказаться как минимум бесполезным: количество предотвращенных ишемических событий со смертельным исходом может быть уравновешено смертельными исходами, вызванными кровотечениями. В худшем случае число смертей, прямо или опосредованно связанных с кровотечениями, может превысить число предотвращенных смертей от ишемических событий, например от инфаркта миокарда (ИМ).
Целесообразность антитромботического вмешательства заключается прежде всего в его влиянии на смертность. При снижении риска смерти от всех причин (общей смертности) преобладание пользы от снижения риска ишемических событий над вредом, наносимым избытком кровотечений, очевидно, что оправдывает применение лекарственного средства, даже когда его влияние на риск несмертельных событий невелико.
Длительность истории успешного снижения риска смерти при ИМ и нестабильной стенокардии превышает четверть века. В серии испытаний АСК у пациентов с нестабильной стенокардией, показавших сходное и убедительное снижение частоты ИМ и смерти (в сумме), статистически значимое снижение общей смертности продемонстрировано только в одном исследовании. Это исследование было проведено в начале 1980-х гг. в Канаде [8]. В нем использовали очень высокую дозу АСК – 325 мг четыре раза в день. Сравниваемое лечение (АСК или плацебо) начиналось в пределах восьми дней после поступления в стационар и продолжалось в среднем 18 месяцев. За этот период смертельные исходы были зарегистрированы у 12 из 276 больных, получавших АСК, и у 27 из 279 принимавших плацебо. Разница в частоте смертельных исходов оказалась статистически значимой.
Наиболее убедительно эффективность АСК при ИМ была продемонстрирована в исследовании ISIS-2 [9]. В нем АСК (162 мг/сут 35 дней) снижала риск смерти по сравнению с плацебо. Для предотвращения одной смерти оказалось необходимым подвергнуть лечению АСК 40 больных. Разница в смертности в пользу АСК в сравнении с плацебо сохранялась и при десятилетнем наблюдении за пациентами [10].
Начало ДАТТ при ОКС связано с успешной оценкой клопидогрела в нескольких клинических исследованиях. В исследование CURE [11] включались больные ОКС без подъема сегмента ST. Нагрузочную дозу клопидогрела (300 мг внутрь) или плацебо назначали немедленно после рандомизации. Впоследствии пациенты продолжали принимать клопидогрел (75 мг в день) или плацебо от трех до 12 месяцев (средняя продолжительность лечения – девять месяцев). К концу наблюдения количество конечных точек в группе больных, получавших комбинацию клопидогрела и АСК, оказалось меньше, чем в группе сравнения (9,3 и 11,4% соответственно; р = 0,001). Частота сердечно-сосудистых смертей (5,1 и 5,5% соответственно) достоверно не различалась.
В исследование CLARITY [12] включались больные до 75 лет в пределах 12 часов от появления ИМ с подъемами сегмента ST на электрокардиограмме. Всем больным назначали АСК. Предполагалось также применение тромболитика и при наличии показаний антикоагулянта. Наблюдение продолжалось 30 суток с момента рандомизации. Первичная конечная точка исследования включала выявленные при ангиографии случаи окклюзии артерии, кровоснабжающей зону инфаркта, смерти от всех причин или рецидив ИМ до выполнения запланированной коронарографии. Первичная конечная точка зарегистрирована в 21,7% случаев в группе плацебо и в 15% случаев в группе клопидогрела (p < 0,001). Преимущественно ангиографический эффект клопидогрела, отмеченный в исследовании CLARITY, нуждался в более убедительных доказательствах. И они были получены в проводимом одновременно с исследованием CLARITY крупномасштабном китайском испытании клопидогрела COMMIT-CCS2 [13]. В нем участвовало 45 852 больных, получавших клопидогрел 75 мг в день (без нагрузочной дозы) и плацебо. Медиана продолжительности применения препарата составила 15 дней (у выживших). В исследовании отмечалось достоверное снижение частоты суммы событий, составивших главную конечную точку (смерть, рецидив инфаркта и инсульт). Кроме того, выявлено достоверное снижение смертности больных (на 7%).
Новые блокаторы P2Y12-рецепторов тромбоцитов и их способность влиять на риск неблагоприятных исходов у больных ОКС
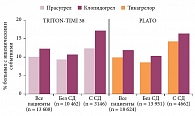
Два препарата, действующие на те же рецепторы, что и клопидогрел, во многом обоснованно претендуют на его место в лечении больных ОКС. Основные аргументы в пользу прасугрела как средства для лечения больных ОКС появились в ходе исследования TRITON-TIMI 38. В нем сравнивали эффекты клопидогрела и прасугрела у 13 608 пациентов с обоими вариантами ОКС, получавших лечение с помощью чрескожных внутрикоронарных процедур [14]. Длительность лечения и наблюдения достигала 15 месяцев. В группе пациентов, принимавших прасугрел, в отличие от группы пациентов, получавших клопидогрел, частота конечной точки (суммы сердечно-сосудистых смертей, ИМ или инсульта) была меньше (9,9 и 12,1% соответственно; p < 0,001). Преимущество прасугрела обеспечивалось снижением риска ИМ: 475 (7,3%) случаев в группе прасугрела и 620 (9,5%) случаев в группе клопидогрела (p < 0,001). Частота инсультов была практически идентичной – 60 (1%) и 61 (1%) случай соответственно. Разница в частоте сердечно-сосудистых смертей была минимальной и статистически незначимой: 133 (2,1%) в группе прасугрела и 150 (2,4%) – в группе клопидогрела. Общая смертность в сравниваемых группах: 188 (3%) случаев в группе прасугрела и 199 (3,2%) – в группе клопидогрела. У больных, принимавших прасугрел, достоверно чаще, чем у больных, получавших клопидогрел, регистрировались кровотечения (2,4 против 1,8%; р = 0,01), в том числе угрожающие жизни (1,4 против 0,9%; р < 0,01) и кровотечения со смертельным исходом (0,4 против 0,1%; р < 0,002). Анализ результатов позволил выявить подгруппы, в которых прасугрел был опаснее клопидогрела. Это лица с перенесенным инсультом и больные старше 75 лет. При практически идентичной разнице в частоте комбинированной конечной точки в каждом из вариантов ОКС (с подъемом и без подъема ST) отмечалось заметно меньшее число смертельных исходов в подгруппе больных с подъемом сегмента ST, получавших прасугрел. Одновременно наблюдалась отчетливая тенденция к увеличению смертности на фоне приема прасугрела в подгруппе больных с ОКС без подъема сегмента ST.
Таким образом, прасугрел как одно из звеньев развития ДАТТ с точки зрения влияния его на смертность представляется скорее тупиком, чем ступенью в эволюции антиагрегантной терапии ОКС. Последующее сравнение эффективности и безопасности клопидогрела и прасугрела в лечении пациентов с ОКС без подъема сегмента ST, не подвергавшихся инвазивному вмешательству, показало, что применение прасугрела в составе продолжительной терапии больных, перенесших ОКС без подъема сегмента ST и не подвергавшихся чрескожному коронарному вмешательству в остром периоде заболевания, не имеет преимуществ перед использованием клопидогрела [15].
Наиболее весомыми по влиянию на смертность следует признать результаты оценки основного конкурента прасугрела – тикагрелора, полученные в ходе исследования PLATO [16]. В нем 18 624 больных, госпитализированных с ОКС (с подъемами или без подъемов сегмента ST), с помощью двойного слепого метода и рандомизации были разделены на две группы. В одной из них применялось стандартное лечение, компонентом которого был клопидогрел (300 мг нагрузочная доза для большинства больных, затем 75 мг в сутки), в другой вместо клопидогрела применяли тикагрелор (180 мг нагрузочная доза, затем 90 мг два раза в сутки). Длительность сравнения составила около 12 месяцев. Основная конечная точка наблюдения включала смерть от сердечно-сосудистых причин, ИМ или инсульт. В итоге суммарная частота этих событий составила 9,8% у получавших тикагрелор и 11,7% у принимавших клопидогрел (отношение рисков (ОР) 0,84; 95% доверительный интервал (ДИ) 0,77–0,92; p < 0,001). Выявлены и другие значимые отличия, включая разницу по частоте ИМ (5,8% в группе тикагрелора и 6,9% в группе клопидогрела; p = 0,005), смерти от сердечно-сосудистых причин (4,0 против 5,1% соответственно; p = 0,001). Наиболее убедительным аргументом в пользу тикагрелора следует считать меньшую частоту случаев смерти от любых причин (4,5% в группе тикагрелора против 5,9% в группе клопидогрела; р < 0,001). Снижение общей смертности у больных ОКС на 1,5% уникально с учетом того, что оно зарегистрировано в условиях сравнения не с плацебо, а с активным антитромбоцитарным препаратом с доказанной эффективностью в отношении снижения смертности. Убедительное снижение общей смертности зарегистрировано в подгруппах больных с подъемом сегмента ST, прошедших инвазивное и консервативное лечение. Наиболее выраженным это снижение было в подгруппе больных, подвергнутых в ходе исследования коронарному шунтированию. Снижение риска ишемических событий на фоне применения тикагрелора достигнуто без статистически значимого увеличения риска крупных геморрагических осложнений (11,6% в группе тикагрелора и 11,2% в группе клопидогрела; р = 0,43).
Существует точка зрения, согласно которой большинство позитивных эффектов тикагрелора, как и его негеморрагических побочных действий, не связано с блокадой тромбоцитарных рецепторов к аденозиндифосфату [17]. Еще одна гипотеза, связанная со снижением смертности, – потенциальное взаимодействие со статинами, широко используемыми у больных ОКС. Согласно фармакодинамическим характеристикам, тикагрелор способен усиливать действие ряда статинов, в частности тех, которые метаболизируются с помощью CYP3A4. Исходя из анализа подгрупп в исследовании PLATO, преимущество тикагрелора перед клопидогрелом было особенно заметным у больных, получавших гиполипидемическую терапию. Еще одна гипотеза основана на обратимом взаимодействии тикагрелора с рецепторами тромбоцитов, благодаря которому тикагрелор перераспределяется между всеми тромбоцитами в кровотоке.
Таким образом, в отличие от клопидогрела тикагрелор блокирует новые тромбоциты сразу после их появления, а не после приема очередной дозы препарата. Это перераспределение тикагрелора между тромбоцитами рассматривается как механизм дополнительного снижения смертности [18], в частности, у больных, подвергнутых коронарному шунтированию.
В целом в случае улучшения выживаемости больных понимание конкретного механизма, ответственного за снижение смертности, не так существенно, как в случае с поиском механизмов развития нежелательных эффектов. Лекарство, улучшающее выживаемость больных, имеет право на приоритетное использование, даже когда процесс улучшения выживаемости необъясним.
Возможности ДАТТ у больных с сахарным диабетом
Больные сахарным диабетом (СД) имеют повышенный риск сердечно-сосудистых, в том числе повторных атеротромботических, событий [19]. Тромбоциты больных СД характеризуются повышенной реактивностью, обусловленной нарушением сразу нескольких механизмов их активации, включая повышенную экспрессию рецепторов на поверхности клеток и передачу сигнала внутри тромбоцитов [20–22]. Эти нарушения обусловливают не только высокую частоту неблагоприятных исходов у больных ОКС с СД, но и большую долю больных СД с неполноценным ответом на ДАТТ (при сравнении с больными без СД) [23–26]. У пациентов с ОКС присутствие фонового СД любого типа ведет к особенно высокой частоте ишемических событий, включая смерть. Наличие СД служит сильнейшим независимым предиктором неблагоприятного исхода как в период госпитализации, так и при длительном наблюдении [27]. Негативное влияние СД на течение ОКС прослеживается во всем спектре ОКС и при различных стратегиях ведения больных, включая консервативно леченные нестабильную стенокардию и ИМ без подъема ST [11], ИМ с подъемом сегмента ST с реперфузией в виде тромболизиса [28] и раннее использование чреcкожных внутрикоронарных вмешательств при обоих вариантах ОКС [29, 30]. У больных ОКС с СД чаще встречаются сердечно-сосудистые факторы риска, сопутствующие заболевания и неполноценное лечение [31].
Отметим, что исследований, специально посвященных оценке эффективности и безопасности ДАТТ у больных ОКС с СД, нет. Представления о возможностях усиленной ДАТТ у такой категории больных основаны прежде всего на результатах изложенных выше крупных исследований. В них доля больных с СД настолько велика, что позволила представить результаты оценки ДАТТ у больных с ОКС и СД в виде отдельных публикаций. Так, в исследовании TRITON-TIMI 38 [32] главная конечная точка при использовании праcугрела регистрировалась реже, чем при использовании клопидогрела (12,2 и 17,0% соответственно; ОР 0,70; p < 0,001). Это преимущество прасугрела прослеживалось у больных СД, получавших (14,3 и 22,2% соответственно; ОР 0,63; p = 0,009) и не получающих инсулин (11,5 и 15,3% соответственно; ОР 0,74; p = 0,009). Несмотря на высокую частоту крупных кровотечений у больных СД и то, что СД является фактором риска кровотечений у данной категории больных, клопидогрел не имел зарегистрированного в исследовании в целом преимущества перед прасугрелом. Крупные кровотечения отмечались у 2,5% больных, получавших клопидогрел, и у 2,6% пациентов, принимавших прасугрел (ОР 1,06; p = 0,81). В подгруппе больных СД прасугрел снижал риск тромбоза стента (с 3,6% в группе клопидогрела до 2% в группе прасугрела; ОР 0,31; p = 0,008). Все эти преимущества прасугрела представляют для российских врачей исключительно познавательный интерес, поскольку препарат отсутствует в стране. Напротив, его основной конкурент тикагрелор широко используется при ОКС и имеет основания для использования у больных с ОКС и СД [33].
4662 больных в исследовании PLATO имели подтвержденный СД, 1036 получали инсулин. У больных СД при использовании тикагрелора (в сравнении с клопидогрелом) отмечалось снижение риска ишемических событий, сопоставимое со снижением риска в исследовании в целом и со снижением риска в подгруппе больных без СД. Снижался риск развития главной конечной точки (ОР 0,88; 95% ДИ 0,76–1,03), общей смертности (ОР 0,82; 95% ДИ 0,66–1,01), тромбоза стента (ОР 0,65; 95% ДИ 0,36–1,17). Достигалось это без увеличения риска крупных кровотечений. Преимущество тикагрелора сохранялось и в подгруппе больных, получавших инсулин. Несмотря на большую амплитуду снижения риска ишемических событий у больных с СД, получавших прасугрел (см. рисунок), говорить о преимуществе прасугрела перед тикагрелором на основании подобного сравнения неправомерно. Прямое сравнение фармакодинамических характеристик тикагрелора и прасугрела у больных с СД указывает на преимущество тикагрелора.
В проспективном слепом перекрестном исследовании участвовали 30 больных с ОКС и СД. Оценка реактивности тромбоцитов, проводимая с помощью VerifyNow, через 15 дней использования стандартных доз тикагрелора и прасугрела выявила лучшее подавление активности тромбоцитов на фоне применения тикагрелора (45,2 PRU [95% ДИ 27,4–63,1]) по сравнению с использованием прасугрела (80,8 PRU [95% ДИ 63,0–98,7]) (p = 0,001).
В другом исследовании 100 больных СД, подвергнутых чрескожному коронарному вмешательству в связи с ОКС, были рандомизированы на группу прасугрела (60 мг) и группу тикагрелора (180 мг) [34]. Оценка активности тромбоцитов через 6–18 часов после нагрузочной дозы с помощью метода VASP показала преимущество тикагрелора. При его использовании индекс VASP составил 17,3 ± 14,2, что оказалось существенно ниже (p = 0,009), чем на фоне применения прасугрела (27,7 ± 23,3%). Сохранение высокой активности тромбоцитов (VASP ≥ 50%) на фоне лечения отмечалось у 6% больных, получавших тикагрелор, и у 16% пациентов, принимавших прасугрел (p = 0,2).
Разумеется, клиническое значение фармакодинамических преимуществ тикагрелора перед прасугрелом у больных ОКС и СД может быть проверено только в крупном исследовании со сравнением частоты ишемических событий. Но проблема выбора второго антиагреганта в дополнение к АСК у больных ОКС и СД в России решена на другом уровне. Таким препаратом является тикагрелор, поскольку прасугрел в нашей стране отсутствует.
Заключение
Эволюция антитромбоцитарной терапии острых коронарных синдромов достигла уровня, при котором мерой целесообразности применения конкретного лекарственного средства становится его способность влиять на смертность. В настоящее время на вершине эволюции в составе двойной антитромбоцитарной терапии, обязательной для большинства больных, находится АСК в сочетании с тикагрелором. Каждый из них оказывает существенное влияние на смертность. Тикагрелор является препаратом первого выбора у больных с острым коронарным синдромом и сопутствующим сахарным диабетом.