Единство и различие стратегии клинического питания и нутритивной поддержки больных хроническим панкреатитом: национальные рекомендации и рекомендации ESPEN
- Аннотация
- Статья
- Ссылки
- English
В 2020 г. Европейской ассоциацией клинического питания и метаболизма (ESPEN) опубликованы клинические рекомендации по нутриционной поддержке больных острым и хроническим панкреатитом (ХП) [1]. В связи с тем что до сих пор окончательно не сформирован междисциплинарный российский консенсусный документ по нутритивной поддержке пациентов с ХП, группой соавторов данной публикации был проведен сравнительный анализ европейского гайдлайна и ряда отечественных публикаций разного уровня, транслированный через призму традиционных врачебных решений и мнений ученых России. Сопоставление предлагаемой стратегии применения нутриционной коррекции проявлений внешнесекреторной недостаточности поджелудочной железы (ВНПЖ) на фоне ХП поможет врачам гастроэнтерологам, терапевтам, хирургам оптимизировать данный дополнительный метод лечения и предотвратить тяжелые расстройства нутриционного статуса пациентов с этой патологией. Важно выявить спорные моменты, особенно касающиеся отдельных наиболее сложных клинических состояний больных ХП и их нутриционного статуса, определить оптимальное решение данной проблемы.
Каковы риски развития мальнутриции у больных ХП?
Риск развития мальнутриции при ХП высокий, и это состояние часто встречается у данной группы больных (сильный консенсус, уровень достигнутого соглашения – 100%).
ХП – это заболевание, характеризующееся прогрессивным развитием необратимых изменений на фоне воспаления поджелудочной железы (ПЖ), приводящего к перманентному структурному повреждению ткани ПЖ и индукции фиброгенеза, что в свою очередь может клинически проявляться абдоминальной болью и признаками экзо- и эндокринной недостаточности ПЖ [2–3].
Мальнутриция представляет собой позднее, но крайне важное проявление ХП и зависит от степени тяжести и продолжительности течения заболевания. В манифестации ВНПЖ и мальнутриции у больных алкогольным и идиопатическим ХП наблюдается ряд различий. Латентный период до появления первых жалоб и симптомов, характерных для ХП, включающих в себя боль и мальабсорбцию/мальнутрицию, составляет от пяти до десяти лет при алкогольном панкреатите, однако этот срок может быть длиннее при панкреатите неалкогольной этиологии. Несмотря на неоднородность данных, существует очевидный риск развития мальнутриции у пациентов с любой этиологией ХП [3–5]. Средний или высокий риск развития мальнутриции по шкале Универсального скрининга мальнутриции (англ. Malnutrition Universal Screening Tool, MUST), равный единице или выше, был выявлен у 31,5% пациентов [6]. Аналогично в исследовании с участием амбулаторных пациентов с ХП недостаточная масса тела и нутритивный риск были диагностированы у 26% пациентов [7].
В то же время в проспективном когортном исследовании с включением 62 пациентов с ХП и 66 пациентов контрольной группы было показано, что более чем у половины пациентов с ХП наблюдались избыточный вес или ожирение [8]. Тем не менее у пациентов с ХП по сравнению с контрольной группой были выявлены достоверные различия в тестах оценки мышечной силы.
У больных ХП при снижении массы тела от умеренной до тяжелой степени сокращение тощей массы тела и саркопения могут стать причиной уменьшения функциональной активности пациента, что потенциально влияет на качество жизни [9]. Кроме того, ВНПЖ приводит к повышению риска значительной потери костной массы и тяжелого остеопороза [10, 11]. Результаты проспективного исследования [9] с участием 182 пациентов с ХП показали, что саркопения была диагностирована у 17% пациентов (у 74% пациентов с ХП индекс массы тела (ИМТ) был выше 18,5 кг/м2). За период наблюдения было выявлено, что наличие саркопении было ассоциировано с повышенным риском госпитализации (отношение шансов (ОШ) 2,2; 95% доверительный интервал (ДИ) 0,9–5,0; p = 0,07), увеличением срока пребывания в стационаре (p < 0,001) и снижением выживаемости (отношение рисков (ОР) 6,7; 95% ДИ 1,8–25,0; p = 0,005).
Метаанализ по оценке частоты встречаемости саркопении, включивший в себя семь исследований и 604 пациентов с ХП, продемонстрировал более высокую частоту регистрации саркопении – 42,09% (95% ДИ 27,845–57,055) [12].
Каковы причины мальнутриции у больных ХП?
Основными причинами мальнутриции при ХП являются ВНПЖ, абдоминальная боль, злоупотребление алкоголем, сниженное потребление пищи, сахарный диабет и курение (сильный консенсус, уровень достигнутого соглашения – 97%).
У больных ХП на риск развития дефицита питательных веществ и мальнутриции одновременно влияют ряд факторов. Прежде всего недостаточность ПЖ (внешнесекреторная, но часто и эндокринная) может привести к нарушению пищеварения и мальабсорбции. Клинические симптомы ВНПЖ включают в себя стеаторею, боль в животе, снижение массы тела и мальнутрицию. У 50% больных ХП наблюдается увеличение расхода энергии в состоянии покоя, что приводит к отрицательному энергетическому балансу и недостаточности питания [13].
Наконец, боль в животе, которая часто встречается у пациентов с ХП, может приводить к сокращению и неполноценности рациона питания и способствовать развитию мальнутриции. Табакокурение является независимым фактором риска развития ХП, а также может быть модификатором заболевания, действуя синергично с приемом алкоголя, и, следовательно, вносит свой вклад в качестве фактора риска мальнутриции [2].
Авторы национального российского руководства «Парентеральное и энтеральное питание» (2014) [23] рассматривают недостаточность питания как частое осложнение алкогольного, идиопатического ХП, связывая развитие мальнутриции с реализацией нескольких механизмов: инактивация пищеварительных ферментов из-за ацидификации двенадцатиперстной кишки и преципитации желчных кислот, нарушения полостного пищеварения; ограничение приема пищи из-за страха постпрандиального усиления боли; снижение активности эндогенной антиоксидантной системы; воздействие ксенобиотиков (алкоголь, никотин, токсические соединения); осложненное течение ХП (сахарный диабет, псевдокисты ПЖ и рак ПЖ). Российский консенсус (2017) по диагностике и лечению ХП сохраняет прежнюю концепцию. Значение нутриционной недостаточности, развивающейся на фоне ХП, все еще недооценивается на современном этапе [14, 15].
Какие диагностические исследования предпочтительны для оценки статуса питания у пациентов с ХП?
Оценка нутриционного статуса должна быть комплексной с учетом клинических проявлений, антропометрических параметров, лабораторных и специальных инструментальных тестов. Не следует использовать только ИМТ, поскольку изолированно данный показатель не позволяет оценить саркопению у пациентов с ХП и ожирением (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 97%).
В исследованиях, посвященных оценке мальнутриции, выявлено несколько биохимических биомаркеров, которые связаны с данным состоянием [16]. В исследованиях распространенности мальнутриции сообщалось о ее различных симптомах. S.S. Olesen и соавт. в поперечном исследовании 166 пациентов с ХП определили, что недостаточная масса тела была диагностирована у 26% пациентов [7]. В то же время, по данным S.N. Duggan и соавт., более половины пациентов из проспективного контролируемого когортного исследования (n = 128) попадали по оценке ИМТ в категорию пациентов с избыточной массой тела/ожирением [8]. При этом у пациентов часто отмечали снижение объема мышечной массы и пониженный функциональный статус, оцененный с помощью динамометрических тестов, по сравнению со здоровыми людьми. Следовательно, ИМТ изолированно не может считаться адекватным методом оценки статуса питания. Снижение веса в процентах считается более надежным индикатором дебюта мальнутриции и связано с более высокими рисками периоперационных осложнений при выполнении хирургического вмешательства [17].
Таким образом, комплексная оценка статуса питания позволяет диагностировать начальную мальнутрицию, саркопению и дефицит микронутриентов, своевременная верификация которых в комбинации с клиническими биомаркерами определяет вероятность неблагоприятного прогноза заболевания.
Авторы национального российского руководства «Парентеральное и энтеральное питание» (2014) [23] считают, что у больных ХП крайне сложно диагностировать начальные стадии мальнутриции. На более поздних стадиях имеются отклонения в составе тела, которые можно выявить при помощи метода БИМ (биоимпедансного анализа состава тела). Российский консенсус (2017) [15] по диагностике и лечению ХП предлагает оценивать нутриционный статус, особенно на фоне проведения заместительной ферментной терапии (ЗФТ), с помощью блока биомаркеров: увеличение ИМТ и массы тела, уровней витамина Е, ретинол-связывающего белка, преальбумина.
Как часто больным ХП проводят скрининг на дефицит витаминов, микроэлементов и макронутриентов?
Пациенты должны проходить скрининг дефицита витаминов, микроэлементов и макронутриентов не реже одного раза в год. Лицам с тяжелым основным или сопутствующими заболеваниями или неконтролируемой мальабсорбцией назначение скрининга может требоваться чаще (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 100%).
Больные ХП подвержены высокому риску мальнутриции как с точки зрения дефицита массы тела, так и с точки зрения изменения его состава [8]. Мальнутриция существенно снижает качество жизни [7, 18] и выживаемость после оперативного лечения [19]. Нутритивная поддержка может улучшить параметры нутритивного статуса и влияет на уменьшение интенсивности абдоминальной боли [20]. В этой связи для своевременного начала нутритивной поддержки необходимо регулярно проводить нутриционный скрининг. Недостаток витаминов и микроэлементов (витамин B12, фолиевая кислота, витамины A, D и E, цинк, селен, железо) хорошо описан у пациентов с ВНПЖ. Дефициты проявляются по-разному: в некоторых исследованиях сообщается о снижении уровней лабораторных маркеров [8, 10, 21], а в некоторых клинических случаях – о заболеваниях, манифестирующих клинически, в том числе о куриной слепоте [22]. Однако рекомендаций о частоте обследований или о вероятных сроках развития дефицита витаминов и микроэлементов не опубликовано. Поскольку дефицит микроэлементов клинически проявляется только на поздней стадии, для выявления ранних его признаков необходимо проводить регулярный скрининг.
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] и Российском консенсусе по диагностике и лечению ХП (2017) [15] нет четкого указания на периодичность скрининга пациентов с ХП, так как течение этого заболевания отличается разной степенью тяжести проявлений мальнутриции, что требует персонифицированного подхода к каждому пациенту.
Какие рекомендации относительно диеты и употребления белков, жиров и углеводов следует давать пациентам с ХП?
Пациентам с ХП не нужно соблюдать ограничительную диету (сильный консенсус, уровень достигнутого соглашения – 94%).
Больным ХП с нормальным статусом питания следует придерживаться сбалансированного рациона питания (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 94%).
Больным ХП с нарушением статуса питания следует рекомендовать употреблять пищу с высоким содержанием белка и калорий в виде пяти-шести небольших приемов пищи в день (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 94%).
Пациентам с ХП следует избегать диеты с очень высоким содержанием клетчатки (степень рекомендации B – сильный консенсус, уровень достигнутого соглашения – 91%).
У пациентов с ХП нет необходимости в ограничении пищевых жиров, за исключением случаев, когда стеаторея не купируется другим образом (сильный консенсус, уровень достигнутого соглашения – 100%).
Существует крайне мало данных, позволяющих описать оптимальную диету для пациентов с ХП. Исторически пациентам рекомендовали диету с низким содержанием жиров. Данные исследований в Нидерландах показывают, что 48–58% пациентов все еще придерживаются таких рекомендаций и ограничивают потребление жиров [11, 24]. Международными руководствами при ХП рекомендуется питаться полноценно в рамках сбалансированного рациона и избегать ограничения жиров [2, 25]. В небольших исследованиях продемонстрировано, что у пациентов с очень легкой формой заболевания ПЖ, которые не употребляли алкоголь регулярно и соблюдали диету с очень низким содержанием жиров (< 20 г жира в день), наблюдалось уменьшение симптомов диспепсии [26]. Также было показано, что пациентам, которые придерживались диеты с высоким содержанием жиров, диагноз ХП был установлен в более молодом возрасте и вероятность развития продолжительной абдоминальной боли оказалась выше [26], что указывает на потенциальную роль жиров в начальном развитии ХП. Однако после того как диагноз ХП был установлен, различий в тяжести или частоте осложнений заболевания выявлено не было. В рандомизированном клиническом исследовании (РКИ), в котором сравнивали наблюдение специалиста по питанию и назначение биологически активных добавок (БАД) с пищей в когорте из 60 пациентов с ХП и мальнутрицией, была показана хорошая переносимость нутритивной поддержки, в которой 33% энергии пациенты усваивали из жиров [20]. У больных, получавших нутритивную поддержку, наблюдалось улучшение статуса питания и уменьшение интенсивности боли при отсутствии каких-либо побочных эффектов [20].
Пациенты, соблюдающие диету с очень высоким содержанием клетчатки, сообщали об усилении метеоризма. В небольшом исследовании (n = 12) у пациентов с ХП на фоне такой диеты отмечено увеличение массы стула в сутки и потери жиров с ним. Это исследование показало, что диета с очень высоким содержанием клетчатки может снижать эффективность ЗФТ, что приводит к мальабсорбции. Таким образом, этой группе пациентов диета с очень высоким содержанием клетчатки не рекомендуется [27].
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] очень подробно изложены диетические рекомендации с описанием стандартной диеты с механическим, химическим щажением и диеты с повышенным содержанием белка. Даны указания по соблюдению потребления определенного объема жидкости, калоража. Рекомендовано включать в рацион 40–60 г в сутки жира, 80–90 г в сутки белка, 300–350 г в сутки углеводов. Диета с повышенным содержанием белка предполагает употребление его до 110–120 г. Российский консенсус по диагностике и лечению ХП рекомендует ограничение жиров только в случае нарушения их усвоения, несмотря на оптимизированную ЗФТ [14].
Показаны ли пациентам с ХП биологически активные добавки к пище со среднецепочечными триглицеридами или без них?
Биологически активные добавки к пище должны назначаться пациентам со сниженным статусом питания только в том случае, если перорального питания недостаточно для достижения целевых значений калорийности и белка (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 100%).
Если добавление ЗФТ в достаточных дозах и исключение избыточного бактериального роста не привели к облегчению симптомов мальабсорбции и сопровождающих ее симптомов, можно назначать БАД со среднецепочечными триглицеридами (англ. medium-chain triglycerides, МСТ) (степень рекомендации 0 – сильный консенсус, уровень достигнутого соглашения – 97%).
Эффективность таких БАД у пациентов с ХП изучали в нескольких исследованиях. В одном из них было показано, что 80% пациентов можно назначать лечение в виде диеты и ЗФТ, остальные же нуждаются в дополнительном употреблении пероральных пищевых добавок с триглицеридами [4]. БАД могут быть полезны истощенным пациентам с ХП, особенно если целевые значения по калорийности и потреблению белка не могут быть достигнуты с помощью обычного питания и коррекции рациона диетологом. БАД представляют собой простой способ увеличить потребление нутриентов с пищей, но долгосрочная приверженность лечению в этом случае может быть затруднена. РКИ, посвященные относительной эффективности различных смесей (например, стандартных или пептидных с МСТ), нами не были найдены. Однако для пациентов с ВНПЖ энтеральное питание, состоящее из предварительно гидролизированных молекул и смеси длинноцепочечных жирных кислот и МСТ, теоретически может иметь потенциальное преимущество, так как абсорбция МСТ в меньшей степени зависит от активности липазы [28]. Уменьшение потребления жира с пищей или замена диетического жира на MCT может привести к снижению потребления энергии и, следовательно, к отрицательному энергетическому балансу. Помимо этого, MCT имеют неприятный вкус и их применение может вызвать такие побочные эффекты, как судороги, тошнота и диарея. До настоящего времени какого-либо явного преимущества МСТ по сравнению со стандартными длинноцепочечными триглицеридами при использовании вместе с ЗФТ в исследованиях показано не было [28]. В одном РКИ изучали эффективность БАД у пациентов с ХП и тяжелым нарушением статуса питания [20]. В результате коррекции рациона под наблюдением специалиста по питанию были получены те же результаты, что и при использовании коммерческой добавки, обогащенной МСТ. Пациенты в обеих группах также получали ЗФТ, поэтому объяснить больший набор массы тела в группе, получавшей MCT, только наличием ЗФТ в схеме лечения невозможно. Если в плане лечения рассматривается добавление МСТ, их дозу следует медленно увеличивать в зависимости от переносимости пациентом.
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] рекомендовано включать МСТ при наличии постпрандиальных болей, но данный вид жиров имеет меньшую энергетическую ценность и может привести к ухудшению вкусовых качеств еды, способствует снижению приверженности диете и повышению психоэмоционального напряжения в целом. В Российском консенсусе по диагностике и лечению ХП [14] не рекомендуется дополнительное использование МСТ, так как убедительных доказательств их эффективности не получено.
Когда пациентам с ХП показано назначение добавок витаминов и микроэлементов (вне профилактики остеопороза)?
Уровни жирорастворимых (A, D, E, K) и водорастворимых (витамин B12, фолиевая кислота, тиамин) витаминов и минералов (магний, железо, селен и цинк) следует контролировать (если есть возможность) и восполнять их дефицит, если таковой диагностирован или зарегистрированы его клинические симптомы. Добавки следует предлагать пациентам с установленной мальабсорбцией (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 95%).
Распространенность дефицитов жирорастворимых витаминов составляет 3–14,5% для витамина A, 58–77,9% для витамина D, 9–24% для витамина E и 13–63% для витамина K [8, 10, 29]. В проспективном контролируемом когортном исследовании 128 пациентов и 66 здоровых лиц контрольной группы, сопоставимых по возрасту/полу, 14,5 и 24,2% имели дефицит витаминов А и Е соответственно. Причем различие было статистически значимым по сравнению с контрольной группой. У 19% пациентов концентрация витамина А в сыворотке была повышена [8]. Это необходимо принимать во внимание, поэтому добавление всех жирорастворимых витаминов всем пациентам с ХП вслепую не рекомендуется.
Дефицит водорастворимых витаминов у больных ХП встречается реже. Исследование с участием 301 пациента с ХП и 266 человек контрольной группы показало, что у пациентов с ХП концентрации витаминов A, D и E были статистически значимо ниже, однако уровень витамина B12 в подгруппах не различался [10]. Аналогично в другом когортном исследовании с участием 114 пациентов с ХП (33% с ВНПЖ) не было выявлено статистически значимого дефицита витамина B12 (0%) и фолиевой кислоты (2,2%) [33].
Следует учитывать развитие вторичного дефицита тиамина при сопутствующем алкоголизме [16]. В некоторых исследованиях «случай – контроль» у больных ХП отмечался дефицит минералов и микроэлементов, были выявлены более низкие уровни цинка, селена [16] и магния [30]. Более того, низкий уровень магния, по-видимому, был связан с ВНПЖ [30].
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] рекомендовано при выраженных признаках внешнесекреторной недостаточности витаминов А, D, Е, К и группы В дополнительный прием 600 мкг органического селена, 540 мг витамина С, 9000 МЕ бета-каротина, 270 МЕ альфа-токоферола и 2 г метионина. Российский консенсус по диагностике и лечению ХП [14] рекомендует их применять только при явных клинических проявлениях или серологическом скрининге.
Когда пациентам с ХП показано энтеральное питание и как его следует вводить?
Энтеральное питание (ЭП) следует назначать пациентам с мальнутрицией, у которых проведение пероральной нутритивной поддержки оказалось неэффективно (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 100%).
ЭП следует вводить через назоеюнальный зонд пациентам с болевым синдромом, стойкой тошнотой или рвотой и стенозом выходного отдела (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 100%).
Пациентам, которым проведение ЭП требуется на срок более 30 дней, его введение может обеспечиваться путем выполнения перкутанной эндоскопической гастростомии с еюнальной экстензией (англ. Percutaneous Endoscopic Gastrostomy with Jejunal Extension, PEG-J) или прямой чрескожной эндоскопической еюностомии/хирургической еюностомии (англ. Direct Percutaneous Endoscopic Jejunostomy, DPEJ) (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 97%).
Если стандартные формулы смесей для ЭП не переносятся пациентом, ему могут быть назначены полуэлементные формулы с MCT (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 94%).
ЗФТ следует назначать пациентам, которым требуется проведение ЭП, если есть признаки ВНПЖ (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 100%).
Пероральная нутритивная поддержка под наблюдением специалиста по питанию обычно эффективна в отношении улучшения нутритивного статуса у пациентов с ХП [20]. ЭП показано примерно 5% пациентов с ХП [5]. Показания к ЭП основаны на результатах нескольких когортных исследований, а РКИ отсутствуют [2]. В четырех ретроспективных сериях была продемонстрирована эффективность ЭП у пациентов с ХП в отношении увеличения веса и контроля боли [31–34]. Два из них включали соответственно 58 [32] и 50 [34] пациентов, которым был установлен назоеюнальный зонд. Длительное питание через PEG-J или DPEJ получали 57 [31] и 58 пациентов [33]. Все исследования показали, что этот тип нутритивной поддержки у пациентов с ХП безопасен и эффективен, даже в случае стеноза выходного отдела желудка [33, 34].
Данные высокого качества относительно применения энтеральных смесей с различными составами у пациентов с ХП малочисленны. Однако есть основания полагать, что полуэлементные энтеральные смеси с МСТ более адаптированы для еюнального питания по сравнению с полимерными смесями [35]. В двух из вышеупомянутых исследований [33, 35] полуэлементные смеси показали хорошую переносимость. Тем не менее стоимость этих смесей выше, а данные об экономической эффективности отсутствуют. Пациентам с ВНПЖ, у которых не наблюдается улучшения при применении полуэлементных смесей, ферментные препараты можно вводить вместе со смесью [36]. В таком случае выполняется вскрытие капсул и растворение ферментных микросфер в загущенной кислой жидкости (густой фруктовый сок или фруктовый сок, сравнимый по густоте с фруктовым нектаром, используемый при дисфагии) для введения через зонд.
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] даны рекомендации по приему энтеральных питательных смесей для повышения пищевой и биологической ценности рациона с учетом особенности клинического течения ХП: при стойкой гипергликемии (более 7 ммоль/л) вводят специальную смесь, не содержащую глюкозу; при благоприятном течении ХП назначают стандартную формулу смесей. Российский консенсус по диагностике и лечению ХП [14] рекомендует при назначении препаратов парентерального питания (ПП) и ЭП базироваться не на степени тяжести мальдигестии, а на основании изменения показателей нутриционного статуса.
Когда пациентам с ХП показано парентеральное питание и как оно должно вводиться?
Парентеральное питание может быть назначено пациентам со стенозом выходного отдела желудка, пациентам с осложнением в виде свищей или в случае непереносимости ЭП (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 100%).
Для ПП предпочтительным путем введения является центральный венозный доступ (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 100%).
ПП редко используется у пациентов с ХП [2, 5]. ЭП сохраняет иммунную функцию и архитектуру слизистой оболочки и снижает вероятность гипергликемии, в то время как ПП в том числе увеличивает риск катетер-ассоциированных инфекций и септических осложнений [4]. Таким образом, ПП показано только тогда, когда применение ЭП невозможно (например, при обструкции выходного отдела желудка, необходимости декомпрессии желудка, невозможности введения зонда в тощую кишку или наличии осложненного свища) или когда целевые значения по питанию достигаются посредством ЭП только частично. ПП в основном назначают на короткий период времени, а исследования результатов долгосрочного назначения отсутствуют. В этом случае стандартный питательный раствор следует вводить посредством центрального венозного доступа, например, через периферически вводимый центральный венозный катетер. Противопоказания к ПП не отличаются от общих противопоказаний к лечебному питанию.
В национальном российском руководстве «Парентеральное и энтеральное питание» [23] рекомендовано рассматривать применение ПП при возникновении постпрандиальной воспалительной реакции, рвоты, тошноты.
Каковы показания для начала ЗФТ у пациентов с ХП?
ЗФТ следует начинать, когда ВНПЖ проявляется клинически или есть признаки мальабсорбции/мальнутриции по данным лабораторных исследований. Точная оценка статуса питания обязательна для выявления признаков мальабсорбции (степень рекомендации A – сильный консенсус, уровень достигнутого соглашения – 100%).
ВНПЖ определяется как недостаточная секреция ферментов ПЖ (ацинарная функция) и/или бикарбоната натрия (протоковая функция) [2]. Диагностика ВНПЖ может быть сложной практической задачей, потому что функция и секреция зависят не только от количества или качества сохранной ткани ПЖ [37], но также от сложных механизмов ее стимуляции [38]. Более того, в современной литературе используются различные лабораторные маркеры ВНПЖ и их референсные значения [39]. По этим причинам сообщается о широком диапазоне (от 22 до 94%) показателей распространенности ВНПЖ среди больных ХП [6, 16]. Наиболее частым клиническим признаком ВНПЖ является стеаторея [40], определяемая по наличию жира в стуле и обычно проявляющаяся метеоризмом, вздутием живота, диспепсией, позывами к дефекации и схваткообразной болью в животе. В систематическом обзоре 14 исследований эффективности ЗФТ у пациентов с ХП и ВНПЖ коэффициент абсорбции жира составил < 80%, а абсорбция жира в кале – менее 7–15 г в день [39]. Явная стеаторея отсутствует, если нет тяжелой или декомпенсированной ВНПЖ (когда секреция липазы ПЖ составляет менее < 10% от нормы). Однако отсутствие явной стеатореи не всегда является показателем адекватной абсорбции и нормального нутритивного статуса. ВНПЖ тесно связана с изменениями показателей биохимического анализа крови и клиническими признаками нутриционной недостаточности [41]. Лечение ВНПЖ включает в себя заместительную терапию ферментами ПЖ, которые следует использовать для поддержания массы тела и лечения симптомов диспепсии [42]. Осведомленность о ВНПЖ среди многих врачей за пределами специализированных центров, особенно среди врачей первичной медико-санитарной помощи, оставляет желать лучшего [24]. Следовательно, причина симптомов у пациентов с ВНПЖ может быть не диагностирована или таким пациентам могут рекомендовать диетические ограничения для лечения клинических проявлений мальабсорбции. Проведенное исследование показало, что пациенты в основном отмечали неудовлетворенность в отношении сложности лечения диспепсических симптомов, соблюдения правильного рациона питания и пищеварения. Действительно, многие из таких пациентов и лиц, осуществляющих уход за ними, ссылались на задержки оценки статуса питания и начала ЗФТ, что вызывало дополнительный стресс, которого можно было бы избежать [43]. Отсутствие лечения ВНПЖ пагубно влияет на качество жизни пациентов [44]. Поскольку количественное измерение фекального жира часто не проводится, рекомендуется начинать ЗФТ при наличии клинических признаков мальабсорбции или антропометрических и/или биохимических признаков нутриционной недостаточности [4, 32, 44]. Такие признаки включают в себя потерю веса, изменение состава тела при биоимпедансном анализе и снижение уровней маркеров нутритивного статуса (альбумин, холинэстераза, преальбумин, ретинол-связывающий белок и магний) [30]. Хотя предполагается, что стеаторея является наиболее важным клиническим проявлением ВНПЖ, в нескольких исследованиях показано снижение всасывания жирорастворимых витаминов даже у пациентов с ВНПЖ от легкой до умеренной степени тяжести [45].
Неалкогольная жировая болезнь печени (НАЖБП) также является недостаточно диагностируемым осложнением ВНПЖ. Механизмы, лежащие в основе развития НАЖБП при ВНПЖ, отличаются от таковых при метаболическом синдроме, поскольку в первом случае состояние связано с нарушением всасывания таких незаменимых аминокислот, как холин, что в свою очередь приводит к снижению содержания в плазме аполипопротеина В [46], главного компонента липопротеинов низкой плотности.
В национальном российском руководстве «Парентеральное и энтеральное питание» [23] рекомендовано ЗФТ применять с каждым приемом пищи и энтеральных питательных смесей при выраженных признаках внешнесекреторной недостаточности (стеаторея, полифекалия), при наличии значимой редукции массы тела (более 20% обычной или 10% нормальной массы тела) дозы ферментных препаратов увеличивают в 2–4 раза. В Российском консенсусе по диагностике и лечению ХП [15] рекомендовано применять ЗФТ при наличии в кале жира более 15 г в сутки и при клинических проявлениях мальабсорбции.
Какие ферментные препараты лучше всего использовать для ЗФТ?
Для лечения ВНПЖ следует использовать pH-чувствительные ферментные препараты в виде микросфер с кишечнорастворимой оболочкой (степень рекомендации A – сильный консенсус, уровень достигнутого соглашения – 100%).
Есть несколько препаратов, используемых в качестве ЗФТ, которые лицензированы во всем мире. Все они животного происхождения и содержат в различных концентрациях и соотношениях панкреатические липазу, амилазу, протеазу и другие полученные из поджелудочной железы белки и нуклеиновые кислоты. На эффективность ЗФТ влияет несколько факторов: смешивание с пищей, скорость опорожнения желудка, соединение с химусом и желчными кислотами и быстрое высвобождение ферментов в двенадцатиперстной кишке [47]. В настоящее время большинство препаратов ферментов ПЖ имеют форму pH-чувствительных капсул с кишечнорастворимым покрытием, содержащих микросферы или таблетки, которые защищают ферменты от кислотности желудочного сока, что позволяет им быстро распадаться при pH > 5,5 в двенадцатиперстной кишке [47]. От обычных порошковых форм или таблеток без кишечнорастворимой оболочки ученые и клиницисты давно отказались, поскольку при этом панкреатические ферменты частично инактивируются пепсином и кислотностью желудочного сока [48]. Эффективность более совершенных форм панкреатина в виде энтеросолюбильных минимикросфер была продемонстрирована в нескольких исследованиях [49–51] и метаанализах [39, 52]. В кокрановском обзоре эффективности препаратов ферментов ПЖ с кишечнорастворимым покрытием у пациентов с ВНПЖ была продемонстрирована более высокая эффективность микросфер по сравнению с таблетками [53]. Было также продемонстрировано, что минимикросферы диаметром 1,0–1,2 мм обладают более высокой лечебной эффективностью по сравнению с микросферами 1,8–2,0 мм [54]. В другом исследовании сравнивали два препарата панкреатических ферментов с кишечнорастворимой оболочкой: влагоустойчивый, содержащий от 90 до 110% меченой липазы в период срока годности продукта, и потенциально нестабильный в присутствии влаги и разлагающийся с течением времени. Характеристики влагоустойчивого препарата должны были позволить более точное дозирование, что обеспечило бы более предсказуемую терапевтическую эффективность и снизило риск передозировки – потенциального фактора риска фиброзирующей колонопатии. Результаты свидетельствуют о сопоставимой эффективности и безопасности лечения ВНПЖ у пациентов с муковисцидозом [55].
В национальном российском руководстве «Парентеральное и энтеральное питание» [23] авторы рекомендуют употреблять быстрорастворимые энтеросолобильные минимикросферы (панкреатин 10 000–25 000 ЕД липазы). Российский консенсус по диагностике и лечению хронического панкреатита [15] рекомендует принимать ферментные препараты с кислотоустойвой оболочкой, в том числе энтеросолобильные минимикросферы с диаметром менее 2 мм. Поскольку выработка собственных ферментов быстро возрастает и может достигать максимума уже через 20–30 минут после приема пищи, одним из требований к современным препаратам панкреатина является быстрое высвобождение ферментов в двенадцатиперстной кишке [2]. Отметим, что комбинированные препараты панкреатина с компонентами желчи не упоминаются в рекомендациях [2, 17, 29]. Сегодня они представлены в форме таблеток или драже и не соответствуют современным требованиям к ЗФТ. Кроме того, присутсвие компонентов желчи значимо расширяет список побочных эффектов и противопоказаний.
Как следует употреблять препараты ЗФТ?
Пероральные ферментные препараты следует потреблять вместе с основными приемами пищи и перекусами (степень рекомендации B – сильный консенсус, уровень достигнутого соглашения – 100%).
Для эффективной работы ЗФТ необходимо смешивание ферментов и химуса [49]. В одном исследовании влияния времени приема ЗФТ в зависимости от приема пищи на мальабсорбцию жира было показано, что оптимальное время приема ферментов – во время или после еды. Не наблюдалось значительных различий в эффективности препаратов, когда пациенты принимали ЗФТ непосредственно перед едой [56]. Многие пациенты предпочитают принимать ЗФТ перед началом еды, поэтому следует рекомендовать распределять капсулы на весь прием пищи при употреблении нескольких капсул или больших порций еды [56, 57].
Какова оптимальная дозировка ферментных препаратов?
Дозировку подбирают индивидуально в зависимости от степени тяжести ВНПЖ и состава пищи. На практике минимальная доза липазы составляет 20 000–50 000 PhU (фармакологических единиц) липазы (в зависимости от препарата) и должна приниматься вместе с основными приемами пищи, а половина этой дозы – с перекусами (степень рекомендации A – сильный консенсус, уровень достигнутого соглашения – 100%).
Рекомендуемая доза зависит от клинического ответа пациента, но дозу ферментных препаратов и кратность приема необходимо тщательно контролировать, а также модифицировать в зависимости от количества пищи, потребляемой пациентом, режима питания, метода приготовления, размеров порций и прогрессирования заболевания.
Для переваривания обычной еды требуется минимум 30 000 МЕ естественно секретируемой панкреатической липазы. Рекомендуемая начальная доза составляет около 10% количества липазы, секретируемой физиологически после обычного приема пищи [58]. При этом следует учитывать, что 1 МЕ естественно секретируемой липазы равняется 3 PhU в коммерческих препаратах, а минимальное количество липазы, необходимое для переваривания нормальной еды, составляет 90 000 PhU (эндогенная плюс липаза, вводимая перорально).
Результаты нескольких РКИ показали эффективность ЗФТ в виде минимикросфер с кишечнорастворимой оболочкой в дозе от 40 000 до 80 000 PhU липазы на основной прием пищи и половинной дозы на промежуточный прием пищи [50, 51, 56, 57]. Результаты исследований микросфер с кишечнорастворимой оболочкой продемонстрировали аналогичную эффективность доз от 10 000 до 40 000 PhU липазы на прием пищи, что указывает на отсутствие зависимости «доза – реакция» для этих препаратов [60]. При отсутствии достаточного ответа у пациента доза ЗФТ может быть увеличена. Для взрослых максимально допустимой дозы ЗФТ не существует, потому что нет риска передозировки, так как пероральные ферменты ПЖ, превышающие потребности, выводятся со стулом. С осторожностью следует относиться к назначению высоких доз детям, так как у них были описаны случаи развития стриктур толстой кишки после применения высоких доз препаратов замедленного высвобождения с кишечнорастворимым покрытием [61].
В национальном российском руководстве «Парентрельное и энтеральное питание» [23] авторы рекомендуют употреблять ферменты в дозе 10000–25000 ЕД липазы за прием пищи или энтеральной питательной смеси, при выраженной ВНПЖ возможно увеличение их до 25000–40000 ЕД липазы. Российский консенсус по диагностике и лечению ХП допускает увеличение дозы ферментов до 75–80 тыс. ЕД липазы на прием пищи, однако при превышении 10–20 тыс. на 1 кг массы тела больного возможен риск развития фиброзирующей колонопатии [15].
Как следует оценивать эффективность ЗФТ?
Эффективность ЗФТ следует оценивать по уменьшению выраженности желудочно-кишечных симптомов и улучшению нутриционных параметров (антропометрических и биохимических). У пациентов, не ответивших на лечение, оценка эффективности лечения должна быть расширена до функциональных тестов ПЖ (экскреция жира в кале или дыхательный тест с 13C-смешанными триглицеридами).
Метаанализ, включающий 14 РКИ [39], показал, что при приеме ЗФТ увеличивался коэффициент всасывания жира, а также снижалась выраженность желудочно-кишечных симптомов по сравнению с исходным уровнем или применением плацебо. В двух открытых расширенных исследованиях длительностью до одного года после завершения основных РКИ, включенных в метаанализ, было продемонстрировано значительное улучшение нутриционных параметров и увеличение массы тела [49]. Обзор опубликованных данных [16] и рекомендации по лечению ХП [2] рассматривают использование нутриционных маркеров в качестве оптимального способа оценки эффективности ВНПЖ. Контролировать рацион и статус питания необходимо регулярно, чтобы максимально поддерживать приверженность пациентов к лечению и обеспечить необходимую частоту наблюдения диетолога и/или нутрициолога пациентам с установленной мальнутрицией [62]. У пациентов с недостаточным ответом оценивать эффективность ЗФТ помогают исследования функциональной активности ПЖ [39]. Дыхательный тест с 13C-смешанными триглицеридами – метод, который способен заменить трудновыполнимые на практике и энергозатратные тесты на экскрецию фекального жира и может использоваться для пациентов, получающих ЗФТ [63].
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] и Российском консенсусе по диагностике и лечению хронического панкреатита [15] приведены критерии эффективности ЗФТ, которые включают в себя уменьшение диспепсического синдрома, прекращение диареи, стабилизацию массы тела, улучшение показателей окислительного стресса и антиоксидантного статуса.
Что делать в случае неудовлетворительного клинического ответа?
В случае неудовлетворительного клинического ответа следует увеличить дозу ЗФТ или добавить ингибитор протонной помпы (ИПП). Если и это не дало результатов, следует исключить другие причины мальабсорбции, такие как синдром избыточного бактериального роста в тонкой кишке (СИБР) (степень рекомендации B – сильный консенсус, уровень достигнутого соглашения – 97%).
Назначение рекомендуемой дозы 20000–50000 PhU липазы с основными приемами пищи продемонстрировало эффективность в отношении симптомов более чем у половины пациентов [39]. При отсутствии достаточного ответа у пациента доза ЗФТ может быть увеличена.
У пациентов с недостаточным ответом на ЗФТ уменьшение секреции желудочного сока с помощью ИПП может привести к значительному улучшению и даже нормализации переваривания жира. Такие результаты были показаны в проспективном когортном исследовании с участием 21 пациента с ХП: 43% имели первичный недостаточный ответ на ЗФТ, а у 29% ответ был достигнут после добавления ИПП [64]. Однако в обзоре, включившем 34 исследования, роста эффективности ЗФТ при добавлении ИПП или антагонистов рецепторов гистамина второго типа отмечено не было [65]. При этом отмечена крайняя неоднородность включенных в исследования выборок и схем лечения, что предполагает значительную систематическую ошибку.
Сохранение симптомов также может объяснить СИБР [66]. Недавно опубликованное проспективное исследование «случай – контроль» показало, что СИБР присутствовал у 15% пациентов с ХП, в то время как ни у одного здорового в группе контроля водородный дыхательный тест с глюкозой не выявил положительный результат [67].
Российский консенсус по диагностике и лечению хронического панкреатита [15] рекомендует при неэффективности ЗФТ искать другие причины сохраняющихся симптомов, такие как избыточная желудочная секреция, неадекватное перемешивание ферментов и нутриентов, замедленное растворение оболочек микросфер в тонкой кишке, низкий рН в ДПК и тощей кишке, несоблюдение пациентами схемы назначенного лечения, СИБР, инвазия простейших, целиакия.
Влияет ли техника хирургического лечения ХП на ВНПЖ и статус питания?
Все хирургические вмешательства одинаково влияют на применение ЗФТ и нутритивный статус в отдаленном периоде наблюдения. Ткане- и органосохраняющие операции более предпочтительны (степень рекомендации A – сильный консенсус, уровень достигнутого соглашения – 100%).
Хирургическое вмешательство эффективно у тщательно отобранных пациентов. Общие показания к хирургическому вмешательству при ХП включают в себя некупируемый болевой синдром, нарушение проходимости двенадцатиперстной кишки, желчных и главного панкреатического протоков и подозрение на злокачественные образования данных локализаций [68].
Хирургические вмешательства по поводу ХП можно в общих чертах разделить на три категории: дренирующие вмешательства, частичная резекция ПЖ с резекцией двенадцатиперстной кишки или без нее и тотальная панкреатэктомия. M. Kemper и соавт. [69] опубликовали подробный обзор всех существующих методик. При дренирующих вмешательствах выполняется вскрытие расширенного протока ПЖ и наложение анастомоза с проксимальным отделом тощей кишки. К наиболее распространенным дренирующим вмешательствам относятся модифицированная операция Пьюстау, также известная как продольная панкреатикоеюностомия, и операция Фрея, которая помимо панкреатикоеюностомии включает в себя частичную резекцию головки ПЖ. У пациентов с персистирующим воспалением головки ПЖ без дилатации протока за местом сужения может быть рекомендовано резецирующее вмешательство, такое как классическая панкреатодуоденальная резекция или дуоденум-сохраняющая резекция головки ПЖ (операция Бегера).
Теоретически непосредственные и отдаленные нарушения статуса питания могут быть обусловлены типом операции, поскольку расширенная резекция паренхимы, сохранение естественного транзита по двенадцатиперстной кишке и желчным путям и секреция ПЖ представляют собой ключевые факторы, влияющие на эндокринную и экзокринную функции [70].
В опубликованных метаанализах продемонстрирована более высокая эффективность операции Бегера в отношении послеоперационного болевого синдрома и качества жизни по сравнению с панкреатодуоденальной резекцией [71]. Однако группы пациентов, включенных в исследования, были крайне неоднородны, а в крупном проспективном РКИ не было показано статистически значимого различия между операциями в отношении влияния на нутритивный статус, качество жизни и сохранение ВНПЖ в отдаленном периоде наблюдения [74]. В метаанализе 23 исследований, опубликованном в 2015 г., сравнивали результаты операции Фрея с панкреатодуоденальной резекцией и операцией Бегера [73]. Показатели качества жизни и функции ПЖ в послеоперационном периоде у пациентов после операции Фрея были выше, чем после панкреатодуоденальной резекции. Данные долгосрочного наблюдения (более 10 лет) из РКИ, сравнивающего операции Фрея и Бегера в лечении ХП, не выявили статистически значимого различия в частоте эндо- или экзокринной недостаточности [74].
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] и Российском консенсусе по диагностике и лечению ХП [14, 15] данная проблема не рассматривалась. Российский консенсус по экзо- и эндокринной недостаточности поджелудочной железы после хирургического лечения постулировал, что нутритивный статус пациентов, перенесших хирургические вмешательства на ПЖ, зависит от первичного состояния пациента, выраженности исходной атрофии паренхимы ПЖ и ее внешнесекреторной недостаточности, объема удаляемой части железы, а также наличия или отсутствия прогрессирования основного заболевания после операции. ВНПЖ после резекции при ХП более выражена и развивается в 90–94% случаев, что позволяет назначать ЗФТ без диагностического тестирования [73].
Каков риск развития остеопороза или остеопении у пациентов с ХП?
Риску развития остеопороза подвержен почти каждый четвертый больной ХП, риск развития остеопатии (остеопороза или остеопении) высокий, и ему подвержены примерно два из трех пациентов с ХП (сильный консенсус, уровень достигнутого соглашения – 97%).
Остеопороз характеризуется структурным разрушением костной ткани и низкой костной массой, что приводит к хрупкости кости и повышенному риску перелома [75]. Остеопороз и остеопения устанавливаются, согласно определению Всемирной организации здравоохранения, по Т-критерию. Т-критерий представляет собой разницу значения между плотностью кости у пациента и у молодых людей (пиковая костная масса) [76]. Остеопения устанавливается на основании снижения Т-критерия от 1,0 до 2,5 стандартных отклонений; остеопороз – снижение Т-критерия ниже 2,5 стандартных отклонений. Остеопороз и остеопению можно также диагностировать по Z-критерию (остеопения – Z-критерий < 1, остеопороз – Z-критерий < 2). Z-критерий представляет собой стандартное отклонение выше или ниже среднего показателя минеральной плотности кости у здоровых мужчин и женщин аналогичного возраста и используется для оценки вторичного остеопороза. Обычно он применяется в диагностике остеопатии у женщин пременопаузального возраста, мужчин в возрасте до 50 лет и детей [77]. В систематический обзор и метаанализ было включено десять исследований, из которых диагноз ставился по Т-критерию в восьми и по Z-критерию в двух исследованиях. На основе модели случайных эффектов было обнаружено, что для всех 513 пациентов с ХП общий уровень распространенности остеопороза составляет 24,3% (95% ДИ 16,6–32,0%), а остеопатии (остеопороза или остеопении) – 65% (95% ДИ 54,7–74,0%) [78]. В двух исследованиях частота остеопороза в контрольной группе составила соответственно 8,6 и 10,2%. Во всех включенных исследованиях отмечены относительно небольшие размеры выборок (< 100 пациентов) и значительная неоднородность, поэтому анализы подгрупп не проводили.
Были выявлены определенные закономерности во включенных в анализ исследованиях, например, связь между ВНПЖ и более низкой минеральной плотностью костей. Имеющиеся данные, однако, не смогли доказать прямую связь между концентрацией витамина D в сыворотке крови и низкой минеральной плотностью костей, что свидетельствует о том, что дефицит витамина D является не единственным фактором деминерализации костей. Другими факторами, которые могут вносить свой вклад в процесс преждевременной деминерализации костей при ХП, являются интенсивное курение, низкая физическая активность и хроническое воспаление [79].
Важной клинической конечной точкой остеопороза является костный перелом. В двух крупных ретроспективных исследованиях изучали данное явление среди пациентов с ХП. Первым исследованием был ретроспективный анализ базы данных пациентов с ХП, проходивших лечение в больнице третьего уровня оказания медицинской помощи. В исследование были включены 3192 пациента с ХП и 1 436 699 человек из контрольной группы. Распространенность переломов (доля пациентов с переломами от общего числа пациентов) составила 1,1% в контрольной группе (16 208/1 436 699) и 4,8% у пациентов с ХП (154/3192); для сравнения: риск болезни Крона составил 3,0% (182/6057), цирроза печени – 4,8% (805/16658), целиакии – 5,0% (74/1480) [80]. Во второе ретроспективное когортное исследование из Дании было включено 2594 пациента с ХП. Скорректированный коэффициент риска для любого перелома в этой группе оказался на уровне 1,7 (95% ДИ 1,6–1,8) [81]. У пациентов с ХП, получавших ЗФТ по поводу мальабсорбции жира, риск переломов оказался ниже, чем у других пациентов с ХП (ОР 0,8; 95% ДИ 0,7–0,9). Метаанализ шести исследований, включавший 2 025 918 респондентов (18 844 с ХП, 2 007 074 – контроль), показал обобщенную частоту переломов у пациентов с ХП 14,09% (95% ДИ 5,877–25,098). При исключении из анализа двух исследований с широким ДИ (менее 150 пациентов с ХП в каждом) обобщенная частота переломов составила 9,25% (95% ДИ 1,930–21,221; I2 = 99,74%). В целом ХП значительно повышал риск переломов (ОШ 2,819; 95% ДИ 1,855–4,282; I2 = 97,14%). Интересно, что у пациентов с ХП, получавших ЗФТ по поводу мальабсорбции жира, риск переломов оказался ниже, чем у других пациентов с ХП (ОР 0,8; 95% ДИ 0,7–0,9) [82].
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] и Российском консенсусе по диагностике и лечению ХП [14, 15] данную проблему не рассматривали.
Какие методы следует использовать для выявления пациентов из группы риска?
Для диагностики остеопатии у пациентов с ХП должна использоваться двухэнергетическая рентгеновская абсорбциометрия (DXA) (степень рекомендации A – сильный консенсус, уровень достигнутого соглашения – 100%).
Американский колледж радиологии ставит своей целью определить диагностическую ценность нескольких радиологических методов для разных групп пациентов. Хотя прямо ХП не упоминается, специалисты колледжа утверждают, что у женщин в пременопаузе и мужчин в возрасте 20–50 лет с мальабсорбцией DXA поясничного отдела позвоночника и бедра (бедер) или дистального отдела предплечья является диагностическим методом для выявления низкой минеральной плотности кости [83]. Не достаточно точно определено, когда и кому из пациентов с ХП следует предлагать эти исследования. Тем не менее рекомендации Американской гастроэнтерологической ассоциации по выявлению остеопороза при других желудочно-кишечных заболеваниях гласят: первичный скрининг с помощью DXA должен проводиться у пациентов с хотя бы одним дополнительным фактором риска остеопороза [84]. Эта рекомендация предназначалась специально для пациентов с воспалительными заболеваниями кишечника, целиакией и пациентов после резекции желудка. В панъевропейском консенсусе по диагностике и лечению ХП (HaPanEU) отмечено, что исследование плотности костной ткани с помощью DXA должно проводиться пациентам с ХП и дополнительным фактором риска: женщины в постменопаузе, пациенты с ранее перенесенными низко- или атравматичными переломами, мужчины старше 50 лет и пациенты с мальабсорбцией [2]. С учетом сопутствующих заболеваний и затрат на лечение переломов костей, возможно, стоит рассмотреть оценку базовой плотности костной ткани для всех пациентов с ХП [85].
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] и Российском консенсусе по диагностике и лечению ХП [14, 15] данную проблему не рассматривали.
Каковы рекомендации по профилактике и лечению заболеваний, связанных со снижением плотности костной ткани?
Всем пациентам с ХП следует рекомендовать основные меры профилактики, в том числе адекватное потребление кальция/витамина D и при показаниях добавление ЗФТ, регулярные физические нагрузки и отказ от курения и употребления алкоголя. Дополнительное медикаментозное лечение следует назначать пациентам с остеопатией и, в частности, с остеопорозом (степень рекомендации GPP – сильный консенсус, уровень достигнутого соглашения – 97%).
Причин развития остеопатии при ХП несколько: низкие концентрации витамина D в сыворотке из-за нарушения всасывания жирорастворимого витамина D, плохое питание (в том числе низкое потребление кальция) и/или недостаточное воздействие солнечных лучей, курение и употребление алкоголя, низкая физическая активность и хроническое воспаление. Следовательно, всем пациентам с ХП следует рекомендовать основные меры профилактики, которые включают в себя адекватное потребление кальция/витамина D и ЗФТ, если диагностирована ВНПЖ, регулярные физические нагрузки и отказ от курения и алкоголя [2]. Исследования пероральных препаратов витамина D и кальция у пациентов с остеопенией и применения бисфосфонатов при остеопорозе в основном проводили среди женщин в постменопаузе и пожилых пациентов. На основе этих результатов и с учетом невысокого уровня затрат и низкого уровня побочных эффектов у пациентов с остеопатией возможен ежедневный прием препаратов витамина D (800 МЕ) и кальция (500–1000 мг) [44]. Пациентам с остеопенией рекомендуется повторять DXA каждые два года, при этом для пациентов с остеопорозом нет конкретных рекомендаций, кроме приема назначенных препаратов, скрининга на другие причины заболевания и/или направления к узкому специалисту [2].
В национальном российском руководстве «Парентеральное и энтеральное питание» (2014) [23] и Российском консенсусе по диагностике и лечению ХП [3] данную проблему не рассматривали.
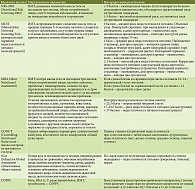
В таблице показано применение различных шкал для оценки рисков возникновения нутриционных расстройств и состояния нутриционного статуса. В настоящее время продолжают оставаться актуальными шкалы NRS-2002, MUST, MNA, COPPS, CONUT [86].
Рассмотренные прогностические и скрининговые шкалы применяли у больных ХП. К недостаткам этих шкал относится практически повсеместное использование ИМТ, однако этот параметр у людей с ожирением или хорошо развитой мышечной массой объективно не отразит риски нутриционной недостаточности. На наш взгляд, в качестве идеального маркера в шкале должен указываться не ИМТ, а индекс мышечной массы, но данный показатель требует инструментального обследования и иной трактовки. Ориентировочное определение степени выраженности мышечной массы, жировой массы не несет достоверной информации. Динамика потери массы тела и наличие/отсутствие аппетита – простые симптомы, но они сразу ориентируют на риски развития нутриционной недостаточности. Шкала MNA достаточно сложна для воспроизведения, так как надо оценить 18 различных пунктов, информацию по которым частично представляют пациенты, что может внести субъективность и некорректность трактовки. Шкалы, включающие лабораторные параметры (CONUT, COPPS), с одной стороны, наиболее объективны, а с другой – требуют определенных материальных затрат. Изучаемые концентрационные показатели у пациентов с признаками нарушений гидробаланса не покажут истинных значений, что также приведет к неверной интерпретации. Все эти данные указывают на необходимость продолжить изучение шкал и их валидизацию на большем числе пациентов с ХП.
В данном обзоре представлено сопоставление подходов недавно опубликованных рекомендаций Европейской ассоциации клинического питания и метаболизма (ESPEN) по нутриционной поддержке больных ХП с положениями национального российского руководства «Парентеральное и энтеральное питание» и Российского консенсуса по диагностике и лечению хронического панкреатита. Во многом они совпадают, но ряд нюансов нуждается в дополнительном рассмотрении и пересмотре. Подобный вывод мы сделали ранее, при анализе раздела данного документа, посвященного острому панкреатиту [87].
T.N. Kuzmina, PhD, K.A. Nikolskaya, PhD, M.A. Kiryukova, M.V. Malykh, M.V. Chebotareva, Yu.A. Kucheryavyi, PhD, D.S. Bordin, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Scientific Research Institute of Healthcare and Medical Management of the Moscow City Health Department
Ilyinsky Hospital
Tver State Medical University
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Tatiana N. Kuzmina, t.kuzmina@mknc.ru
Nutritional support is one of the additional treatment methods for the exocrine pancreatic insufficiency consequences in chronic pancreatitis. Nutritional insufficiency risk assessment in these patients, timely diagnosis, and its correction are based on the use of the most optimal methods and treatment schemes.
The article presents an overview and analysis of the European Association for Clinical Nutrition and Metabolism (ESPEN) recently published guidelines on nutritional support in chronic pancreatitis.