Генетические аспекты артериальной гипертензии у больных сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Oбследовано 82 больных СД 2 типа с АГ второй и третьей степени. Оценены углеводный и липидный обмен, уровень эндотелина 1 (Э-1), альбуминурия (АУ) в утренней порции мочи. Идентификацию полиморфных маркеров T-786C гена eNOS3 и Lys198Asn генa EDN1 осуществляли с помощью полимеразной цепной реакции. Суточное мониторирование артериального давления проводилось с использованием аппарата «Валента». Эндотелийзависимую вазодилатацию (ЭЗВД) оценивали по методу D. Celermajer.
Результаты. При оценке лабораторных показателей у больных СД 2 типа и АГ выявлено превышение целевых значений углеводного и липидного обмена, уровня Э-1. При анализе распределения частот аллелей и генотипов гена eNOS3 в исследуемой группе и группе контроля соотношение патологических генотипов СС составило 39,0 и 0,0% (р < 0,05), гетерозигот ТС – 61,0 и 100,0% (р < 0,05). Аллель Т выявлен в 61,1 и 100,0% случаев соответственно (р < 0,05). ЭЗВД Δd у пациентов с генотипом СС составила 14,6 ± 0,9%, с генотипом ТС – 19,5 ± 1,1% (р = 0,009). Различий в распределении частот генотипов и аллелей Lys198Asn генa EDN1 у больных СД 2 типа с АГ и здоровых лиц не обнаружено. Однако у носителей генотипа AsnAsn отмечено достоверное повышение Э-1, корреляция Э-1 с показателем АУ и выраженное нарушение суточного ритма артериального давления.
Вывод. Носительство генотипа СС полиморфизма Т-786C гена eNOS3 ассоциировано с развитием артериальной гипертензии у больных сахарным диабетом 2 типа.
Материал и методы. Oбследовано 82 больных СД 2 типа с АГ второй и третьей степени. Оценены углеводный и липидный обмен, уровень эндотелина 1 (Э-1), альбуминурия (АУ) в утренней порции мочи. Идентификацию полиморфных маркеров T-786C гена eNOS3 и Lys198Asn генa EDN1 осуществляли с помощью полимеразной цепной реакции. Суточное мониторирование артериального давления проводилось с использованием аппарата «Валента». Эндотелийзависимую вазодилатацию (ЭЗВД) оценивали по методу D. Celermajer.
Результаты. При оценке лабораторных показателей у больных СД 2 типа и АГ выявлено превышение целевых значений углеводного и липидного обмена, уровня Э-1. При анализе распределения частот аллелей и генотипов гена eNOS3 в исследуемой группе и группе контроля соотношение патологических генотипов СС составило 39,0 и 0,0% (р < 0,05), гетерозигот ТС – 61,0 и 100,0% (р < 0,05). Аллель Т выявлен в 61,1 и 100,0% случаев соответственно (р < 0,05). ЭЗВД Δd у пациентов с генотипом СС составила 14,6 ± 0,9%, с генотипом ТС – 19,5 ± 1,1% (р = 0,009). Различий в распределении частот генотипов и аллелей Lys198Asn генa EDN1 у больных СД 2 типа с АГ и здоровых лиц не обнаружено. Однако у носителей генотипа AsnAsn отмечено достоверное повышение Э-1, корреляция Э-1 с показателем АУ и выраженное нарушение суточного ритма артериального давления.
Вывод. Носительство генотипа СС полиморфизма Т-786C гена eNOS3 ассоциировано с развитием артериальной гипертензии у больных сахарным диабетом 2 типа.
Одним из ведущих факторов риска развития и прогрессирования микро- и макрососудистых осложнений сахарного диабета (СД) признана артериальная гипертензия (АГ). Частота ее встречаемости при СД в два раза превышает общепопуляционные значения, составляя 10–30% при СД 1 типа и 60–80% при СД 2 типа, при наличии ожирения – до 93% и до 40% у лиц с нарушенной толерантностью к глюкозе [1]. При сочетании СД и АГ риск развития ишемической болезни сердца (ИБС), инфаркта миокарда (ИМ) и инсульта увеличивается в два – четыре раза, уремии и гангрены нижних конечностей – в 20 раз [2].
Артериальная гипертензия – многофакторное, полигенное заболевание. В настоящее время известно, что АГ на 30–50% обусловлена генетическими факторами. При этом большую роль играет аллельный полиморфизм генов, кодирующих факторы и функцию эндотелия.
В настоящее время исследователи все больше внимания уделяют роли эндотелиальных клеток в развитии органной патологии, в том числе АГ, а также в формировании диабетических микро- и макроангиопатий.
Многие авторы рассматривают дисфункцию эндотелия в качестве одного из основных механизмов развития АГ и ее осложнений. С одной стороны, эндотелиальные клетки представляют мишень для гемодинамических факторов циркулирующей крови, с другой – сама АГ является фактором патологического воздействия на эндотелий сосудов: высокое гидравлическое давление механически повреждает клетки эндотелия и нарушает его синтетическую и сосудодвигательную функции [3].
Среди факторов, продуцируемых эндотелием и участвующих в регуляции артериального давления (АД), одним из важнейших считается оксид азота (NO). В физиологических условиях NO обладает вазодилатирующим эффектом. Кроме того, он способен модулировать высвобождение других вазоактивных медиаторов, ингибировать пролиферацию гладкомышечных клеток, адгезию лейко-цитов, агрегацию тромбоцитов и макрофагов, продукцию эндотелина, подавлять экспрессию провоспалительных генов [4].
Образование NO в организме происходит из L-аргинина под воздействием синтазы оксида азота (NO-синтазы). Из трех известных форм данного фермента при изучении АГ и дисфункции эндотелия интерес представляет эндотелиальная NO-синтаза (eNOS3). Ген eNOS3 состоит из 26 экзонов, расположен на длинном плече 7-й хромосомы (7q36.1) [5]. В настоящее время наиболее изучены три варианта полиморфизма гена: G894T, 4b/a и T-786C.
Полиморфный участок T-786C расположен в промоторной области гена в положении 786 от участка инициации транскрипции и представляет собой однонуклеотидный полиморфизм ТС. Установлено, что наличие аллеля С в положении 786 приводит к снижению промоторной активности гена и уровня eNOS3, что обусловливает недостаточность синтеза и высвобождения NO [6]. Установлено, что полиморфизм С-786Т ассоциируется с коронарным вазоспазмом и ИМ в японской и украинской популяциях, сердечной недостаточностью у афроамериканцев и риском развития АГ у европейцев [7]. Наличие аллеля С и генотипа СС рассматривается как независимый фактор риска развития ИБС, ИМ в европейской [8, 9] и других популяциях [10, 11].
В развитии АГ и сосудистых осложнений СД имеет значение не толь-ко снижение вазодилатации, но и активация вазоконстрикции. Одним из самых мощных вазоконстрикторных факторов, продуцируемых эндотелием, признан пептид семейства эндотелинов эндотелин 1 (Э-1). Он комплексируется с эндотелиновым рецептором А на поверхности гладкомышечных клеток сосудов, что при активации G-белков и фосфолипазы С приводит к повышению в них концентрации кальция и развитию вазоконстрикции. Опи-саны также провоспалительные, митогенные, проатеросклеротические эффекты Э-1. Повышенный уровень Э-1 обнаружен у больных АГ, ИБС, ИМ, СД [12, 13]. В работах отечественных исследователей отмечена корреляция уровня Э-1 с тяжестью АГ и диабетической нефропатии [14].
Анализ литературы свидетель-ствует, что однонуклеотидный полиморфизм гена Э-1 (EDN1), локализованного на хромосоме 6р24-23, заключающийся в замене лизина (Lys) на аспарагин (Asn) в положении 198, приводит к повышению плазменного уровня Э-1. Наиболее высокая концентрация Э-1 характерна для носителей аллеля Asn, достоверно более низкая – для лиц с генотипом LysLys [7]. Доказана также ассоциация полиморфизма гена EDN1 с развитием АГ, хронической болезни почек [15] и диабетической ретинопатии [16] у больных СД, а также хронической сердечной недостаточности [17–19] и венозной недостаточности нижних конечностей [20].
В то же время необходимо отметить, что данные о влиянии генетических факторов на развитие АГ разных исследователей противоречивы. Это объясняется, с одной стороны, полигенностью и многофакторностью патогенетических механизмов АГ, с другой стороны, популяционными различиями. Степень ассоциации одинаковых генетических маркеров в разных популяциях может значительно различаться, следовательно, необходимы дальнейшие исследования в этой области.
Цель настоящего исследования – выявить распределение частот аллелей и генотипов и ассоциацию полиморфных маркеров Т-786C гена eNOS3 и Lys198Asn гена EDN1 у больных сахарным диабетом 2 типа с артериальной гипертензией.
Материал и методы
Обследовано 82 больных СД 2 типа с АГ второй и третьей степени. Средний возраст – 58,9 ± 1,6 года, длительность СД – 11,8 ± 1,2 года, индекс массы тела – 31,4 ± 0,9 кг/м2. Все пациенты получали диетотерапию, сахароснижающие и антигипертензивные препараты.
При генотипировании группу контроля составили 12 человек без нарушений углеводного обмена и АГ. Группы исследования и контроля были сопоставимы по возрасту.
Перед проведением обследования все больные подписали информированное согласие. Протокол исследования одобрен локальным этическим комитетом ФГБОУ ВО «РязГМУ» Минздрава России.
Проведено общеклиническое и антропометрическое обследование, а также исследование углеводного и липидного обмена. Концентрацию Э-1 в плазме крови определяли методом иммуноферментного анализа (Biomedica Gruppe, Австрия). Идентификацию полиморфных маркеров T-786C гена eNOS3 и Lys198Asn генa EDN1 проводили методом полимеразной цепной реакции. Геномную ДНК выделяли из цельной крови пациентов с применением стандартных наборов праймеров (НПФ «Литех», Россия). Визуализация продуктов амплификации выполнялась с помощью электрофореза в 3%-ном агарозном геле с добавлением бромистого этидия в ультрафиолетовом свете.
Исследование альбуминурии (АУ) в разовой (утренней) порции мочи проводили на аппарате NycoCard (Норвегия). Скорость клубочковой фильтрации (СКФ) рассчитывали по уровню креатинина по формуле CKD-EPI (CKD-EPI-creat).
Суточное мониторирование артериального давления (СМАД) проводилось по стандартной методике с помощью аппарата «Валента» (Россия). Эндотелийза-висимую вазодилатацию (ЭЗВД) оценивали с помощью манжеточной пробы при дуплексном сканировании плечевой артерии по методике D. Celermajer и соавт. (1992) на ультразвуковом сканере LOGIQbookXP (Китай).
Для статистической обработки данных использовали программу STATISTICA 6.0. Нормальность распределения проверяли по критерию Колмогорова – Смирнова. Результаты представлены в виде М ± m. Коэффициент корреляции r рассчитывали методом Спирмена. Относительный риск заболевания у носителей определенного аллеля и генотипа определяли как показатель отношения шансов (Odds Ratio – OR), значение которого рассчитывали с помощью онлайн-калькулятора программы «Медицинская статистика» (http://medstatistic.ru/calculators.html). Различия считали статистически значимыми при р < 0,05.
Результаты и их обсуждение
Показатели углеводного обмена у больных СД 2 типа и АГ: уровень глюкозы крови натощак – 7,8 ± 0,4 ммоль/л, постпрандиальная гликемия – 9,7 ± 0,3 ммоль/л, гликированный гемоглобин – 8,1 ± 0,3%. В липидном спектре выявлено превышение целевых значений общего холестерина – 5,9 ± 0,3 ммоль/л, холестерина липопротеинов низкой плотности – 3,4 ± 0,2 ммоль/л, триглицеридов – 2,9 ± 0,2 ммоль/л. Уровень Э-1 – 1,76 ± 0,09 фмоль/мл (референсные значения менее 0,26 фмоль/мл), СКФ (по формуле CKD-EPI-creat, 2009) – 71,8 ± 3,4 мл/мин, АУ – 18,6 мг/л. У 19,5% больных последний показатель был более 20 мг/л.
Диабетическая ретинопатия первой и второй стадии диагностирована у 21,9% пациентов, диабетическая нефропатия в стадии микроальбуминурии – у 19,5%, макроангиопатии (ИБС, цереброваскулярная болезнь, атеросклероз артерий нижних конечностей) – у 30,5% больных.
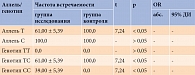
Согласно данным литературы, в европейской популяции частота встречаемости генотипов ТТ, ТС и СС в положении 786 гена eNOS3 варьируется – от 30 до 40%, от 41 до 52% и от 14 до 18% соответственно [10]. Согласно результатам нашего исследования, соотношение патологического генотипа СС в группах исследования и контроля составило 39,0 и 0% (р < 0,05), гетерозигот ТС – 61,0 и 100,0% соответственно (р < 0,05). Аллель Т выявлен у 61,1 и 100,0% (р < 0,05), аллель С – у 100,0 и 100,0% (р > 0,05) (табл. 1). Полученные данные позволяют сделать вывод об участии генотипа СС полиморфизма Т-786C гена eNOS3 в развитии АГ у пациентов с СД 2 типа.
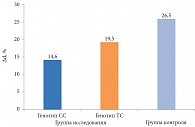
При оценке ЭЗВД с проведением манжеточной пробы с реактивной гиперемией в группе исследования прирост диаметра плечевой артерии (Δd) у пациентов с генотипом СС составил 14,6 ± 0,9%, с генотипом ТС – 19,5 ± 1,1% (р = 0,009), что достоверно отличалось от группы контроля (р1 = 0,002 и р2 = 0,0234) (рисунок). Значения Δd коррелировали с уровнем АУ (r = -0,56, р = 0,0326).
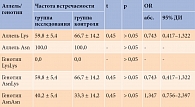
При анализе распределения частоты генотипов и аллелей гена EDN1 у пациентов с СД 2 типа и АГ носительство мутантного аллеля Asn в гомозиготном состоянии (AsnAsn) составило 40,2%, в гетерозиготном (AsnLys) – 59,8%, генотип LysLys – 0%, аллель Lys – 59,8%, что достоверно не отличалось от группы контроля (табл. 2). Однако уровень Э-1 был в два раза выше у носителей аллеля Asn в гомозиготном состоянии, чем у носителей аллеля Asn в гетерозиготном состоянии – 2,03 ± 0,16 против 1,36 ± 0,07 фмоль/мл(p = 0,00025).
В ряде опубликованных исследований у больных СД 1 и 2 типов отмечена положительная корреляционная зависимость между уровнем Э-1, альбуминурией и протеинурией, отрицательная – между уровнем Э-1 и СКФ [21, 22].
В нашем исследовании показа-тель Э-1 достоверно коррелировал с уровнем АУ (r = 0,49, p = 0,0477). Корреляция с СКФ не зафиксирована.
При анализе результатов СМАД у пациентов с СД 2 типа и АГ индекс времени диастолического АД (ДАД) значительно превышал норму. Так, ДАДдень – 73,9 ± 7,3%, ДАДночь – 87,3 ± 7,1%, ДАДсут – 75,1 ± 7,0%. Отмечено также нарушение циркадного ритма АД в виде недостаточного снижения ДАД в ночные часы (профиль non-dipper – у 52,4%, night-picker – у 25,6%).
У пациентов с генотипом СС полиморфизма Т-786C гена eNOS3 наблюдалось достоверное преобладание профиля non-dipper по сравнению с носителями генотипа ТС – 62,5 ± 8,5 и 38,0 ± 6,8% соответственно (р = 0,0271), а также тенденция к повышению вариабельности систолического и диастолического АД в дневное и ночное время. Индекс времени ДАДсут (гипер) был достоверно выше у носителей генотипа AsnAsn полиморфизма Т-786C гена EDN1, чем у носителей генотипа AsnLys, – 89,8 ± 7,2 и 64,3 ± 6,1% (р = 0,0084).
Заключение
Результаты настоящего исследования подтвердили связь риска развития и прогрессирования АГ с генами, кодирующими факторы эндотелия. Носительство генотипа СС полиморфизма Т-786C гена eNOS3 ассоциировано с развитием артериальной гипертензии у больных сахарным диабетом 2 типа. У носителей генотипа AsnAsn полиморфизма Lys198Asn EDN1 отмечены достоверно более высокий плазменный уровень вазоконстриктора эндотелина 1, положительно коррелирующий с показателями альбуминурии, и выраженное нарушение суточного ритма артериального давления с преобладанием профиля non-dipper.
Авторы заявляют об отсутствии конфликта интересов.
I.I. Dubinina, MD, PhD, Prof., S.V. Berstneva, PhD
I.P. Pavlov Ryazan State Medical University
Contact person: Inessa I. Dubinina, inessadubinina@mail.ru
The Purpose. To study the frequency distribution of alleles and genotypes and to identify the association of polymorphic markers T-786C eNOS3 gene and Lys198Asp EDN1 gene with hypertension in patients with diabetes mellitus (DM) type 2.
Material and methods. 82 patients with DM type 2 and hypertension 2–3 stage were examined. The study of carbohydrate, lipid metabolism, endothelin 1 (E-1) level, morning albuminuria (AU) test were done. Identification of polymorphic markers T-786C eNOS3 gene and Lys198Asp EDN1 gene was done by PCR-based assays. Blood pressure monitoring was performed using the apparatus ‘Valenta’. Endothelium-dependent vasodilation (EDD) was assessed by D. Celermajer.
Results. The evaluation of laboratory parameters in patients with DM type 2 and hypertension revealed the excess of the target values of carbohydrate, lipid metabolism, increased E-1. When analyzing the frequency distribution of alleles and genotypes of the eNOS3 gene, the ratio of pathological CC genotypes in the group of patients with DM and control was: 39.0% and 0% (p < 0.05); heterozygote TС: 61.0% and 100.0% (p < 0.05); allele T was identified in 61.1% and 100.0%, respectively (p < 0.05). In the evaluation of EDD, Δd in patients with CC genotype was 14.6 ± 0.9%, with TC genotype 19.5 ± 1.1% (p = 0009). There were no differences in the frequency distribution of genotypes and alleles of the Lys198Asn EDN1 gene in patients with DM type 2 and hypertension and control group. At the same time, carriers of the AsnAsn genotype showed a significant increase of E-1 level, correlation of E-1 with AU and daily rhythm of blood pressure violations.
Conclusion. Presence of the CC genotype of the T-786C polymorphism eNOS3 gene is associated with the development of hypertension in patients with diabetes mellitus type 2.

