Имунофан в комплексном лечении детей c повторными респираторными заболеваниями и микоплазменной инфекцией
- Аннотация
- Статья
- Ссылки
- English

Введение
M. Еaton в 1944 г. выделил инфекционный возбудитель, вызывающий пневмонию у хлопковых крыс. В 1962 г. R. Chanock и соавт. доказали, что данный агент не относится к бактериям и вирусам, а представляет семейство Mycoplasmataceae. С 1963 г. возбудитель стал называться Mycoplasma pneumoniae. Микоплазма широко распространена в природе, включая растения, организм животных и человека. M. pneumoniae относится к роду Mycoplasma семейства Mycoplasmataceae класса Mollicutes. M. pneumoniae вызывает атипичные инфекции респираторного тракта. Сложность лечения данной инфекции связана с наличием у возбудителя приспособительных механизмов, отсутствием ригидной стенки, вызывающим полиморфизм клеток и недостаточную чувствительность при лечении, что способствует хронизации процесса. У детей и подростков возбудитель может вызывать воспалительные заболевания верхних дыхательных путей (фарингиты, синуситы) и нижних дыхательных путей (пневмония). Инфекция передается воздушно-капельным путем, случаи обострения чаще наблюдаются в осенне-зимний период в организованных коллективах (детские сады, школы, студенческие лагеря, дислокация военных). При микоплазменной пневмонии развиваются кашель с вязкой мокротой, симптомы обструкции, приходится проводить дифференциальный диагноз с бронхиальной астмой, особенно при тяжелом течении пневмонии. Подтвердить диагноз рентгенологически не всегда возможно, пневмония может быть очаговой, сегментарной или с поражением интерстиция. Для установления диагноза проводят ПЦР-диагностику. При поражении нижних дыхательных путей для диагностики используют мокроту, бронхоальвеолярную жидкость, полученную при бронхоскопии. Если получить такой биологический материал невозможно, используют мазки и соскобы со слизистой задней стенки глотки. При отрицательном результате ПЦР-диагностики и наличии клинических симптомов рекомендовано определение специфических IgM- и IgG-антител (АТ) к M. pneumoniae, при этом IgM-АТ указывают на инфекцию или ее обострение [1].
Многие исследователи используют термин «респираторный микоплазмоз», чаще он наблюдается у детей старше 5 лет, подростков и взрослых до 40 лет. При острых респираторных заболеваниях диагностика инфекции встречается в 10–16%, а при нарастании заболеваемости – в 25–50% случаев [2]. Возможно развитие моноинфекции M. pneumoniae либо микст-инфекций, вирусно-бактериальных ассоциаций с вирусами гриппа, парагриппа, аденовирусом, респираторно-синцитиальным вирусом и бактериями (Streptococcus pneumoniae, Haemophilus influenzae, Chlamydia рneumoniaе, Moraxella catarrhalis) [3, 4]. Отсутствие у M. pneumoniae способности синтезировать липиды приводит к отсутствию защитной клеточной стенки, сохранению по типу паразита, в клетках – к устойчивости возбудителя к антибиотикам, включая β-лактамные. Формируются персистирующая инфекция и хронические заболевания респираторного тракта [5]. Чувствительность к инфекции может быть генетически детерминирована. У пациентов с иммунодефицитными состояниями персистирующая инфекция формируется чаще (онкология, ВИЧ-инфекция, синдром Дауна) [6]. Клинически инфекция верхних дыхательных путей проявляется в развитии симптомов риносинусита, назофарингита, ларингита, тонзиллита, трахеита [2, 6]. При развитии сухого «лающего» кашля необходимо проводить дифференциальный диагноз с бронхообструктивным синдромом, в ряде случаев – с бронхиальной астмой [13]. Тяжелое течение микоплазменной инфекции может сопровождаться формированием бронхита, пневмонии, бронхоэктатической болезни, фиброза легких. При наличии у пациента иммунодефицитных состояний возможно развитие аутоиммунных и других заболеваний: миокардита, менингоэнцефалита, артрита, нефрита, гепатита, иммунных цитопений, бронхиальной астмы, синдрома Стивенса – Джонсона [6, 7]. Основными препаратами в лечении микоплазменной инфекции являются антибиотики, макролиды. При отсутствии тяжелого течения и локализации в верхних дыхательных путях у пациентов можно использовать симптоматическую терапию (антисептики, противокашлевые препараты). При развитии бронхообструктивного синдрома назначают лечение по стандартам (Лазолван, Пульмикорт, Беродуал через небулайзер). Антибиотики назначают пациентам с возможностью развития осложнений, при тяжелом течении инфекции, пневмонии, больным с иммунодефицитными состояниями [8, 9].
Нас интересовали изменения в иммунной системе у пациентов с микоплазменной инфекцией. В последние годы интенсивно изучается проблема первичных иммунодефицитов (ПИД), изучаются их клинические маски, генетические маркеры. ПИД относят к тяжелым генетически детерминированным заболеваниям, при которых наблюдается нарушение иммунологических взаимодействий. Частота ПИД остается низкой: во Франции – один случай на 13 000, в Германии – один cлучай на 46 000 жителей. Особенно тяжело протекают комбинированные формы ПИД – тяжелый комбинированный иммунодефицит (ТКИН). Многие исследователи связывают низкую заболеваемость ПИД с дефектами методов диагностики [10]. В нашей стране проводится программа скрининга на ТКИН среди новорожденных детей, имеющая большое значение для выживания пациентов. В 2017 г. Международный союз иммунологических обществ (International Union of Immunological Societirs – IUIS) предложил переименовать ПИД в термин «врожденные ошибки иммунитета». В настоящее время выделено 450 нозологических синдромов, разбитых на группы с доказанными генетическими дефектами.
Остается неясным патогенез приобретенных иммунодефицитов. Взаимосвязи между приобретенным и врожденным иммунодефицитами могут реализоваться через развитие соматических мутаций, вызывающих дефект функции белков или выработку аутоантител к рецепторам. Механизмы иммунопатогенеза остаются неясными, для ПИД характерны тяжелые клинические проявления, торпидные к традиционной терапии. В клинике мы тем не менее встречаемся с нарушениями иммунологических показателей, которые поддаются коррекции с помощью иммунотропных препаратов. Эти нарушения можно расценивать как иммунодисрегуляцию.
Цель исследования – оценить эффективность препарата Имунофан в комплексном лечении микоплазменной инфекции у часто болеющих детей с хроническими заболеваниями носо- и ротоглотки и иммунодисрегуляцией.
Задачи исследования:
- оценить клинико-иммунологические особенности при микоплазменной инфекции у часто болеющих детей с хроническими заболеваниями носо- и ротоглотки (ЧБД-ХЗ);
- проанализировать эффективность Имунофана в комплексном лечении микоплазменной инфекции у ЧБД-ХЗ с иммунодисрегуляцией;
- разработать рекомендации по применению Имунофана в комплексном лечении микоплазменной инфекции у ЧБД-ХЗ с иммунодисрегуляцией.
Материал и методы
Нами выбран Имунофан – разрешенный в педиатрической практике иммунотропный препарат, содержащий синтетический гексапептид с молекулярной массой 836 Да, ближайшим аналогом его является тимопентин (Timunox, Швейцария). Препарат стимулирует процессы созревания Т-лимфоцитов, кооперативные взаимодействия CD4+-клеток и клеток костного мозга, повышает активность ЕК-клеток и кислородзависимой системы бактерицидности нейтрофилов, активирует ранние этапы антителогенеза, синтез иммуноглобулинов M, G, A. Имунофан стимулирует нарушенную продукцию тимических гормонов, в том числе сывороточного тимического фактора, а также интерлейкина-2 (ИЛ-2), интерферона (ИФН).
Исследование проведено на базе ФГБУ «ГНЦ Институт иммунологии» ФМБА России.
Уточненные критерии включения ЧБД-ХЗ в исследование:
- дети с частыми респираторными инфекциями (6–16 раз в год) и подтвержденной инфекцией M. pneumoniae;
- наличие хронических заболеваний рото- и носоглотки (риносинусит, назофарингит) не менее одного года от установления диагноза (не менее четырех обострений за последние 12 месяцев) вне периода обострения на момент начала исследования;
- дети с иммунодисрегуляцией, снижением показателей иммунной системы;
- отсутствие противопоказаний к выбранным методам лечения.
Критерии исключения пациентов из исследования:
- дети с тяжелыми соматическими заболеваниями в стадии суб- и декомпенсации (геморрагический синдром, диабет, заболевания печени, эндокринной системы, почек и других внутренних органов, аутоиммунные заболевания, активная и латентная форма туберкулеза);
- дети с аллергическими заболеваниями (бронхиальная астма, диффузный атопический дерматит, аллергический ринит средней и тяжелой степени тяжести, поллиноз в период обострения, полипоз носа II–IV степени);
- дети с антенатальной герпесвирусной инфекцией и активной инфекцией цитомегаловируса и вируса Эпштейна – Барр;
- индивидуальная непереносимость отобранных препаратов для лечения;
- дети, получавшие иммуномодулирующие препараты в течение шести предыдущих месяцев.
Всем ЧБД-ХЗ [12] проводили общий анализ крови и мочи, биохимический анализ крови на начало исследования и через год; M. pneumoniae определяли методом ПЦР в мазке из носо- и ротоглотки («ДНК-технология», Россия); IgM- и IgG-АТ; общий IgE методом ИФА («Хема-Медика», Россия) до лечения, через четыре и шесть месяцев.
Обследовано 80 ЧБД-ХЗ, 55 из них получали в комплексном лечении Имунофан, 25 детей были отнесены к группе сравнения.
Имунофан получали 55 ЧБД-ХЗ (26 детей в возрасте пяти – семи лет; 18 детей 7,1–12 лет; 11 детей 12,1–15 лет; средний возраст 9,8 ± 2,7 лет; 28 мальчиков и 27 девочек), инфицированных М. pneumoniae, включая:
- 30 ЧБД-ХЗ (общая группа, 16 мальчиков и 14 девочек, средний возраст 9,9 ± 2,6 лет) – в виде инъекций 50 мкг внутримышечно 10 дней;
- 25 ЧБД-ХЗ (с изначально сниженным количеством Т-клеток, 12 мальчиков и 13 девочек, средний возраст 9,8 ± 2,7 лет) – в виде суппозиториев 100 мкг ректально 10 дней (для снижения инвазивности лечения).
25 ЧБД-ХЗ (группа сравнения) с изначальным снижением Т-клеток (13 девочек и 12 мальчиков, 11 детей в возрасте пяти – семи лет; 10 детей 7,1–12 лет; четверо детей 12,1–15 лет; средний возраст 9,9 ± 2,6 лет), инфицированные M. pneumoniae, получали традиционное лечение, включая спиромицин (Ровамицин) по показаниям, без назначения Имунофана. Группы были сходны по полу и возрасту. Клинико-иммунологическое обследование детей проводили после приема спиромицина до назначения Имунофана, через два-три дня после окончания курса, через четыре месяца от начала приема препарата. Группу сравнения обследовали до и после приема спиромицина и через четыре месяца. Все пациенты были проконсультированы ЛОР-врачом; у 20 из них диагностирован риносинусит; у большинства пациентов диагностированы частые обострения назофарингита. В каждой подгруппе у 15 пациентов был диагностирован поллиноз с сенсибилизацией к пыльце деревьев. У 15 из 80 пациентов диагностирован атопический дерматит (локальная форма), они проконсультированы дерматологом. Дети получали лечение по стандартам в период обострения (антигистаминные и антилейкотриеновые препараты; местная терапия при атопическом дерматите). Имунофан назначали вне периода обострения.
С эпидемиологическими целями обследованы ближайшие родственники инфицированных детей (родители, братья, сестры). У 8% родителей (мать – 6%, отец – 2% случаев), у 10% братьев и 6% сестер (дети посещали организованные коллективы) методом ПЦР-диагностики определено инфицирование M. pneumoniae с клиническими проявлениями на момент обследования (назофарингит, риносинусит, острый бронхит), что потребовало назначения антибиотика (спиромицина). Сестры и братья, посещающие организованные коллективы, могут быть причиной инфицирования и реинфицирования детей.
По показаниям детям делали рентгенографию гайморовых и лобных пазух. Передняя и задняя риноскопия проводилась ЛОР-врачом по показаниям.
Иммунологическое исследование проводили в начале наблюдения и через четыре месяца. Популяционный и субпопуляционный состав лимфоцитов периферической крови исследовали по инструкции стандартным методом цитометрии с помощью моноклональных антител (МКАТ) фирмы Beckman-Coulter (США): относительное и абсолютное количество CD3+-, CD4+-, CD8+-, CD16+-, CD19+-, HLA-DR+-клеток. Использовали МКАТ с двойной меткой фирмы Becton-Diсkinson (Simultest, США): CD3-HLA-DR+-, CD3+HLA-DR+-, CD4+CD25+-, CD3-CD16+-, CD3+CD16+-клетки. Пробы анализировали стандартным методом на проточном цитометре Epics PROFILE-II (Cultronics, США). Сывороточные иммуноглобулины (А, М, G) определяли стандартным методом радиальной иммунодиффузии по Манчини.
Интерфероновый статус определяли методом ИФА (АО «Вектор», Россия) по стандартной методике.
Исследование хемилюминесценции (спонтанная, индуцированная, индекс стимуляции) проводили на люминометре LKB-Wallac 1251 (Швеция) по инструкции.
Статистическая обработка результатов выполнена с помощью программы Standart с использованием пакета программ Statistica 6.0 (StatSoft Inc, США). Использованы вариационный, одно- и многофакторный корреляционный виды статистического анализа с определением критериев достоверности по Стьюденту, интервальной оценки квадратичного отклонения и дисперсии нормального распределения по критерию c2, U-критерия Манна – Уитни, среднего геометрического титра антител.
Результаты
В анализах крови не отмечено значимых отклонений количества лейкоцитов, палочкоядерных и нейтрофильных лейкоцитов. У 15 детей количество лейкоцитов составило 8–10 × 109/л за счет лимфоцитов или сегментоядерных нейтрофилов. У 20 детей были повышены СОЭ (12–16 мм/ч) и уровень эозинофилов в периферической крови до 5–10% (400–900 кл/мкл). После курса Имунофана в общей группе и у больных со снижением Т-клеток отмечалось достоверное повышение относительного количества лимфоцитов (в общей группе – 31,2 ± 1,7 и 38,5 ± 1,2%; у пациентов со снижением Т-клеток – 30 ± 1,4% и 38,5 ± 1,2% соответственно) после курса Имунофана. Динамика остальных показателей не была значительной.
Со стороны биохимических показателей крови патологии не выявлено. В общем анализе мочи у 15 больных выявлена оксалатурия, у 10 больных – фосфатурия, дети наблюдались у нефролога.
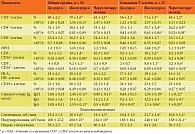
В таблице 1 представлена динамика иммунологических показателей при приеме Имунофана в общей группе больных (30 детей), отдельно представлена группа (25 детей) со снижением CD3+- или CD4+-клеток на начало наблюдения, получавшая Имунофан в виде ректальных суппозиториев. Клинические проявления у пациентов были сходными, все дети получали антибиотик спиромицин в возрастных дозировках до назначения Имунофана. У четырех детей при приеме спиромицина наблюдали повышение температуры до 38 °С, препарат был заменен на Вильпрафен в возрастных дозировках. В общей группе после курса Имунофана нужно отметить повышение относительного количества CD3+-, CD4+-, ЕК-, ТЕК-клеток, показателей спонтанной и индуцированной хемилюминесценции, уровней IgM и IgA в сыворотке (р < 0,05). В группе больных со снижением Т-клеток, получавших Имунофан менее инвазивным способом (в виде суппозиториев), динамика показателей была сходной. Через четыре месяца после курса показатели снижались (р < 0,05).
Назначение Имунофана приводит у ЧБД-ХЗ к повышению уровня сывороточного ИФН-α, а также спонтанного и индуцированного синтеза ИФН-α и ИФН-γ клетками, через четыре месяца положительный эффект снизился. Повышение индуцированного синтеза ИФН-α и ИФН-γ может быть связано с сохранением резервов клеток и значимо при борьбе с инфекциями. У трех пациентов мы не наблюдали значительного повышения синтеза ИФН. Курс Имунофана при необходимости можно повторить через четыре месяца после начала проявления инфекции. Средний геометрический титр IgM- и IgG-АТ к M. pneumoniae снижался после курса лечения (c2 > 3,8; p < 0,05), но титр IgG-АТ сохранялся выше диагностического (норма 1:16 для M. pneumoniae). Через четыре месяца после курса лечения ПЦР-анализ был отрицательным (табл. 2).
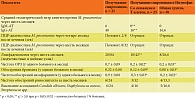
Мы оценили эффективность лечения через шесть месяцев у пациентов, получавших Имунофан, и в группе сравнения (табл. 3). Все дети получали спиромицин. В группе с изначальным снижением Т-клеток и в общей группе достоверно снижается средний геометрический титр IgM- и IgG-АТ к Mycoplasma pneumoniae, отрицательные результаты ПЦР-анализа. Через шесть месяцев у 32% ЧБД-ХЗ в группе сравнения определяется положительная ПЦР, чего не наблюдали у получавших Имунофан. У получавших Имунофан в мазках из зева мы не зафиксировали более выраженного снижения высеваемости Candida albicans, Staphylococcus aureus, Streptococcus spp. У пациентов с эпизодами бронхита клинически наблюдали сухой кашель и проводили дифференциальный диагноз с аллергическими заболеваниями [13, 16]. У 15 (50%) больных общей группы и 15 (60%) пациентов в группе со снижением Т-клеток наблюдали повышение общего IgЕ с учетом возрастных нормативов в пределах 90–140 МЕ/мл. После курса Имунофана не отмечено аллергических реакций и повышения общего IgE. После проведенного лечения кашель не беспокоил, данных, свидетельствующих о развитии бронхиальной астмы, не обнаружено. В группе сравнения мы не наблюдали достоверной динамики иммунологических показателей, поэтому данные не представлены в табл. 3. У 15 (60%) детей группы сравнения также был повышен общий IgE.
Со стороны клинических проявлений отмечено снижение частоты ОРЗ, бронхита и хронического назофарингита (р < 0,05). Частота риносинусита в группах достоверно не отличалась. Отмечено снижение в 3,5 раза частоты ОРЗ, в 2,5 раза – обострений хронического назофарингита и бронхита (p < 0,05), а также количества детей с увеличением шейных и подчелюстных лимфатических узлов (c2 > 3,8; р < 0,05). Размер лимфатических узлов (шейные и подчелюстные) уменьшился через шесть месяцев, у 20 ЧБД-ХЗ пальпировались единичные лимфатические узлы (0,5–0,6 см).
Иммунотропные препараты, созданные как лекарственные средства в 60-х годах XX века, могут действовать на клетки иммунной системы или выработку цитокинов. Необходимо выработать показания к их назначению на основании механизма действия. Действие Имунофана включает быструю фазу (от двух-трех часов до двух-трех суток) и продолжается до четырех месяцев (средняя и медленная фазы). В быструю фазу развивается детоксикационный эффект, активируется антиоксидантная система, повышаются продукция церулоплазмина, лактоферрина, активность каталазы, перекисное окисление липидов, подавляются распад фосфолипидов, синтез арахидоновой кислоты, снижаются уровень холестерина и продукция медиаторов воспаления. При токсическом и инфекционном поражении печени снижаются цитолиз, активность трансаминаз и уровень билирубина в крови.
В среднюю фазу (начинается через двое-трое суток, продолжается до 7–10 суток) повышаются фагоцитоз, гибель внутриклеточных бактерий и вирусов. В медленную фазу (начинается через 7–10 суток, продолжается до четырех месяцев) нормализуются показатели иммунной системы, повышается продукция специфических антител.
ЧБД составляют 20–60% всех детей в регионах и относятся к группе диспансерного наблюдения. Клинически для них характерны частые респираторные инфекции, возникающие на фоне транзиторных изменений в иммунной системе. По классификации Института гигиены детей и подростков Министерства здравоохранения РФ ЧБД относят ко второй группе здоровья (дети с отягощенным биологическим анамнезом, функциональными и морфологическими особенностями, то есть дети с риском развития у них хронического заболевания) [12]. По нашим данным, исследование иммунной системы у ЧБД с хроническими заболеваниями и микоплазменной инфекцией подтверждает изменения врожденного и адаптивного иммунитета (снижение относительного количества CD3+-, CD4+-, ЕК-, ТЕК-клеток, показателей спонтанной и индуцированной хемилюминесценции, уровней IgM, IgA в сыворотке). Эти изменения являются транзиторными, можно отнести их к иммунодисрегуляции при запаздывании развития иммунной системы [12].
Результаты нашего исследования показывают, что при приеме Имунофана у ЧБД-ХЗ, инфицированных M. pneumoniae, отмечается повышение числа Т-, ЕК-, ТЕК-клеток, ИРИ, показателей хемилюминесценции, уровней IgM, IgA в сыворотке синтеза ИФН-α и ИФН-γ. Положительный эффект Имунофана уменьшался через четыре месяца, по показаниям курс можно повторить. Положительная динамика указывает на наличие резервов и подтверждает наличие иммунодисрегуляции, а не иммунодефицита.
Микоплазма вызывает активацию перекисного окисления липидов, повреждение и гибель эпителиоцитов, развитие процесса воспаления в легочной ткани. Отмечается повышение В-клеток (CD20+) и сывороточного IgM [11].
После острого периода может формироваться персистирующая инфекция M. pneumoniae. Действительно, через четыре месяца у 2 (8%) пациентов, а через шесть месяцев уже у 8 (32%) пациентов группы сравнения ПЦР-анализ был положительный и появился риск обострения инфекции. У этих детей мы наблюдали обострения бронхита и назофарингита. У ЧБД-ХЗ, получавших Имунофан через шесть месяцев, ПЦР-анализ был отрицательный. Клинически уменьшается количество детей с лимфаденопатией, частота ОРЗ снижается в 3,5 раза, обострения рецидивирующего бронхита и хронического назофарингита – в 2,5 раза. С учетом возможности персистирующей инфекции у ЧБД-ХЗ предпочтительно назначение системных иммунотропных препаратов, к каковым относится Имунофан.
Для уменьшения реинфицирования необходимо обследовать ближайших родственников, особенно сестер и братьев, посещающих организованные коллективы. После перенесенной инфекции не формируется стойкого, протективного иммунитета. Инфекция нижних дыхательных путей может протекать как бронхит, пневмония [14, 15].
У 15 (50%) больных общей группы и 15 (60%) пациентов в группе со снижением Т-клеток наблюдали повышение общего IgЕ с учетом возрастных нормативов в пределах 90–140 МЕ/мл. У пациентов диагностирован поллиноз, но Имунофан не назначали в период обострения. При локальном атопическом дерматите усиление высыпаний отмечено при нарушении диеты (цитрусовые, шоколад, яйца). После курса Имунофана не отмечено усиления аллергических реакций и повышения общего IgE.
Заключение
Профилактика рецидивов респираторного микоплазмоза и персистирующей инфекции имеет социальное значение для формирования здорового поколения. Данных о возможности применения Имунофана при микоплазменной инфекции в доступной литературе не найдено. За период наблюдений было отмечено уменьшение иммунодисрегуляции, снижение числа эпизодов ОРЗ, назофарингита, бронхита. Побочных явлений, осложнений и аллергических реакций зафиксировано не было, поэтому применение Имунофана в педиатрии безопасно. У ЧБД-ХЗ группы сравнения с изначальным снижением Т-клеток и инфицированных M. pneumoniae, получавших спиромицин, достоверной динамики иммунологических показателей не отмечено.
T.P. Markova, PhD, Prof., D.G. Chuvirov, PhD
Academy of Postgraduate Education, Moscow
Contact person: Tatyana P. Markova, logot12@list.ru
The article present up-to-date on immunodysregulation in the children with recurrent respiratory diseases (acute respiratory infections, nazopharyngitis, bronchitis) and Mycoplasma infecton. in the treatment with imunofan and spiromycin. Imunofan – an activator of the production of IFNα и IFNγ. Number of T-, NK-, ТNK-cells, chemiluminescence indices, serum IgG, IgA were increased. After 6 monthers of observation number of acute respiratory infections, nazopharyngitis, bronchitis were decreased in 2.5–3.5 times. Number of patients with lymphadenopathy was decreased too. PCR-analysis was negative, serum IgG and IgM antibody to Mycoplasma pneumoniae were lower, than in the group without imunofan treatment.
