количество статей
6422
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Ингаляционные глюкокортикостероиды и их комбинация с пролонгированными симпатомиметиками в достижении контроля над бронхиальной астмой
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Пульмонология и оториноларингология" № 2 (29)
- Аннотация
- Статья
- Ссылки
- English
Вследствие неконтролируемой бронхиальной астмы существенно повышается риск обострений, возрастает количество принимаемых базисных препаратов и препаратов по потребности, быстрее снижается функция легких, качество жизни пациентов, возрастает число обращений за медицинской помощью и госпитализаций, повышается риск развития летального исхода. Именно поэтому оценка контроля заболевания является важнейшей задачей. Использование опросников по контролю астмы влияет не только на оценку контроля, но и на выбор терапии. Как правило, пациенты обращаются к врачам, когда их заболевание соответствует третьей ступени. Применение комбинированных противоастматических препаратов (ингаляционных глюкокортикостероидов и бета-2-агонистов длительного действия) возможно не только у больных с неконтролируемой астмой на фоне проводимой терапии, но и у первичных пациентов. Комбинированный препарат Зенхейл, в состав которого входит мометазона фуроат и формотерол, представляет собой эффективное и безопасное средство базисной терапии бронхиальной астмы.
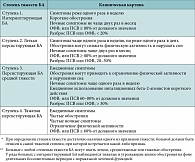
Таблица 1. Классификация бронхиальной астмы по степени тяжести* на основании клинической картины до начала терапии**

Таблица 2. Ступенчатый подход к терапии бронхиальной астмы

Таблица 3. Классификация бронхиальной астмы по уровню контроля CINA-2009
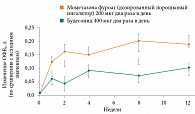
Рисунок. Динамика ОФВ1 на фоне применения Асманекса Твистхейлера и будесонида Турбухалера у пациентов со среднетяжелой бронхиальной астмой
Актуальность
Бронхиальная астма (БА) является тяжелым социальным бременем и влечет за собой значительные расходы на диагностику и лечение как со стороны самих пациентов и их родственников, так и со стороны системы здравоохранения. В связи с высокой распространенностью БА является актуальной проблемой здравоохранения не только в России, но и в мире [1, 2]. Цель лечения БА – достижение и поддержание контроля над заболеванием. Критерии хорошо контролируемой астмы:
- отсутствие дневных симптомов (или два и менее в неделю);
- отсутствие ограничений повседневной активности, в том числе физических нагрузок;
- отсутствие ночных симптомов или пробуждений;
- отсутствие потребности в препаратах неотложной помощи (или два и менее эпизодов в неделю);
- нормальные или близкие к ним показатели функции внешнего дыхания (ФВД);
- отсутствие обострений.
Увеличение потребности в препаратах неотложной помощи, особенно ежедневное использование, указывает на потерю контроля над БА и необходимость пересмотра терапии [1]. Исполнительный комитет GINA в 2006 г. рекомендовал не только включить в обновленный доклад новые научные данные, но и применить более рациональный подход к лечению БА, основанный на уровне ее контроля, а не степени тяжести [3].
Основная задача терапии БА – установление длительного контроля над заболеванием, а не просто лечение симптомов. Для определения необходимого объема терапии предложена классификация по тяжести течения БА (табл. 1). Если на первом визите врач оценивает степень тяжести течения БА у пациента и назначает ему соответствующую этой степени терапию (табл. 2), то на последующих визитах оцениваются результаты контроля БА, которые удалось достичь благодаря назначенной терапии. В настоящее время рекомендуется новый подход к контролю БА с оценкой текущего и последующего снижения риска обострений, нестабильного течения заболевания, быстрого снижения функции легких, побочных эффектов (табл. 3). Степень тяжести заболевания может варьировать в течение месяцев или лет, поэтому подход, основанный на уровне контроля, позволяет отражать не только тяжесть заболевания, но и ответ пациента на терапию.
Правильно ли мы и наши пациенты оцениваем контроль БА? На этот вопрос частично ответило исследование EUCAN AIM [4]. Это крупнейшее, наиболее полное международное исследование БА и ее терапии из всех проведенных в Европе и Канаде за последние десять лет. Телефонный опрос проводили в шести странах – Канаде, Франции, Германии, Италии, Испании и Соединенном Королевстве. В выборку исследования из каждой страны было включено около 400 взрослых пациентов или родителей пациентов подросткового возраста. В рамках исследования EUCAN AIM было проведено 2420 интервью. Путем набора случайных телефонных номеров проводили систематический скрининг, направленный на выявление семей, члены которых на тот момент страдали БА, диагностированной врачом. Пациента с БА определяли как человека, у которого было диагностировано данное заболевание либо у которого имелись приступы или симптомы в течение последнего года либо он принимал на момент опроса противоастматические препараты. В опросе участвовали взрослые пациенты и пациенты подросткового возраста, страдавшие БА. В семьях, в которых отсутствовали пациенты с БА или имелись только пациенты с БА младше 12 лет, опрос не проводили (такие семьи отсеивались во время скрининга). В семьях, в которых имелось более одного пациента, страдавшего БА и соответствовавшего критериям включения в исследование, с помощью компьютерной системы для телефонного опроса случайным образом отбирали одного человека, который участвовал в опросе. Если возраст отобранного для участия в опросе пациента составлял от 12 до 17 лет, в опросе участвовал взрослый член семьи, наиболее осведомленный о течении БА и ее терапии. В целом в выборку исследования было включено 2420 пациентов с БА, в том числе 2173 взрослых пациента и 247 родителей пациентов подросткового возраста (от 12 до 17 лет). Большинство респондентов воспринимали астму как полностью или хорошо контролируемую. Тем не менее у многих из них имелись симптомы БА в дневное, ночное время или во время физической нагрузки каждый день или в течение большинства дней на протяжении последних четырех недель. По данным опроса четверо из пяти пациентов с БА (80%) оценили астму как хорошо контролируемую или полностью контролируемую на протяжении того же периода. Для более объективной оценки контроля БА у участвовавших в этом исследовании пациентов использовали рекомендации (GINA), позволявшие оценить контроль симптомов заболевания. Контроль БА на протяжении последних четырех недель у пациентов, участвовавших в исследовании EUCAN AIM, оценивали по объективным критериям, основанным на рекомендациях GINA. Согласно критериям GINA только у 18% взрослых пациентов и пациентов подросткового возраста из стран Европы и Канады заболевание можно было классифицировать как контролируемое. Неконтролируемое течение заболевания отмечалось у 23%.
В исследовании EUCAN AIM была предпринята попытка установить, что в большей степени снижает качество жизни пациентов – ежедневные симптомы или внезапные тяжелые эпизоды БА. Внезапные тяжелые эпизоды БА в течение последнего года испытывали примерно четверо из десяти пациентов. Большинство из них (от 30 до 49%) отметили, что ежедневные симптомы и внезапные тяжелые эпизоды влияют на качество жизни примерно одинаково. Однако от 29 до 49% пациентов с бронхиальной астмой сообщили, что внезапные тяжелые эпизоды оказывают большее влияние на качество их жизни по сравнению с 16 до 28% пациентов, отметивших, что на качество их жизни сильнее влияют ежедневные симптомы.
Противовоспалительная терапия БА
Основными противовоспалительными препаратами для лечения БА являются ингаляционные глюкокортикостероиды (ИГКС), которые назначаются при персистирующей астме любой степени тяжести. Механизм действия ИГКС многогранен. Их противовоспалительный эффект связан со стабилизирующим действием на биологические мембраны, уменьшением капиллярной проницаемости, что объясняет их выраженный противоотечный эффект. ИГКС стабилизируют лизосомальные мембраны, что приводит к ограничению выхода различных протеолитических ферментов за пределы лизосом, предупреждает деструктивные процессы в тканях и вместе с тем уменьшает выраженность воспалительных реакций. В отличие от других противовоспалительных средств у ИГКС наиболее четко выражено антипролиферативное действие. ИГКС угнетают пролиферацию фибробластов и их активность в синтезе коллагена и, следовательно, склеротические процессы в бронхиальном дереве в целом [5, 6].
Противовоспалительный эффект проявляется на уровне генов, кодирующих синтез белков, участвующих в развитии воспаления. Они ингибируют экспрессию генов провоспалительных цитокинов (интерлейкинов (ИЛ) 1, 6, 8, гранулоцитарно-макрофагального колониестимулирующего фактора), металлопротеиназ (коллагеназы, стромелизины), активатора плазминогена, циклооксигеназы, NO-синтетазы. ГКС усиливают экспрессию генов ингибитора липокортина, угнетают эозинофилопоэз и вызывают апоптоз зрелых эозинофилов крови, снижая содержание эозинофилов в тканях бронхиального дерева [7, 8].
ГКС свойственно также мощное противоаллергическое действие, обусловленное снижением продукции IgE-иммуноглобулинов, повышением гистаминсвязывающей способности крови, стабилизацией мембран тучных клеток и уменьшением высвобождения из них медиаторов аллергии, снижением чувствительности периферических тканей к гистамину и серотонину с одновременным повышением чувствительности к адреналину, бета-2-агонистам [9–11].
Частота развития побочных эффектов и их выраженность при лечении пероральными и топическими ГКС резко различаются. Во-первых, пероральные ГКС назначают в дозах, исчисляемых в миллиграммах, топические – микрограммах. Во-вторых, топические ГКС действуют местно и их системные эффекты обусловлены только той дозой, которая попадает в кровоток. Это часть проглоченной фракции и легочная фракция препарата; они мизерны по сравнению с дозой перорального ГКС, поступающей в системный кровоток.
Таким образом, влияние ИГКС на состояние гипоталамо-гипофизарной системы носит дозозависимый характер и выявляется только при анализе биохимических параметров [11]. Исходя из сказанного ИГКС рассматриваются как средства первой линии в терапии всех патогенетических вариантов БА персистирующего течения, начиная с БА легкой степени [11, 12]. К ИГКС, давно применяемым в клинической практике, относятся беклометазона дипропионат, будесонид, флутиказона пропионат, флунизолид, триамцинолона ацетонид, к более поздним – циклесонид и мометазона фуроат.
Препарат Асманекс Твистхейлер (мометазона фуроат)
Асманекс Твистхейлер зарегистрирован в России относительно недавно, но уже широко используется в клинической практике. Механизм противоаллергического и противовоспалительного действия мометазона фуроата обусловлен способностью ингибировать высвобождение медиаторов воспаления. In vitro мометазона фуроат существенно ингибирует высвобождение лейкотриенов из лейкоцитов. В культурах клеток мометазона фуроат продемонстрировал высокую способность ингибировать синтез и высвобождение ИЛ-1, ИЛ-5, ИЛ-6, а также фактора некроза опухоли альфа (ФНО-альфа). Мометазона фуроат также является ингибитором продукции LT (лейкотриенов), чрезвычайно мощным ингибитором Тh2-цитокинов, ИЛ-4 и ИЛ-5, CD4+ Т-клетками человека [13].
Особенностью препарата Асманекс Твистхейлер является высокое сродство (аффинность) с ГКС-рецепторами человека. Это сродство в 16 раз выше, чем у дексаметазона, в семь раз выше, чем у триамцинолона ацетонида, в пять раз – чем у будесонида и в полтора раза – чем у флутиказона [14, 15]. Эффективность ИГКС определяется противовоспалительной активностью и быстротой наступления эффекта. Противовоспалительная активность ИГКС зависит от аффинности к ГКС-рецепторам.
Эффективность и безопасность Асманекса Твистхейлера изучались в двойных слепых плацебоконтролируемых исследованиях с участием более 2000 пациентов с легкой и средней персистирующей БА. В исследованиях продемонстрировано, что препарат в качестве монотерапии обеспечивает контроль симптомов БА и характеризуется высокой системной безопасностью. Применение Асманекса Твистхейлера в дозах от 200 до 800 мкг/сут улучшает ФВД (по показателям пиковой скорости выдоха и объема форсированного выдоха за первую секунду (ОФВ1)), приводит к улучшению контроля симптомов БА, снижает потребность в применении ингаляционных бета-адреностимуляторов. Улучшение показателей функции внешнего дыхания наблюдается у некоторых пациентов уже через 24 часа после начала терапии, однако максимальный эффект обычно достигается не ранее чем через одну-две недели. Достигнутый эффект сохраняется на протяжении всего периода лечения. Быстрое улучшение состояния пациентов – важный показатель эффективности препарата, который также способствует повышению приверженности терапии [16–18].
Сравнение Асманекса Твистхейлера в дозе 400 мкг в сутки и будесонида Турбухалера в суточной дозе 800 мкг продемонстрировало преимущества мометазона фуроата в отношении улучшения ФВД (прирост ОФВ1, пиковой скорости выдоха) (рисунок), а также в отношении снижения дозы бета-2-агонистов короткого действия (КДБА) (снижение средней суточной дозы сальбутамола на 90,66 мкг по сравнению со снижением на фоне будесонида Турбухалера на 33,90 мкг) [19].
При ингаляционном применении системная биодоступность мометазона фуроата достаточно низкая. При использовании в рекомендованных дозах концентрация препарата в плазме находится около или ниже порога определения (50 пг/мл). Вследствие этого невозможно определить ни период полувыведения, ни объем распределения мометазона фуроата после ингаляции. У пациентов с БА при регулярном применении Асманекса Твистхейлера в течение четырех недель в дозах от 200 мкг два раза в сутки до 1200 мкг/сут не выявляются признаки подавления гипоталамо-гипофизарно-надпочечниковой системы. Безопасность Асманекса Твистхейлера зависит еще от одного чрезвычайно важного свойства – связывания с белками плазмы после всасывания из легких. По данным исследований, по мере увеличения связывания с белками плазмы уменьшается системное воздействие препарата. У препарата Асманекс Твистхейлер это свойство значительно выше, чем у беклометазона дипропионата, будесонида и флутиказона пропионата [15, 20].
Преимуществами Асманекса Твистхейлера в качестве стартовой терапии БА являются его высокое сродство с ГКС-рецепторами, доказанная эффективность в отношении текущей клинической симптоматики и влияние на факторы риска возможных неблагоприятных последствий БА (ОФВ1, частота и тяжесть обострений, потребность в системных ГКС), а также высокий профиль безопасности и удобное устройство доставки. Препарат выпускается в ингаляционном устройстве Твистхейлер. Устройство представляет собой дозированный порошковый ингалятор, содержащий мелкодисперсный порошок. Простота устройства и необходимая минимальная скорость вдоха 30 литров в минуту представляются преимуществом для пациентов с нарушениями функции дыхания. Размеры частиц препарата в ингаляторе в среднем 2,2 мкм. Это позволяет достигать хорошего распределения во всех отделах бронхиального дерева.
Ингалятор активируется при закрывании крышки после предыдущего использования. Перед ингаляцией активации устройства не требуется – достаточно открыть крышку и сделать вдох. Такая конструкция исключает вероятность неполучения дозы препарата из-за забывчивости пациентов и неактивации ингалятора перед вдыханием препарата. Выпуск препарата в разных дозах позволяет использовать Асманекс Твистхейлер в режиме «повышение/понижение дозы», четырехкратно увеличивать дозу монопрепарата при потере контроля (с 200 до 800 мкг) в соответствии с рекомендациями GINA. Это имеет особое значение для пациентов с заболеваниями сердечно-сосудистой системы (при тахикардии, в случае изменений на ЭКГ, а также когда назначение комбинированной терапии нежелательно из-за побочных эффектов бета-агонистов). Применение препарата Асманекс Твистхейлер эффективно у пациентов с недостаточной приверженностью терапии, поскольку допускается ингаляция один раз в день, а также у больных со стероидофобией (однократный прием и хорошая переносимость).
Что касается применения препарата во время беременности, адекватных и хорошо контролируемых исследований не проводилось. Однако после ингаляционного применения концентрация мометазона фуроата в плазме крови очень низка. Воздействие на плод чрезвычайно мало, вероятность токсического воздействия на репродуктивность низка. Применение Асманекса Твистхейлера (как и других ИГКС) во время беременности и у кормящих матерей возможно только в том случае, если предполагаемая польза для матери превышает потенциальный риск для плода или ребенка.
Монотерапия ИГКС рекомендуется в качестве основного подхода у всех пациентов с легкой персистирующей БА и как один из возможных вариантов лечения у пациентов с БА средней степени тяжести.
Вопрос монотерапии БА с помощью ИГКС предполагает раннюю и правильную диагностику заболевания и оценку контроля назначенного лечения. При неправильном выборе препаратов и недостаточной терапии воспалительного процесса симптомы могут не только не уменьшаться, но и нарастать, что в свою очередь способно привести к бесконтрольному течению БА и обострению заболевания.
Фиксированные комбинации ИГКС и бета-2-агонистов длительного действия
Современные руководства по лечению среднетяжелой и тяжелой БА рекомендуют использовать комбинированную терапию ИГКС и бета-2-агонистами длительного действия (ДДБА). Как показали результаты исследования, добавление ДДБА к низким и средним дозам ИГКС обеспечивает лучший контроль БА, чем удвоение дозы ГКС. Метаанализ ряда исследований продемонстрировал, что включение ингаляционного ДДБА в схему лечения больных, у которых БА не удается контролировать низкими или высокими дозами ИГКС, позволяет достичь лучшего контроля заболевания, чем увеличение дозы ИГКС в два раза и более (уровень доказательности А) [21–24].
В основе комбинированной терапии с использованием ИГКС и ДДБА лежит синергизм данных лекарственных средств. ИГКС увеличивают скорость синтеза бета-рецепторов, что обеспечивает их высокую плотность на мембране клеток-мишеней, а также повышают активность бета-2-рецепторов. ДДБА активируют ГКС-рецепторы. При этом на фоне приема ДДБА для активации рецептора требуются более низкие дозы ИГКС. ДДБА обеспечивают повышение ядерной транслокации стероид-рецепторного комплекса в ядро, где он взаимодействует со специфичной областью гена-мишени, что приводит к усилению противовоспалительной активности и повышению синтеза бета-2-рецепторов [25–27]. Таким образом, противовоспалительный эффект достигается при использовании меньших доз ИГКС.
Следует помнить, что в целях безопасности использование формотерола и салметерола больными БА возможно только при одновременном применении адекватных доз ИГКС.
Возможность эффективного лечения БА с использованием комбинированной терапии ИГКС и ДДБА привела к внедрению в клиническую практику препаратов, сочетающих фиксированные дозы ИГКС и ДДБА в одном ингаляторе. ДДБА облегчают состояние больных, что повышает приверженность терапии; поддерживающая доза ИГКС воздействует на воспаление в дыхательных путях и улучшает контроль над заболеванием. Более того, использование фиксированных комбинаций снижает прямые и непрямые затраты на лечение по сравнению с применением тех же лекарственных средств в отдельных ингаляторах. Кроме того, в 2005, 2008 и 2010 гг. [28] Управление по контролю за продуктами и лекарствами США (Food and Drug Administration – FDA) провело дополнительную оценку безопасности ДДБА при бронхиальной астме. Причиной беспокойства стали данные о повышении риска тяжелых обострений у некоторых пациентов, получавших салметерол. Однако из представленных данных следовало, что повышенный риск отмечался прежде всего у вполне определенной группы пациентов – темнокожих американцев, не получавших терапии ингаляционными гормональными препаратами до начала лечения салметеролом. Кроме того, отмечалось повышение риска тяжелых обострений в тех случаях, когда лечение салметеролом начиналось на фоне выраженного ухудшения или уже имевшегося обострения БА. В сообщении приведены данные об использовании салметерола, противоречащем действующей инструкции по применению препарата (назначение салметерола проведено в отсутствие терапии ИГКС, назначение препарата в период обострения БА). Поэтому создание фиксированных комбинаций обеспечивает дополнительную безопасность терапии.
Ингаляторы с фиксированными комбинациями препаратов более удобны для пациентов, повышают приверженность терапии, обеспечивают одновременное введение бета-2-агониста и ИГКС. До настоящего времени в практике российского здравоохранения применялись три препарата с фиксированными комбинациями: флутиказона пропионат и салметерол (Серетид), будесонид и формотерол (Симбикорт), беклометазон и формотерол (Фостер). Недавно был зарегистрирован четвертый комбинированный препарат Зенхейл (мометазона фуроат и формотерол).
Препарат Зенхейл
Составными компонентами препарата Зенхейл являются ИГКС мометазона фуроат и ДДБА формотерол.
Формотерол редко вызывает парадоксальный бронхоспазм, обладает дозозависимым эффектом и выраженными бронхолитическими свойствами, может использоваться для купирования симптомов БА. Проведенные исследования показали безопасность даже высоких доз формотерола по показателям интервала QTc, содержания глюкозы и калия в плазме крови. Формотерола фумарат – мощный бета-2-агонист 12-часового действия. Для этого препарата характерно уникальное сочетание фармакологических свойств:
- высокая эффективность в сочетании с высокой бета-2-селективностью, что обеспечивает хороший профиль безопасности препарата;
- быстрое начало действия (в течение 1–3 минут);
- продолжительный эффект (в течение 12 часов);
- отсутствие антагонистического действия по отношению к КДБА, что имеет огромное клиническое значение в ситуациях, предусматривающих сочетанный прием длительно и короткодействующих адреномиметиков [29–32];
- отсутствие кумуляции в терапевтических дозах [9–12].
Формотерол обладает уникальной промежуточной липофильностью, являясь умеренно липофильным препаратом, способным быстро взаимодействовать с рецептором, поэтому его действие начинается через 1–3 минуты. В то же время он проникает в липофильную область мембраны, откуда постепенно выделяется для повторного взаимодействия с активным участком рецептора, благодаря чему продолжительность действия достигает 12 часов. Тем не менее механизм пролонгированного действия формотерола не до конца изучен [13].
Безопасность и эффективность препарата Зенхейл подтверждены в ходе трех рандомизированных двойных слепых многоцентровых клинических исследований в параллельных группах (P04073, P04334 и P04431) продолжительностью от 12 до 26 недель. В исследования было включено 2225 пациентов в возрасте 12 лет и старше с персистирующей БА, не поддающейся контролю при применении ИГКС в низких, средних и высоких дозах (исходные значения ОФВ1 составляли от 66 до 75% от ожидаемых нормальных значений).
Два исследования были посвящены сравнению эффективности препарата Зенхейл в дозе 50/5 и 100/5 мкг по две ингаляции дважды в сутки с эффективностью плацебо и каждого входящего в состав препарата компонента – мометазона фуроата и формотерола (исследования P04073 и P04334) (протокол предусматривал монотерапию ДДБА, в настоящее время изолированное назначение ДДБА невозможно). В третьем исследовании сравнивали эффективность двух доз препарата Зенхейл (100/5 и 200/5 мкг) с эффективностью мометазона фуроата (исследование P04431). Все исследуемые препараты вводились с помощью дозированных ингаляторов по две ингаляции два раза в день.
В 26-недельном плацебоконтролируемом исследовании (исследование P04334 – применение препарата Зенхейл в средней дозе) участвовал 781 пациент в возрасте 12 лет и старше. Пациенты первой группы (n = 191) получали препарат Зенхейл 100/5 мкг, пациенты второй группы (n = 192) – мометазона фуроат 100 мкг, третьей (n = 202) – формотерола фумарат 5 мкг, четвертой (n = 196) – плацебо. Каждый препарат вводили с помощью дозированного аэрозольного ингалятора по две ингаляции два раза в день. Применение других препаратов поддерживающей терапии было прекращено. Был предусмотрен вводный период продолжительностью две-три недели с применением мометазона фуроата 100 мкг в режиме по две ингаляции два раза в день.
Группы исследования были сопоставимы по исходным характеристикам. Средний возраст участников исследования составил 42,4 года. Среди пациентов 41% составляли мужчины и 59% женщины, 72% пациентов были представителями европеоидной расы, 28% – представителями других рас. У пациентов имелась персистирующая БА, которая не поддавалась адекватному контролю при применении ИГКС в средних дозах до рандомизации. Средние значения ОФВ1 и средние значения ОФВ1 в процентах от ожидаемого значения оказались сопоставимы во всех группах (2,3 л, 73% от должных значений). Основными критериями эффективности служили показатели площади под кривой для ОФВ1, измеряемые путем серийной спирометрии на протяжении 12 часов (AUC 0–12 ч), и время до первого тяжелого обострения БА (определялось как наличие любого из следующих признаков: уменьшение ОФВ1 на 20%, уменьшение ПСВ на 30% в течение двух или более последовательных дней, неотложная терапия, госпитализация или применение системных ГКС или других противоастматических препаратов, запрещенных протоколом исследования).
По всем исследуемым параметрам препарат Зенхейл продемонстрировал высокую эффективность. Кроме того, у пациентов, получавших Зенхейл 100/5 мкг по две ингаляции два раза в день, отмечено улучшение по ряду вторичных параметров. Уменьшение относительного количества ночей с пробуждениями, связанными с БА, во время которых требовалось применение КДБА, было статистически достоверно более выраженным по сравнению с пациентами, получавшими плацебо (р < 0,001). Таким образом, влияние препарата Зенхейл 100/5 мкг, применявшегося по две ингаляции два раза в день, на некоторые дополнительные критерии эффективности, в том числе на относительное количество ночей с пробуждениями, превышало таковое плацебо (-60 и -15%) [33].
Применение препарата приводило также к достоверному по сравнению с плацебо снижению общего потребления препаратов неотложной помощи (КДБА): -0,6 и +1,1 ингаляции/день, р < 0,001.
Безопасность мометазона фуроата и формотерола (МФ/Ф) в дозах 100/10, 200/10 и 400/10 мкг два раза в день изучалась в пяти многоцентровых международных рандомизированных клинических исследованиях III фазы длительностью от 12 до 52 недель с участием свыше 3000 пациентов с БА в возрасте 12 лет и старше. Основанием для назначения фиксированной комбинации было отсутствие контроля БА при использовании монотерапии низкими, средними или высокими дозами ИГКС.
Профиль побочных эффектов МФ/Ф соответствовал таковому при лечении отдельными монокомпонентами препарата и флутиказона пропионатом/салметеролом. У пациентов не отмечалось клинически значимых изменений в анализах крови и ЭКГ.
В ходе исследований оценивали состояние гипоталамо-гипофизарно-надпочечниковой системы. Функцию оси «гипоталамус – гипофиз – надпочечники» оценивали в 52-недельном исследовании на основании 24-часового значения AUC для концентрации кортизола в плазме крови. Клинически значимого влияния препарата Зенхейл на концентрацию кортизола в плазме крови не обнаружено. 404 пациента с БА получали Зенхейл 100/5 мкг, Зенхейл 200/5 мкг, флутиказона пропионат/салметерол 125/25 или 250/25 мкг по две ингаляции два раза в день (все препараты вводились с помощью дозированного аэрозольного ингалятора). На 52-й неделе среднее значение AUC (0–24 часа) для концентрации кортизола в плазме крови оказалось соответственно на 2,2, 29,6, 16,7 и 32,2% меньше исходного [34].
Зенхейл выпускается в трех дозах – 50/5, 100/5 и 200/5, что соответствует высвобождению 50, 100 и 200 мкг мометазона фуроата и 5 мкг формотерола фумарата дигидрата при каждой ингаляции. Максимальная рекомендуемая суточная доза для пациентов в возрасте 12 лет и старше – 800 мкг мометазона фуроата/20 мкг формотерола фумарата дигидрата (200/5 мкг препарата Зенхейл по две ингаляции два раза в день). Ингалятор Зенхейл оснащен счетчиком доз, отсчитывающим каждую дозу, что позволяет пациенту следить за наличием препарата в ингаляторе. Когда препарат заканчивается, устройство автоматически блокируется.
У некоторых пациентов увеличивается вероятность развития нежелательных эффектов при применении высоких доз формотерола. Поэтому не следует применять более двух рекомендованных ингаляций препарата Зенхейл в день. При остром приступе астмы или в случае, когда симптомы заболевания появляются между введениями препарата, для быстрого облегчения симптомов целесообразно использовать ингаляционный КДБА.
Заключение
Контроль БА – важнейший маркер правильности назначенной противоастматической терапии. Достижение контроля БА позволяет уменьшить риск обострений, обращений за медицинской помощью и госпитализаций, сократить количество ингаляций препаратов для облегчения симптомов БА, предупредить снижение функции легких и качества жизни пациентов и снизить риск смерти. Правильный выбор начальной терапии во многом определяет дальнейшее течение заболевания. Фиксированные комбинации ИГКС и ДДБА с доказанной эффективностью и хорошим профилем безопасности рекомендованы для лечения БА начиная с третьей ступени и зачастую могут использоваться уже с момента диагностики заболевания. Если в состав фиксированных комбинаций входит формотерол, наступление быстрой бронходилатации скорее всего станет дополнительным аргументом в пользу приверженности базисной терапии. Препарат Зенхейл обеспечивает достижение контроля у разных групп пациентов с БА, нуждающихся в приеме комбинированного препарата. Разнообразие выпускаемых дозировок препарата Зенхейл позволяет при достижении контроля снизить дозы ИГКС, не меняя сам препарат. Если на фоне лечения Зенхейлом пациент достигает стойкого контроля БА на низких дозах, возможен переход на однократный прием соответствующего ИГКС – препарата Асманекс.
1. Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma. UPDATED 2011. www.ginasthma.org.
2. Masoli M., Fabian D., Holt S. et al. The global burden of asthma: executive summary of the GINA Dissemination Committee report // Allergy. 2004. Vol. 59. № 5. P. 469–478.
3. Global Initiative for Asthma. Workshop Report, 2006. http://www.ginasthma.com/download.asp?intId=217.
4. Highlights from Asthma Insight and Management in Europe and Canada (EUCAN AIM): A Multicountry Survey of Asthma Patients. Merck, Sharp & Dohme. 2010.
5. Barnes N.C. Advances in inhaled steroid therapy // Eur. Respir. Rev. 1994. № 4. P. 295–300.
6. Brattstrand R. What factors determine anti-inflammatory activity and selectivity of inhaled steroids // Eur. Respir. Rev. 1997. № 7. P. 356–361.
7. Cox G., Ohtoshi T., Vancheri C. et al. Promotion of eosinophil survival by human bronchial epithelial cells and its modulation by steroids // Am. J. Respir. Cell. Mol. Biol. 1991. Vol. 4. № 6. P. 525–531.
8. Borson D.B., Gruenert D.C. Glucocorticoids induce neutral endopeptidase in transformed human tracheal epithelial cells // Am. J. Physiol. 1991. Vol. 260. № 2. Pt. 1. P. L83–89.
9. Jeffery P.K., Godfrey R.W., Adelroth E. et al. Effects of treatment on airway inflammation and thickening of basement membrane reticular collagen in asthma. A quantitative light and electron microscopic study // Am. Rev. Respir. Dis. 1992. Vol. 145. № 4. Pt. 1. P. 890–899.
10. Mak J.C., Nishikawa M., Barnes P.J. et al. Glucocorticosteroids increase beta 2-adrenergic receptor transcription in human lung // Am. J. Physiol. 1995. Vol. 268. № 1. Pt. 1. P. L41–46.
11. Mak J.C., Nishikawa M., Shirasaki H. et al. Protective effects of a glucocorticoid on downregulation of pulmonary beta 2-adrenergic receptors in vivo // J. Clin. Invest. 1995. Vol. 96. № 1. P. 99–106.
12. Johnson M. Pharmacodynamics and pharmacokinetics of inhaled glucocorticoids // J. Allergy. Clin. Immunol. 1996. Vol. 97. № 1. Pt. 2. P. 169–176.
13. Buist A.S. Development of evidence based guidelines for inhaled therapeutic interventions in asthma // Eur. Resp. Rev.1998. Vol. 8. № 58. P. 322–323.
14. Yang T.T., Li S., Wyka B., Kenyon D. Drug delivery performance of the mometasone furoate dry powder inhaler // J. Aerosol. Med. 2001. Vol. 14. № 4. P. 487–494.
15. Sahasranaman S., Issar M., Hochhaus G. Metabolism of mometasone furoate and biological activity of the metabo lites // Drug. Metab. Dispos. 2006. Vol. 34. № 2. P. 225–233.
16. Padden J., Skoner D., Hochhaus G. Pharmacokinetics and pharmacodynamics of inhaled glucocorticoids // J. Asthma. 2008. Vol. 45. Suppl. 1. P. 13–24.
17. Price D., Robertson A., Bullen K. et al. Improved adherence with once-daily versus twice-daily dosing of mometasone furoate administered via a dry powder inhaler: a randomized open-label study // BMC Pulm. Med. 2010. Vol. 10. № 1.
18. Corren J., Berkowitz R., Murray J.J., Prenner B. Comparison of once-daily mometasone furoate versus once-daily budesonide in patients with moderate persistent asthma // Int. J. Clin. Pract. 2003. Vol. 57. № 7. P. 567–572.
19. Bousquet J., D'Urzo A., Hebert J. et al. Comparison of the efficacy and safety of mometasone furoate dry powder inhaler to budesonide Turbuhaler // Eur. Respir. J. 2000. Vol. 16. № 5. P. 808–816.
20. Wardlaw A., Larivee P., Eller J. et al. Efficacy and safety of mometasone furoate dry powder inhaler vs fluticasone propionate metered-dose inhaler in asthma subjects previously using fluticasone propionate // Ann. Allergy. Asthma. Immunol. 2004. Vol. 93. № 1. P. 49–55.
21. Nathan R.A., Nayak A.S., Graft D.F. et al. Mometasone furoate: efficacy and safety in moderate asthma compared with beclomethasone dipropionate // Ann. Allergy. Asthma. Immunol. 2001. Vol. 86. № 2. P. 203–210.
22. Greening A.P., Ind P.W., Northfield M., Shaw G. Added salmeterol versus higher-dose corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid. Allen & Hanburys Limited UK Study Group // Lancet. 1994. Vol. 344. № 8917. P. 219–224.
23. Woolcock A., Lundback B., Ringdal N., Jacques L.A. Comparison of addition of salmeterol to inhaled steroids with doubling of the dose of inhaled steroids // Am. J. Respir. Crit. Care Med. 1996. Vol. 153. № 5. P. 1481–1488.
24. Pauwels R.A., Löfdahl C.G., Postma D.S. et al. Effect of inhaled formoterol and budesonide on exacerbations of asthma. Formoterol and Corticosteroids Establishing Therapy (FACET) International Study Group // N. Engl. J. Med. 1997. Vol. 337. № 20. P. 1405–1411.
25. Kips J.C., O'Connor B.J., Inman M.D. et al. A long-term study of the antiinflammatory effect of low-dose budesonide plus formoterol versus high-dose budesonide in asthma // Am. J. Respir. Crit. Care Med. 2000. Vol. 161. № 3. Pt. 1. P. 996–1001.
26. Barnes P.J. Scientific rationale for inhaled combination therapy with long-acting beta2-agonists and corticosteroids // Eur. Respir. J. 2002. Vol. 19. № 1. P. 182–191.
27. Mak J.C., Nishikawa M., Shirasaki H. et al. Protective effects of a glucocorticoid on downregulation of pulmonary beta 2-adrenergic receptors in vivo // J. Clin. Invest. 1995. Vol. 96. № 1. P. 99–106.
28. http://www.fda.gov/
29. Palmqvist M., Ibsen T., Mellén A., Lötvall J. Comparison of the relative efficacy of formoterol and salmeterol in asthmatic patients // Am. J. Respir. Crit. Care Med. 1999. Vol. 160. № 1. P. 244–249.
30. Politiek M.J., Boorsma M., Aalbers R. Comparison of formoterol, salbutamol and salmeterol in methacholine-induced severe bronchoconstriction // Eur. Respir. J. 1999. Vol. 13. № 5. P. 988–992.
31. Van Noord J.A., Smeets J.J., Raaijmakers J.A. et al. Salmeterol versus formoterol in patients with moderately severe asthma: onset and duration of action // Eur. Respir. J. 1996. Vol. 9. № 8. P. 1684–1688.
32. Anderson G.P. Formoterol: pharmacology, molecular basis of agonism, and mechanism of long duration of a highly potent and se-lective beta 2-adrenoceptor agonist bronchodilator // Life Sci. 1993. Vol. 52. № 26. P. 2145–2160.
33. Nathan R.A., Nolte H., Pearlman D.S., P04334 Study Investigators. Twenty-six-week efficacy and safety study of mometasone furoate/formoterol 200/10 microg combination treatment in patients with persistent asthma previously receiving medium-dose inhaled corticosteroids // Allergy Asthma Proc. 2010. Vol. 31. № 4. P. 269–279.
34. Maspero J.F., Nolte H., Chérrez-Ojeda I., P04139 Study Group. Long-term safety of mometasone furoate/formoterol combination for treatment of patients with persistent asthma // J. Asthma. 2010. Vol. 47. № 10. P. 1106–1115.
Inhaled glucocorticosteroids (ICS) and combinations of ICS and long-acting sympathomimetics for achieving asthma control
N.P. Knyazheskaya
Pirogov Russian national research medical university
Contact person: Nadezhda Pavlovna Knyazheskaya, kniajeskaia@mail.ru
Uncontrolled asthma is associated with more frequent exacerbations, emergency department visits and hospital admissions, increased number of maintenance and reliever medications, faster decrease of lung function and quality of life and increased risk of death. Thus, assessment of asthma control level is a crucial part of asthma management. Use of asthma control questionnaires influences assessment of asthma control and the choice of therapy. The majority of patients seeking medical help need step III asthma therapy. Inhaled glucocorticoteroid + long-acting beta2-agonist combinations may be recommended both for uncontrolled asthma patients already receiving maintenance therapy and for treatment naïve patients with newly-diagnosed asthma. Mometasone furoate/formoterol combination (Zenhale) is an effective and safe preparation for the maintenance treatment of asthma.
СТАТЬИ по теме
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
