Ключевые факторы успеха длительного лечения остеопороза. Российский конгресс по остеопорозу, остеоартрозу и другим метаболическим заболеваниям скелета. Сателлитный симпозиум компании «Амджен»
- Аннотация
- Статья
- Ссылки
В Казани 9 сентября 2016 г. в рамках Российского конгресса по остеопорозу, остеоартрозу и другим метаболическим заболеваниям скелета состоялся сателлитный симпозиум компании «Амджен». На мероприятии прозвучали доклады российских и зарубежных специалистов, посвященные практическим вопросам лечения остеопороза и профилактики переломов. В частности, рассмотрены преимущества применения современных антирезорбтивных препаратов.
В Казани 9 сентября 2016 г. в рамках Российского конгресса по остеопорозу, остеоартрозу и другим метаболическим заболеваниям скелета состоялся сателлитный симпозиум компании «Амджен». На мероприятии прозвучали доклады российских и зарубежных специалистов, посвященные практическим вопросам лечения остеопороза и профилактики переломов. В частности, рассмотрены преимущества применения современных антирезорбтивных препаратов.



Ключевые факторы успеха терапии остеопороза: лечение до достижения цели
Поскольку остеопороз – системное нарушение скелета, характеризующееся снижением прочности костной ткани, что повышает риск переломов1, а прочность костной ткани определяется ее плотностью и качеством, логично предположить, что лечение должно способствовать достижению оптимальной плотности, качества и прочности кости. Это в свою очередь позволит снизить риск остеопоротических переломов.
Текущие рекомендации по терапии постменопаузального остеопороза предполагают выявление и лечение пациентов группы риска для предотвращения таких переломов2.
Определение целевых значений терапии остеопороза имеет важное значение для ее индивидуализации (в зависимости от риска переломов и/или показателей минеральной плотности кости (МПК)), оценки соотношения «польза/риск», упрощения принятия решений об изменении или отмене терапии, повышения комплаентности пациентов лечению3.
Докладчик отметил, что существуют потенциальные ограничения достижения целевых значений. Так, определение одного целевого значения может привести к недооценке других потенциальных факторов риска. Достижение пограничного целевого значения не гарантирует сопоставимого снижения риска переломов у разных пациентов. Не решено, что следует делать, когда пациент достигает целевых значений. Кроме того, при реализации современной концепции лечения необходимо учитывать такие проблемы клинической практики, как недостаточность диагностики и терапии остеопороза, а также несоблюдение режима последней.
В настоящее время для диагностики остеопороза применяются критерии Всемирной организации здравоохранения. В соответствии с ними значения МПК, отклоняющиеся от пика костной массы (Т-критерий) менее чем на 1,0 стандартное отклонение (СО), расцениваются как норма, на -1,0– -2,5 СО – как остеопения, более чем на -2,5 СО – как остеопороз.
В ходе многочисленных исследований установлена значимая корреляция между снижением МПК и риском переломов.
Результаты исследования FLEX, в котором оценивалась динамика МПК через десять лет в группах больных, продолживших принимать алендронат в течение всего периода наблюдения или переведенных на плацебо через первые пять лет активного лечения, продемонстрировали зависимость частоты клинических переломов костей от МПК проксимального отдела бедра, достигнутой после пяти лет терапии антиостеопоротическим препаратом. Так, у продолживших прием алендроната риск переломов был значительно ниже4.
Более значительный рост МПК в позвоночнике и бедре на фоне терапии связан со снижением риска перелома позвонков5.
Для лечения остеопороза используют антирезорбтивные препараты, ведущее место среди которых занимают бисфосфонаты и деносумаб. На сегодняшний день получены данные об эффективности и безопасности длительного непрерывного применения деносумаба – в течение восьми лет (продленная фаза исследования FREEDOM). Такая терапия ассоциировалась с продолжением прироста МПК позвоночника и бедра и снижением риска внепозвоночных переломов по сравнению с терапией плацебо6.
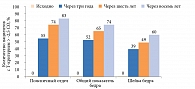
Прием деносумаба в течение восьми лет позволяет женщинам, страдающим остеопорозом, достичь неостеопоротических значений Т-критерия (рис. 1).
Результаты исследований свидетельствуют о необходимости продолжения терапии остеопороза деносумабом после достижения целевых показателей. Так, после прекращения использования препарата показатели МПК поясничного отдела позвоночника значительно снижаются и восстанавливаются после возобновления применения7.
Профессор Дж. Билезикян подчеркнул, что у больных остеопорозом первичные переломы обусловливают высокий риск переломов в будущем. В ряде исследований зафиксированы серьезные остеопоротические переломы в течение пяти лет после переломов бедра, плеча или клинических переломов позвонков. После перенесенного перелома любой локализации риск повторного перелома удваивается8, 9.
В заключение докладчик отметил, что при выборе лекарственного средства необходимо учитывать особенности каждого больного: наличие факторов риска переломов, показатели МПК, маркеров костной резорбции. Задача врача – оценить краткосрочную и долгосрочную вероятность перелома и на основании этого принять решение о лечении.
В ряде случаев общепринятые методы лечения пероральными бисфосфонатами являются неэффективными. Пациентам с высоким риском остеопоротических переломов, в том числе повторных, показано непрерывное длительное лечение эффективным антирезорбтивным средством, таким как деносумаб.
Длительное лечение остеопороза: данные клинических исследований
Ольга Михайловна отметила, что остеопороз, как и другие хронические заболевания, требует длительного лечения. Поэтому при выборе препарата необходимо быть уверенным в его безопасности и сохранении клинического эффекта в течение длительного времени.
Многочисленные исследования подтверждают целесообразность длительного лечения деносумабом. Оптимальный режим применения – 60 мг п/к один раз в шесть месяцев.
Эффективность деносумаба при постменопаузальном остеопорозе изучалась в исследовании FREEDOM. Основное исследование, длившееся три года, показало, что на фоне лечения деносумабом в дозе 60 мг п/к МПК в позвоночнике, общем показателе бедра, шейке бедра увеличилась по сравнению с приемом плацебо.
В продленную фазу исследования FREEDOM (extension) вошли 4550 женщин, завершившие исследование FREEDOM: 2343 из них продолжили прием деносумаба (данные за десять лет), 2207 – переведены с плацебо на деносумаб (данные за семь лет). У пациенток первой группы увеличение МПК продолжилось во всех отделах скелета. Так, средний прирост МПК за десять лет составил 21,6% в позвоночнике и 9,1% в бедре. У пациенток второй группы сократилась частота переломов позвонков, бедренной кости6.
По данным исследователей, ежегодная частота позвоночных и внепозвоночных переломов на фоне терапии деносумабом оставалась низкой в течение всего периода наблюдения. Отмечалась также низкая частота развития нежелательных явлений, в том числе серьезных. Незарегистрированные ранее побочные эффекты не наблюдались10.
В исследовании FREEDOM в группах деносумаба и плацебо наблюдалось сопоставимое количество побочных эффектов. В продленной фазе исследования их число не увеличилось.
Особый интерес представляет анализ частоты развития различных инфекций на фоне терапии деносумабом. Это обусловлено тем, что RANK (Receptor Activator of Nuclear Factor kappa B) и лиганд RANK (RANKL) экспрессируются не только клетками костной ткани, но и клетками иммунной системы, включая активированные Т- и В-лимфоциты, дендритные клетки, что подразумевает изменение их функций во время применения деносумаба. Согласно результатам исследования FREEDOM, общее число инфекционных осложнений в группе деносумаба было не выше, чем в группе плацебо. У пациентов, получавших деносумаб, в основной части исследования наблюдались серьезные инфекции брюшной полости, мочевыводящих путей и уха, однако повышения риска сепсиса или смерти не зафиксировано. С увеличением длительности терапии частота побочных эффектов снижалась.
На фоне терапии деносумабом отмечены случаи гипокальциемии. Для ее профилактики все больные должны получать препараты кальция и витамина D. «Наличие гипокальциемии является противопоказанием к применению препарата», – подчеркнула выступающая.
В продленной фазе исследования FREEDOM зарегистрировано восемь случаев тяжелой симптомной гипокальциемии, которые быстро купировалась после назначения препаратов кальция с витамином D. При этом семь из восьми пациентов страдали тяжелой почечной недостаточностью.
Развитие остеонекроза нижней челюсти подтверждено в четырех случаях: в двух – у пациентов, которые начали лечение деносумабом, в двух – у пациентов, продолживших его применение.
Деносумаб не замедлял консолидацию переломов и не увеличивал риск развития онкологических заболеваний.
Несмотря на то что деносумаб и бисфосфонаты относятся к одной и той же группе препаратов, механизмы их действия существенно различаются. Деносумаб представляет собой полностью человеческое рекомбинантное моноклональное IgG2-антитело к RANKL. RANKL – цитокин семейства фактора некроза опухоли. Это основной белок костной резорбции, который продуцируется остеобластами. Деносумаб связывает и ингибирует RANKL, препятствует его связыванию с RANK, таким образом он ингибирует образование остеокластов, их активность и выживание.
Бисфосфонаты не влияют на RANK, RANKL, они связываются с костной тканью и поглощаются остеокластами. Накапливаясь в митохондриях, вещество нарушает энергетический баланс клетки и ускоряет ее апоптоз.
В отличие от бисфосфонатов деносумаб циркулирует в крови и межклеточной жидкости в течение полугода. Этим объясняется его более выраженный клинический эффект11, 12.
Далее докладчик представила результаты двух сравнительных многоцентровых рандомизированных исследований деносумаба с бисфосфонатом алендронатом – DECIDE и STAND. В исследовании DECIDE принимали участие женщины в постменопаузальном периоде, ранее не получавшие лечение. В ходе исследования установлено, что терапия деносумабом характеризуется более выраженным повышением МПК бедра по сравнению с терапией алендронатом13. В исcледовании STAND с участием пациенток с постменопаузальным остеопорозом и низким показателем МПК зафиксирован более высокий прирост МПК и снижение маркеров костной резорбции в группе, переведенной на деносумаб, по сравнению с группой, продолжавшей терапию алендронатом. Деносумаб и алендронат имели сходные профили безопасности14.
Проведено исследование фазы III по оценке эффективности перевода на деносумаб или ибандронат женщин в постменопаузе, ранее получавших субоптимальную ежедневную или еженедельную терапию бисфосфонатами. Основными конечными точками стали оценка безопасности терапии, процентное изменение МПК бедра, шейки бедра и поясничного отдела позвоночника к 12-му месяцу терапии, а также процентное изменение уровня маркеров костной резорбции через один и шесть месяцев от исходного15. Полученные данные подтвердили способность деносумаба быстро и выраженно тормозить костную резорбцию, а также значимо повышать уровень МПК во всех отделах скелета. По числу побочных эффектов группы практически не различались, за исключением случаев экземы, гиперчувствительности и желудочно-кишечных расстройств. В группе больных, принимавших деносумаб, их было больше.
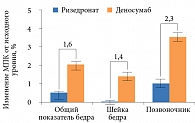
Другое сравнительное исследование фазы III, изучавшее эффективность перевода на деносумаб или ризедронат женщин в постменопаузе, недостаточно приверженных терапии алендронатом, продемонстрировало более выраженную положительную динамику МПК бедра, шейки бедра и поясничного отдела позвоночника к 12-му месяцу в группе деносумаба по сравнению с группой ризедроната (рис. 2)16.
Применение деносумаба в течение шести месяцев приводило к быстрому снижению маркеров резорбции костной ткани – в среднем на 60,6%.
Часто в случае неэффективности пероральных бисфосфонатов пациентов переводят на один из внутривенных бисфосфонатов, поскольку считается, что они имеют более высокую эффективность. В клинической практике наиболее широко используется золедроновая кислота.
Сравнение эффективности деносумаба и золедроновой кислоты проводилось в двойном слепом рандомизированном исследовании. В него были включены 643 пациентки с постменопаузальным остеопорозом, не менее двух лет получавшие пероральные бисфосфонаты. Участниц рандомизировали на две группы. Первая получала деносумаб в дозе 60 мг п/к один раз в шесть месяцев, вторая – золедроновую кислоту в дозе 5 мг в/в один раз в год. Через 12 месяцев прирост МПК был существенно выше в группе деносумаба. Снижение уровня C-телопептида в сыворотке крови и N-терминального пропептида проколлагена 1-го типа в группе деносумаба также было более значительным по сравнению с таковым в группе золедроновой кислоты. Частота побочных эффектов в обеих группах была аналогичной. Случаи остеонекроза нижней челюсти, гипокальциемии и задержки консолидации переломов не зарегистрированы. Зафиксировано три атипичных перелома бедра: два – в группе деносумаба, один – в группе золедроновой кислоты17.
Таким образом, деносумаб, представляющий собой моноклональное антитело RANKL, является мощным антирезорбтивным препаратом, ингибирующее действие которого на костную резорбцию приводит к повышению МПК во всех отделах скелета и снижению риска переломов.
Обратимость механизма действия обусловливает необходимость длительного, а возможно, постоянного применения. Эффективность препарата сохраняется высокой на протяжении всего периода применения при хорошем профиле безопасности.
Клинический опыт применения препарата Пролиа (деносумаб)
Под наблюдением находились 144 пациента, применявших препарат Пролиа от одного до четырех лет. Подавляющее число были женщины с постменопаузальным остеопорозом в возрасте 54–91 года – 98 пациентов, из них 73% с предшествующими переломами. Другая группа включала 27 женщин в постменопаузе и мужчин старше 50 лет с остеопорозом и первичным гиперпаратиреозом (ПГПТ). У семи из них – неуточненная топика, у пяти – рецидив мягкого течения после первой операции, у 15 – отказ от операции или противопоказания из-за сопутствующих заболеваний. Возраст пациентов – 63–92 года. Десять пациентов дополнительно получали цинакальцет. В отдельную группу больных вошли десять женщин в возрасте 54–75 лет с постменопаузальным остеопорозом, имевших в анамнезе эстрогензависимый рак молочной железы и получавших терапию ингибиторами ароматазы. Три из них ранее перенесли перелом. Наблюдали еще пять женщин в постменопаузе с переломами тел позвонков, которые принимали глюкокортикостероиды, и шесть мужчин в возрасте 76–92 лет с сенильным остеопорозом и предшествующими переломами.
У 45 из 144 больных в анамнезе – хроническая болезнь почек III–IV стадии – скорость клубочковой фильтрации (СКФ) 55–24 мл/мин/1,73 м2. Одна пациентка была на гемодиализе, два пациента с тяжелым остеопорозом – после аллотрансплантации почки.
У 90 пациентов в динамике измеряли уровень МПК, у всех больных – уровень кальция, креатинина, фосфора, щелочной фосфатазы.
Витамин D исходно измерен у 85 (60%) пациентов.
Уровень маркеров костной резорбции в динамике определяли у 93 (65%).
Деносумаб назначен как первичная терапия 15% больным, остальные в течение двух – восьми лет получали различные бисфосфонаты. Три пациентки принимали стронция ранелат, три – терипаратид.
Всем больным рекомендованы препараты витамина D, пациентам без ПГПТ – препараты кальция. При подтвержденном дефиците или недостатке витамина D до начала терапии деносумабом проводили их коррекцию. Гипокальциемии исходно ни у одного пациента не наблюдалось.
Анализ результатов лечения деносумабом продемонстрировал снижение маркеров костной резорбции в первые три – шесть месяцев практически у всех пациентов – от 0,353–0,96 до 0,09–0,01 нг/мл вне зависимости от диагноза, пола и возраста. Прирост МПК в позвонках составлял от 2,5 до 6,8% в год, в шейке бедра – от 1,8 до 3%. У пациентов с ПГПТ прирост МПК в лучевой кости на втором году лечения – от 1,3 до 2,1%. Не повысился уровень МПК у трех пациентов с глюкокортикостероидным остеопорозом, у пациентки на гемодиализе. При этом потери МПК у больных, принимавших глюкокортикостероиды, не зафиксировано.
Из всей выборки у одной пациентки с постменопаузальным остеопорозом через пять месяцев после первой инъекции деносумаба зарегистрирован перелом лучевой кости (падение на лед) и один хирургический перелом шейки плеча.
Снижения роста за время наблюдения не отмечалось.
Терапия деносумабом характеризовалась как безопасная и хорошо переносимая. Среди нежелательных явлений встречались кожные реакции у двух пациенток с постменопаузальным остеопорозом, что потребовало отмены лечения. У одной пациентки усилилась боль в костях и спине, которая послужила причиной отказа от второй инъекции препарата. Не захотел продолжать терапию после трех инъекций деносумаба и 92-летний пациент из-за боязни прогрессирования катаракты.
Гипокальциемия, в том числе у пациентов с хронической болезнью почек, снижение СКФ и повышение уровня креатинина не отмечены.
Далее профессор Л.Я. Рожинская провела разбор нескольких клинических случаев.
Клинический случай 1. Пациентка Т., 88 лет, обратилась с жалобами на боли в спине. Менопауза с 42 лет. В семейном анамнезе перелом бедра у отца в возрасте 82 лет. Остеопороз выявлен за десять лет до обращения, перелом лучевой кости в 70 лет, плечевой кости, компрессионные переломы тел позвонков в 75 лет установлены при обследовании. В 2006 г. МПК в L1–L4 – -3,5 СО по Т-критерию, шейке бедра – -3,0 СО. Больная получала лечение в течение трех лет алендронатом, далее в течение трех лет ибандронатом. В первые годы терапии отмечен прирост МПК до 4% в позвонках и до 2,5% в бедре. В 2012 г. зафиксировано снижение уровня витамина D до 10,6 нг/мл. Добавлен колекальциферол. В 2013 г. пациентка перенесла три падения и перелом левой лучевой кости. Результаты денситометрии показали отрицательную динамику уровня МПК. При дообследовании: кальций, фосфор, креатинин, щелочная фосфатаза, кальций в суточной моче – в норме, витамин D – 18,2 нг/мл, маркер костной резорбции – в норме, остеокальцин – 32,4 нг/мл. На рентгенограммах позвонков – снижение высоты Th12 до третьей степени.
Пациентке поставлен диагноз: постменопаузальный остеопороз, тяжелая форма с переломами тел позвонков, обеих лучевых костей, плечевой кости, отрицательная динамика на фоне терапии бисфосфонатами.
Был назначен колекальциферол 50 000 МЕ в неделю в течение шести недель, затем поддерживающая доза 15 000 МЕ в неделю, кальция карбонат – одна таблетка после ужина, Пролиа 60 мг п/к один раз в шесть месяцев.
Через три месяца после первой инъекции препарата Пролиа отмечено значительное снижение маркера костной резорбции – 0,08 нг/мл (на 78%), витамина D – 31 нг/мл, все остальные показатели в норме. На фоне лечения нежелательных явлений зафиксировано не было.
Через шесть месяцев от начала терапии пациентка отмечала улучшение общего состояния, отсутствие боли в спине, расширение двигательной активности. Через год сохранялись целевые значения витамина D, продолжилось снижение уровня маркеров костной резорбции. Прирост МПК в позвонках на 3,2%, в бедренной кости на 3,4%. Новых переломов, снижения роста не обнаружено. Через три года лечения новые переломы не выявлены, пациентка продолжает быть активной. МПК в позвонках +8,4%, в бедренной кости +4,7%. Рекомендовано продолжить лечение препаратом Пролиа, колекальциферолом 15 000 МЕ в неделю, Кальцемином Адванс по одной таблетке после ужина.
Клинический случай 2. Пациент Ш., 76 лет, жалуется на боли в тазобедренных суставах и слабость в ногах. В анамнезе: ишемическая болезнь сердца, нестабильная стенокардия, два стентирования коронарных артерий (1999 и 2012 гг.), артериальная гипертензия третьей степени. Распространенный спондилоартроз с выраженным вторичным корешковым синдромом, коксартроз. В 2011 г. диагностирован остеопороз без переломов, снижение уровня МПК до -2,8 СО по Т-критерию. В позвоночнике уменьшения МПК не зафиксировано, в лучевой кости – -3,6 СО.
При обследовании у больного выявлена гиперкальциемия 2,6–2,75 ммоль/л, повышение уровня паратгормона – 180 пг/мл, маркера костной резорбции и остеокальцина. При проведении ультразвукового исследования (УЗИ) – гиперплазия трех околощитовидных желез размером от 0,9 × 0,7 до 1,2 × 0,9 см, конкременты в почках до 0,6 см без клиники мочекаменной болезни. Пациенту поставлен диагноз: ПГПТ с гиперкальциемией, гиперкальциурия, гиперплазия трех околощитовидных желез, костно-висцеральная форма (остеопороз без переломов, нефролитиаз), мягкое течение. В 2011 г. назначено капельное вливание золедроновой кислоты в дозе 5 мг один раз в год. На фоне инъекций Акласты в декабре 2012 г. наблюдался прирост МПК в бедренной кости до 4%, в позвонках и лучевой кости изменения отсутствовали. В 2014 г. после трех лет лечения золедроновой кислотой зафиксирована отрицательная динамика уровня МПК в шейке бедра – -5,2%, лучевой кости – -2,4%. Через шесть месяцев после введения золедроновой кислоты снижения уровня маркеров костной резорбции не наблюдалось. Уровень кальция в крови сохранялся в пределах 2,68–2,71 ммоль/л. Уровень паратгормона – 208–230 пг/мл.
Было принято решение с марта 2014 г. назначить пациенту препарат Пролиа в дозе 60 мг п/к один раз в шесть месяцев. Больному сделано пять инъекций, последняя – в марте 2016 г.
В апреле 2016 г. проведено обследование: кальций – 2,55 ммоль/л (верхний предел нормы), паратгормон – 166 пг/мл, фосфор – 1,01 ммоль/л, маркер костной резорбции – 0,069 нг/мл, остеокальцин – 14 нг/мл, кальций в моче – 8 ммоль/сут, витамин D – в норме. Результаты денситометрии показали прирост МПК в позвоночнике на 8,4%, в шейке бедра на 4,6%, средней трети лучевой кости на 2,6%. УЗИ околощитовидных желез и почек – без отрицательной динамики. Пациент продолжает терапию деносумабом.
Клинический случай 3. Пациентка А., 58 лет. Активных жалоб нет. В 2011 г. проведена тиреоидэктомия, радиойодтерапия по поводу папиллярного рака щитовидной железы. До 2016 г. получала супрессивные дозы тиреоидных гормонов, затем заместительную терапию. В 2013 г. – правосторонняя мастэктомия, лучевая терапия с последующим применением ингибитора ароматазы Аримидекса. В январе 2014 г. у пациентки произошел низкотравматичный перелом левой лучевой кости.
Данные анализов в пределах нормы: кальций – 2,31 ммоль/л, витамин D – 17,1 нг/мл, креатинин – 55 мкмоль/л, кальций в моче – 3,69 ммоль/сут. Наблюдается незначительное повышение уровня бета-кросслапса (0,74 нг/мл), снижение уровня тиреотропного гормона (ТТГ) до 0,009 мЕд/л. Свободный тироксин – 16 пмоль/л, тиреоглобулин – 0,1 нг/мл.
По данным денситометрии: МПК L1–L4 – -3,2 СО, шейки бедра – -1,9 СО, правой лучевой кости (33% радиус) – -2,9 СО. Снижения роста не отмечено. На боковых рентгенограммах позвоночника не выявлено уменьшения высоты тел позвонков.
Больной поставлен диагноз: послеоперационный гипотиреоз, компенсация после тиреоидэктомии и радиойодтерапии по поводу рака щитовидной железы, состояние после правосторонней мастэктомии и лучевой терапии по поводу эстрогензависимого рака, терапии ингибиторами ароматазы. Остеопороз смешанного генеза без переломов с максимальным снижением уровня МПК в позвонках до -3,2 СО по Т-критерию, переломом лучевой кости, дефицит витамина D.
В данном клиническом случае факторами риска развития остеопороза и переломов стали низкая масса тела пациентки (рост 158 см, масса тела 53 кг), низкое потребление кальция, супрессивная терапия левотироксином и ингибиторами ароматазы.
С марта 2014 г. больной назначен препарат Пролиа в стандартной дозе один раз в шесть месяцев. Проведено шесть инъекций, последняя – в сентябре 2016 г. Рекомендованы также 1000 мг кальция ежедневно, 30 000 МЕ колекальциферола один раз в неделю (в дальнейшем доза снизилась до 5000 МЕ).
Результаты обследования после двух лет терапии деносумабом (май 2016 г.): уровень кальция, креатинина, витамина D в норме, маркеры костной резорбции сохраняются в пределах 0,06 нг/мл, ТТГ – 0,9 мЕд/л, паратгормона – 36,5 пг/мл. По данным денситометрии, значения МПК за два года терапии препаратом Пролиа в позвоночнике изменились с -3,2 до -2,7 СО, шейке бедра с -1,9 до -1,6 СО, в правой лучевой кости с -2,9 до -2,8 СО.
Известно, что в течение десятилетий тамоксифен являлся основным препаратом терапии рака молочной железы. На сегодняшний день в профилактике рецидива эстрогензависимого рака молочной железы доказана эффективность ингибиторов ароматазы18. Они все чаще включаются в стандартные схемы лечения рака молочной железы, поскольку обладают более благоприятным профилем безопасности по сравнению с тамоксифеном19. Однако их применение в период постменопаузы сопровождается повышением ремоделирования кости, что приводит к снижению МПК и увеличению частоты переломов. Поэтому в схему лечения таких больных должны добавляться остеомодифицирующие препараты. В ряде исследований доказана эффективность применения деносумаба для профилактики потери МПК и снижения риска переломов у пациентов, принимающих ингибиторы ароматазы в течение длительного времени20.
В конце выступления профессор Л.Я. Рожинская подчеркнула, что показаниями к применению препарата Пролиа (деносумаб) являются постменопаузальный остеопороз, сенильный остеопороз у мужчин, потеря костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и у мужчин, получающих гормондепривационную терапию.
Заключение
В составе препарата Пролиа – ингибитор резорбции костной ткани деносумаб. Деносумаб – полностью человеческое моноклональное антитело, высокоспецифичный ингибитор RANKL. Он подавляет образование, снижает функционирование и выживаемость остеокластов.
На фоне применения деносумаба уменьшается интенсивность костной резорбции.
На сегодняшний день получены данные об эффективности и безопасности длительного непрерывного применения деносумаба. Терапия деносумабом способствует увеличению уровня МПК не только в трабекулярной, но и в кортикальной кости. При этом положительная динамика отмечается рано и увеличивается с течением времени. Деносумаб подавляет маркеры костной резорбции. Стабильно пониженный их уровень сохраняется до полугода.
Препарат Пролиа предназначен для лечения постменопаузального остеопороза. Он также продемонстрировал эффективность в предупреждении переломов у мужчин, получавших андрогенную депривационную терапию по поводу рака предстательной железы. Кроме того, деносумаб снижает риск новых переломов тел позвонков у женщин, получающих лечение по поводу гормонально зависимого рака молочной железы без метастатического поражения скелета.
Препарат Пролиа хорошо переносится и безопасен.
