количество статей
6422
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Коррекция недостаточности витамина D
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Педиатрия" №1 (3)
- Аннотация
- Статья
- Ссылки
- English
Статья посвящена чрезвычайно актуальной в детской популяции проблеме дефицита витамина D. По данным многочисленных исследований, дефицит витамина D приводит к нарушению минерального и костного метаболизма и повышенному риску развития хронических заболеваний. Поскольку в современных условиях жизни в городе практически невозможно поддерживать статус витамина D на достаточном уровне за счет солнечного ультрафиолетового облучения и питания, необходимо восполнять дефицит витамина D и поддерживать его содержание на оптимальном уровне с помощью добавок витамина D к питанию не только у детей раннего возраста, но и детей старшего возраста, подростков и взрослых.
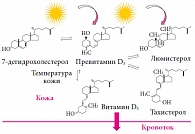
Рис. 1. Механизм образования витамина D
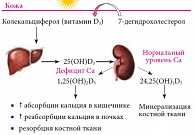
Рис. 2. Метаболизм витамина D
![Таблица 1. Нормы потребления витамина D в США [36]*](/upload/resize_cache/iblock/908/195_350_1/908da8c7096011740ba3d9fe2bce5d7a.jpg)
Таблица 1. Нормы потребления витамина D в США [36]*
![Таблица 2. Содержание витамина D в продуктах питания [38]](/upload/resize_cache/iblock/c36/195_350_1/c36b9c7f154c7a57436c026969c70065.jpg)
Таблица 2. Содержание витамина D в продуктах питания [38]
![Таблица 3. Препараты витамина D [9]](/upload/resize_cache/iblock/588/195_350_1/5889ca8d1b2be77a3043fd34903236dd.jpg)
Таблица 3. Препараты витамина D [9]
В работах A.F. Hess и L.J. Unger, опубликованных в 1921 г., был подтвержден положительный лечебный эффект воздействия солнечного света на детей, страдающих от рахита [5]. В 1930-х гг. был выделен эффективный для коррекции симптомов рахита экстракт из дрожжей, подвергнутых ультрафиолетовому облучению, обогащенный витамином D2. Поскольку данное производство не было высокозатратным, в Соединенных Штатах Америки и Европе витамин D2 стали широко использовать для обогащения пищевых продуктов, включая молоко и хлеб. В дальнейшем начали извлекать 7-дегидрохолестерин из ланолина овечьей шерсти и воздействовать на него ультрафиолетом для получения витамина D3, что также оказалось недорого. Витамином D3 стали фортифицировать многие продукты питания и пищевые добавки [1]. Но в начале 1950-х гг. произошел «всплеск» гиперкальциемии, в связи с чем в большинстве европейских стран запретили обогащение молока и молочных продуктов витамином D. В США и по сей день производится обогащение витамином D3 молока и апельсинового сока [6].
Предполагают, что существование витамина D в природе насчитывает как минимум полмиллиарда лет с момента его синтеза одноклеточными организмами океанического планктона под воздействием солнечного света. Однако значение витамина D в физиологии низших форм жизни, проживающих в воде, остается до сегодняшнего дня неизвестным. По-видимому, витамин D стал играть важную роль в метаболизме кальция в период выхода первых позвоночных организмов на сушу, когда появилась необходимость эффективно утилизировать менее доступный на суше кальций для минерализации скелета [7]. В продуктах растительного происхождения содержится эргокальциферол (витамин D2). Всасывание витамина D2 происходит в основном в двенадцатиперстной и тощей кишке в присутствии желчных кислот. Впоследствии он транспортируется лимфатической системой кишечника в составе хиломикронов [8]. Фотосинтез витамина D в коже осуществляется в несколько этапов. Когда излучение длиной волны 280–310 нм достигает поверхности кожи, около 10% его отражается, а 90% проникает в эпидермис и обеспечивает превращение 7-дегидрохолестерола (провитамина D3) в превитамин D3. Впоследствии превитамин D3 под влиянием температуры кожи превращается в витамин D3 (колекальциферол) (рис. 1) [9, 10].
Образовавшийся в коже и поступивший с хиломикронами лимфы из кишечника колекальциферол связывается со специфическим витамин-D-связывающим белком, осуществляющим его транспортировку к местам дальнейшего метаболизма. Часть витамина D транспортируется в жировую и мышечную ткани, где он фиксируется, представляя собой резервную форму. Основное же его количество переносится в печень, где происходит первый этап трансформации – гидроксилирование с образованием кальцидиола (25(ОН)D3). Образование кальцидиола катализирует 25-гидроксилаза, содержащаяся на внутренней мембране митохондрий печени. Образованный в печени 25-гидроксиколекальциферол переносится с помощью витамин-D-связывающего белка в почки, где в проксимальных извитых канальцах осуществляется второй этап его трансформации, приводящий к образованию гормонально активной формы витамина D кальцитриола (1,25(ОН)2D3) или альтернативного метаболита 24,25(ОН)2D3. В условиях дефицита кальция и фосфора в организме метаболизм 25(ОН)D3 идет по пути образования 1,25(ОН)2D3, основной эффект которого направлен на повышение сывороточной концентрации кальция путем усиления его всасывания из кишечника и реабсорбции в почках, а также посредством резорбции кальция из костей.
Процесс образования кальцитриола катализируется ферментом альфа-1-гидроксилазой, присутствующей в митохондриях клеток почечных канальцев. При нормальной или повышенной концентрации кальция и фосфора в сыворотке крови нарастает активность фермента 24-гидроксилазы, под действием которой образуется альтернативный метаболит 25(ОН)D3 – 24,25(ОН)2D3, обеспечивающий фиксацию кальция и фосфора в костной ткани (рис. 2). 25(OH)D является единственным метаболитом витамина D, который используется для определения его статуса в организме человека. 25(OH)D имеет период полураспада около 2–3 недель. Он включает в себя витамин D, полученный из продуктов питания, и витамин D, который вырабатывается в коже после пребывания на солнце [6, 11–13]. Несмотря на то что 1,25(OH)D3 является биологически активной формой витамина D и мог бы рассматриваться как идеальная мера для уточнения статуса витамина D, это не так. Сывороточное содержание 1,25(OH)2D не дает никакой информации о статусе витамина D в организме и часто является нормальным или даже повышенным вследствие вторичного гиперпаратиреоза, связанного с дефицитом витамина D. Наиболее актуальным подходом считается определение метаболита 25(ОН)D [1]. Как только снижается содержание витамина D в сыворотке крови, происходит уменьшение кишечной абсорбции кальция.
На этом фоне временно снижается количество ионизированного кальция в крови, что является сигналом для увеличения секреции паратиреоидного гормона (ПТГ). Последний регулирует метаболизм кальция за счет канальцевой реабсорбции кальция в почках, увеличения мобилизации кальция из костей скелета и увеличения почечного производства 1,25(OH)D. Таким образом, за счет увеличения уровня ПТГ уровень 1,25(OH)D будет нормальным или повышенным. Его концентрация не является информативной для достоверного определения статуса витамина D в организме человека. Кроме того, период полураспада 1,25(OH)D составляет 4–6 часов, а количество циркулирующих молекул данного метаболита в тысячу раз меньше, чем молекул 25(OH)D [14]. Определение уровня 1,25(OH)D представляется значимым лишь для диагностики ряда наследственных и приобретенных заболеваний, при которых могут происходить нарушения обмена кальция в почках (например, болезнь Де Тони – Дебре – Фанкони, почечный тубулярный ацидоз, витамин-D-резистентный рахит и др.), а также при хронической почечной недостаточности [15]. Определение уровня ПТГ в сыворотке крови является лишь косвенной характеристикой статуса витамина D в организме, поскольку у многих людей с низким уровнем витамина D не всегда отмечается заметное увеличение ПТГ.
Последний важен для проведения оценки костного метаболизма у пациентов с хронической почечной недостаточностью и для контроля фармакологического лечения остеопороза [16]. Большинство экспертов, изучающих влияние витамина D на обменные процессы в организме, сходятся во мнении о том, что при дефиците 25(OH)D его содержание в сыворотке крови составляет менее 20 нг/мл, при недостаточности – в пределах 21–29 нг/мл. Целевая концентрация витамина D в сыворотке крови как детей, так и взрослых должна соответствовать уровню более 30 нг/мл для обеспечения всех положительных влияний этого витамина на организм человека [6, 17]. На основании литературных данных избыточным считается уровень витамина D в крови выше 150–200 нг/мл. Интоксикация проявляется развитием гиперкальциемии, гиперкальциурии и часто гиперфосфатемии [18, 19]. К клиническим признакам дефицита витамина D относятся:
- увеличенный риск возникновения переломов из-за снижения костной массы и уменьшения всасывания кальция из кишечника с 30–40% до 10–15%;
- рахит у детей;
- остеомаляция и остеопороз;
- снижение иммунной функции (большая восприимчивость к инфекциям и пролонгация времени болезненных состояний) [20].
- замедляется рост;
- изменяется форма черепа и поздно закрывается большой родничок;
- запаздывает появление зубов, эмаль которых в большей степени подвержена повреждению кариесом, чем у здоровых детей;
- формируются искривления позвоночника (сколиоз) и деформации грудной клетки;
- искривляются ножки и возникает плоскостопие;
- развивается плоский таз, что особенно актуально для девочек, поскольку из-за такой анатомической особенности у женщины роды через естественные родовые пути могут оказаться невозможными.
- появление необоснованного беспокойства ребенка, раздражительности, пугливости (часто просыпается по ночам, вздрагивает);
- повышенная потливость во время кормлений и сна (просыпается на мокрой подушке), вследствие чего становится заметен «вытертый» затылок из-за раздражающего воздействия пота на кожу головы [9].
I стадия:
- снижается уровень 25(OH)D, что приводит к гипокальциемии и эуфосфатемии;
- уровень 1,25(OH)2D может увеличиться или остаться неизменным;
- уровень 25(OH)D продолжает снижаться;
- для поддержания уровня кальция в крови повышается уровень ПТГ и инициирует процесс деминерализации костей;
- возникают эукальциемия и гипофосфатемия, незначительно возрастает уровень костной фракции щелочной фосфатазы;
- тяжелый дефицит 25(OH)D с гипокальциемией, гипофосфатемией и повышением уровня щелочной фосфатазы [20].
Рекомендованное нормативное потребление витамина D различается между странами Европы и варьирует в диапазоне от 0 до 600 МЕ для различных групп населения [33]. Например, по данным Европейского Союза по нормам суточного потребления основных питательных веществ (Директива 2008/100/EC), потребность человека в витамине D составляет 200 МЕ [34]. В России, согласно методическим рекомендациям «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации» (2008), физиологическая потребность в витамине D для детей и взрослых для обеспечения костных эффектов составляет 400 МЕ/сут, для людей старше 60 лет – 600 МЕ/сут [35]. Значения рекомендуемой диетической дотации для витамина D, приведенные в таком документе, как «Нормы потребления» (Dietary Reference Intakes – DRIs), разработанном отделом по пищевым продуктам и питанию (Food and Nutrition Board, FNB) Института медицины Национальной академии (National Academies) США (2010 г.), выше, чем в России [36] (табл. 1).
Потребность ребенка первого года жизни в витамине D составляет 400 МЕ/сут. Детям, находящимся на грудном вскармливании, необходимо осуществлять дотацию витамина D в дозе 400 МЕ/сут с 4–5-недельного возраста. Если малыш находится на искусственном вскармливании и получает ≥ 1000 мл/сут смеси, обогащенной витамином D с содержанием не менее 400 МЕ (дети второго полугодия жизни), то витамин D дополнительно не вводится. В случае если ребенок получает < 1000 мл/сут смеси (дети первого полугодия жизни), то витамин D добавляют в дозе 400 МЕ/сут [36]. Очень немногие продукты по своей природе содержат витамин D. Одним из наиболее богатых источников является жирная рыба (лосось, тунец, скумбрия) [36, 37]. Небольшое количество витамина D содержится в говяжьей печени, сыре и яичных желтках (табл. 2) [38]. Витамин D в этих продуктах представлен в форме метаболита 25(OH)D3 [39]. В переменных количествах витамин D2 содержится в грибах [40, 41]. На рынке также существуют продукты питания, обогащенные витамином D (молоко, йогурты, детское питание). Продукты, обеспечивающие 20% или более от дневной нормы витамина D, считаются источниками питательных веществ с высоким его содержанием [37]. Ультрафиолетовое (УФ) излучение с длиной волны 290–320 нм проникает через кожу и преобразует 7-дегидрохолестерин в провитамин D3, который, в свою очередь, становится витамином D3 [36]. На синтез витамина D влияют следующие факторы:
- время года;
- время суток;
- продолжительность светового дня;
- наличие облачности, смога;
- содержание в коже меланина;
- использование солнцезащитных кремов [36].
Существует две формы добавок витамина D в витаминизированных продуктах: D2 (эргокальциферол) и D3 (колекальциферол), которые отличаются по химической структуре. Витамин D2 производится с помощью УФ-облучения эргостерина в дрожжевых грибах, а витамин D3 – путем облучения 7-дегидрохолестерина ланолина [45]. Витамины D2 и D3 традиционно считаются эквивалентными, поскольку большинство механизмов и действий данных форм идентичны и способны оказать терапевтический эффект при рахите. Витамин D из продуктов питания и как результат кожного синтеза способствует эффективному повышению концентрации метаболита 25(OH)D в сыворотке крови [48]. В настоящее время для профилактики и лечения рахита используются 2 препарата витамина D (табл. 3) [9]. Следует отметить, что существующие масляные формы препарата не всегда хорошо всасываются, особенно у недоношенных детей с незрелой пищеварительной системой, а также при наличии у ребенка следующих сопутствующих заболеваний желудочно-кишечного тракта, характеризующихся сниженной способностью к усвоению жиров:
- синдром нарушенного кишечного всасывания в тонкой кишке (пищевая аллергия, экссудативная энтеропатия, целиакия);
- панкреатит;
- муковисцидоз;
- болезнь Крона, неспецифический язвенный колит и др.
У детей с фосфат-диабетом уменьшение клинических признаков заболевания отмечено в 16,6% случаев [49]. В исследовании О.В. Чугуновой и соавт. (2002) была доказана целесообразность применения Аквадетрима в терапии рахита средней степени тяжести у 68 детей первого года жизни. На фоне применения препарата отмечалась значительная положительная динамика как клинических симптомов рахита (сроки прорезывания зубов, исчезновение краниотабеса, нормализация мышечного тонуса, устранение слабости связочного аппарата), так и лабораторных показателей (нормализация параметров фосфорно-кальциевого обмена). Нежелательных реакций на препарат в ходе исследования выявлено не было [50]. Противопоказанием к назначению профилактической дозы витамина D является идиопатическая кальциурия (болезнь Вильямса – Бурне). Органическое поражение центральной нервной системы с симптомами краниостеноза является относительным противопоказанием, особенно при необходимости проведения этим детям противосудорожной терапии, которая способствует развитию остеопении. Дети с малыми размерами большого родничка не имеют противопоказаний к профилактическому назначению витамина D, если сохраняются возрастные темпы роста окружности головы [9].
В целях терапии в настоящее время рекомендуются умеренные лечебные дозы витамина D, не превышающие 2000–5000 МЕ в сутки, которые назначаются на срок 4–6 недель в соответствии со степенью тяжести процесса. Лечебные дозы витамина D показаны детям с клиникой активного рахита. После достижения терапевтического эффекта лечебную дозу витамина D заменяют профилактической (500–1500 МЕ/сут). В период остаточных изменений целесообразным является назначение адекватных профилактических доз витамина в комплексе с обеспечением ребенка рациональным питанием, проведением массажа, лечебной физкультуры для нормализации мышечного тонуса и максимального устранения развившихся костных изменений [51]. Скрининг и ликвидация дефицита витамина D у детей и подростков смогут улучшить состояние здоровья костной системы и снизить риск развития хронических заболеваний. В настоящее время повышенное внимание и интерес со стороны педиатров и других специалистов к витамину D у детей являются вполне оправданными. Рекомендации увеличивать время активного отдыха на свежем воздухе и принимать добавки витамина D смогут улучшить здоровье как детского, так и взрослого населения.
1. Holick M.F. Vitamin D status: measurement, interpretation, and clinical application // Ann. Epidemiol. 2009. Vol. 19. № 2. P. 73–78.
2. Shin Y.H., Shin H.J., Lee Y.J. Vitamin D status and childhood health // Korean J. Pediatr. 2013. Vol. 56. № 10. P. 417–423.
3. Holick M.F. Resurrection of vitamin D deficiency and rickets // J. Clin. Invest. 2006. Vol. 116. № 8. P. 2062–2072.
4. Huldschinsky K. Heilung von Rachitis durch Kunstliche Hohensonne // Deutsche Med. Wochenschr. 1919. Vol. 45. Р. 712–713.
5. Hess A.F., Unger L.J. The cure of infantile rickets by sunlight // JAMA. 1921. Vol. 77. Р. 39–41.
6. Holick M.F. High prevalence of vitamin D inadequacy and implications for health // Mayo Clin. Proc. 2006. Vol. 81. № 3. P. 353–373.
7. Holick M.F. Phylogentic and evolutionary aspects of vitamin D from phytoplankton to human / Ed. by P.K.T. Pang, M.P. Schreibman. Vertebrate endocrinology: fundamentals and biomedical implications. Florida: Academic Press, 1989. P. 7–43.
8. Новиков П.В. Рахит и наследственные рахитоподобные заболевания у детей. М.: Триада-Х, 2006. 336 c.
9. Захарова И.Н., Коровина Н.А., Боровик Т.Э., Дмитриева Ю.А. Рахит и гиповитаминоз D – новый взгляд на давно существующую проблему. Пособие для врачей. М., 2011. 96 с.
10. Захарова И.Н., Яблочкова С.В., Дмитриева Ю.А. Известные и неизвестные эффекты витамина D // Вопросы современной педиатрии. 2013. Т. 12. № 2. С. 20–25.
11. Bouillon R. Vitamin D: from photosynthesis, metabolism, and action to clinical applications // Endocrinology / Ed. by L.J. de Groot, J.L. Jameson. Philadelphia: WB Saunders, 2001. Р. 1009–1028.
12. Bischoff-Ferrari H.A., Giovannucci E., Willett W.C. et al. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes // Am. J. Clin. Nutr. 2006. Vol. 84. № 1. P. 18–28.
13. Захарова И.Н., Коровина Н.А., Дмитриева Ю.А. Роль метаболитов витамина D при рахите у детей // Педиатрия. 2010. Т. 89. № 3. С. 68–73.
14. Brown E.M., Gamba G., Riccardi D. et al. Cloning and characterization of an extracellular Ca(2+)-sensing receptor from bovine parathyroid // Nature. 1993. Vol. 366. № 6455. P. 575–580.
15. Holick M.F., Garabedian M. Vitamin D: photobiology, metabolism, mechanism of action, and clinical applications // Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism / Ed. by M.J. Favus. Sixth edition. Chapter 17. Washington, DC: American Society for Bone and Mineral Research, 2006. Р. 129–137.
16. Sahota O., Mundey M.K., San P. et al. The relationship between vitamin D and parathyroid hormone: calcium homeostasis, bone turnover, and bone mineral density in postmenopausal women with established osteoporosis // Bone. 2004. Vol. 35. № 1. P. 312–319.
17. Bischoff-Ferrari H.A., Giovannucci E., Willett W.C. et al. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes // Am. J. Clin. Nutr. 2006. Vol. 84. № 1. P. 18–28.
18. Adams J.S., Lee G. Gains in bone mineral density with resolution of vitamin D intoxication // Ann. Intern. Med. 1997. Vol. 127. № 3. P. 203–206.
19. Koutkia P., Chen T.C., Holick M.F. Vitamin D intoxication associated with an over-the-counter supplement // N. Engl. J. Med. 2001. Vol. 345. № 1. P. 66–67.
20. Wagner C.L., Greer F.R.; American Academy of Pediatrics Section on Breastfeeding; American Academy of Pediatrics Committee on Nutrition. Prevention of rickets and vitamin D deficiency in infants, children, and adolescents // Pediatrics. 2008. Vol. 122. № 5. P. 1142–1152.
21. Дмитриева Ю.А. Факторы риска и особенности течения рахита у детей раннего возраста в современных условиях: автореф. дис. … канд. мед. наук. М., 2011. 24 с.
22. Madden K., Feldman H.A., Smith E.M. et al. Vitamin D deficiency in critically ill children // Pediatrics. 2012. Vol. 130. № 3. P. 421–428.
23. Harel Z., Flanagan P., Forcier M., Harel D. Low vitamin D status among obese adolescents: prevalence and response to treatment // J. Adolesc. Health. 2011. Vol. 48. № 5. P. 448–452.
24. Ganji V., Zhang X., Shaikh N., Tangpricha V. Serum 25-hydroxyvitamin D concentrations are associated with prevalence of metabolic syndrome and various cardiometabolic risk factors in US children and adolescents based on assay-adjusted serum 25-hydroxyvitamin D data from NHANES 2001-2006 // Am. J. Clin. Nutr. 2011. Vol. 94. № 1. P. 225–233.
25. Shin Y.H., Kim K.E., Lee C. et al. High prevalence of vitamin D insufficiency or deficiency in young adolescents in Korea // Eur. J. Pediatr. 2012. Vol. 171. № 10. P. 1475–1480.
26. Brehm J.M., Acosta-Pérez E., Klei L. et al. Vitamin D insufficiency and severe asthma exacerbations in Puerto Rican children // Am. J. Respir. Crit. Care Med. 2012. Vol. 186. № 2. P. 140–146.
27. Sharief S., Jariwala S., Kumar J. et al. Vitamin D levels and food and environmental allergies in the United States: results from the National Health and Nutrition Examination Survey 2005-2006 // J. Allergy Clin. Immunol. 2011. Vol. 127. № 5. P. 1195–1202.
28. Holick M.F. Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis // Am. J. Clin. Nutr. 2004. Vol. 79. № 3. P. 362–371.
29. Jenab M., Bueno-de-Mesquita H.B., Ferrari P. et al. Association between pre-diagnostic circulating vitamin D concentration and risk of colorectal cancer in European populations: a nested case-control study // BMJ. 2010. Vol. 340. P. b5500.
30. Giovannucci E., Liu Y., Rimm E.B. et al. Prospective study of predictors of vitamin D status and cancer incidence and mortality in men // J. Natl. Cancer Inst. 2006. Vol. 98. № 7. P. 451–459.
31. Camurdan O.M., Döğer E., Bideci A. et al. Vitamin D status in children with Hashimoto thyroiditis // J. Pediatr. Endocrinol. Metab. 2012. Vol. 25. № 5–6. P. 467–470.
32. Temmerman J.C. Vitamin D and cardiovascular disease // J. Am. Coll. Nutr. 2011. Vol. 30. № 3. P. 167–170.
33. Doets E.L., de Wit L.S., Dhonukshe-Rutten R.A. et al. Current micronutrient recommendations in Europe: towards understanding their differences and similarities // Eur. J. Nutr. 2008. Vol. 47. Suppl. 1. P. 17–40.
34. Recommended Daily Allowance (RDA) according to the EC Nutrition Labelling Directive 2008/100/EC.
35. Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации. Методические рекомендации. МР 2.3.1.2432-08 (от 18 декабря 2008 г.). 41 с.
36. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: National Academy Press, 2010.
37. U.S. Department of Agriculture, Agricultural Research Service. 2011. USDA National Nutrient Database for Standard Reference, Release 24. http://www.ars.usda.gov/ba/bhnrc/ndl.
38. Лесняк О.М., Беневоленская Л.И. Остеопороз / под ред. О.М. Лесняк, Л.И. Беневоленской. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2009. 272 с.
39. Ovesen L., Brot C., Jakobsen J. Food contents and biological activity of 25-hydroxyvitamin D: a vitamin D metabolite to be reckoned with? // Ann. Nutr. Metab. 2003. Vol. 47. № 3–4. P. 107–113.
40. Mattila P.H., Piironen V.I., Uusi-Rauva E.J., Koivistoinen P.E. Vitamin D contents in edible mushrooms // J. Agric. Food Chem. 1994. Vol. 42. P. 2449–2453.
41. Calvo M.S., Whiting S.J., Barton C.N. Vitamin D fortification in the United States and Canada: current status and data needs // Am. J. Clin. Nutr. 2004. Vol. 80. № 6. Suppl. P. 1710S–1716S.
42. Wharton B., Bishop N. Rickets // Lancet. 2003. Vol. 362. № 9393. P. 1389–1400.
43. Holick M.F. Photobiology of vitamin D // Vitamin D / Ed. by D. Feldman, J.W. Pike, F.H. Glorieux. Second edition. Vol. I. Burlington, MA: Elsevier, 2005.
44. Wolpowitz D., Gilchrest B.A. The vitamin D questions: how much do you need and how should you get it? // J. Am. Acad. Dermatol. 2006. Vol. 54. № 2. P. 301–317.
45. Holick M.F. Vitamin D deficiency // N. Engl. J. Med. 2007. Vol. 357. № 3. P. 266–281.
46. Holick M.F. Vitamin D: the underappreciated D-lightful hormone that is important for skeletal and cellular health // Curr. Opin. Endocrinol. Diabetes. 2002. Vol. 9. P. 87–98.
47. International Agency for Research on Cancer Working Group on artificial ultraviolet (UV) light and skin cancer. The association of use of sunbeds with cutaneous malignant melanoma and other skin cancers: A systematic review // Int. J. Cancer. 2007. Vol. 120. № 5. P. 1116–1122.
48. Cranney C., Horsely T., O’Donnell S. et al. Effectiveness and safety of vitamin D. Evidence Report/Technology Assessment No. 158 prepared by the University of Ottawa Evidence-based Practice Center under Contract No. 290-02.0021. AHRQ Publication No. 07-E013. Rockville, MD: Agency for Healthcare Research and Quality, 2007.
49. Новиков П.В., Кази-Ахметов Е.А., Сафонов А.В. Новая (водорастворимая) форма витамина D3 для лечения детей с витамин-D-дефицитным и наследственным витамин-D-резистентным рахитом // Российский вестник перинатологии и педиатрии. 1997. № 6. С. 45–48.
50. Романюк Ф.П., Алферов В.П., Колмо Е.А., Чугунова О.В. Рахит (пособие для врачей). СПб., 2002. 64 с.
51. Захарова И.Н., Коровина Н.А., Дмитриева Ю.А. Профилактика и лечение рахита у детей раннего возраста // Медицинский совет. 2012. № 5. С. 70–80.
Treatment of vitamin D deficiency
I.N. Zakharova,
I.N. Zakharova,
S.V. Vasilyeva,
Yu.A. Dmitriyeva,
М.V. Mozzhukhina,
Ye.A. Yevseyeva
State Budgetary Educational Institution for Continuing Professional Education Russian Medical Academy of Postgraduate Education of the Ministry of Health of Russia
Contact person: Irina Nikolayevna Zakharova, zakharova-rmapo@yandex.ru
The article addresses vitamin D deficiency – a highly prevalent problem among children nowadays. Numerous studies have demonstrated negative effects of vitamin D deficiency on mineral and bone metabolism and lifelong risk of chronic diseases. In an urban setting, solar UV radiation and dietary supply are usually unable to cover the requirements in vitamin D. Thus, to correct vitamin D deficiency and maintain optimal vitamin D status, vitamin D supplementation is recommended not only in infants but also in older children, adolescents and adults.
Key words: children, vitamin D status, symptoms of vitamin D deficiency, prevention and treatment of vitamin D deficiency
State Budgetary Educational Institution for Continuing Professional Education Russian Medical Academy of Postgraduate Education of the Ministry of Health of Russia
Contact person: Irina Nikolayevna Zakharova, zakharova-rmapo@yandex.ru
The article addresses vitamin D deficiency – a highly prevalent problem among children nowadays. Numerous studies have demonstrated negative effects of vitamin D deficiency on mineral and bone metabolism and lifelong risk of chronic diseases. In an urban setting, solar UV radiation and dietary supply are usually unable to cover the requirements in vitamin D. Thus, to correct vitamin D deficiency and maintain optimal vitamin D status, vitamin D supplementation is recommended not only in infants but also in older children, adolescents and adults.
Key words: children, vitamin D status, symptoms of vitamin D deficiency, prevention and treatment of vitamin D deficiency
Новости на тему
13.09.2022 01:00:00
29.06.2022 01:00:00
СТАТЬИ по теме
СТАТЬИ этих авторов
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
