Мнение эндокринолога и офтальмолога о проблеме микрососудистых осложнений у пациентов с сахарным диабетом
- Аннотация
- Статья
- Ссылки

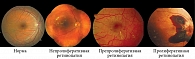
Какое поражение глаз считается диабетической ретинопатией?
Согласно Алгоритмам специализированной медицинской помощи больным сахарным диабетом 2019 г.1, диабетическая ретинопатия (ДР) – микрососудистое осложнение сахарного диабета (СД), характеризующееся поражением сетчатки в результате ишемии, повышения проницаемости и эндотелиальной дисфункции сосудов.
В настоящее время, согласно классификации ДР, принятой общероссийской общественной организацией «Ассоциация врачей-офтальмологов» в 2019 г. для применения в амбулаторной практике, выделяют три стадии заболевания (таблица, рис. 1).
В специализированных диабетологических центрах и отделениях лазерной микрохирургии глаза, а также в научных и клинических исследованиях используется самая полная на сегодняшний день классификация ETDRS 1991 г.2
Как часто встречается диабетическая ретинопатия при сахарном диабете 1 и 2 типов?
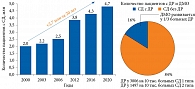
По частоте встречаемости ДР занимает второе место среди осложнений СД. При этом ее распространенность одинакова у страдающих СД 1 и 2 типов3, 4. Согласно данным федерального регистра СД, в 2020 г. у 749 тыс. пациентов с СД имела место ДР (рис. 2)3, из них у 230 тыс. – диабетический макулярный отек (ДМО).
Диабетические поражения сетчатки (пролиферативная ретинопатия и макулярный отек) являются основной причиной слепоты среди лиц трудоспособного возраста в экономически развитых странах и третьей по значимости причиной снижения зрения у лиц старше 65 лет (после возрастной макулярной дегенерации и глаукомы).
При длительности СД более 15 лет примерно 2% больных становятся слепыми, 10% – слабовидящими5, 6.
Можно ли назвать данное осложнение поздним?
Очень часто именно офтальмологи первыми диагностируют СД у пациентов при осмотре глазного дна. Данное осложнение может быть первым клиническим проявлением нарушения углеводного обмена и даже предшествовать постановке диагноза СД 2 типа. У пациентов с СД 1 типа данное осложнение формируется, как правило, гораздо позже постановки диагноза.
Согласно статистике, у трети пациентов с ДР формируется ДМО4. Диабетический макулярный отек может возникнуть на любой стадии ДР, а также носить транзиторный характер.
Диабетический макулярный отек – утолщение сетчатки, связанное с накоплением жидкости в межклеточном пространстве вследствие нарушения гематоретинального барьера и несоответствия между выходом жидкости и способности к ее реабсорбции клетками пигментного эпителия1. С точки зрения офтальмолога правильнее было бы говорить о диабетической ангиоретинопатии. Диабетическая ангиопатия является начальной стадией микрососудистого поражения сетчатки при СД. На этой стадии офтальмологические жалобы отсутствуют. Заболевание диагностируется при первичных или профилактических осмотрах и является важным предиктором развития патологических процессов в сетчатке, приводящих к ангиоретинопатии. Таким образом, диабетическая ангиоретинопатия – специфичное позднее микрососудистое осложнение СД, развивающееся, как правило, последовательно – от изменений, связанных с повышенной проницаемостью и окклюзией ретинальных сосудов, до появления новых сосудов и фиброглиальной ткани. Она является одним из проявлений генерализованной микроангиопатии7.
Что способствует формированию диабетической ретинопатии?
С позиции эндокринологов, ведущим фактором развития эндотелиальной дисфункции, которая в свою очередь лежит в основе формирования ДР, является вариабельность гликемии. При оценке маркеров оксидативного стресса (8-iso-PGF2a) установлена их корреляция с вариабельностью глюкозы, чего не наблюдалось при стойкой гипергликемии8–10. На фоне стойкой гипергликемии происходит апоптоз эндотелиальных клеток, после чего активируются факторы роста. При колебаниях гликемии в экспериментальных условиях от 5,0 до 20,0 ммоль/л в течение 14 дней апоптоз отмечался в 2,5 раза чаще11. Таким образом, быстрое снижение и нормализация гликемии может привести к формированию транзиторного макулярного отека.
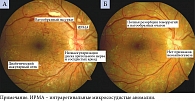
По мнению офтальмологов, в основе патогенеза ДР лежит ишемия вследствие окклюзии капилляров сетчатки. Причиной нарушения перфузии сетчатки признано поражение эндотелия сосудов (эндотелиальный стресс), возникающее из-за резкого усиления ретинального кровотока в условиях гипергликемии и приводящее к образованию тромбов в капиллярном русле. Открытие шунтов (интраретинальных микрососудистых аномалий) в ответ на значительное снижение кровоснабжения лишь усугубляет ситуацию, поскольку перераспределяет кровоток в обход неперфузируемой сетчатки. Повреждение эндотелия, усиление агрегации тромбоцитов и активация факторов коагуляции способствуют окклюзии капилляров. Важная роль в этом процессе принадлежит свободным радикалам, которые оказывают повреждающее воздействие на эндотелиальные клетки. Увеличение площади ишемии приводит к повышению экспрессии фактора роста эндотелия сосудов (vascular endothelial growth factor – VEGF). Выработка VEGF выше критического уровня ассоциируется с развитием основных клинических проявлений диабетического поражения сетчатки – макулярного отека и неоваскуляризации. Воздействуя на эндотелиальные белки плотных межклеточных контактов, VEGF увеличивает сосудистую проницаемость. Это в свою очередь усиливает экссудацию и накопление экстрацеллюлярной жидкости и белков в ткани сетчатки. Жидкость, которая проходит через стенку капилляров, в норме реабсорбируется пигментным эпителием (наружный гематоретинальный барьер) и соседними капиллярами сетчатки. Когда диффузия превышает потенциальные возможности пигментного эпителия и капилляров к реабсорбции жидкости, появляются клинические признаки макулярного отека.
Изменения в экстрацеллюлярном матриксе, обеспечивающие миграцию эндотелиальных клеток, повышенная экспрессия VEGF, разрушение контактов между эндотелиальными клетками способствуют появлению новообразованных сосудов, которые растут по задней поверхности стекловидного тела. Стенка новообразованного сосуда неполноценна, что приводит к выходу за его пределы как компонентов плазмы, так и цельной крови. Это стимулирует разрастание соединительной ткани в зонах неоваскуляризации. Поскольку соединительная ткань всегда стремится к сокращению, а адгезия фиброваскулярного конгломерата к задней поверхности стекловидного тела очень плотная, развивается отслойка стекловидного тела. Как правило, в этот момент происходит разрыв новообразованного сосуда с развитием преретинальных (перед поверхностью сетчатки) или витреальных (в полость стекловидного тела) кровоизлияний. Рецидивирующие кровоизлияния и происходящее вследствие этого рубцевание задних отделов стекловидного тела приводят к образованию патологических витреоретинальных сращений, которые могут вызвать тракционную отслойку сетчатки12–14.
В 2016 г. были опубликованы данные, подтверждающие влияние вариабельности гликемии на состояние глазного дна, формирование ДР у беременных с СД 1 типа. Использование помповой инсулинотерапии с суточным мониторингом гликемии и исключением значимых ее колебаний в течение суток привело к снижению прогрессирования ДР с 13 до 4%15.
Что такое диабетический макулярный отек с точки зрения офтальмологов?
В современной классификации дано определение диабетической макулопатии и выделены две ее формы.
Отечная макулопатия, или диабетический макулярный отек, связана с локальной диффузией жидкости из микроаневризм или измененных сосудов и характеризуется утратой фовеолярного рефлекса, утолщением сетчатки в макулярной зоне, отложением твердых экссудатов. Длительно существующий макулярный отек может привести к кистозному изменению сетчатки с формированием прозрачных микрокист.
Ишемическая макулопатия связана с резким нарушением кровотока в центральных отделах сетчатки и проявляется ишемическими тонкими отеками16, 17.
Как офтальмологи могут помочь в диагностике заболевания эндокринологам?
Эндокринологи – это боги гормонов и конечно же самостоятельно не могут оценить состояние глазного дна, именно поэтому для правильной оценки ситуации им необходима помощь офтальмологов. На этом сделан акцент в Алгоритмах специализированной медицинской помощи больным сахарным диабетом 2019 г.1 Кроме того, в документе определена частота консультаций специалистов в зависимости от длительности СД и клинических проявлений. Показания для направления пациентов в специализированные центры на консультацию к офтальмологу следующие:
- жалобы на снижение остроты зрения;
- острота зрения ниже 0,5 (6/12, 20/40);
- проверка остроты зрения или обследование сетчатки не могут быть выполнены при скрининговом обследовании;
- повторное полное офтальмологическое обследование после лазерной коагуляции сетчатки.
Существует ли корреляция между ретинопатией и другим микрососудистым осложнением СД, в частности нефропатией?
Еще в 2002 г. были опубликованы данные, подтверждающие, что ДР является значимым независимым предиктором прогрессирования микро- или макроальбуминурии18, 19. Дальнейшие исследования показали четкую связь ДР со снижением скорости клубочковой фильтрации. Так, тяжесть ДР на исходном уровне позволяла определить темп снижения расчетной скорости клубочковой фильтрации20, 21.
С учетом сказанного представляется немаловажным потенциальный вклад сахароснижающих препаратов в профилактику и замедление микрососудистых осложнений СД.
Каковы основные направления терапии диабетической ретинопатии?
В задачи эндокринологов входит своевременная коррекция сахароснижающей терапии для достижения компенсации углеводного обмена и уменьшения вариабельности гликемии в течение суток. В целях профилактики развития и прогрессирования ДР необходимо поддержание не только индивидуальных целевых уровней гликемического контроля, но и артериального давления, липидов плазмы. Кроме того, эндокринологи должны мотивировать пациентов к наблюдению у офтальмологов, информировать их о необходимости осмотров с расширенным зрачком не реже одного раза в год, при наличии показаний – даже чаще, вне зависимости от отсутствия жалоб на зрение. В реальной клинической практике часто приходится сталкиваться с мнением пациентов о том, что консультация офтальмолога нужна только при ухудшении остроты зрения. Такая позиция может привести к необратимым последствиям – слепоте и инвалидизации в ее итоге.
Состояние пациентов необходимо оценивать в динамике. При появлении новых жалоб со стороны органа зрения или снижении остроты зрения показано безотлагательное обращение к офтальмологу.
Несмотря на отсутствие данных исследований наивысшего уровня доказательности относительно эффективности при ДР и ДМО, возможно применение ангиопротекторов и корректоров микроциркуляции, антиоксидантов и антигипоксантов, фенофибрата и др.14, 22, 23
При препролиферативной и пролиферативной ДР необходимо проведение панретинальной лазерной коагуляции24. Как правило, стандартная панретинальная лазерная коагуляция осуществляется за несколько сеансов. Сеансы панретинальной лазерной коагуляции могут проводиться как в стационарных, так и в амбулаторных условиях под инстилляционной анестезией, при максимальном медикаментозном мидриазе.
Лазерную коагуляцию обычно начинают с нижних отделов средней периферии, так как эти зоны могут стать недоступными в случае кровоизлияния в стекловидное тело. Лазерное воздействие продолжают с носовой стороны от диска зрительного нерва, на верхней периферии и завершают в области височной периферии. Коагуляты наносят на всю поверхность средней периферии глазного дна от височных сосудистых аркад. При наличии пролиферативной ДР с неоваскуляризацией радужки и/или угла передней камеры необходимо коагулировать также крайние периферические отделы сетчатки. Показанием к незамедлительному проведению панретинальной лазерной коагуляции является пролиферативная ДР в сочетании с наличием факторов высокого риска снижения зрения. К таковым относят:
- препапиллярные новообразованные сосуды, размер которых превышает или равен 1/4–1/3 площади диска зрительного нерва;
- препапиллярные новообразованные сосуды любого размера в сочетании с интравитреальным или преретинальным кровоизлиянием;
- преретинальные новообразованные сосуды, размер которых превышает 1/2 площади диска, в сочетании с интравитреальным или преретинальным кровоизлиянием.
Уровень гликированного гемоглобина более 10% в сочетании с пролиферативной ДР требует проведения панретинальной лазерной коагуляции не дожидаясь существенного улучшения контроля гликемии25–28.
При наличии ДМО зарубежные и российские эксперты рекомендуют в качестве препаратов первой линии использовать интравитреальные инъекции ингибиторов ангиогенеза29–32.
В Российской Федерации зарегистрированы два анти-VEGF-препарата для терапии ДМО – афлиберцепт и ранибизумаб33, 34. Клинический пример успешного лечения ДМО по протоколу (пять загрузочных интравитреальных инъекций афлиберцепта в дозе 2 мг каждые четыре недели) представлен на рис. 3.
Исходя из данных исследований реальной клинической практики, в России пациенты посещают офтальмологов, как правило, уже при значимом снижении зрения – 0,08–0,1235. Согласно международным и российским рекомендациям, для таких больных препаратом выбора является афлиберцепт31, 33, 36. Однако в рутинной клинической практике используется весь арсенал терапевтических и хирургических опций. Например, проведение лазерной коагуляции оправданно при персистирующем или угрожающем фовеа макулярном отеке через 24 недели в отсутствие положительной динамики в отношении толщины центральной зоны сетчатки и остроты зрения на фоне анти-VEGF-терапии в течение двух месяцев13. Глюкокортикостероиды в виде внутриглазного импланта также важный инструмент для лечения пациентов с ДМО, но в основном в качестве второй линии. У не ответивших на терапию анти-VEGF-препаратами (после трех – шести инъекций в зависимости от ответа конкретного пациента) возможен перевод на стероиды31.
Подготовка пациентов к лазерному или хирургическому вмешательству осуществляется при участии эндокринологов и терапевтов. При необходимости назначают консультацию нефролога (при нарушении функции почек), кардиолога (при наличии осложнений со стороны сердечно-сосудистой системы), невропатолога (при наличии диабетической невропатии), подиатра и/или хирурга (при синдроме диабетической стопы)12, 13, 37–41.
При интравитреальном введении ингибиторов ангиогенеза или глюкокортикостероида в виде импланта следует учитывать потенциальный риск осложнений, таких как инфекционный и неинфекционный эндофтальмит, ятрогенная катаракта, гемофтальм, отслойка сетчатки и др.42, 43
Панретинальная лазерная коагуляция сетчатки уменьшает риск потери зрения и слепоты. У некоторых пациентов при ее проведении может произойти кровоизлияние в стекловидное тело. Кровоизлияние обусловлено СД, но не лазером и может означать, что потребуется еще больше сеансов. Лазерная коагуляция сетчатки часто ухудшает периферическое и боковое зрение, может умеренно снизить центральное зрение. Этот краткосрочный побочный эффект компенсируется долгосрочным уменьшением риска выраженного снижения зрения и слепоты1.
Пациенты, получающие интравитреальные инъекции, должны незамедлительно сообщать врачам о симптомах, указывающих на воспаление (эндофтальмит). Речь, в частности, идет о боли в глазах или увеличении неприятных ощущений, усилении покраснения глаз, нечеткости или снижении зрения, увеличении светочувствительности или числа мушек в поле зрения1.
Возможно ли влияние инсулинотерапии на исходы лечения диабетического макулярного отека анти-VEGF-препаратами?
Ретроспективно были проанализированы истории болезней пациентов с СД 2 типа и ДМО, получавших анти-VEGF-препараты на фоне пероральной сахароснижающей терапии и инсулинотерапии. Применение инсулина было связано с желанием добиться стойкого гликемического контроля и невозможностью достичь нормогликемии при использовании стандартных сахароснижающих препаратов. Группы терапии были сопоставимы по уровню гликированного гемоглобина. За 12 месяцев его средние значения оставались стабильными, что указывало на компенсацию состояния. Необходимо отметить, что в более ранних работах сообщалось об увеличении проницаемости сосудов сетчатки и прогрессировании ДР с ухудшением зрения на фоне применения инсулина44–47. В рассматриваемом исследовании продемонстрирована высокая эффективность анти-VEGF-препаратов у пациентов как на пероральной сахароснижающей терапии, так и на ее комбинации с инсулином. В обеих группах наблюдался более выраженный ответ на терапию анти-VEGF при оптимальном гликемическом контроле, что подчеркивает критическую важность коммуникации между врачами-офтальмологами, лечащими ДМО, и врачами эндокринологами-диабетологами, занимающимися системным контролем диабета48.
Есть ли особенности ведения пациентов с рассматриваемыми патологиями в условиях COVID-19?
При COVID-19 сахарный диабет рассматривается в качестве одного из значимых факторов риска развития неблагоприятных исходов вследствие более тяжелого течения инфекции в условиях гипергликемии и других отягчающих факторов, таких как пожилой возраст, ожирение, высокая частота сопутствующей патологии (артериальная гипертензия, сердечно-сосудистые заболевания, слепота на один или оба глаза)49.
Доля пациентов с СД среди заболевших COVID-19 колеблется от 16,2% в Китае до 25,0% в России50, 51.
Несмотря на неуклонный рост числа публикаций, посвященных анализу различных факторов риска тяжелого течения COVID-19 при СД и его осложнениях, прогрессивно возросло количество противоречий в отношении тактики ведения пациентов с офтальмологическими осложнениями – диабетической ретинопатией и макулярным отеком, а также в отношении развития слепоты вследствие отсрочки лечения. Этому способствуют небольшой объем и разнородность выборок в исследованиях офтальмологов и эндокринологов, а также скорость анализа информации52. В период пандемии COVID-19 офтальмологические практики многих стран стремились приспособиться под новые условия работы. В частности, было опубликовано большое количество зарубежных руководств, нацеленных на систематизацию оказываемой офтальмологами медицинской помощи, в том числе в отношении терапии заболеваний сетчатки и проведения интравитреальных инъекций. В них подчеркивается необходимость продолжения или инициации анти-VEGF-терапии у пациентов с диабетическим макулярным отеком, неоваскулярной возрастной макулярной дегенерацией, макулярным отеком вследствие окклюзии вен сетчатки при соблюдении всех необходимых мер предосторожности53. Предпочтение рекомендуется отдавать простым и понятным режимам посещения и обследования, так как пациенты должны продолжать терапию заболеваний сетчатки даже в условиях пандемии. Предписывается строго соблюдать меры профилактики распространения инфекции и сокращать длительность пребывания пациентов в клинике. Предпочтение отдается предварительному скринингу пациентов по телефону с целью выявления симптомов COVID-19. В приоритете офтальмологов и эндокринологов пациенты с ДМО и ангиоретинопатией, новые пациенты с выраженным снижением зрения, пациенты с диагнозом «неоваскулярная глаукома», монокулярные пациенты (или пациенты с остротой зрения менее 0,2 на одном глазу). Лица с макулярным отеком и ангиоретинопатией, у которых лечение уже было отложено более чем на шесть месяцев во время локдауна в связи с COVID-19, должны продолжить терапию, визиты не должны откладываться более чем на четыре – шесть месяцев. Следует ограничить использование оптической когерентной томографии и проведение расширенного офтальмологического обследования. Предпочтение отдается простым режимам дозирования. Необходимо избегать изменений режима дозирования, требующего частого мониторинга. У получающих интравитреальные инъекции с различными межинъекционными интервалами следует вернуться к последнему максимальному эффективному интервалу. В условиях высокой эпидемической опасности больные СД должны соблюдать режим проведения загрузочных инъекций и отдавать предпочтение препаратам с большей продолжительностью действия53–55.
Президент Европейского общества ретинологов Франк Хольц (Frank Holz) подчеркнул, что интравитреальные инъекции не следует считать необязательной процедурой. Не может быть и речи о том, чтобы откладывать их на неопределенный срок, до тех пор, пока пандемия не закончится, поскольку это нанесет ущерб зрению пациентов и качеству их жизни в долгосрочной перспективе56.

