Натрий-глюкозный котранспортер 1: роль в патогенезе сахарного диабета 2 типа и других заболеваний и потенциальная мишень для терапевтического воздействия
- Аннотация
- Статья
- Ссылки
- English
Данный обзор посвящен описанию локализации, функции белков-переносчиков НГЛТ-1 в разных органах и тканях, их роли в норме и при СД 2 типа, а также рассмотрению их в качестве потенциальной мишени для фармакологического вмешательства при СД 2 типа.
Данный обзор посвящен описанию локализации, функции белков-переносчиков НГЛТ-1 в разных органах и тканях, их роли в норме и при СД 2 типа, а также рассмотрению их в качестве потенциальной мишени для фармакологического вмешательства при СД 2 типа.


Введение
Гомеостаз глюкозы имеет важнейшее значение для здоровья человека, так как глюкоза является основным источником энергии для всех органов и тканей, особенно для головного мозга. В физиологических условиях глюкоза выполняет функцию облигатного энергетического субстрата для головного мозга, который практически не может использовать альтернативные виды «топлива». Нервные клетки не способны синтезировать глюкозу или хранить ее значительное количество в виде гликогена, поэтому для нормального функционирования головного мозга требуется непрерывное поступление глюкозы из кровотока [1, 2]. В норме в течение дня наблюдаются небольшие колебания уровня глюкозы, которые отражают физиологическую реакцию организма в ответ, например, на прием углеводов с пищей, физическую активность или эмоциональный стресс. Слишком низкие и, наоборот, высокие ее уровни оказывают неблагоприятное влияние на организм. Гипогликемия в первую очередь вызывает дефицит энергии в головном мозге, что приводит к развитию его функциональной недостаточности [2]. Гипергликемия является основным признаком сахарного диабета (СД) и важнейшим фактором развития его осложнений. Таким образом, важно поддерживать уровень глюкозы в пределах нормальных значений [1].
В гомеостазе глюкозы участвуют не только инсулин и глюкагон, но и другие гормоны, а также адипокины [3]. Важную роль в метаболизме глюкозы играют и белки-переносчики, которые обеспечивают ее трансмембранное перемещение. Белками-переносчиками в клетках млекопитающих являются глюкозные транспортеры (ГЛЮТ) и натрий-глюкозные котранспортеры нескольких типов. Белки семейства ГЛЮТ облегчают диффузию глюкозы, в то время как белки семейства НГЛТ осуществляют активный транспорт D-глюкозы/галактозы и ионов натрия [1, 4, 5]. Движущей силой для активного транспорта глюкозы через белки-переносчики НГЛТ становится концентрационный градиент натрия.
Гипотезу о натрий-глюкозном котранспорте впервые выдвинул Боб Крейн на симпозиуме по мембранному транспорту и метаболизму, состоявшемся в Праге в 1960 г. Ученый описал схему совместного переноса глюкозы и ионов натрия через мембрану щеточной каемки тонкой кишки. Позднее эта гипотеза была подтверждена и расширена в контексте трансэпителиального транспорта не только в кишечнике, но и в других органах и тканях.
С момента клонирования натрий-глюкозного котранспортера 1 (НГЛТ-1) в 1987 г. началось активное изучение строения и функции белков-переносчиков семейства НГЛТ и их роли в поддержании состояния здоровья и развитии различных заболеваний.
На сегодняшний день достигнуты впечатляющие успехи в исследовании генетики, молекулярной биологии, биохимии, биофизики и структуры белков НГЛТ [5]. Наиболее изученными среди них являются НГЛТ-1 и НГЛТ-2. Согласно опубликованным данным, НГЛТ-2 экспрессированы преимущественно в почках, в то время как тканевая экспрессия НГЛТ-1 практически повсеместна [4, 5]. Роль НГЛТ-2 в норме и при патологии (например, при сахарном диабете или семейной почечной глюкозурии) хорошо изучена, однако о роли НГЛТ-1 знают гораздо меньше.
В данной статье подробно рассматривается функция белков-переносчиков НГЛТ-1 в различных органах и тканях, а также их роль в качестве потенциальной мишени для фармакологического вмешательства при СД 2 типа и других заболеваниях.
Представленность натрий-глюкозного котранспортера 1 в разных органах и тканях и эффекты его ингибирования
Кишечник
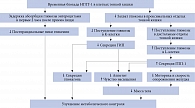
НГЛТ-1 является основным кишечным транспортером глюкозы [4, 6]. Большую часть глюкозы организм получает с углеводами пищи. Поступившие в желудочно-кишечный тракт углеводы расщепляются с помощью кишечных ферментов до моносахаридов, которые затем поглощаются ворсинками тонкой кишки. В тонкой кишке НГЛТ-1 локализованы на щеточной каемке энтероцитов и принимают участие в абсорбции глюкозы/галактозы в кровоток [6, 7]. После того как натрий и глюкоза через НГЛТ-1 поступают внутрь энтероцита, они транспортируются к базальной мембране клетки и поступают в кровоток через локализованные на ней каналы – K+/Na+-аденозинтрифосфатазу (АТФаза) и ГЛЮТ-2 соответственно [6]. Важно отметить, что в кишечнике НГЛТ-1 локализованы не только на апикальной мембране энтероцитов, но и внутри клетки, в субапикальных отделах клетки. Полагают, что расположение НГЛТ-1 во внутриклеточных пузырьках обеспечивает быстрое увеличение количества белков-переносчиков при поступлении в просвет тонкой кишки глюкозы. Повышение количества НГЛТ-1 является физиологической реакцией на увеличение концентрации глюкозы в кишечнике для обеспечения ее эффективного всасывания [6]. У пациентов с СД 2 типа экспрессия НГЛТ-1 на щеточной каемке энтероцитов повышена в 4,3 раза по сравнению со здоровыми лицами, в связи с чем поглощение энтероцитами глюкозы происходит в 3,3 раза быстрее, что обусловливает выраженные постпрандиальные пики гликемии [8]. Блокада НГЛТ-1 поможет смягчить постпрандиальные подъемы уровня глюкозы, уменьшить вариабельность гликемии и улучшить гликемический контроль у пациентов с СД 2 типа, что и было показано в исследованиях с использованием препарата канаглифлозин [9, 10].
Канаглифлозин имеет сродство не только с НГЛТ-2, но и с НГЛТ-1. Соотношение констант ингибирования НГЛТ-2/НГЛТ-1 приблизительно равно 1:200. Это означает, что для ингибирования НГЛТ-2 нужна меньшая концентрация канаглифлозина, чем для ингибирования НГЛТ-1. При приеме канаглифлозина в терапевтической дозе создается достаточная концентрация для одновременной блокады НГЛТ-2 и НГЛТ-1. Соотношение констант ингибирования НГЛТ-2/НГЛТ-1 у селективных ингибиторов НГЛТ-2 на порядок выше, например у эмпаглифлозина 1:2500. Как следствие, в терапевтических дозах эти препараты не ингибируют НГЛТ-1 в той же степени, что и канаглифлозин [11]. В рамках клинических исследований было доказано, что транзиторное ингибирование НГЛТ-1 при приеме канаглифлозина, особенно в дозе 300 мг, значимо снижало пики постпрандиальной гликемии за счет задержки абсорбции глюкозы в кишечнике в первые два часа после приема пищи как у здоровых лиц [9], так и у пациентов с СД 2 типа [10]. Через два – четыре часа после еды отмечалось постепенное увеличение всасывания глюкозы, в результате чего не происходило ее мальабсорбции [9]. Этот эффект не наблюдался при приеме других препаратов из класса ингибиторов НГЛТ-2. Согласно результатам рандомизированного двойного слепого перекрестного исследования с участием 54 здоровых лиц, проведенного S. Sha и соавт., значимое снижение вариабельности уровня глюкозы в плазме крови после еды относительно исходных показателей наблюдалось при приеме 300 мг канаглифлозина, такого эффекта не отмечалось при применении дапаглифлозина в дозе 10 мг [12]. Данное исследование продемонстрировало важную роль НГЛТ-1 в регуляции постпрандиальной гликемии и позволило рассматривать его в качестве новой мишени для фармакологического воздействия при комплексном лечении СД 2 типа.
Обнаружение НГЛТ-1 в K- и L-клетках тонкой кишки, секретирующих глюкозозависимый инсулинотропный полипептид (ГИП) и глюкагоноподобный пептид 1 (ГПП-1), также имело важное биомедицинское значение. Фармакологическая блокада НГЛТ-1 потенциально может влиять на глюкозозависимую секрецию этих энтерогормонов. Необходимо отметить, что I. Vrhovac и соавт. выявили экспрессию белков НГЛТ-1 во внутриклеточных везикулах только в части K- и L-клеток. Эта гетерогенность может указывать на наличие нескольких субпопуляций или разные функциональные состояния K- и L-клеток [6, 7]. Клиническое значение неоднородности клеточных популяций только предстоит выяснить. Однако уже сегодня есть представление об эффектах временной блокады НГЛТ-1 на глюкозозависимую секрецию ГИП и ГПП-1. Так, T. Hira и соавт. в ходе изучения влияния канаглифлозина на продукцию инкретинов у крыс с ожирением установили, что пероральное введение канаглифлозина одновременно с нагрузкой глюкозой увеличивало уровень общего и активного ГПП-1 и снижало уровень общего и активного ГИП в портальной системе уже через 15 минут. При этом в исследованиях in vitro канаглифлозин напрямую не влиял на высвобождение ГПП-1. Полученные результаты позволили предположить, что пероральное введение канаглифлозина подавляет секрецию ГИП за счет ингибирования НГЛТ-1 в верхних отделах кишечника. В свою очередь ингибирование абсорбции глюкозы в проксимальных отделах тонкой кишки увеличивало концентрацию глюкозы в дистальном отделе тонкой кишки, где локализуются L-клетки, секретирующие ГПП-1. Был сделан вывод, что повышение секреции ГПП-1 при приеме канаглифлозина может быть обусловлено увеличением доставки глюкозы в нижний отдел тонкой кишки [13].
Установлено также, что бактерии, населяющие дистальный отдел тонкой кишки, метаболизируют глюкозу до короткоцепочечных жирных кислот, которые являются сильными стимуляторами секреции L-клетками ГПП-1 [6, 7].
Кишечные эффекты блокады НГЛТ-1 на метаболический контроль у пациентов с СД 2 типа представлены на рис. 1.
Описанное выше дифференцированное влияние канаглифлозина на уровень инкретинов может обеспечивать дополнительное преимущество при лечении пациентов с СД 2 типа и сопутствующим ожирением [13]. Известно, что снижение инкретинового эффекта, в основном за счет сокращения выработки ГПП-1 при неизменной секреции ГИП, у пациентов с ожирением, нарушенной толерантностью к глюкозе и СД 2 типа является одним из механизмов нарушения секреции инсулина. Поэтому у больных СД 2 типа препараты, оказывающие влияние на синтез инкретинов, имеют потенциальное преимущество перед препаратами без указанного эффекта. Особенно это касается ГПП-1, который помимо прямого глюкозозависимого эффекта на секрецию инсулина обладает множественными положительными эффектами в отношении различных органов и тканей [14]. В частности, ГПП-1 ингибирует секрецию глюкагона как непосредственно за счет прямого воздействия на α-клетки поджелудочной железы, так и опосредованно за счет увеличения синтеза инсулина и соматостатина. Это свойство ГПП-1 имеет крайне важное значение для пациентов с СД 2 типа, у которых часто наблюдаются гиперглюкагонемия и ослабление супрессивного влияния гипергликемии на синтез и секрецию данного гормона. Кроме того, ГПП-1 способен оказывать положительное центральное воздействие. Он стимулирует центры, регулирующие аппетит и энергозатраты, что способствует снижению аппетита и более быстрому наступлению чувства насыщения, а значит, снижению массы тела [15].
Важно отметить, что у пациентов с СД 2 типа отмечается уменьшение секреции ГПП-1, при этом его инсулинотропный эффект остается неизменным.
В отношении ГИП на сегодняшний день получены противоречивые данные. Большинство авторов указывают на уменьшение инсулинотропного действия ГИП вне зависимости от его уровня в плазме крови у пациентов с СД 2 типа [14]. ГИП оказывает противоположное ГПП-1 влияние на центры голода и насыщения в головном мозге – повышает аппетит и замедляет наступление чувства насыщения. Неоднозначные данные получены и о влиянии ГИП на секрецию глюкагона. В частности, одни исследователи сообщают о том, что ГИП стимулирует секрецию глюкагона, другие – об отсутствии такого эффекта [15].
Снижение продукции ГИП при ингибировании кишечных НГЛТ-1 не сопровождается существенным негативным влиянием на метаболический контроль у пациентов с СД 2 типа, особенно при сохранении и даже повышении секреции ГПП-1.
Таким образом, эффекты канаглифлозина на секрецию ГИП и ГПП-1 в целом можно считать положительными и имеющими важное клиническое значение. Однако для подтверждения результатов, полученных в экспериментах на животных, необходимо проведение клинических исследований.
Почки
Глюкоза, находящаяся в плазме крови, свободно проходит через клубочковый фильтр в пространство Боумена – Шумлянского вместе с водой, электролитами, мочевиной и другими низкомолекулярными веществами [16, 17]. Так, в первичную мочу за сутки поступает около 180–200 г отфильтрованной глюкозы [16, 17]. Для предотвращения потери такого количества важного энергетического субстрата в проксимальном отделе почечных канальцев предусмотрен механизм реабсорбции глюкозы [7, 16–18]. Реабсорбция глюкозы осуществляется с помощью активного котранспорта глюкозы и натрия через белки-переносчики семейства НГЛТ, расположенные на апикальной мембране эпителиоцитов почечных канальцев. В сегментах S1 и S2 локализованы НГЛТ-2 – основные транспортеры глюкозы в почках, отвечающие за реабсорбцию 90% отфильтрованной глюкозы. После поступления внутрь клеток почечного эпителия глюкоза с помощью НГЛТ-2 по механизму облегченной диффузии проходит через белки-транспортеры ГЛЮТ-2 базолатеральной мембраны в плазму крови. Аналогичным образом происходит трансмембранный перенос глюкозы в сегменте S3 проксимального почечного канальца. В данном случае за транспорт глюкозы через апикальную мембрану отвечают НГЛТ-1. В норме в этом отделе почечных канальцев происходит реабсорбция оставшихся 10% глюкозы. Такой двухэтапный процесс реабсорбции обеспечивает полное всасывание глюкозы (при гликемии < 10 ммоль/л) к тому моменту, когда фильтрат достигает конца проксимального канальца [8, 16–18]. В норме этот механизм предотвращает потерю глюкозы, жизненно необходимой для работы всех систем организма, в первую очередь головного мозга [1].
У пациентов с СД 2 типа количество НГЛТ-2 и ГЛЮТ-2 в почках увеличивается многократно, и белки-переносчики начинают захватывать больше глюкозы, что способствует развитию гипергликемии [19]. Признаком увеличения количества транспортеров глюкозы в почках является повышение почечного порога гликемии, который у пациентов с СД 2 типа в среднем может достигать 13,8 ммоль/л [20]. Так физиологический процесс реабсорбции глюкозы у больных СД 2 типа становится патологическим. Патологическая реабсорбция является одним из звеньев поддержания высокого уровня глюкозы в крови. На это звено направлено действие ингибиторов НГЛТ-2, которые блокируют белки-транспортеры НГЛТ-2 и обеспечивают инсулиннезависимое сахароснижающее действие, а также способствуют некоторому снижению массы тела за счет выведения глюкозы с мочой [21]. Однако при блокировании НГЛТ-2 проксимального извитого канальца их функцию реабсорбции глюкозы берут на себя белки-переносчики НГЛТ-1, которые в данном случае могут захватывать до 30–45% глюкозы из первичной мочи. Это объясняет парадоксально низкий эффект (уменьшение реабсорбции глюкозы на 30–50% при ожидаемых > 80%) селективных ингибиторов НГЛТ-2 [22, 23].
В связи со сказанным ранее при лечении пациентов с СД 2 типа одновременная блокада НГЛТ-2 и НГЛТ-1 может иметь потенциальное преимущество перед селективным ингибированием только НГЛТ-2. Данную гипотезу подтверждают результаты экспериментальных и клинических исследований. Например, в работе V. Sokolov и соавт. ингибирование НГЛТ-1 почечных канальцев канаглифлозином способствовало дополнительной экскреции глюкозы с мочой (порядка 10% от суточной), чего не наблюдалось на фоне применения дапаглифлозина или эмпаглифлозина. Это различие было обусловлено способностью препаратов блокировать НГЛТ-1 (наибольшая у канаглифлозина). Исследование было выполнено на модели количественной системной фармакологии почечной фильтрации глюкозы, НГЛТ-опосредованной реабсорбции и экскреции глюкозы с мочой [24]. Способность канаглифлозина более эффективно увеличивать экскрецию глюкозы с мочой также была продемонстрирована в исследовании S. Sha и соавт. [12]. Уровень суточной экскреции глюкозы с мочой при применении 300 мг канаглифлозина был на 26% выше, чем при приеме 10 мг дапаглифлозина [12].
На настоящий момент времени прямого сравнения эффектов разных ингибиторов НГЛТ-2 на экскрецию глюкозы с мочой у пациентов с СД 2 типа не проводилось, однако можно предположить, что дополнительное ингибирование НГЛТ-1 может обеспечивать некоторое преимущество в достижении лучшего метаболического контроля, в том числе за счет влияния на почки.
В ходе исследований на животных моделях была открыта экспрессия НГЛТ-1 в области macula denca (MD) и их роль в прогрессировании гиперфильтрации [25], которая является важнейшим фактором прогрессирования диабетической нефропатии [26]. Согласно сосудистой теории развития гиперфильтрации, повышенная экспрессия НГЛТ-2 в проксимальных канальцах усиливает реабсорбцию глюкозы и натрия, что приводит к снижению доставки натрия к клеткам MD. Это в свою очередь подавляет действие тубулогломерулярной обратной связи (ТГОС) и приводит к расширению афферентных артериол, увеличению гидростатического давления в капиллярах клубочков и скорости клубочковой фильтрации (СКФ). Ингибирование НГЛТ-2 способствует восстановлению ТГОС в нефроне, а также снижению гиперфильтрации и гломерулярной гипертензии. Однако, если глюкоза не была полностью реабсорбирована в проксимальном почечном канальце (например, при гипергликемии, превышающей почечный порог глюкозы у пациентов с СД, или при приеме ингибиторов НГЛТ-2), она захватывается НГЛТ-1 плотного пятна. Поступление глюкозы в клетки MD, опосредованное НГЛТ-1, увеличивает активность синтазы оксида азота (NO-синтазы). Повышенное образование NO в области плотного пятна приводит к подавлению ТГОС и расширению афферентной артериолы с последующим повышением гидростатического капиллярного давления в почечных клубочках и прогрессированием гиперфильтрации (рис. 2). Ингибирование НГЛТ-1 нивелирует эти эффекты: снижается активность NO-синтазы, восстанавливается ТГОС, уменьшается риск развития гиперфильтрации и почечного повреждения [25, 27].
Таким образом, одновременная блокада НГЛТ-1 и НГЛТ-2 может предотвратить индуцированную внутриканальцевой гипергликемией инактивацию MD-ТГОС и, следовательно, снижение клубочковой гиперфильтрации при СД.
Для подтверждения роли НГЛТ-1 в развитии гиперфильтрации у пациентов с СД 2 типа и определения долгосрочной эффективности и терапевтического потенциала вмешательств, направленных на НГЛТ-1, необходимо проведение хорошо спланированных исследований [27].
Миокард
Не так давно было установлено, что кардиомиоциты (КМЦ) человека экспрессируют на своей поверхности НГЛТ-1 [6, 28, 29]. Кроме того, некоторые авторы указывают, что в сердце человека НГЛТ-1 экспрессируют эндотелиоциты мелких сосудов [6]. В отличие от НГЛТ-1 котранспортеры 2 не обнаруживаются в миокарде ни у здоровых лиц, ни у лиц с СД 2 типа [28]. Важно отметить, что в норме поступление глюкозы в КМЦ преимущественно осуществляется с помощью белков семейства ГЛЮТ, в том числе инсулинзависимого ГЛЮТ-4 [30], НГЛТ-1 не играют существенной роли в обеспечении трансмембранного транспорта глюкозы внутрь клеток [31]. Однако у пациентов с СД 2 типа количество НГЛТ-1 в кардиомиоцитах увеличивается и их роль в утилизации глюкозы значимо возрастает [31].
Вместе с глюкозой внутрь клетки приникает Na+ (с каждым 1 ммоль глюкозы в КМЦ перемещается два иона натрия), что способствует повышению его внутриклеточной концентрации. Увеличение уровня внутриклеточного Na+ приводит к перегрузке цитоплазмы КМЦ ионами Са2+ за счет активации натрий-кальциевого транспортера. Ионы поступают в саркоплазматический ретикулум, а их высокая концентрация ассоциируется с повышением риска развития аритмии. В то же время увеличение концентрации Na+ внутри КМЦ способствует усилению оксидативного стресса. Это происходит за счет активации митохондриального Na+/Ca2+-обменника, способствующего снижению уровня Са2+ в митохондриях. Уменьшение концентрации свободного кальция в митохондриях в свою очередь приводит к замедлению скорости образования восстановленного никотинамидадениндинуклеотидфосфата (НАДФН), необходимого для нейтрализации активных форм кислорода, которые образуются при работе митохондрий [29, 31, 32].
Клиническая значимость указанных выше изменений была продемонстрирована в недавнем исследовании H. Kondo и соавт., обнаруживших, что уровень экспрессии НГЛТ-1 в КМЦ коррелировал с выраженностью оксидативного стресса, факторами повреждения миокарда и уровнем провоспалительных маркеров. Оксидативный стресс в свою очередь способствовал апоптозу КМЦ и поддержанию хронического воспаления, что приводило к развитию миокардиального фиброза и сердечной дисфункции [28]. Снижение содержания Са2+ в митохондриях также ассоциировалось с нарушением в цепи переноса электронов и, как следствие, энергетического баланса КМЦ за счет снижения выработки АТФ [33].
Фармакологическая блокада НГЛТ-1 снижает оксидативный стресс за счет активации АМФ-активируемой протеинкиназы (АМФК) КМЦ, что опосредует подавление НАДФН-оксидазы и обеспечивает значимый антиоксидантный эффект. Снижение оксидативного стресса наряду с повышением активности АМФК связано с восстановлением активности NO-синтазы, что приводит к повышению выработки NO. В совокупности эти механизмы способствуют подавлению воспалительной реакции, повышению выживаемости КМЦ и снижению миокардиального повреждения при СД 2 типа (рис. 3).
H. Kondo и соавт. также установили, что двойной ингибитор НГЛТ-1 и НГЛТ-2 канаглифлозин подавлял активность НАДФН-оксидазы, увеличивал биодоступность тетрагидробиоптерина (кофактора NO-синтазы) и соответственно активность NO-синтазы [28]. Ученые также отметили снижение экспрессии провоспалительных и проапоптотических сигналов в КМЦ и повышение экспрессии генов сигнальных путей, отвечающих за выживаемость клеток. Важно отметить, что канаглифлозин вне зависимости от дозы достоверно уменьшал выраженность оксидативного стресса в КМЦ. В отличие от канаглифлозина селективный ингибитор НГЛТ-2 эмпаглифлозин не способствовал снижению оксидативного стресса в клетках миокарда.
Представленные результаты описывают важный НГЛТ-1-опосредованный механизм дополнительной кардиопротекции при применении препаратов с ингибирующей активностью в отношении этого котранспортера, например канаглифлозина [19].
Легкие
В легких человека НГЛТ-1 локализуются на поверхности альвеолоцитов 2 и внутри клеток Клара бронхиол [6, 34]. Обнаружение НГЛТ-1 именно в альвеолоцитах 2 позволило предположить, что эти белки-переносчики глюкозы могут участвовать в синтезе сурфактанта, обеспечивая данный процесс энергетическим субстратом. С учетом этой функции НГЛТ-1 в легких некоторые авторы высказывают опасение, что фармакологическая блокада переносчиков глюкозы может ухудшить продукцию сурфактанта [6]. Однако на настоящий момент времени не было получено подтверждения этого неблагоприятного эффекта ингибирования НГЛТ-1 на фоне применения современных сахароснижающих препаратов из класса ингибиторов НГЛТ-2, в том числе неселективного канаглифлозина.
В исследованиях на животных моделях также показано, что НГЛТ-1 могут участвовать в регуляции объема поверхностной жидкости дыхательных путей (ASL) и обеспечении низких концентраций глюкозы в ASL [6, 34]. Известно, что глюкоза свободно диффундирует в ASL как через эпителиальную мембрану, так и параклеточным путем, однако в норме в ASL уровни глюкозы примерно в 12,5 раз ниже, чем в плазме крови. Относительно низкие концентрации глюкозы в ASL обеспечиваются за счет активного удаления глюкозы через трансмембранные переносчики глюкозы (НГЛТ-1, ГЛЮТ) против ее градиента концентрации, что способствует защите легких от инфекции. Как в исследованиях на животных моделях, так и в исследованиях гистологических препаратов легких человека было установлено, что захват глюкозы внутрь клеток с помощью НГЛТ-1 является основным механизмом апикального транспорта глюкозы из ASL в дистальных отделах дыхательных путей. На сегодняшний день нет точной информации о том, какие переносчики глюкозы участвуют в базолатеральном трансмембранном транспорте глюкозы в легких, однако некоторые авторы полагают, что эту функцию выполняют белки семейства ГЛЮТ [34].
Установлено, что при респираторных заболеваниях (например, при обострении хронической обструктивной болезни легких (ХОБЛ), тяжелом течении бронхиальной астмы), а также при гипергликемии концентрация глюкозы в ASL повышается за счет увеличения скорости ее диффузии из плазмы крови [34]. Это может быть одной из причин большей подверженности пациентов с СД заражению респираторными инфекциями, часто вызываемыми метициллин-резистентным Staphylococcus aureus (MRSA) или Pseudomonas aeruginosa [34, 35]. Известно, что S. aureus и P. aeruginosa используют глюкозу в качестве субстрата для размножения и роста [34]. В исследованиях на лабораторных животных показано, что повышение уровня глюкозы в ASL связано с увеличением пролиферации этих патогенов в легких [35, 36].
Кроме того, получены данные о том, что СД является фактором, предрасполагающим к заселению верхних отделов дыхательных путей золотистым стафилококком [37], и пациенты с плохим гликемическим контролем более восприимчивы к инфекции, вызванной MRSA [38]. У пациентов с ХОБЛ и сопутствующим СД гораздо чаще, чем у пациентов с ХОБЛ без диабета, в мокроте обнаруживаются грамотрицательные микроорганизмы [39].
В связи с тем что одним из ведущих факторов, ассоциированных с развитием респираторных инфекций, является высокая концентрация глюкозы в ASL, а за ее снижение отвечает в основном НГЛТ-1, T. Oliveira и соавт. изучили роль активности этих белков-переносчиков глюкозы в легких на концентрацию глюкозы в ASL и бактериальную пролиферацию [35]. Для этого исследователи интраназально вводили здоровым крысам и крысам с СД физиологический раствор, изопротеренол (для увеличения активности НГЛТ-1) или флоризин (для ингибирования НГЛТ-1) и через два часа определяли концентрацию глюкозы и пролиферацию MRSA и P. aeruginosa в бронхоальвеолярном лаваже (БАЛ). Кроме того, иммуногистохимическим методом был проанализирован уровень экспрессии НГЛТ-1 на клетках альвеолярного эпителия. Согласно полученным результатам, у животных с диабетом изопротеренол стимулировал миграцию НГЛТ-1 к апикальной мембране альвеолярных клеток и снижал концентрацию глюкозы в БАЛ, тогда как неселективный ингибитор НГЛТ-1 и НГЛТ-2 флоризин, наоборот, увеличивал концентрацию глюкозы в БАЛ. Это сопровождалось изменением пролиферации MRSA in vitro и P. aeruginosa в БАЛ (r = 0,9651 и r = 0,9613 соответственно; p < 0,05). Авторы исследования сделали вывод о наличии связи между активностью НГЛТ-1, концентрацией глюкозы в ASL и легочной бактериальной пролиферацией, а также предположили, что у пациентов с СД повышенная активность НГЛТ-1 может предотвращать бактериальную пролиферацию, тогда как ингибирование НГЛТ-1 – повышать риск бактериальных инфекций [35].
Несомненно, переносить результаты этой экспериментальной работы на препараты, используемые у пациентов с СД 2 типа в клинической практике, нельзя. Во-первых, аналогичных работ, доказавших увеличение уровня глюкозы в ASL и бактериальной пролиферации при ингибировании НГЛТ-1, у людей проведено не было. Во-вторых, флоризин, используемый в исследовании T. Oliveira и соавт. для снижения активности НГЛТ-1, значимо отличается по своим фармакодинамическим и фармакокинетическим свойствам от современных ингибиторов НГЛТ-2, в том числе канаглифлозина [40].
На сегодняшний день не было опубликовано данных об увеличении риска развития респираторных инфекций при применении сахароснижающих препаратов из класса глифлозинов.
В исследовании A. Astrand и соавт. применение дапаглифлозина способствовало снижению роста и выживаемости бактерий в легких за счет снижения доступности глюкозы в ASL, что было связано с нормализацией уровней глюкозы в плазме крови [41]. Можно предположить, что эффект неселективных ингибиторов НГЛТ-2, в частности канаглифлозина, на пролиферацию и жизнеспособность бактерий в легких может быть аналогичным, так как важное значение имеет именно достижение целевой гликемии.
Полагаем, что оценка влияния канаглифлозина на транспорт глюкозы и абсорбцию жидкости в легких должна стать темой дальнейших научных исследований. Кроме того, еще предстоит изучить, какая из многочисленных функций клеток Клара зависит от НГЛТ-1-опосредованной доставки внутриклеточной глюкозы [34].
Трахея и бронхи
В недавних исследованиях на животных моделях было показано, что эпителиальные клетки трахеи и бронхов тоже экспрессируют НГЛТ-1 [6, 34]. С помощью НГЛТ-1, а также белков семейства ГЛЮТ поддерживаются низкие концентрации глюкозы в ASL. В отличие от легких преобладающими переносчиками глюкозы на мембранах эпителиальных клеток трахеи, бронхов и бронхиол являются ГЛЮТ [34]. Вопрос, экспрессируют ли клетки дыхательных путей человека НГЛТ-1, так же как у животных, остается открытым [6, 34]. Однако уже сегодня можно сделать заключение, что клинически значимого увеличения уровня глюкозы в ASL трахеи и бронхов при ингибировании НГЛТ-1 и, следовательно, риска инфицирования трахеи и бронхов ожидать не стоит [34].
Печень
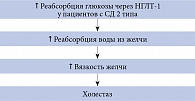
Экспрессия НГЛТ-1 в желчных протоках печени впервые была обнаружена в исследованиях на лабораторных животных [42]. В 2015 г. I. Vrhovac и соавт. подтвердили наличие НГЛТ-1 в печени людей. У человека, так же как у крыс, НГЛТ-1 экспрессированы на апикальной мембране эпителиальных клеток желчных протоков и не обнаруживаются в гепатоцитах [6]. Благодаря этому НГЛТ-1 могут опосредованно регулировать реабсорбцию воды из желчи. В исследованиях на лабораторных животных было показано, что глюкоза поступает из гепатоцитов в желчь пассивно по градиенту концентрации, а затем реабсорбируется в желчных протоках за счет активного натрий-глюкозного котранспорта [43, 44]. Реабсорбция глюкозы в желчных протоках также обеспечивала осмотическую движущую силу для реабсорбции воды через аквапорины [45]. По мнению некоторых авторов, этот механизм может объяснять нарушение оттока желчи и повышение риска развития холестаза у лиц с СД (рис. 4) [6].
На основании результатов экспериментальных работ было выдвинуто предположение, что обратимое ингибирование НГЛТ-1 может увеличить секрецию желчи и предотвратить развитие холестаза при СД 2 типа [6]. Однако для его подтверждения необходимо провести хорошо спланированные клинические исследования.
Поджелудочная железа
Эндокринная часть поджелудочной железы высокочувствительна к уровням гликемии, что позволяет тонко регулировать гомеостаз глюкозы в организме. За трансмембранный транспорт в клетках поджелудочной железы ответственны белки-переносчики семейства ГЛЮТ.
Недавно было обнаружено, что α-клетки островков Лангерганса у мышей и человека экспрессируют НГЛТ-1, обеспечивая натрий-зависимый транспорт глюкозы внутрь клеток, секретирующих глюкагон. В более ранних работах также сообщалось о наличии на поверхности α-клеток белков НГЛТ-2, однако в дальнейшем эти данные не получили подтверждения. Интересно, что более высокий уровень экспрессии НГЛТ-1 в α-клетках островков Лангерганса напрямую был связан с гиперсекрецией глюкагона в моделях диабета [46].
Эта особенность экспрессии белков семейства НГЛТ на поверхности α-клеток может лежать в основе различия влияния разных препаратов из класса ингибиторов НГЛТ-2 на секрецию глюкагона. Так, в нескольких клинических исследованиях было показано, что применение селективных ингибиторов НГЛТ-2 дапаглифлозина и эмпаглифлозина у пациентов с СД 2 типа сопровождалось повышением секреции глюкагона [47, 48]. В то же время прием неселективного канаглифлозина, наоборот, способствовал снижению концентрации глюкагона в плазме крови. T. Suga и соавт. на основании результатов своей исследовательской работы сделали выводы о том, что данный эффект может быть обусловлен именно блокированием канаглифлозином НГЛТ-1 в α-клетках поджелудочной железы [46]. Вероятнее всего, повышение концентрации глюкагона при применении селективных ингибиторов НГЛТ-2 происходит компенсаторно в ответ на резкое снижение гликемии. Временная блокада НГЛТ-1 позволяет смягчить действие этого компенсаторного механизма [46]. Подтверждение этих экспериментальных данных недавно было получено в клиническом исследовании T. Kadowaki и соавт. Добавление канаглифлозина к терапии ингибитором дипептидилпептидазы 4 не сопровождалось повышением уровня глюкагона у пациентов с СД 2 типа [49].
Слюнные железы
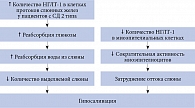
При изучении белков-переносчиков глюкозы в разных органах и тканях было выявлено, что на мембранах эпителиальных клеток слюнных желез тоже присутствуют НГЛТ-1. Здесь они отвечают за реабсорбцию глюкозы и натрия и, как следствие, за уменьшение количества секретируемой в слюнные протоки воды.
В экспериментальных исследованиях на лабораторных животных с СД и артериальной гипертензией обнаружена повышенная экспрессия НГЛТ-1 на базолатеральной мембране клеток протоков слюнных желез [50, 51]. При этом отмечалось уменьшение количества НГЛТ-1 на поверхности миоэпителиоцитов околоушной слюнной железы у крыс с СД, что могло затруднять отток слюны из-за снижения сократительной активности этих клеток [50]. В дальнейшем было установлено, что увеличение экспрессии НГЛТ-1 в ацинарных клетках слюнных желез у животных с СД или артериальной гипертензией снижало количество выделяемой слюны. Кроме того, было выявлено, что симпатическая стимуляция способствовала увеличению количества НГЛТ-1 на мембранах клеток слюнных протоков [51, 52].
Результаты указанных выше работ позволили выдвинуть гипотезу о том, что гипосаливация у лиц с СД и артериальной гипертензией может быть обусловлена увеличением экспрессии НГЛТ-1 (рис. 5) [53].
Снижение слюноотделения способствует развитию заболеваний зубов, десен и слюнных желез [53].
К сожалению, на сегодняшний день нет данных клинических исследований о потенциально положительных эффектах временной фармакологической блокады НГЛТ-1 на саливацию у пациентов с СД 2 типа.
Матка
Для имплантации эмбриона требуется создание благоприятной среды в матке. Ключевым метаболическим изменением, которое происходит на ранних сроках беременности, является повышение содержания гликогена в эндометрии. Накопление гликогена требует предварительного поглощения глюкозы клетками. Гликоген в свою очередь необходим для обеспечения гистиотрофного питания плода на ранних сроках беременности. Децидуализация стромальных клеток эндометрия также требует поглощения повышенного уровня глюкозы. В связи с этим обеспечение трансмембранного переноса глюкозы является крайне важным для благоприятного исхода беременности.
Основными переносчиками глюкозы в эндометрии считаются белки семейства ГЛЮТ. Однако поглощение глюкозы посредством активного транспорта с помощью НГЛТ-1 также играет важную роль в процессах накопления внутриклеточной глюкозы, необходимой для обеспечения децидуализации эндометрия и синтеза гликогена.
В исследовании на лабораторных животных было показано снижение содержания гликогена в эндометрии, а также более мелкий размер помета и низкий вес при рождении от мышей с дефицитом НГЛТ-1 [54].
У пациенток с идиопатическим бесплодием отмечается значительное снижение ГЛЮТ-1 в клетках эндометрия [55].
Не так давно M.S. Salker и соавт. также выявили снижение экспрессии НГЛТ-1 во время окна имплантации у пациенток с привычным невынашиванием беременности по сравнению с контрольной группой [54]. На основании полученных результатов авторы сделали вывод, что относительный дефицит НГЛТ-1 в эндометрии человека при имплантации может предрасполагать к ранней неудаче беременности и повышению риска акушерских осложнений, в том числе к задержке роста плода. Поэтому рекомендовано проявлять особую осторожность при назначении препаратов, ингибирующих активность НГЛТ-1, пациенткам репродуктивного возраста с СД 2 типа как до зачатия, так и во время беременности [54].
Предстательная железа
НГЛТ-1 слабо экспрессируются в эпителиальных клетках здоровой предстательной железы. Однако их экспрессия значительно повышается не только в эпителиальных, но и в стромальных клетках простаты при доброкачественной гиперплазии и особенно при простатической интраэпителиальной неоплазии и раке предстательной железы. У пациентов с раком предстательной железы эпителиальные клетки также начинают экспрессировать НГЛТ-2 [56–58].
Обнаружение нового механизма поступления глюкозы внутрь раковых клеток, нуждающихся в больших количествах глюкозы для роста и выживания, открывает новую потенциальную точку приложения лекарственных средств, направленных на снижение жизнеспособности раковых клеток предстательной железы [56].
Еще в 2013 г. J. Ren и соавт. опубликовали результаты исследования, свидетельствующие о том, что снижение активности НГЛТ-1 его ингибитором (флоринсином) сенсибилизировало раковые клетки предстательной железы к лечению ингибиторами тирозинкиназы рецепторов эпидермального фактора роста [59].
На сегодняшний день активно изучаются потенциальные положительные эффекты ингибиторов НГЛТ-2 у пациентов с раком предстательной железы [58]. Например, в исследованиях in vitro канаглифлозин ингибировал пролиферацию и клоногенную выживаемость раковых клеток, а также способствовал увеличению эффективности химиотерапии доцетакселом и лучевой терапии. Стоит отметить, что дапаглифлозин не оказывал аналогичного действия, что может указывать на ключевое значение блокады НГЛТ-1, которая обеспечивает не только снижение захвата глюкозы раковыми клетками, но и ингибирование митохондриального дыхания, поддерживаемого комплексом I [58–60].
Представленные результаты заслуживают внимания и дальнейшего изучения в хорошо спланированных доклинических и клинических исследованиях.
Заключение
Белки-переносчики НГЛТ-1 представлены в разных органах и тканях человека и участвуют во многих физиологических и патологических процессах. На сегодняшний день хорошо изучена роль кишечных НГЛТ-1, в частности у пациентов с СД 2 типа. В связи с тем что у лиц с СД 2 типа количество и активность НГЛТ-1 в тонкой кишке значимо увеличиваются, эти белки-переносчики начинают поглощать больше глюкозы, обеспечивая выраженные постпрандиальные пики гликемии. Известно, что постпрандиальная гипергликемия ухудшает прогноз у пациентов с СД 2 типа вне зависимости от уровня глюкозы в крови натощак. Именно высокие показатели постпрандиальной глюкозы связаны с повышенным риском развития макрососудистых осложнений СД, сердечно-сосудистой смерти и смерти от всех причин, поэтому при лечении пациентов с СД 2 типа крайне важно обращать внимание именно на значения глюкозы в крови после еды и включать в схемы лечения те препараты, которые способны оказывать влияние на выраженность постпрандиальных пиков, например на неселективные ингибиторы НГЛТ-2, которые обеспечивают одновременную блокаду НГЛТ-1 и НГЛТ-2.
Приведенные в статье данные свидетельствуют, что дополнительная блокада НГЛТ-1 канаглифлозином обеспечивает более плавное всасывание глюкозы из пищи, что позволяет сгладить постпрандиальные пики гликемии.
Наличие НГЛТ-1 в почечных канальцах может объяснить феномен меньшей эффективности селективных ингибиторов НГЛТ-2. При блокаде НГЛТ-2 в почке их функцию частично берут НГЛТ-1, увеличивая свой вклад в реабсорбцию глюкозы – с 10 до 30–50%. В связи с этим применение неселективных ингибиторов НГЛТ-2, например канаглифлозина, может обеспечить лучший гликемический контроль за счет более выраженного глюкозурического действия в дополнение к эффекту блокады кишечных НГЛТ-1.
Не исключено участие НГЛТ-1 в формировании клубочковой гиперфильтрации и прогрессировании диабетической нефропатии. НГЛТ-1, расположенные в области плотного пятна, потенциально могут регулировать сосудистый тонус. Так, при появлении глюкозы в почечных канальцах в области плотного пятна, например при выраженной гипергликемии или приеме ингибиторов НГЛТ-2, НГЛТ-1 обеспечивают захват глюкозы внутрь клеток MD c активацией каскада реакций, приводящих к расширению афферентной артериолы и повышению гиперфильтрации. Ингибирование НГЛТ-1 нивелирует эти эффекты, снижая выраженность клубочковой гиперфильтрации. С указанным механизмом могут быть связаны нефропротективные эффекты одного из ингибиторов НГЛТ-2 канаглифлозина, который активно применяется в нашей клинической практике. Однако для подтверждения этой гипотезы необходимо проведение дальнейших, хорошо спланированных клинических исследований.
Не меньший интерес вызывает роль НГЛТ-1 в миокарде пациентов с СД 2 типа. НГЛТ-1 практически не участвуют в транспорте глюкозы в норме, но становятся активными игроками в этом процессе при СД. Активный захват глюкозы КМЦ через НГЛТ-1 запускает ряд патологических путей, способствующих развитию оксидативного стресса, миокардиального фиброза и поддержанию хронического воспаления. Ингибирование НГЛТ-1 оказывает выраженный кардиопротективный эффект, связанный с подавлением перечисленных патологических процессов.
Изучение локализации и функции НГЛТ-1 в кишечнике, почках и миокарде помогло понять метаболические и органопротективные эффекты неселективных ингибиторов НГЛТ-2 (канаглифлозина). Новые данные о локализации и предположительной роли НГЛТ-1 в легких, печени, поджелудочной железе, эндометрии и других органах и тканях должны стать предпосылкой для проведения дальнейших клинических исследований, в том числе с участием лиц с СД 2 типа. Более подробное изучение физиологических и патологических функций этих белков-переносчиков может открыть новые возможности в ведении сопутствующих состояний у данной группы больных.
Информация о финансовой поддержке работы
Независимая публикация.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
V.M. Plakhotnyaya, E.Yu. Martynova, Yu.E. Poteshkin, PhD
N.I. Pirogov Russian National Research Medical University
LLC ‘Relevant medicine’, Moscow
Contact person: Viktoria M. Plakhotnyaya, vplahotnyaya@gmail.com
Transmembrane movements of glucose are an important part of glucose metabolism in the human body. Glucose transporters (GLUT) facilitate its diffusion, while sodium-glucose cotransporters (SGLT) actively transport glucose against a concentration gradient. Today, the most studied glucose and sodium cotransporters are SGLT-1 and SGLT-2. SGLT-2 are expressed predominantly in the kidney. They perform the function of reabsorbing glucose from urine. These transporter proteins are the target of innovative antihyperglycemic drugs – SGLT-2 inhibitors. Unlike SGLT-2, SGLT-1 have almost ubiquitous tissue localization. SGLT-1 are located intracellularly and on the membranes of the epithelial cells of the renal tubules, enterocytes and cardiomyocytes. The functional features and the role of SGLT-1 in these organs are now well understood both in healthy people and in patients with type 2 diabetes (T2DM). The increased activity of SGLT-1 in patients with type 2 diabetes may be associated not only with the failure to achieve optimal glycemic control, but also with the development of renal and myocardial damage. In this regard, inhibition of SGLT-1 may be important in the choice of glucose-lowering therapy.
This review describes the localization, functions of SGLT-1 in various organs and tissues, and their role in health and disease. It also considers SGLT-1 as a potential target for pharmacological intervention in T2DM.

