Обезболивающие препараты: критерии выбора
- Аннотация
- Статья
- Ссылки


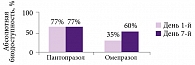

Анальгетический потенциал НПВП
Важность и сложность проблемы адекватного обезболивания у пациентов с соматическими заболеваниями, особенно при сочетанной патологии, обусловлены наличием дополнительных факторов риска, необходимостью приема большого количества лекарственных препаратов и планирования долгосрочной терапии болевого синдрома. Современные концепции развития болевого синдрома отражают постулат «боль есть воспаление и воспалительный ответ». Следовательно, одна из ведущих ролей в инициации и хронизации болевого синдрома принадлежит провоспалительным медиаторам, а именно провоспалительным цитокинам. Синтез последних опосредуется через ядерный фактор транскрипции (NF-κB), активируемый TOLL-рецепторами при повреждении тканей. NF-κB является одним из главных транскрипционных факторов, отвечающих за адаптивные реакции клеток. Активацию NF-κB вызывают физические и химические факторы (радиация, ультрафиолетовый свет, повышенное давление, окислительный стресс, присутствие форболовых эфиров и др.), инфекционные агенты (бактерии, вирусы, паразиты и их продукты), сигнальные молекулы (гормоны, цитокины, ростовые факторы, цАМФ и др.) [1]. NF-κB влияет на различные гены, задействованные в иммунном, острофазовом и воспалительном ответах. К ним относятся гены IL-1β, TNF-α, IL-2, IL-6, IL-12, IL-8 и других хемокинов, индуцибельных ферментов (iNOS, COX-2), молекул клеточной адгезии (ICAM-1, VCAM-1, Е-селектин), главного комплекса гистосовместимости (MHC-I, MHC-II), белков комплемента (В, С3, С4), факторов, контролирующих клеточный цикл (р53, циклин D1 и др.), ингибиторов и активаторов апоптоза (с-IAP1, c-IAP2, FasL, Bcl-2, TRAF-1, TRAF-2 и др.).
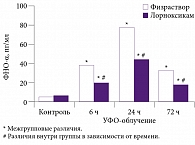
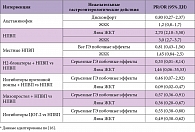
Роль провоспалительных цитокинов заключается в дополнительной сенситизации периферической и центральной нервной системы, а также в органическом повреждении нервных волокон в поврежденной ткани. В связи с этим блокада синтеза провоспалительных цитокинов и, соответственно, снижение сенситизации могут обеспечить дополнительный обезболивающий эффект. Таким действием обладает препарат лорноксикам (в отличие от других нестероидных противовоспалительных препаратов – НПВП), что было продемонстрировано в исследовании, опубликованном в Великобритании в 2008 г. (рис. 1) [2]. Антицитокиновая активность лорноксикама, вероятнее всего, связана с ингибированием NF-κB.
Механизм обезболивающего эффекта НПВП обусловлен блокадой синтеза изоферментов циклооксигеназы (ЦОГ), в частности ЦОГ-2, которая ответственна за синтез провоспалительных цитокинов – триггерных факторов активации болевых рецепторов. Отметим, что побочные эффекты большинства неселективных НПВП связаны с блокадой изофермента ЦОГ-1. При этом практический врач часто забывает, что блокада ЦОГ-1 является причиной резкого снижения синтеза лейкотриенов, которые стимулируют синтез эндогенных опиоидов, обладающих анальгетической активностью. Из известных неселективных НПВП только лорноксикам шунтирует синтез арахидоновой кислоты до лейкотриенов без участия ЦОГ-1, благодаря чему сохраняется синтез эндогенных опиоидов. Этот механизм обеспечивает повышенную анальгетическую активность лорноксикама, что было доказано в большинстве рандомизированных клинических исследований.
Метаанализ, включающий три исследования с участием 673 пациентов, по сравнению эффективности кеторолака, ацетилсалициловой кислоты и лорноксикама продемонстрировал, что для всех доз лорноксикама, превышающих 2 мг, доверительный интервал не включал нулевую величину [3]. Полученные данные свидетельствуют о том, что дозы, равные или превышающие 4 мг, являются достоверно более эффективными при обезболивающем лечении, чем плацебо. Эффективность аспирина 1650 мг соответствует эффективности 4 мг лорноксикама, а эффективность кеторолака 10 мг аналогична эффективности лорноксикама в дозе от 8 до 16 мг. Сопоставимый с наркотическими анальгетиками обезболивающий эффект лорноксикам продемонстрировал в исследованиях, в которых моделью острой боли являлись болевые синдромы после удаления моляров. Описанная в литературе индивидуальная чувствительность к различным НПВП зачастую определяет результативную эффективность препарата в рандомизированных клинических исследованиях. Индивидуальная чувствительность определяется влиянием полиморфизма цитохрома Р450 на фармакокинетику препарата. Так, для метамизола натрия зарегистрировано лишь 2–4% нечувствительных пациентов, для диклофенака натрия – до 25%.
В исследовании, оценивающем влияние полиморфизма Р450 на фармакокинетику лорноксикама, было обнаружено, что кинетика лорноксикама и 5'-гидрокси-лорноксикама одинакова как у лиц, медленно метаболизирующих спартеин/дебризохин или мефенитоин, так и у лиц, быстро метаболизирующих эти вещества, что снижает процент нечувствительных к лорноксикаму пациентов до 2% [4].
Оценка профиля безопасности и прогнозирование эффективности НПВП
Анализ клинических работ и наблюдений позволяет предложить следующую модель стратификации риска нежелательных эффектов НПВП (табл. 1). Наличие соматической полипатии сопряжено с изменениями болевой чувствительности и, следовательно, с трудностями в прогнозировании эффективности определенных доз НПВП. Следует отметить также связь гипогонадизма с неэффективностью синтеза эндогенных морфинов в ответ на боль, что повышает интенсивность болевых ощущений. Высокая распространенность гипогонадизма наблюдается среди пациентов с хроническими неинфекционными заболеваниями: у мужчин – 79,1%, у женщин – до 85%.
Лечение и профилактика острых гастродуоденальных поражений на фоне приема НПВП
Важнейшей причиной развития острых гастродуоденальных поражений и кровотечений является прием НПВП, наиболее активными потребителями которых являются пожилые люди и пациенты с хроническим болевым синдромом. Основными показаниями для назначения НПВП являются воспалительные процессы различного происхождения и локализации, боль, лихорадка, склонность к развитию тромбозов и др.
Длительное или регулярное применение ацетилсалициловой кислоты и других неселективных НПВП у чувствительных больных приводит к целому ряду характерных побочных эффектов, среди которых поражения ЖКТ являются наиболее опасными. Основной механизм патогенеза НПВП-гастропатии: нарушение микроциркуляции в слизистой оболочке желудка вследствие резкого уменьшения синтеза физиологического пула простагландинов, к которому приводит необратимая блокада ЦОГ-1 неселективными НПВП. Уменьшение синтеза нормальных «невоспалительных» простагландинов, в свою очередь, приводит к резкому снижению секреции бикарбоната, муцина и нарушению физиологической репарации (пролиферации и ангиогенеза) эпителия желудка – трех основных гастропротективных механизмов. В этих условиях толерантность гастродуоденальной слизистой оболочки к повреждающему действию соляной кислоты, ишемии желудка и компонентов пищи резко уменьшается, и происходит образование множественных повреждений: острых язв или эрозий слизистой оболочки.
Вызванные НПВП поражения ЖКТ условно подразделяют на несколько основных категорий:
- симптоматические (НПВП-диспепсия): тошнота, рвота, диарея, запоры, изжога, боли в эпигастральной области;
- НПВП-гастропатия: субэпителиальные геморрагии, эрозии и язвы желудка, реже – двенадцатиперстной кишки (ДПК), выявляемые при эндоскопическом исследовании; желудочно-кишечные кровотечения (ЖКК);
- НПВП-энтеропатия.
В целом симптомы поражения ЖКТ на фоне терапии НПВП наблюдаются у 30–40% больных и в 5–15% случаев могут являться причиной отмены лечения уже в течение первых 6 месяцев. В остальных случаях диспепсия не сопровождается эрозивно-язвенными изменениями слизистой ЖКТ, хотя и снижает толерантность слизистой оболочки и существенно увеличивает риск кровотечения. Нередко НПВП-гастропатия не сопровождается развитием каких-либо симптомов, предшествующих тяжелому поражению ЖКТ или кровотечению. Таким образом, наибольшее клиническое значение имеет ассоциированное с НПВП эрозивно-язвенное поражение верхних отделов ЖКТ – желудка или ДПК (НПВП-гастропатия), которое может стать причиной ЖКК и летального исхода.
Согласно анализу, проведенному Управлением по контролю за качеством пищевых продуктов и медикаментов США (FDA), ежегодно НПВП-гастропатии являются причиной от 100 до 200 тыс. госпитализаций и от 10 до 20 тыс. смертельных исходов. НПВП-гастропатии являются причиной 10–15% острых ЖКК, летальность при которых достигает 10%. Так, в 1997 г. в США кровотечения вследствие НПВП-гастропатии стали причиной 16 500 летальных исходов. В Великобритании НПВП ежегодно становятся причиной около 12 000 острых кровотечений и 1200 летальных исходов [5].
НПВП-гастропатия не имеет предикторов и специфических клинических симптомов, не приводит к появлению специфичных жалоб, часто развивается внезапно и, таким образом, может быть спрогнозирована только посредством выявления предикторов и факторов высокого риска ЖКК (табл. 2). Установлено, что наиболее высокая вероятность развития НПВП-гастропатии существует в течение первых 3 месяцев терапии НПВП. К числу провоцирующих факторов необходимо также отнести: курение, злоупотребление алкоголем, отягощенный коморбидный статус и одновременный прием лекарственных средств, уменьшающих репарационный потенциал слизистой оболочки желудка (например, b-блокаторов).
Тяжелые формы НПВП-гастропатии чаще развиваются вследствие терапии аспирином, чем другими НПВП, поскольку обычные препараты ацетилсалициловой кислоты также обладают местнораздражающим действием на слизистую оболочку желудка. Важно также помнить, что терапия высокоселективными НПВП – блокаторами ЦОГ-2 у больных группы риска часто не приводит к ожидаемому снижению риска ЖКК, поскольку в этих случаях возникает необходимость приема более высоких доз препаратов. У большинства же НПВП, обладающих активным анальгезирующим действием, уровень селективности невысокий. Сочетание высокоселективных НПВП и аспирина в небольших дозах является небезопасным для ЖКТ.
Для уменьшения частоты развития опасных ЖКТ-осложнений был создан новый класс НПВП – селективные ингибиторы ЦОГ-2 (с-НПВП). К ним относятся семейство коксибов (целекоксиб, рофекоксиб, эторикоксиб и др.), мелоксикам, нимесулид и др. Результаты ряда крупных исследований, таких как MELISSA, CLASS, VIGOR, TARGET и др., подтвердили, что на фоне приема этих препаратов серьезные ЖКТ-осложнения (ЖКК и перфорации язв) возникают значительно реже, чем при использовании традиционных НПВП (неселективных, н-НПВП). Последним из крупных рандомизированных контролируемых исследований, посвященных изучению безопасности с-НПВП, стало 12-недельное исследование SUCCESS-1, в котором сравнивались целекоксиб 200 и 400 мг/сут (n = 8800) и два н-НПВП: напроксен 1000 мг/сут и диклофенак 100 мг/сут (n = 4394). Результаты показали существенно меньшее количество опасных ЖКТ-осложнений на фоне приема целекоксиба: два случая (0,1 на 100 пациенто-лет) против семи (0,8 на 100 пациенто-лет) на фоне приема препаратов сравнения (р = 0,008). Однако считать с-НПВП полностью безопасными нельзя. В связи с разразившимся в 2004 г. «кризисом коксибов» особую актуальность приобрела проблема кардиоваскулярной безопасности с-НПВП. В частности, в упомянутом выше исследовании SUCCESS-1 за трех- месячный период инфаркт миокарда возник у 10 больных, принимавших целекоксиб, и лишь у одного из получавших препараты сравнения (статистический анализ не показал достоверности этого отличия).
Появляется все больше данных, свидетельствующих о высоком риске ЖКТ-осложнений при приеме с-НПВП. Так, масштабное исследование, проведенное в Канаде, показало, что относительный риск развития ЖКК у пациентов пожилого возраста, принимавших рофекоксиб (n = 14 583), оказался почти в 2 раза выше (1,9 раза), чем у лиц, не получавших НПВП. В крупном популяционном исследовании, проведенном в Европе, оценивался риск развития ЖКК на фоне приема различных НПВП. Среди НПВП наименьший риск был показан для целекоксиба – OR 0,3 (однако авторы отмечают, что эта оценка основана на единичных наблюдениях), промежуточный – для нимесулида (OR 3,2) и мелоксикама (OR 5,7), а наибольший – для диклофенака натрия (7,9).
Совместный прием с-НПВП и низких доз аспирина существенно повышает риск ЖКТ-осложнений. В исследовании CLASS было показано, что частота ЖКК и перфораций язв у больных, принимавших целекоксиб совместно с аспирином, и пациентов, получавших ибупрофен и диклофенак, практически не различалась и составляла 2,01 и 2,12% соответственно. Важные результаты получены при оценке частоты рецидивов ЖКК у пациентов (n = 287), имевших в анамнезе это осложнение и получавших целекоксиб 400 мг или диклофенак 150 мг в комбинации с омепразолом 20 мг/сут. Частота ЖКК через 6 месяцев составила 4,9 и 6,4% соответственно (различие недостоверно).
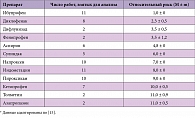
Выявление НПВП-гастропатии и оказание помощи нередко бывает отсрочено, поскольку связь поражения желудка или ЖКК с приемом неселективных НПВП часто упускают. Кроме того, потенциальная токсичность для гастродуоденальной слизистой оболочки различных неселективных НПВП неодинакова, и сам по себе факт приема НПВП не должен трактоваться как несомненная причина гастродуоденального поражения. С другой стороны, выбор в начале лечения препарата, наиболее безопасного с точки зрения гастротоксичности, может быть одним из способов уменьшения риска развития НПВП-гастропатии (табл. 3).
Механизм действия НПВП хорошо известен и оценен Нобелевским комитетом, присудившим сэру Джону Вейну заслуженную награду, и эти препараты заняли прочное место в клинической практике.
Риск острого эрозивно-язвенного поражения гастродуоденальной слизистой на фоне приема НПВП резко увеличивается у пожилых больных с атеросклерозом аорты и сердечной недостаточностью вследствие хронической ишемии гастродуоденальной слизистой оболочки. Обострение ишемической болезни сердца, в частности при остром инфаркте миокарда, особенно повторном, приводит к декомпенсации кровообращения в слизистой желудка и развитию острых язв или эрозий, являющихся причиной значимого ЖКК. Эта вторая по частоте причина кровотечений у пожилых пациентов (особенно с анамнезом пептической ЯБ и сахарным диабетом) на практике часто недооценивается. Между тем в России в 2003–2004 гг. было проведено фундаментальное исследование частоты и распространенности острых эрозивно-язвенных повреждений гастродуоденальной слизистой у больных с острым инфарктом миокарда [6]. По данным 3008 патологоанатомических вскрытий оказалось, что острые эрозии и язвы желудка и ДПК встречаются у 10% больных, умерших от острого инфаркта миокарда. Среди них частота эрозий составляет 48,7%, язв – 24%, петехиальных кровоизлияний – 20,4%. Более чем у 20% больных эти повреждения привели к ЖКК с развитием острой постгеморрагической анемии.
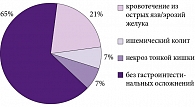
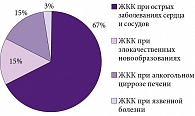
Единственной эффективной стратегией реальной профилактики поражения гастродуоденальной слизистой оболочки является назначение антисекреторных препаратов больным с высоким риском развития НПВП-гастропатии и ЖКК. Этот риск имеет место у большинства пациентов отделений неотложной кардиологии, госпитализированных в многопрофильный стационар СМП. Например, ЖКК составляют около 20% (рис. 2) среди всех смертельных осложнений – непосредственных причин летального исхода у пациентов с сахарным диабетом. Кроме того, на практике эти больные нередко не получают адекватного лечения артериальной гипертензии и сахарного диабета, не имеют доступа к оперативной реваскуляризации сердца. Повсеместно риск ЖКК у этих пациентов не стратифицируется, и они не получают адекватной антисекреторной терапии ни с целью профилактики желудочных кровотечений в амбулаторных условиях, ни на фоне обострения ИБС в стационаре. В этих условиях активная и профилактическая антиагрегантная терапия при остром коронарном синдроме также является рискованной (рис. 3).
Лечение НПВП-гастропатии
Полное прекращение приема НПВП само по себе не приводит к заживлению НПВП-гастропатии у большинства больных. Косвенные данные по этой проблеме дает оценка эффективности плацебо в исследовании G. Tildesley: за 4 недели заживление язв желудка и ДПК отмечалось менее чем у половины больных, которым были отменены НПВП [7].
Ингибиторы протонной помпы (ИПП), несомненно, занимают лидирующую позицию среди средств, используемых для лечения НПВП-гастропатий, – они удобны в применении, эффективны и относительно безопасны. Имеется достаточное количество доказательств эффективности лечебного курса этой группы препаратов. Многолетняя проблема гастротоксичности большинства НПВП сегодня может быть решена обязательным назначением ингибиторов протонной помпы для профилактики эрозивно-язвенных повреждений слизистой оболочки верхних отделов ЖКТ (табл. 4), поскольку анализ РКИ продемонстрировал наибольшее снижение риска данных побочных эффектов при назначении ИПП.
ИПП имеют единый механизм действия, сравнимый клинический эффект, но различаются по скорости и особенностям активации в зависимости от внутриклеточного рН (так называемая рН-селективность), продолжительности и выраженности кислотоснижающего эффекта, особенностям метаболизма в системе цитохрома Р450, побочным эффектам и профилю безопасности. Наилучшие результаты по переносимости среди ИПП показывает пантопразол: при его приеме незначительные побочные эффекты зафиксированы только у 1,1% пациентов.
Пантопразол (Контролок) снижает уровень базальной и стимулированной (независимо от вида раздражителя) секреции соляной кислоты в желудке. Известно, что пантопразол единственный из всех ИПП вызывает необратимую блокаду протонной помпы, а не временное прерывание химической связи, при этом кислотность восстанавливается за счет синтеза новых протонных помп. Тем не менее подавление секреции соляной кислоты сохраняется примерно в течение трех суток. Это обусловлено достижением определенного баланса между количеством вновь синтезируемых молекул протонных помп и количеством уже ингибированных молекул. Единичная в/в доза пантопразола обеспечивает быструю (в течение 1 часа) дозозависимую ингибицию кислотной продукции: при введении 40 мг кислотная продукция уменьшается на 86%, 60 мг – на 98%, 80 мг – на 99%, причем уменьшается не только кислотная продукция, но и объем желудочной секреции. После внутривенного введения стандартной дозы пантопразола 80 мг через 12 часов степень снижения кислотности составляет 95%, а через 24 часа – 79%. Именно поэтому время для возобновления исходной кислотопродукции составляет для ланзопразола около 15 ч, для омепразола и рабепразола – около 30 ч, для пантопразола – примерно 46 ч. Таким образом пантопразол имеет дополнительное преимущество в виде наиболее продолжительного кислотоснижающего эффекта.
Контролок обладает постоянной линейной предсказуемой фармакокинетикой (рис. 4). При удвоении дозы ИПП, имеющих нелинейную фармакокинетику, их концентрация в сыворотке крови будет либо ниже, либо выше ожидаемой, т.е. она непредсказуема. Это может привести к неадекватному контролю секреции кислоты или оказать влияние на безопасность использования препарата. Кроме того, пантопразол, в отличие от других ИПП, имеет наиболее низкую аффинность к печеночной цитохром-Р450-ферментной системе. При одновременном применении нескольких препаратов, метаболизирующихся цитохромом Р450, их эффективность может меняться. Пантопразол не влияет на активность цитохрома Р450, поэтому не дает клинически значимых перекрестных реакций с другими лекарственными средствами. Это значительно расширяет область его применения с достижением хорошего профиля безопасности. Дополнительным преимуществом данного препарата является наличие пероральной и парентеральной форм, позволяющее обеспечить преемственность терапии.
Таким образом, при наличии высокого риска эрозивно-язвенного поражения слизистой оболочки верхних отделов ЖКТ необходимо немедленное назначение ингибиторов протонной помпы, среди которых пантопразол имеет ряд преимуществ. Высокая эффективность, линейная фармакокинетика и отсутствие взаимодействия с другими лекарствами делают пантопразол универсальным ингибитором протонной помпы.
Другие побочные эффекты НПВП
Особую обеспокоенность вызывает риск кардиотоксичности и негативного влияния некоторых НПВП на синтез протеогликанов хряща. Большой резонанс вызвали результаты исследования VIGOR (Vioxx Gastrointestinal Outcomes Research), свидетельствующие о более высокой частоте развития инфаркта миокарда у пациентов с ревматоидным артритом, получавших ингибитор ЦОГ-2 рофекоксиб (0,5%), чем у больных, получавших НПВП (напроксен) (0,1%) [8]. При этом доза рофекоксиба, применявшаяся в этом исследовании, была в 2 раза выше, чем рекомендуемая. Кроме того, было описано четыре клинических наблюдения развития тромбозов у пациентов с системной красной волчанкой и антифосфолипидным синдромом, получавших целекоксиб. На основании анализа результатов клинических испытаний рофекоксиба и целекоксиба было высказано предположение о том, что кардиоваскулярные осложнения являются класс-специфическим побочным эффектом ингибиторов ЦОГ-2. Полагают, что они могут снижать ЦОГ-2-зависимый синтез PGI2 клетками сосудистого эндотелия, но не влияют на ЦОГ-1-зависимый синтез TхA2 тромбоцитами, что потенциально может приводить к нарушению баланса PGI2/TхA2 и, следовательно, к активации, агрегации и адгезии тромбоцитов и увеличению риска тромбообразования. Принципиальная возможность этого негативного сценария получила определенные экспериментальные подтверждения [9]. В 2006 г. был опубликован метаанализ, продемонстрировавший повышение риска инфаркта миокарда при приеме селективных ингибиторов ЦОГ-2 по сравнению с плацебо [10]. Для двух препаратов – рофекоксиба и целекоксиба – риск оказался статистически значимо выше, а для трех – эторикоксиба, лумиракоксиба и валдекоксиба – риск значимо не отличался от плацебо, но число РКИ и пациентов, принимавших в них участие, было в 6,5 раз меньше, чем для первых двух средств. Обобщенный риск инфаркта миокарда при приеме селективных ингибиторов ЦОГ-2 составил 0,6% в год, а при приеме плацебо – 0,3% в год (OR 1,86; 95% ДИ 1,33–2,59). Схожие результаты были получены и для общего числа сосудистых осложнений, а в отношении количества инсультов и смертей от сосудистой патологии статистически значимых различий обнаружено не было. Для традиционных НПВП также были получены сведения о повышении сердечно-сосудистого риска, они были опубликованы как в вышеупомянутом метаанализе РКИ, так и в систематическом обзоре обсервационных исследований [11] и в анализе реестра [12]. Суммируя результаты этих публикаций, можно отметить, что для ибупрофена отмечено повышение риска повторных инфарктов миокарда и риска смерти (по результатам анализа реестра), но риск увеличения числа сосудистых осложнений не возрастал; для диклофенака отмечено статистически значимое повышение риска по всем параметрам, включая повторные инфаркты миокарда и увеличение смертности. Это дало основание Американской ассоциации сердца посчитать, что применение селективных ингибиторов ЦОГ-2 сопряжено со значительным увеличением риска у пациентов с кардиоваскулярной патологией и не может быть рутинным в клинической практике [13].
Следует признать, что увеличение смертности от тромботических осложнений у пациентов с кардио-васкулярными заболеваниями является класс-специфическим эффектом НПВП. Однако эффект кардиотоксичности имеет значимые различия у препаратов этого класса. Исследования in vitro демонстрируют лучший показатель сбалансированной ингибиции изоферментов ЦОГ у лорноксикама. Также установлена прямая корреляция между приемом НПВП и анамнезом кардиальной патологии у пациентов с первым эпизодом сердечной недостаточности. Результаты исследования J. Page и соавт. представлены в таблице 5 [14].
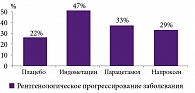
Более того, для некоторых НПВП характерным является негативное воздействие на хрящ в виде блокады синтеза протеогликанов и, как следствие, прогрессирование болезни. Показано, что в наибольшей степени отрицательно на хрящ при остеоартрозе (ОА) влияют производные индол/инденуксусной кислоты (индометацин), хотя и производные пропионовой кислоты (ибупрофен, напроксен и др.) также примерно на 30% ускоряют прогрессирование ОА (по данным рентгенографии). Все неселективные НПВП снижают синтез ГАГ, необходимых для регенерации хряща (рис. 5, 6) [18]. Однако для ряда неселективных НПВП (например, лорноксикама) доказано отсутствие супрессивного влияния на синтез глюкозаминогликанов.
Дополнительный анализ пре- и пострегистрационных исследований лорноксикама позволяет выявить ряд дополнительных преимуществ этого препарата:
- отсутствие негативного влияния на хрящ – лучшая переносимость при ОА в сравнении с коксибами;
- низкий процент эрозивно-язвенных поражений слизистой оболочки верхних отделов ЖКТ в спектре гастроэнтерологических побочных эффектов;
- отсутствие зависимости частоты выявления побочных эффектов от возраста (моложе и старше 65 лет);
- отсутствие значимого влияния на артериальное давление.
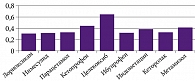
По данным VirtualToxLab™ 3.8.7 (Estimating the toxic potential of drugs, chemicals and natural products, 2010), токсический потенциал лорноксикама среди НПВП представляется самым низким (рис. 7). Анализируя современные литературные данные, представляется, что лорноксикам сочетает оптимальный профиль анальгетического потенциала и безопасности в аспекте длительного перманентного применения, что делает его препаратом выбора для лечения ОА.

