Основные принципы фармакотерапии рецидивирующих инфекций мочевых путей
- Аннотация
- Статья
- Ссылки
Рецидивирующие инфекции нижних мочевых путей (РИНМП) являются широко распространенными заболеваниями, которые с трудом поддаются лечению. Как правило, терапия РИНМП включает курсы антибиотиков и растительных препаратов, обладающих противовоспалительным и мочегонным действием.
Канефрон® Н – комбинированный лекарственный препарат, который оказывает комплексное действие: диуретическое, спазмолитическое, противовоспалительное, антиоксидантное, антимикробное и нефропротективное. Эффективность и безопасность препарата Канефрон® Н в лечении РИНМП подтверждены результатами целого ряда клинических исследований и опытом применения препарата как в России, так и за рубежом.
Рецидивирующие инфекции нижних мочевых путей (РИНМП) являются широко распространенными заболеваниями, которые с трудом поддаются лечению. Как правило, терапия РИНМП включает курсы антибиотиков и растительных препаратов, обладающих противовоспалительным и мочегонным действием.
Канефрон® Н – комбинированный лекарственный препарат, который оказывает комплексное действие: диуретическое, спазмолитическое, противовоспалительное, антиоксидантное, антимикробное и нефропротективное. Эффективность и безопасность препарата Канефрон® Н в лечении РИНМП подтверждены результатами целого ряда клинических исследований и опытом применения препарата как в России, так и за рубежом.

Инфекции мочевых путей (ИМП) представляют серьезную проблему для здоровья миллионов людей: ежегодно в Западной Европе регистрируется свыше 10 млн случаев ИМП [1]. При ИМП отмечается высокая частота рецидивов инфекции, которая принимает хронический характер и протекает с частыми обострениями. При неосложненной инфекции нижних мочевых путей воспалительный процесс затрагивает слизистую оболочку уретры и мочевого пузыря, в дальнейшем, при восходящем пути инфицирования, он может распространяться и на почечную лоханку. Поражение почечной паренхимы инфекционно-воспалительным процессом может привести к развитию пиелонефрита, хронической почечной недостаточности и бактериемии.
Рецидивирующие инфекции нижних мочевых путей у женщин остаются в настоящее время весьма распространенным и трудно поддающимся лечению заболеванием. Инфекции мочевых путей – одно из самых частых заболеваний у женщин репродуктивного возраста. Ежегодно в США диагностируется 7 млн случаев РИНМП среди женщин. У 25–35% пациенток в возрасте от 20 до 40 лет отмечается, по крайней мере, один эпизод инфекции в год, а к 65 годам он развивается у каждой третьей женщины [2, 3]. В период постменопаузы риск РИНМП возрастает, что обусловлено изменениями, связанными с дефицитом эстрогенов.
Для обозначения заболевания существует более 20 терминов, отображающих его этиологию и патогенез. До внедрения в урологическую практику эндоскопических методов исследования подобные состояния обозначались как cystospasm, vesica hysterica, neuralgia vesicae и т.д., что соответствовало представлениям о нейрогенном генезе РИНМП. С появлением цистоуретроскопии появились новые термины: cystitis colli, trigonitis, cystitis trigoni, отражающие представления о воспалительной природе заболевания. Однако отсутствие ответа на ряд вопросов – почему заболеванию подвержены только женщины, почему неэффективна противовоспалительная антибактериальная терапия, почему моча таких больных, как правило, стерильна – способствовало широкому распространению таких терминов, как цисталгия, цистопатия, асептический уретрит, уретральный синдром. Высокая частота РИНМП у гинекологических больных обусловила появление таких определений, как генитально-пузырная дисфункция, гинекологический невроз мочевого пузыря. Термин «рецидивирующие инфекции нижних мочевых путей» представляется наиболее удачным, так как является собирательным понятием, объединяющим воспалительные заболевания мочеиспускательного канала и мочевого пузыря, протекающие со сходными клиническими проявлениями.
В международной литературе существует однозначное определение неосложненной инфекции мочевых путей – это инфекция у здоровой небеременной амбулаторной пациентки в возрасте 16–65 лет, не сопровождающаяся лихорадкой [4, 5]. РИНМП следует разделять на вновь возникающие (эндогенная реинфекция) и инфекции с новым микроорганизмом (экзогенная рецидивирующая инфекция). У женщин чаще наблюдается последняя форма. При экзогенных рецидивирующих инфекциях в ходе дальнейшей диагностики обычно не выявляют анатомических отклонений. Различают неосложненные и осложненные инфекции верхних или нижних мочевых путей. К неосложненным инфекциям мочевых путей относят острые циститы, пиелонефриты и уретриты у больных, чаще женщин, при отсутствии каких-либо нарушений оттока мочи из почек или из мочевого пузыря и структурных изменений в почках или мочевыводящих путях, а также у пациентов без серьезных сопутствующих заболеваний. Это обычный острый восходящий цистит или пиелонефрит без нарушения оттока мочи, сопровождающийся расстройствами мочеиспускания, наличием примесей гноя в моче, иногда – крови в моче, субфебрильной температурой тела и болями в боку. В большинстве случаев острый цистит является поверхностной инфекцией слизистой мочевого пузыря, которая легко поддается терапии антимикробными препаратами. В то же время цистит очень часто рецидивирует, даже у пациентов с анатомически нормальными мочевыми путями.
Этиология и патогенез
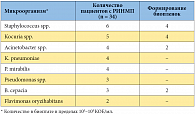
Осложненные ИМП вызываются большим количеством разнообразных грамотрицательных и грамположительных микроорганизмов. Спектр возбудителей данных инфекций определяется географическим регионом, а также зависит от профиля отделения, даже в пределах одного лечебного учреждения. По данным четырех крупномасштабных исследований бактериальных возбудителей нозокомиальных ИМП (SENTRY, 1998; ESGNI-003, 2000; PEP, 2003 и исследования структуры госпитальных ИМП г. Штраубинга, 2001), в 70–80% случаев этиологическими агентами инфекций являлись такие грамотрицательные микроорганизмы, как E. coli, Pseudomonas spp., Proteus spp., Klebsiella spp., Enterobacter spp. Грамположительные бактерии вызывали осложненные ИМП в 15–30% случаев и были представлены энтерококками и стафилококками [6]. При длительном дренировании (более 28 дней) мочевых путей у больных с нейрогенными расстройствами мочеиспускания полимикробную бактериурию выявляют практически во всех случаях. При длительном дренировании мочевого пузыря из мочи больных часто выделяют такие микроорганизмы, как E. coli, Pseudomonas spp., Proteus spp., Morganella spp., Acinetobacter spp., Enterococcus spp., P. stuartii (табл. 1). Особое значение в развитии ИМП у больных с нейрогенными расстройствами мочеиспускания имеет образование биопленки на поверхности мочевого дренажа [4, 7, 8]. Биопленка представляет собой скопление микроорганизмов и продуктов их жизнедеятельности, формирующих структурное сообщество, связанное с какой-либо поверхностью. Биопленка формируется в три этапа:
-
синтез пленки вокруг инородного тела (мочевого дренажа) микроорганизмом;
-
прикрепление микроорганизмов с последующей микробной адгезией за счет образования экзополимера;
-
рост, размножение и распространение биопленки.
При воздействии уреазы на мочевину повышается рН мочи и в гель матрикса биопленки добавляются ионы кальция и магния, что приводит к образованию кристаллов фосфата кальция и магния с аммонием. Формирование кристаллов в щелочной моче и прикрепление бактерий к поверхности биопленки способствуют ее агрегации и росту. Основным структурным элементом биопленки является микроколония – оформленное в матриксе сообщество из бактериальных клеток одного или нескольких видов. Обычно биопленка состоит из трех слоев: прикрепленного к дренажу, основного (микроорганизмы) и свободного поверхностного слоя. Биопленка является особой формой выживания бактерий, которая резистентна не только к антимикробным препаратам, но и к факторам защиты макроорганизма, что может приводить к развитию хронических персистирующих инфекций. Бактерии в составе биопленки обладают кооперативной чувствительностью и взаимодействуют друг с другом. Кроме того, в пределах как моно-, так и полимикробных пленок между различными штаммами и видами бактерий осуществляется передача генетической информации, которая обусловливает лекарственную устойчивость. В биопленках бактерии обычно выживают при концентрациях антимикробных препаратов, в 1000–1500 раз превышающих необходимые для гибели микроорганизмов того же вида в форме планктона.
В присутствии мочевого дренажа ИМП могут распространяться следующим образом: восходящим путем (по биопленкам и просвету дренажа) и с турбулентным потоком бактерий в виде планктона. Неполное опорожнение мочевого пузыря, обструктивные уропатии, пузырно-мочеточниковый рефлюкс также способствуют восходящему развитию ИМП. Предрасполагающими факторами ИМП у больных с нейрогенными расстройствами мочеиспускания являются инфравезикальная обструкция, катетеризация мочевого пузыря и другие инструментальные вмешательства [4, 8]. Возникновению ИМП у больных с нейрогенными расстройствами мочеиспускания также способствует
нарушение трофики тканей мочеиспускательного канала и мочевого пузыря.
Причины рецидивирования
Высокая частота рецидивов ИМП обусловлена следующими факторами [6]
-
анатомо-физиологическими особенностями женского организма (короткая и широкая уретра, ее близость к естественным резервуарам инфекции – анусу, влагалищу);
-
способностью грамотрицательных микроорганизмов, вызывающих инфекционный процесс в уретре и мочевом пузыре, к адгезии к клеткам эпителия вследствие наличия фимбрий и ворсин;
-
частыми сопутствующими гинекологическими заболеваниями;
-
воспалительными процессами влагалища, гормональными нарушениями, приводящими к дисбиозу влагалища и размножению в нем патогенной микрофлоры;
-
генетической предрасположенностью (наличие антигенов системы АВ0);
-
частотой половых актов и характером применяемых контрацептивов.
Фармакотерапевтические возможности
Таким образом, поиск возможных путей решения проблемы ИМП, и в частности рецидивирующих форм, требует объединения усилий акушеров-гинекологов и урологов. Согласно рекомендациям по лечению ИМП, этиологической является антибактериальная терапия. Выбор препарата должен основываться на результатах длительных многоцентровых плацебоконтролируемых исследований. Такое исследование (ARESC) было проведено в 2003–2006 гг. В ходе исследования были определены возбудители неосложненных ИМП и их чувствительность к антибактериальным препаратам. Оказалось, что более чем в 70% случаев возбудителями ИМП являются грамотрицательные микроорганизмы (E. coli). При назначении антибактериальной терапии целесообразным является выбор препаратов, резистентность к которым составляет менее 10%. При беременности рекомендовано применение защищенных пенициллинов, цефалоспоринов II–III поколения 7-дневными курсами. Фосфомицина трометамол, который обладает пролонгированным (до 80 ч) действием, может назначаться однократно. Следует учесть, что проведение курса антибактериальной терапии (в том числе у беременных) не является гарантией отсутствия рецидивов заболевания. Так, по данным метаанализа клинических исследований ципрофлоксацина, частота эрадикации возбудителей острого цистита у женщин при трех- и семидневном приеме препарата составила 95% (340 из 359 и 241 из 255 больных соответственно), а частота рецидивов – 14 и 18% соответственно [4, 6].
Лечение
Особенностью хронических заболеваний мочевыводящих путей очень часто является бессимптомное течение, вследствие чего они нередко обнаруживаются только при значительном снижении функции почек. Такие заболевания лечат длительно, чередуя курсы антибиотиков и растительных препаратов. Принципы современной терапии острого пиелонефрита можно представить следующим образом:
-
рациональное назначение перорального или парентерального антибиотика;
-
использование нестероидных противовоспалительных средств;
-
обильное введение в организм жидкости (перорально или внутривенно);
-
госпитализация (при пиелонефрите тяжелого течения, осложненной форме или сепсисе).
Важно отметить, что при выявлении осложненной инфекции мочевыводящих путей обязательной является эрадикация поддающихся коррекции осложняющих факторов. Так, при остром обструктивном пиелонефрите прежде всего необходимо восстановить отток мочи из пораженной почки путем катетеризации лоханки или установления пункционной нефростомы.
При неосложненном пиелонефрите (неосложненной инфекции верхних мочевых путей) продолжительность антибиотикотерапии обычно составляет 7–14 дней. При остром неосложненном пиелонефрите легкой и средней тяжести рекомендуется терапия пероральными фторхинолонами, такими как ципрофлоксацин или левофлоксацин. В качестве альтернативы (при распространенности в популяции E. сoli, продуцирующей бета-лактамазу расширенного спектра действия, менее 10%) могут быть использованы пероральные цефалоспорины III поколения – цефтибутен. Амоксициллин/клавуланат не рекомендуется для эмпирической терапии пиелонефрита. Его применение целесообразно только при выявлении чувствительного грамположительного микроорганизма. В популяциях с высокой (более 10%) резистентностью к фторхинолонам и высокой распространенностью (более 10%) кишечной палочки с бета-лактамазой расширенного спектра действия исходная эмпирическая терапия до получения результатов посева проводится парентерально аминогликозидом или карбапенемом.
При неосложненном пиелонефрите тяжелого течения (с тошнотой и рвотой), когда пациент не может принимать препараты перорально, изначально терапия проводится парентеральным антибиотиком, относящимся к одной из перечисленных выше групп. Пациентки с пиелонефритом тяжелого течения обязательно должны быть госпитализированы и получать инфузионную терапию. По окончании 1–2-недельного курса антибиотикотерапии острого пиелонефрита в случае сохранения у пациентки каких-либо симптомов показано контрольное бактериологическое исследование мочи. У больных, перенесших острую инфекцию нижних или верхних мочевых путей, для поддержания уровня диуреза (2 и более литров в сутки) целесообразно обильное потребление жидкости.
В настоящее время отмечается явный рост интереса к фитотерапии – лечению лекарственными средствами растительного происхождения. Фитотерапия имеет давнюю историю: первые упоминания о ней относятся к XXVII веку до н.э. На сегодняшний день эффективность применения лекарственных растений доказана не только опытом лечения, но и с помощью биохимических, биологических (на молекулярном и клеточном уровне), а также структурно-аналитических методов. Современная медицина научилась работать с растениями и использовать их потенциал. Актуальность фитотерапии сегодня обусловлена следующими факторами:
-
экстракты лекарственных растений не уступают по эффективности химическим веществам, а нередко даже превосходят их;
-
фитотерапевтическое лечение характеризуется низким риском развития осложнений и нежелательных побочных эффектов;
-
комплексные фитотерапевтические препараты обладают дополнительными преимуществами благодаря их многокомпонентному разнонаправленному действию.
Таким образом, растительные препараты, обладающие противовоспалительным и мочегонным действием, приобретают все большее значение в терапии заболеваний мочевыводящих путей. Применять растительные препараты можно в течение длительного времени, они редко вызывают осложнения и нежелательные побочные действия. Канефрон® Н – комбинированный лекарственный препарат, в состав которого входят трава золототысячника (Centaurium umbellatum), корень любистока (Levisticum officinale) и листья розмарина (Rosmarinus officinale), оказывающие разнонаправленное действие на человеческий организм (табл. 2).
Фармакологические эффекты препарата Канефрон® Н
Препарат оказывает комплексное диуретическое, спазмолитическое, противовоспалительное, антиоксидантное, антимикробное, нефропротективное действие, обладает способностью снижать выраженность протеинурии и концентрацию мочевины и креатинина в сыворотке крови. Доказана способность Канефрона Н влиять на кристаллизацию солей и тормозить камнеобразование. Наиболее активными компонентами препарата Канефрон® Н являются фенольные гликозиды и фенолкарбоновые кислоты (розмарин, любисток, золототысячник), фталиды (любисток), секоиридоиды (золототысячник), эфирные масла (любисток, розмарин), флавоноиды (золототысячник, розмарин). Входящие в состав препарата вещества оказывают антисептическое, спазмолитическое, противовоспалительное действие на мочеполовой тракт, уменьшают проницаемость капилляров почек, обладают диуретическим эффектом, улучшают функцию почек, потенцируют эффект антибактериальной терапии. В траве золототысячника присутствуют алкалоиды, флавоноидные соединения, горькие гликозиды, феноловые кислоты. В состав любистока входят эфирные масла, фенолкарбоновые кислоты, фталиды. Розмарин содержит розмариновую кислоту, эфирные масла и флавоноиды.
Различные механизмы действия препарата Канефрон® Н на организм определяются входящими в его состав эфирными маслами (любисток, розмарин), фенолкарбоновыми кислотами (розмарин, любисток, золототысячник), фталидами (любисток), горечами (золототысячник). Диуретический эффект Канефрона Н обусловлен комплексным воздействием лекарственных веществ препарата на различные мишени. Эфирные масла расширяют сосуды почек, что способствует улучшению кровоснабжения почечного эпителия, а также оказывают влияние на функцию эпителия почечных канальцев. Это проявляется, главным образом, в уменьшении реабсорбции ионов Na+ и воды. Диуретическое действие фенолкарбоновых кислот объясняется осмотическим эффектом: при попадании в просвет почечных канальцев они создают высокое осмотическое давление (обратному всасыванию эти препараты не подвергаются), вследствие чего значительно снижается реабсорбция воды и ионов Na+. В результате выведения из организма избытка жидкости и солей натрия снижается артериальное давление. Растительные мочегонные препараты обладают более щадящим действием по сравнению с современными синтетическими препаратами. Как известно, основные признаки воспаления связывают с действием медиаторов воспаления (брадикинин, простагландины, гистамин, серотонин и др.). Противовоспалительные свойства Канефрона Н в основном обеспечиваются розмариновой кислотой и связаны с подавлением синтеза медиаторов воспаления или замедлением их высвобождения и активации.
Все лекарственные растения, входящие в состав препарата Канефрон® Н, содержат вещества (фенолкарбоновые кислоты, эфирные масла и др.), обладающие антимикробным действием. Следует отметить широкий противомикробный спектр лекарственных растений и их активность при устойчивой к синтетическим препаратам микрофлоре. Особенностью данных лекарственных растений является сочетание противомикробных и противовоспалительных свойств, что особенно важно при лечении хронических инфекций мочевыводящих путей. Установлено, что Канефрон® Н усиливает выведение солей мочевой кислоты. Усиление выделения мочевой кислоты препятствует выпадению в мочевыводящих путях кристаллов, росту имеющихся камней и формированию новых. Также было отмечено, что данный препарат подщелачивает мочу, если она резко кислая при уратном нефролитиазе, и поддерживает уровень pH в диапазоне 6,2–6,8, что также препятствует образованию уратных камней. Спазмолитическое действие Канефрона Н обусловлено флавоноидами. В результате действия препарата Канефрон® Н на тубулярный аппарат почки значительно снижается выделение белка с мочой из-за ранее перенесенных патологических процессов, повреждающих тубулярный аппарат. Высокая эффективность и безопасность Канефрона Н (отсутствие острого и хронического токсического действия, в том числе тератогенного) были подтверждены экспериментальными и клиническими данными, полученными в ходе проведенных исследований, а также многолетним опытом применения препарата как в России, так и за рубежом.
Выводы
Итак, лечение РИНМП должно быть патогенетически обоснованным и включать в себя:
-
коррекцию анатомических нарушений;
- лечение ИППП;
-
коррекцию гормональных нарушений;
-
посткоитальную профилактику;
-
лечение воспалительных и дисбиотических гинекологических заболеваний;
-
коррекцию гигиенических и сексуальных факторов;
-
коррекцию иммунных нарушений;
-
местное лечение.
Канефрон® Н – комбинированный лекарственный препарат, который оказывает комплексное действие: диуретическое, спазмолитическое, противовоспалительное, антиоксидантное, антимикробное и нефропротективное. Эффективность и безопасность препарата Канефрон® Н в лечении РИНМП подтверждены результатами целого ряда клинических исследований и опытом применения препарата как в России, так и за рубежом.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
