Острые вопросы использования менопаузальной гормональной терапии. V Национальный научно-образовательный конгресс «Онкологические проблемы от менархе до постменопаузы». Сателлитный симпозиум компании «Эбботт»
- Аннотация
- Статья
- Ссылки
Менопаузальная гормональная терапия и РМЖ
Клинический профессор Университета Сиднея, руководитель клиники нарушений менопаузы и менструального цикла Королевского госпиталя Норт-Шорт, экс-президент Международного и Австралийско-Новозеландского обществ проблем менопаузы Родин БЭЙБЕР начал выступление с характеристики основных типов рака молочной железы (РМЖ).
Выделяют гормон-рецептор-положительные опухоли (2/3 всех видов РМЖ), в большинстве своем эстроген (ER)/прогестерон (PR)-положительные, которые могут стимулироваться МГТ и тамоксифеном. Различают также гормон-рецептор-отрицательные и HER2-положительные опухоли, содержащие фактор роста HER2. Согласно вторичной классификации, опухоли подразделяют на четыре группы. Первая (люминальные А) представлена опухолями ER+, PR+, HER2-, вторая (люминальные В) – ER+, PR-, HER2+, третья (HER2+) – ER-, PR-, HER2+, четвертая (базальные) – трижды негативными опухолями, наиболее распространенными среди женщин с генетическими мутациями1.
Рак молочной железы – самый распространенный вид рака в женской популяции, от которого ежегодно умирает 550 тыс. женщин2. Частота встречаемости РМЖ колеблется от 25,9 на 100 тыс. женщин в Центральной Африке до 90 на 100 тыс. женщин в Западной Европе, Австралии и Новой Зеландии, выживаемость – от 80% и более в Австралии, Северной Америке, Швеции и Японии до 60% в странах со средними доходами и ниже 40% в странах с низкими доходами. В России распространенность РМЖ составляет в среднем 45,6 на 100 тыс., смертность (с поправкой на возраст) – 17,2 на 100 тыс. женщин.
Различают модифицированные и немодифицированные факторы риска РМЖ. К немодифицированным относят женский пол, этническую принадлежность, место рождения и проживания, возраст старше 50 лет, генетические мутации, раннюю и позднюю менопаузу, высокую плотность ткани молочной железы, отягощенный семейный анамнез по РМЖ (более одной степени родства), предраковые заболевания молочной железы в анамнезе, предшествующее радиооблучение, воздействие диэтилстильбэстролом. Модифицированные факторы риска включают малоподвижный образ жизни, избыточный вес или ожирение, репродуктивный анамнез (отсутствие неотягощенной беременности, грудного вскармливания, рождение первого ребенка после 30 лет), употребление алкоголя и некоторых форм менопаузальной гормональной терапии (МГТ).
Перечисленные факторы связаны с низким, средним и высоким относительным риском развития РМЖ. Низким риском (< 2) характеризуются поздняя менопауза, раннее менархе, отсутствие родов, ожирение, потребление алкоголя, высокий социально-экономический статус и долгосрочное использование некоторых видов МГТ. Со средним риском (2–4) ассоциируются возраст старше 65 лет, рождение первенца после 30 лет, плотность молочной железы > 50%, семейный анамнез пременопаузального РМЖ, РМЖ в анамнезе, атипичные повреждения молочной железы, радиационное облучение. С высоким риском (> 4) связаны такие факторы, как женский пол, наличие генетических мутаций, протоковой карциномы, плотность молочной железы > 75%, семейный анамнез по РМЖ у трех и более родственниц.
Установлено, что в Великобритании у женщин в возрасте 50–59 лет риск развития РМЖ в течение пяти лет в общей популяции составляет 23 случая на 1000 женщин, на фоне применения комбинированной МГТ (конъюгированный эстроген (КЭ) и медроксипрогестерона ацетат (МПА)) – 27 случаев на 1000, при использовании монотерапии эстрогеном – 19 случаев на 1000 женщин. Между тем у курящих женщин риск развития РМЖ в течение пяти лет достигает 26 случаев на 1000 женщин, употребляющих алкоголь до двух доз в день – 28 на 1000. При наличии избыточного веса или ожирения этот показатель практически удваивается – 47 случаев на 1000 женщин. Сказанное означает, что на риск развития РМЖ в большей степени влияет не гормонотерапия, а вредные привычки и нездоровый образ жизни.
Профессор Р. Бэйбер проанализировал результаты ряда наблюдательных клинических исследований влияния МГТ на риск развития РМЖ, отметив, что подобные исследования могут указывать на ассоциативную связь между факторами, но не причинно-следственную.
G.A. Colditz и соавт. изучали здоровье медсестер (The Nurses Health Study) (1995) и установили, что использование МГТ менее пяти лет не приводит к значимому повышению относительного риска (ОР) РМЖ, а в случае применения МГТ более пяти лет ОР увеличивается незначительно – 1,463. Кроме того, при использовании МГТ менее пяти лет значимое увеличение ОР отсутствует, в случае применения МГТ более пяти лет ОР достигает 1,354.
Сравнительной оценке влияния монотерапии эстрогеном и терапии комбинацией «эстроген + прогестаген» на риск развития РМЖ посвящен ряд исследований. Метаанализ пяти исследований показал, что комбинированная терапия более значимо увеличивает риск РМЖ, чем монотерапия эстрогеном5.
В наиболее масштабном рандомизированном контролируемом исследовании (РКИ) «Инициатива во имя здоровья женщин» (Women's Health Initiative – WHI)6 пациентки были разделены на две группы. Первую составили 16 608 женщин с гистерэктомией в анамнезе, вторую – 10 739 женщин с интактной маткой. Пациентки после гистерэктомии получали терапию КЭ 0,625 мг/сут в комбинации с МПА 2,5 мг/cут (n = 8506) или плацебо (n = 8102), пациентки с интактной маткой – монотерапию КЭ 0,625 мг/сут (n = 5310) или плацебо (n = 5429).
Целью исследования стала оценка эффективности МГТ у женщин старшего возраста в постменопаузальном периоде. Средний возраст участниц составил 63 года, 10% женщин были в возрасте 50–54 лет, 20% – в возрасте 55–59 лет, 45% – 60–69 лет и 25% женщин – 70–79 лет. Первичной оценкой было состояние сердечно-сосудистого здоровья, вторичной – здоровье костной ткани и риск развития РМЖ.
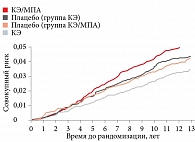
Первоначально полученные данные продемонстрировали повышение риска развития РМЖ на 26% в группе КЭ/МПА по сравнению с группой плацебо. Данные эффективности монотерапии эстрогеном, опубликованные через два года, показали отсутствие риска развития РМЖ среди женщин, принимавших эстрогены, по сравнению с пациентками, получавшими плацебо. Ученые сделали вывод, что риск развития РМЖ повышается при добавлении к эстрогену синтетического МПА.
На основании результатов длительного наблюдения с оценкой кумулятивных рисков РМЖ с учетом возраста, расы/этнической принадлежности исследователи пришли к заключению, что применение КЭ ассоциируется с более низкой частотой развития РМЖ (ОР 0,77; 95%-ный доверительный интервал (ДИ) 0,62–0,95). В то же время на фоне применения комбинации «КЭ + МПА» риск развития РМЖ увеличивается (ОР 1,25; 95% ДИ 1,07–1,46) (рис. 1)7, 8.
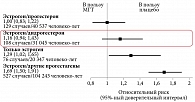
Возникает закономерный вопрос: считается ли подобное влияние прогестагенов их классовым эффектом? Ответить на этот вопрос попытались H. Lyytinen и соавт. В финском когортном исследовании участвовало свыше 50 тыс. женщин старше 50 лет, которые получали различную МГТ в течение пяти лет и более9. В ходе исследования отмечалось неравномерное увеличение риска развития РМЖ при использовании разных прогестагенов. Минимальный ОР развития РМЖ наблюдался у женщин, принимавших комбинацию «эстрадиол + дидрогестерон». Он не был статистически значимым и составил 1,13. У женщин, получавших комбинированные препараты, содержащие эстрадиол и МПА, ОР составил 1,64, у тех, кто получал эстрадиол в комбинации с другими прогестагенами, – 2,07.
Во французском когортном исследовании E3N участвовали свыше 80 тыс. женщин, получавших лечение в течение 8,1 года10. Согласно полученным данным, у женщин на фоне применения комбинации «эстроген + дидрогестерон» (Фемостон) практически отсутствовало увеличение риска РМЖ (ОР 1,16). Более высокий риск зафиксирован у тех, кто получал монотерапию эстрогеном (ОР 1,29) или комбинированную МГТ с другими прогестагенами (ОР 1,69) (рис. 2).
Резюмируя сказанное, профессор Р. Бэйбер сделал несколько важных выводов.
Наблюдательные исследования продемонстрировали небольшое повышение риска РМЖ на фоне применения МГТ, которое становится статистически значимым примерно после пяти лет терапии.
Риск развития РМЖ на фоне комбинации «эстроген + прогестаген» несколько выше, чем на фоне монотерапии эстрогеном, но нивелируется выбором такого нейтрального прогестагена, как прогестерон или дидрогестерон.
Результаты РКИ показали повышение риска развития РМЖ, ассоциированного с использованием комбинированной терапии «эстроген + МПА», который становится статистически значимым через пять и более лет использования МГТ.
В РКИ, в которых женщины получали только монотерапию эстрадиолом, риск развития РМЖ после семилетнего лечения отсутствовал.
Как оценить онкологический риск перед назначением МГТ и проводить мониторинг терапии
Согласно оценке состояния онкологической помощи населению в России за 2019 г., доля пациенток с РМЖ среди основного контингента больных злокачественными новообразованиями весьма значительна – 18,3%11. При этом, как отметила Светлана Владимировна ЮРЕНЕВА, д.м.н., профессор, ведущий сотрудник отделения гинекологической эндокринологии Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. академика В.И. Кулакова, вице-президент Ассоциации гинекологов-эндокринологов, у 55,9% больных РМЖ выявлен случайно, у 27,7% РМЖ зарегистрирован на стадиях III–IV.
При назначении гормонотерапии специалист должен оценить потенциальный риск развития РМЖ, сердечно-сосудистых заболеваний и венозной тромбоэмболии. Докладчик подчеркнула, что своевременное назначение МГТ женщинам в возрасте ≤ 59 лет способствует увеличению продолжительности жизни. В то же время назначение МГТ после 60 лет при длительности менопаузы более десяти лет ассоциируется с риском для пациентки.
Риск развития РМЖ оценивают на основании анамнеза и результатов маммографического скрининга (BI-RADS). Как уже отмечалось, выделяют немодифицированные, модифицированные и ятрогенные факторы риска развития РМЖ12. Среди немодифицированных факторов высокий риск ассоциирован с генетическими мутациями, в частности мутациями гена BRCA-1/2. Не случайно при наличии семейного анамнеза РМЖ первой степени родства рекомендуется проводить анализ на наличие указанных мутаций. Кроме того, согласно последним данным, мутация гена PALB2 может на 30% повышать риск развития РМЖ, а мутация генов CHEK2 и АТМ связана с повышением риска возникновения гормонозависимого РМЖ.
К ятрогенным факторам прежде всего относится лучевая терапия. Установлено, что лучевая терапия лимфомы у молодых женщин (< 20 лет) практически в 55 раз повышает риск развития РМЖ. Ятрогенные причины могут быть связаны с МГТ эстрогеном в комбинации с некоторыми видами гестагенов.
В нашей стране пока не существует валидизированного опросника, который помог бы практикующему врачу на приеме оценить риск развития РМЖ у пациентки. В США для расчета риска РМЖ используется Gail Model for Breast Cancer. Наличие таких факторов, как раннее менархе, поздняя менопауза, семейный анамнез РМЖ первой степени родства, некоторые заболевания молочной железы, позволяют оценить пятилетний риск РМЖ и риск в течение ожидаемой продолжительности жизни, назначить определенные профилактические меры либо хемопревенцию. Но использование данного калькулятора ограничено при BRCA-1/2 и других мутациях и не показано при РМЖ in situ в анамнезе.
Согласно приказу Минздрава России от 20 октября 2020 г. № 1130н, сегодня обязанностью гинеколога на приеме являются осмотр и пальпация молочной железы13. Женщинам в возрасте 40–75 лет проводится маммографический скрининг – маммография в двух проекциях с двойным прочтением маммограмм один раз в два года. Женщинам до 40 лет в отсутствие факторов риска выполняется ультразвуковое исследование (УЗИ) молочных желез один раз в два года, а при наличии факторов риска и/или жалоб – один раз в год. При подозрении на патологические изменения проводятся маммография и УЗИ молочных желез независимо от возраста пациенток.
Заключение результатов маммографии должно содержать описание маммограммы по категории BI-RADS. Оценка маммографии по классификации, соответствующей категориям BI-RADS-1 и BI-RADS-2, дает основание для назначения МГТ. Помимо этого следует определить плотность молочных желез, то есть с помощью маммографии классифицировать BI-RADS по ACR. Фактор среднего риска определяет 3-й тип (ACR: C), что соответствует картине умеренно развитой железистой ткани, где 51–75% занимают плотные структуры или нетипично расположенные участки уплотненной структуры. Фактор высокого риска определяет 4-й тип (ACR: D), что соответствует картине выраженной железистой ткани, выраженной фиброзной мастопатии, где более 75% занимают плотные структуры. Это крайне важно, поскольку высокая маммографическая плотность фоновых изменений – фактор риска РМЖ для женщин пострепродуктивного возраста.
Какова врачебная тактика в зависимости от заключения по BI-RADS? Пациентки с BI-RADS-1/2 наблюдаются акушером-гинекологом и могут использовать гормональную терапию. Наличие других категорий BI-RADS требует дополнительного обследования, консультации или наблюдения врача-онколога. При исключении злокачественных новообразований женщины с доброкачественными заболеваниями молочной железы находятся под диспансерным наблюдением акушера-гинеколога.
Профессор С.В. Юренева констатировала, что в исследованиях последних 50 лет не удалось окончательно установить причинно-следственную связь между МГТ и РМЖ14. Однако при назначении МГТ выбор следует делать в пользу комбинации с наиболее безопасным гестагеном. Результаты французского исследования E3N и финского когортного исследования показали, что комбинации эстрадиола и дидрогестерона или микронизированного прогестерона практически не ассоциируются с повышением риска развития РМЖ в отличие от других гестагенов, поэтому применение таких комбинаций предпочтительно9, 10.
В сентябре 2020 г. были опубликованы результаты объединенного исследования «случай – контроль», целью которого стала оценка риска развития РМЖ в зависимости от вида и длительности МГТ15. В исследование были включены данные двух британских регистров с участием 98 611 женщин в возрасте от 50 до 79 лет с первичным диагнозом РМЖ и 457 000 женщин без РМЖ, которые составили группу контроля.
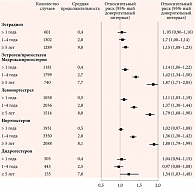
Исследователи установили, что монотерапия эстрадиолом, назначаемая женщинам после гистерэктомии, ассоциируется с незначительным повышением риска при длительности лечения более пяти лет. Повышение риска РМЖ напрямую коррелирует с видом гестагена, который входит в состав комбинированной МГТ. Лучший профиль безопасности имеет эстрадиол в комбинации с дидрогестероном. Показано, что после пяти лет терапия комбинацией «эстрадиол + дидрогестерон» демонстрирует самый низкий относительный риск РМЖ по сравнению с комбинацией эстрогена/МПА, эстрогена/левоноргестрела и эстрогена/норэтистерона ацетата, на фоне которых риск развития РМЖ увеличивается уже в первый год терапии и возрастает по мере ее продолжительности (рис. 3).
Наименьшая заболеваемость и число дополнительных случаев РМЖ на 10 тыс. женщин-лет отмечается на фоне монотерапии эстрадиолом у женщин в возрасте 50–59 лет (+ три случая) по сравнению с никогда не получавшими МГТ. Заболеваемость РМЖ в общей популяции составляет 31,5 случая на 10 тыс. женщин-лет. Вклад МГТ в увеличение этого показателя невелик: заболеваемость РМЖ на фоне МГТ составляет 33 случая на 10 тыс. женщин-лет. Тем не менее даже такой небольшой прирост позволяет сделать вывод, что МГТ относится к факторам, незначительно повышающим риск развития РМЖ.
Важной составляющей лечения является мониторинг риска РМЖ на фоне МГТ. В этом плане трудно переоценить значение регулярного маммографического обследования. По данным шведского популяционного исследования (Swedish Cancer Register) с участием более 549 тыс. женщин в возрасте 40–69 лет, маммография снижает риск фатального РМЖ на 25% при его выявлении на поздней стадии, на 41% уменьшает риск смерти от РМЖ в течение десяти лет16.
Итак, мониторинг состояния молочных желез на фоне МГТ предполагает проведение маммографического обследования в двух проекциях с оценкой по BI-RADS и ACR один раз в год. Это согласуется с рекомендациями NCCN (National Comprehensive Сancer Network), в соответствии с которыми маммография проводится один раз в год в случае высокой плотности молочных желез (ACR: D).
Таким образом, основным инструментом оценки риска развития РМЖ считается маммографическое исследование с оценкой состояния молочных желез по BI-RADS и указанием маммографической плотности по ACR, а при применении МГТ – ежегодный маммографический контроль с оценкой по BI-RADS и ACR.
В заключение профессор С.В. Юренева подчеркнула, что монотерапия эстрадиолом, как и МГТ комбинациями «эстрадиол + дидрогестерон» и «эстрадиол + микронизированный прогестерон», характеризуется наименьшим риском развития РМЖ.
Незапланированные кровотечения при приеме МГТ
Незапланированное кровотечение, часто возникающее при использовании как последовательных, так и непрерывных комбинированных препаратов, приводит к снижению приверженности лечению17. По словам Елены Александровны УЛЬРИХ, д.м.н., профессора, главного научного сотрудника Национального медицинского исследовательского центра им. В.А. Алмазова, профессора кафедры онкологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, ведущего научного сотрудника Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова, кровотечения на фоне МГТ – одна из наиболее частых причин отмены гормональной терапии, которая так необходима женщинам пострепродуктивного возраста для улучшения их качества жизни.
Любое вагинальное кровотечение в постменопаузе (более 12 месяцев после последнего естественного менструального цикла) в отсутствие МГТ требует обследования для исключения рака эндометрия (РЭ). По оценкам, ежегодно в мире регистрируется свыше 300 тыс. случаев рака тела матки (РТМ). В России РТМ, на долю которого приходится более 24 тыс. случаев, занимает первое место в структуре онкогинекологической заболеваемости. Возраст пациенток с РЭ в подавляющем большинстве случаев (80%) превышает 60 лет.
Согласно новой молекулярной классификации РТМ, опухоли подразделяют на четыре подкласса в зависимости от наличия/отсутствия мутаций: POLE-мутация, p53-мутация, дефицит MMR, NSMP. Вместе с тем не утрачивает актуальности классификация Я.В. Бохмана, на основании которой выделяют два патогенетических варианта РЭ: гормонозависимый (70–80%) и автономный (30–40%).
Первый патогенетический вариант считается метаболически обусловленным. Женщины с метаболическим синдромом, ожирением, гипертонией, сахарным диабетом, бесплодием, ранним менархе и поздней менопаузой, РМЖ в анамнезе имеют повышенный риск развития РТМ. Пониженный риск отмечается у женщин, принимающих комбинированные оральные контрацептивы. Высокий риск развития РТМ характерен для женщин с синдромом Линча, мутациями MLH1, MSH2, MSH6, PMS2, зачастую с наследственным неполипозным колоректальным раком, РЭ или раком яичников в анамнезе.
Согласно рекомендациям Минздрава России (2015), перед назначением МГТ необходимо провести ряд обследований, направленных на уточнение личного и семейного анамнеза (гистер- или овариэктомия, рак репродуктивных органов, тромбоз, сердечно-сосудистые заболевания, диабет), индекса массы тела, уровня артериального давления, гинекологическое и онкоцитологическое исследование (PAP-тест), обследование молочных желез, УЗИ органов малого таза. В рекомендациях уточняется, что при толщине эндометрия до 4 мм МГТ не противопоказана, при толщине эндометрия до 7 мм возможно назначение циклической гормонотерапии прогестагенами под контролем УЗИ на пятый день менструации. При толщине эндометрия более 7 мм проводятся гистероскопия и раздельное диагностическое выскабливание.
В исследовании M.C. Pike и R.K. Ross (2000) показано, что у женщин с интактной маткой на фоне пятилетней терапии эстрогенами риск развития РТМ составляет 2,17, на фоне пятилетней терапии прогестагенами в последовательном (более десяти дней в месяц) или постоянном режиме – 1,0718.
В исследовании WHI6 оценивали риск развития РЭ в группе МГТ комбинацией КЭ/МПА (n = 8506) и группе плацебо (n = 8102) в течение шести лет и более. Согласно полученным данным, риск развития РЭ в группе МГТ был низким и сопоставим с таковым в группе плацебо (0,83).
При непрерывной комбинированной МГТ число женщин с кровотечением снижается после 6–12 месяцев лечения. Предполагается, что после девяти месяцев только 3–10% женщин будут иметь какие-либо нарушения по типу кровянистых выделений. При трансдермальном применении непрерывной комбинированной МГТ число женщин, у которых после 12 месяцев лечения наблюдаются кровотечения или кровянистые выделения, колеблется от 10 до 20%19.
При длительности постменопаузального периода до 12 месяцев аменорея часто не достигается предположительно из-за наличия остаточного эндометрия, простимулированного эндогенными эстрогенами. В такой ситуации может возникнуть непредсказуемое прорывное кровотечение. Во избежание этого рекомендуется использовать циклическую МГТ в течение 12 месяцев после последней менструации.
При длительности постменопаузального периода более 12 месяцев аменорея зависит от баланса между эстрогенным эффектом и прогестагенным действием компонентов МГТ на эндометрий. Неадекватный прогестагеновый эффект может привести к гиперплазии, кровотечению и риску развития РЭ. Поэтому при назначении комбинированной МГТ следует делать выбор в пользу безопасного гестагенового компонента. Особое внимание необходимо уделять пациенткам из групп риска (ожирение, сахарный диабет, наследственный анамнез).
В случае незапланированного кровотечения на фоне непрерывной комбинированной МГТ необходимо провести ряд обследований, чтобы исключить РЭ, а затем выяснить причину произошедшего. Лечение доброкачественных изменений подразумевает прежде всего тщательный сбор анамнеза. Необходимо выяснить, когда возникает кровотечение, какие препараты принимает пациентка, имелось ли нарушение приема МГТ, когда было обследование шейки матки и проч. Кроме того, нужно провести физикальное обследование, включающее осмотр вульвы, влагалища и шейки матки.
При маточном кровотечении в постменопаузальном периоде рекомендуется УЗИ для оценки толщины эндометрия с целью прогнозирования риска развития РТМ. Незначительный риск ассоциируется с толщиной эндометрия менее 4 мм.
Согласно алгоритму ведения пациенток с незапланированным кровотечением в постменопаузе на фоне МГТ, разработанному Американской коллегией акушеров и гинекологов (ACOG-2018), при использовании МГТ риск развития РЭ невысокий – 1–1,5%, в отсутствие МГТ – 10%. Толщина эндометрия менее 4 мм на фоне МГТ ассоциируется с риском развития РЭ 0,1–0,2%, без МГТ – 0,6–0,8%. В обоих случаях проводится наблюдение. По мнению докладчика, срок наблюдения пациенток с незапланированным кровотечением на фоне МГТ не должен превышать 4–6 недель. Пациенток с кровотечением в отсутствие МГТ необходимо незамедлительно направлять на гистологическое исследование эндометрия.
УЗИ является методом выбора при незапланированном кровотечении на фоне непрерывной комбинированной МГТ. Дальнейшая тактика во многом зависит от результатов исследования, поэтому опыт специалиста ультразвуковой диагностики имеет решающее значение.
Гормонозависимые злокачественные новообразования или предраковые состояния либо подозрение на них являются противопоказанием для назначения МГТ. Можно ли больным РЭ после лечения назначать МГТ? По оценкам, пятилетняя выживаемость больных РЭ превышает 75%, а у пациенток с РЭ стадии I достигает 90%. Большинство больных подлежит хирургическому лечению. Немаловажно, что 25% больных – пременопаузального возраста, после лечения у них развиваются явления хирургической менопаузы, существенно ухудшающие качество жизни.
За период 1986–2006 гг. был проведен ряд исследований эффективности МГТ после радикального лечения РЭ, в основном стадии I. Метаанализ S. Shim и соавт.20 продемонстрировал, что риск рецидивирования РЭ стадии I у пациенток на фоне МГТ сопоставим с таковым в группе контроля.
В проспективном исследовании «случай – контроль» (2005) участвовали 80 больных РЭ стадии I (средний возраст – 45 лет), которые после радикального лечения РЭ были разделены на группу комбинированной МГТ (n = 50) и группу контроля (n = 30)21, 22. Длительность применения МГТ составила 18 месяцев, период последующего наблюдения – 36 месяцев. В группе комбинированной МГТ не было зафиксировано ни одного рецидива РЭ. При этом качество жизни было выше, чем в группе контроля.
Таким образом, по мнению профессора Е.А. Ульрих, больным РЭ стадии I после лечения можно назначать МГТ, но только под наблюдением онкогинеколога. В целом выбор правильного препарата и понимание механизма аномального кровотечения – ключевые моменты успешного назначения МГТ.
Управление аномальными кровотечениями при исключении неоплазий эндометрия
По данным, представленным Натальей Михайловной ПОДЗОЛКОВОЙ, д.м.н., профессором, заведующей кафедрой акушерства и гинекологии Российской медицинской академии непрерывного профессионального образования, частота аномальных кровотечений на фоне циклической МГТ составляет 8–40%. При этом прорывные кровотечения отмечаются менее чем в 10% случаев. Частота кровотечений на фоне непрерывной МГТ достигает 77%, но после 6–9 месяцев приема существенно снижается – 3–10% случаев.
В общемедицинской и гинекологической практике выделяют три основных механизма кровотечений: кровотечение вследствие разрыва стенки сосуда при травме, некрозе родившегося миоматозного узла; эрозивное кровотечение, связанное с разъеданием кровеносной стенки сосудов при опухолях, туберкулезе; диапедезное кровотечение на фоне повышения проницаемости сосудистой стенки при воспалительных процессах. Но есть еще один уникальный механизм – отторжение функционального слоя эндометрия с соответствующим кровотечением при снижении в крови уровня половых стероидных гормонов. Остановить такое кровотечение можно за счет повышения концентрации половых стероидов.
Установлено, что эндометрий на фоне МГТ несколько отличается от эндометрия у женщин, не использующих МГТ. Сосуды эндометрия на фоне гормональной терапии становятся более хрупкими, стенки состоят только из эндотелиальных клеток, базальной мембраны и перицитов, при этом отсутствуют гладкомышечные клетки, ответственные за сужение сосудов.
Безусловно, гормональная терапия не вызывает увеличения калибра сосудов, не сопровождается изменением экспрессии матриксных металлопротеиназ или увеличением продукции фактора роста эндотелия сосудов (VEGF). Тем не менее при непрерывной МГТ сосуды эндометрия становятся более хрупкими. В связи с этим, например, повышение уровня артериального давления может привести к кровотечению.
Менструальное кровотечение и менструальноподобное кровотечение на фоне МГТ отличаются механизмом отторжения эндометрия. Менструальное кровотечение сопровождается отторжением 2/3 эндометрия, разрывом спиральных артериол. При менструальноподобном кровотечении на фоне МГТ отмечаются локальное повреждение верхних слоев эндометрия и повреждение вновь образованных сосудов микроциркуляторного русла в эндометрии.
Возникновение аномального кровотечения при МГТ требует поэтапного исключения причин, прежде всего обусловленных заболеваниями матки (аденома, субмукозная миома, полип эндометрия и др.). Следует оценить приверженность пациентки терапии, взаимодействие принимаемых ею лекарственных средств, наличие хронических и острых заболеваний желудочно-кишечного тракта. При ожирении может иметь место повышение уровня эндогенных эстрогенов жировой тканью, которые действуют на эндометрий. Крайне важно адекватное соотношение эстрогена/гестагена в препарате, поскольку несбалансированное соотношение по процентному или количественному составу может влиять на эндометрий. Коррекция данного соотношения и режима введения дает положительный эффект.
Таким образом, алгоритм обследования пациентки с аномальным кровотечением на фоне МГТ в первую очередь предусматривает подробный анамнез, исключение сопутствующих состояний и факторов риска, уточнение типа МГТ. Если на фоне циклической МГТ кровотечения повторяются более двух циклов, уточняется тип кровотечения, в зависимости от которого намечается дальнейшая тактика лечения. При менее чем двух циклах кровотечения и отсутствии факторов риска проводится наблюдение.
Наблюдение также показано при кровотечении менее шести месяцев на фоне непрерывной МГТ в отсутствие факторов риска. Если на фоне непрерывной МГТ кровотечение продолжается более шести месяцев, определяются тип кровотечения и дальнейшая тактика ведения пациентки.
На фоне циклической МГТ в эстрогеновой фазе может возникнуть пролонгированная, обильная менструальноподобная реакция (МПР), в гестагеновой фазе – незапланированное кровотечение и в любом периоде – кровомазание. Какова тактика ведения пациенток?
При пролонгированной МПР или обильном кровотечении в эстрогеновой фазе при тонком эндометрии можно увеличить дозу эстрогена или дозу гестагена либо сменить гестаген. В случае неэффективности нужно снизить дозу эстрогена. При кровотечении до окончания приема гестагенов в гестагеновой фазе рекомендуется увеличить дозу гестагена или сменить тип гестагена. При кровомазании в любом периоде увеличивают дозу эстрогена. Линейка препаратов Фемостон позволяет подобрать необходимое соотношение доз эстрадиола и дидрогестерона.
Алгоритм ведения пациенток с кровотечением на фоне непрерывной МГТ предполагает уменьшение дозы эстрогена. При недостаточном купировании вазомоторных симптомов у женщин в возрасте менее 51 года с толщиной эндометрия 4–6 мм рекомендуется заменить непрерывную комбинированную МГТ ультранизкими дозами эстрадиола/дидрогестерона циклической комбинированной МГТ более высокими дозами эстрадиола/дидрогестерона (Фемостон 1/10). Женщинам старше 50 лет при недостаточном купировании вазомоторных симптомов увеличивают дозу гестагена или меняют гестаген. По мнению профессора Н.М. Подзолковой, непрерывная МГТ комбинированным препаратом, содержащим 1 мг эстрадиола и 10 мг дидрогестерона (Фемостон 1/10), оптимальна для данной категории пациенток.
В заключение профессор Н.М. Подзолкова констатировала, что причины аномальных кровотечений на фоне МГТ и подходы к их устранению различны. Но эксперты сходятся во мнении, что менопаузальная гормональная терапия в конечном счете уменьшает риск возникновения рака эндометрия и в большинстве случаев характеризуется благоприятным соотношением «польза – риск».
Заключение
Подводя итог, профессор С.В. Юренева подчеркнула, что особое значение в повышении онкологической безопасности при ведении пациенток в пери- и постменопаузе на фоне МГТ имеет мультидисциплинарный подход с участием акушера-гинеколога, онкогинеколога и рентгенолога. Безусловно, тщательный сбор анамнеза (возраст пациенток, исходное состояние здоровья, длительность менопаузы) и индивидуальный подход к выбору препарата позволяют теоретические риски МГТ свести к минимуму, а пользу от лечения сделать максимальной.

