Поддерживающая терапия дурвалумабом при немелкоклеточном раке легкого после химиолучевой терапии
- Аннотация
- Статья
- Ссылки
- English

![Рис. 1. Общая выживаемость пациентов с НМРЛ в клиническом исследовании PACIFIC [14]](/upload/resize_cache/iblock/13d/195_350_1/Zukov2.jpg)
![Рис. 2. Выживаемость без прогрессирования пациентов с НМРЛ в клиническом исследовании PACIFIC [14]](/upload/resize_cache/iblock/41e/195_350_1/Zukov3.jpg)
![Рис. 3. Выживаемость без прогрессирования (А) и общая выживаемость (Б) пациентов с НМРЛ в ретроспективном исследовании [15]](/upload/resize_cache/iblock/02e/195_350_1/Zukov4.jpg)
![Таблица 2. Некоторые нежелательные реакции у пациентов с НМРЛ, получавших дурвалумаб [16]](/upload/resize_cache/iblock/22c/195_350_1/Zukov5.jpg)
Введение
Рак легкого занимает лидирующее место в структуре онкологической заболеваемости и смертности как в России, так и в мире. Согласно прогнозам, данное заболевание останется одной из ведущих проблем онкологии, продолжая удерживать первое место в структуре смертности среди злокачественных новообразований, существенно опережая темпы роста других нозологий. При этом примерно у 70% пациентов заболевание диагностируется на стадии местно-распространенного и метастатического процесса. Половина пациентов умирает в первый год после постановки диагноза, а пятилетняя выживаемость напрямую зависит от стадии заболевания. Так, при стадии IA она более 80%, при стадии IV около 6% [1].
В современной онкологии подходы к лечению немелкоклеточного рака легкого (НМРЛ) изменяются достаточно часто. Это связано с появлением доказательств эффективности новых схем как уже зарегистрированных лекарственных препаратов, так и новых молекул, полученных в результате клинических исследований. Тем не менее для пациентов со стадиями НМРЛ IIIB и IIIC (местно-распространенный неоперабельный рак) основным эффективным методом лечения считается химиолучевая терапия (ХЛТ), которая может быть одновременной или последовательной в зависимости от статуса пациента [2].
Биологические основы радиотерапевтического лечения
Биологический эффект облучения выражается в цитотоксическом воздействии, реализуемом за счет повреждения клеточной ДНК. В результате проявляется системный иммуномодулирующий эффект облучения, который может приводить к разнонаправленным изменениям. Так, известны факты усиления в результате радиотерапевтического воздействия противоопухолевого Т-клеточного иммунитета, а также снижения иммуногенности опухоли, иммуноопосредованного метастазирования и активности эффекторных иммунных клеток в опухоли и ее микроокружении [3–6].
Необходимо также отметить, что ионизирующее излучение может вызывать и иммуносупрессию, которая препятствует развитию системного противоопухолевого иммунитета. Среди таких эффектов – привлечение в очаг облучения иммуносупрессивных клеток (миелоидных супрессорных клеток, воспалительных моноцитов или опухоль-ассоциированных макрофагов), способствующих росту опухоли или изменению опухолевого микроокружения таким образом, что Т-лимфоциты утрачивают свой противоопухолевый потенциал [7].
Кроме того, важно отметить так называемый эффект свидетеля – радиоиндуцированный коммунальный эффект, заключающийся в передаче in vitro радиационных сигналов от облученных клеток необлученным. Этот феномен может проявляться и на уровне целого организма, когда поражаются органы и ткани, непосредственно не подвергающиеся ионизирующему облучению. В радиобиологии подобный эффект называется абскопальным. Имеются сообщения о случаях абскопального ответа на радиотерапевтическое лечение у пациентов с НМРЛ [8, 9].
Комбинации лучевой терапии с иммуноонкологическими препаратами
Сообщения об исследованиях эффективности комбинаций лучевой терапии с иммуноонкологическими препаратами появились в первом десятилетии ХХI в. [10]. Впоследствии стало понятно, что с широким внедрением в клиническую практику иммуноонкологических препаратов открываются дополнительные опции для лечения пациентов с неоперабельным НМРЛ в сочетании с лучевой терапией. Подтверждение тому – большое количество клинических исследований на различных стадиях заболевания (табл. 1).
Для оценки эффективности проводимого лечения целесообразно помимо лучевых методов диагностики использовать лабораторные показатели, поскольку оценка ответа опухоли по критериям RECIST 1.1 не всегда оправданна. Среди причин, затрудняющих процесс оценки по критериям RECIST 1.1, можно указать параканкрозные изменения и развивающиеся постлучевые изменения в легком, маскирующие как регресс опухоли, так и ее потенциальное прогрессирование. Псевдопрогрессирование после стереотаксической радиотерапии рака легкого может наблюдаться до одного года после завершения лечения при проведении позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ/КТ), и сопровождаться увеличением накопления фтордезоксиглюкозы (ФДГ) [11, 12]. Данное явление связано с рентгенологически определяемым увеличением объема опухоли в результате инфильтрации ее эффекторными Т-лимфоцитами. Чтобы проводить качественную оценку ответа опухоли у пациентов, получающих иммунотерапию, были разработаны модифицированные критерии iRECIST [13].
Эффект дурвалумаба у пациентов с НМРЛ после лучевого лечения
Одним из самых многообещающих иммуноонкологических препаратов, используемых в лечении пациентов с НМРЛ после лучевой терапии, является дурвалумаб. Эффективность этой опции подтверждена в плацебо-контролируемом рандомизированном исследовании III фазы PACIFIC. В исследовании сравнивали эффективность дурвалумаба и плацебо у пациентов с нерезектабельным НМРЛ стадии III и отсутствием прогрессирования болезни после стандартной ХЛТ, включавшей два цикла платиносодержащего режима. Пациенты были рандомизированы в соотношении 2:1 в группы дурвалумаба (в дозе 10 мг на 1 кг массы тела внутривенно) и плацебо (каждые две недели в течение 12 месяцев). Препарат вводили по завершении ХЛТ. Результаты достижения первичных и вторичных конечных точек исследования, полученные в 2017 г., послужили основанием для отнесения дурвалумаба к стандарту консолидирующей терапии по данному показанию. В 2021 г. были опубликованы результаты пятилетнего наблюдения за пациентами в исследовании PACIFIC, которые подтвердили и закрепили полученный ранее результат.
В исследование были включены 713 пациентов с медианой возраста 64 года (70% мужчин). У 46% диагностирован плоскоклеточный рак, у 53% – стадия IIIA, у 50% зафиксирован объективный противоопухолевый эффект на фоне ХЛТ. Экспрессия PD-L1 более чем на 25% опухолевых клеток отмечалась у 22% больных, менее 25% – у 41% и не определялась у 37% пациентов. При медиане наблюдения 61,6 месяца у цензурируемых больных медиана общей выживаемости (ОВ) составила 47,5 месяца в группе дурвалумаба и 29,1 месяца в группе плацебо (рис. 1). Отличия были статистически значимы (HR 0,72). Кроме того, пятилетняя ОВ в группе дурвалумаба была лучше, чем в группе плацебо, – 42,9 и 33,4% соответственно. Медиана выживаемости без прогрессирования (ВБП) составила 16,9 месяца в группе иммунотерапии и 5,6 месяца в группе плацебо (HR 0,55) (рис. 2). Пятилетняя ВБП в группе дурвалумаба почти вдвое превысила таковую в группе плацебо – 33,1 против 19%. Частота появления новых метастатических очагов оказалась пропорционально ниже при использовании дурвалумаба (24,2%) по сравнению с плацебо (33,3%), а метастазы в головном мозге выявлены у 6,5 и 11,8% больных соответственно [14].
Несмотря на то что дурвалумаб уже признан стандартом лечения пациентов с НМРЛ стадии III после ХЛТ, остается открытым вопрос о том, сколько времени должно пройти от момента завершения лучевой терапии до начала лечения и как это время способно влиять на исходы болезни. Для ответа на этот вопрос было проведено ретроспективное исследование (результаты опубликованы в Red Journal). В него были включены 728 пациентов с НМРЛ стадии III, получавшие радикальную ХЛТ и дурвалумаб в течение 120 дней после завершения лучевой терапии. Время между последним сеансом лучевой терапии и первой инфузией дурвалумаба анализировали в многофакторных регрессионных моделях Кокса для первичных исходов ВБП и ОВ с поправкой на исходные характеристики пациента и заболевания. Для первичного анализа исследователи использовали 120-дневный ориентир, измеряющий ВБП и ОВ через 120 дней после завершения облучения. Были получены данные о медиане времени от завершения радиотерапии до начала лечения дурвалумабом. Она составила 41 день (диапазон 30–58). В регрессионном анализе Кокса время от завершения радиотерапии до начала приема дурвалумаба не показало связи с ВБП (скорректированное отношение рисков (ОР) 1,01 за неделю; р = 0,4) или с ОВ (скорректированное ОР 1,02 в неделю; р = 0,3). Начало лечения дурвалумабом менее чем через 14 дней после радиотерапии также не было связано с улучшением анализируемых показателей (рис. 3). Причем результаты были надежными при анализе чувствительности с использованием различных аналитических методов [15].
Нежелательные реакции
Профиль безопасности дурвалумаба в исследовании PACIFIC (n = 475) у пациентов с НМРЛ, которые завершили как минимум два цикла одновременной ХЛТ в период от одного до 42 дней до включения в исследование, представлен в табл. 2 [16]. В указанной популяции пациентов наиболее частыми нежелательными реакциями были кашель – 40,2% (против 30,3% в группе плацебо), инфекции верхних дыхательных путей (26,1 и 11,5%) и сыпь (21,7 и 12% соответственно). Наиболее частой нежелательной реакцией 3–4-й степени тяжести (по общим терминологическим критериям нежелательных явлений Национального института онкологии США, версия 4.03) была пневмония: 6,5% у пациентов, получавших дурвалумаб, и 5,6% у пациентов, получавших плацебо. Общая частота нежелательных реакций 3–4-й степени тяжести у пациентов, получавших дурвалумаб, составила 12,8%, плацебо – 9,8% (табл. 2) [16].
Стоит отметить, что применение дурвалумаба чаще ассоциировалось с развитием иммуноопосредованных нежелательных реакций. Эти реакции в большинстве случаев разрешались после назначения соответствующей гормональной или иммуносупрессивной терапии или отмены препарата.
Опыт использования дурвалумаба
Пациент К. 59 лет обратился в поликлинику КГБУЗ «Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского» (КККОД) в мае 2021 г.
Из анамнеза известно, что пациент считает себя больным с января 2021 г. С жалобами на малопродуктивный кашель, одышку при физической нагрузке обратился в поликлинику по месту жительства, где при дообследовании диагностировано злокачественное новообразование левого легкого. Для уточнения распространенности опухолевого процесса и решения вопроса о дальнейшей тактике лечения пациента направили в КККОД.
Выполнена бронхоскопия. Гистологическое заключение: низкодифференцированная аденокарцинома. EGFR – отрицательный, PDL-1-статус не исследовался, ALK – негативный.
Пациент – курильщик, стаж курения 20 лет. На момент обследования не курил в течение года.
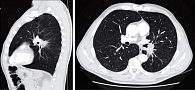
Данные КТ органов грудной клетки от 13 июля 2021 г.: на фоне интерстициальных изменений в легких в виде смешанной буллезной эмфиземы отмечаются единичные узелковые уплотнения до 2–3 мм, вероятно поствоспалительного характера. В области корня левого легкого, вдоль прилежащих отделов косой междолевой плевры (последняя утолщена, уплотнена в прилежащих отделах) – объемное образование неоднородной плотности, с неровными контурами, размерами около 33 × 30 × 33 мм, после контрастирования неравномерно накапливает контрастный препарат, муфтообразно охватывает левую легочную артерию, деформирует ее на данном уровне, неравномерно суживает просвет, с признаками инвазии (без четких границ). Просвет сужен до 2 мм на протяжении до 19–20 мм. Кроме того, образование муфтообразно охватывает, неравномерно суживает и деформирует просвет В6. Образование несколько вдается в область средостения, на отдельных участках прилежит к левой стенке пищевода, без убедительных признаков инвазии. Увеличенных внутригрудных лимфоузлов не выявлено (рис. 4).
Отдаленные метастазы в ходе обследования не обнаружены.
На основании полученных данных пациенту установлен диагноз: центральный рак нижней доли левого легкого, стадия IIIb (T3N1M0).
На момент обращения в КККОД сохранялись жалобы на малопродуктивный кашель, одышку при физической нагрузке. Сопутствующие заболевания: гипертоническая болезнь III стадии, риск 4. Мочекаменная болезнь.
По данным эхокардиографии, фракция выброса – 65%.
Тактика лечения пациента обсуждалась на врачебном консилиуме в КККОД. С учетом результатов обследования, общего состояния пациента было принято решение о проведении ХЛТ по радикальной программе. С 12 июля по 24 августа 2021 г. выполнено два курса полихимиотерапии (ПХТ) в рамках одновременной ХЛТ по схеме: паклитаксел 175 мг/м2 + карбоплатин AUC 5, цикл – 21 день. Переносимость лечения удовлетворительная, нежелательных явлений не зафиксировано.
С 12 июля по 24 августа 2021 г. пациенту проведен курс дистанционной конформной ЛТ на линейном ускорителе электронов TrueBeam с помощью фиксирующего устройства MammaBoard с использованием трехмерного планирования объема облучения (3D-CRT) после КТ-топометрической разметки. При ЛТ опухоли нижней доли левого легкого разовая очаговая доза (РОД) составляла 2,0 Гр, суммарная очаговая доза (СОД) – 60,0 Гр. Одновременно облучали пораженные лимфатические узлы: РОД – 2,0 Гр, СОД – 60,0 Гр. Облучение проводилось ежедневно, пять раз в неделю. Лучевые реакции не выражены.
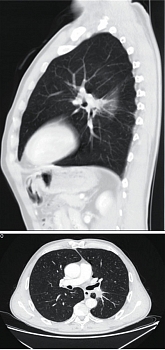
Сразу по завершении ХЛТ проведено контрольное обследование – КТ органов грудной клетки (рис. 5). КТ органов грудной клетки от 23 августа 2021 г.: в корне левого легкого объемное образование с лучистыми контурами, размерами 26 × 18 × 25 мм (ранее 33 × 30 × 33 мм), окутывающее и суживающее просвет нижней долевой ветви левой легочной артерии на протяжении 22 мм, деформирующее просвет В6, инфильтрирующее междолевую плевру. Трахея и бронхи I–III порядка проходимы, не деформированы. Жидкости в плевральной полости нет. Лимфатические узлы не увеличены. Средостение структурно, дополнительных образований в нем не определяется.
Данные КТ органов брюшной полости от 23 августа 2021 г. – без особенностей. Таким образом, после проведения одновременной ХЛТ достигнут частичный ответ.
В сентябре 2021 г. пациенту по решению врачебного консилиума КККОД рекомендовано проведение иммунотерапии препаратом дурвалумаб в дозе 10 мг/кг внутривенно капельно, каждые две недели.
После шести курсов иммунотерапии выполнено контрольное обследование. КТ органов грудной клетки от 24 декабря 2022 г.: в корне левого легкого объемное образование с лучистыми контурами, примерными размерами 26 × 17 × 24 мм (ранее 26 × 18 × 25 мм), окутывающее и суживающее просвет нижней долевой ветви левой легочной артерии на протяжении 22 мм, деформирующее просвет В6, инфильтрирующее междолевую плевру. Жидкости в плевральной полости нет. Лимфатические узлы – без динамики.
С 24 сентября 2021 г. по настоящий момент выполнено 12 введений дурвалумаба. Нежелательных явлений, требующих коррекции или прекращения терапии, не зарегистрировано.
Заключение
Результаты исследования PACIFIC подтверждают эффективность поддерживающей терапии дурвалумабом после ХЛТ, что выражается в увеличении ОВ и ВБП. Кроме того, сроки начала консолидирующей иммунотерапии в пределах 120 дней по завершении лучевой терапии не влияют на показатели ОВ и ВБП в реальной клинической практике. В настоящее время использование консолидирующей терапии дурвалумабом по окончании ХЛТ по радикальной программе при неоперабельном местно-распространенном НМРЛ считается стандартом лечения, что закреплено в том числе в российских и международных клинических рекомендациях.
R.A. Zukov, PhD, Prof., I.P. Safontsev, PhD, Yu.V. Kozina
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Federal Siberian Scientific and Clinical Center
Contact person: Ruslan A. Zukov, zukov_rus@mail.ru
Lung cancer is on the leading position in the structure of oncological morbidity and mortality both in Russia and across the Globe. Treatment approaches for non-small cell lung cancer (NSCLC) are updated quite frequently. This is due to the release of evidence of the new regimens effectiveness, both already registered drugs and new molecules obtained as a result of clinical trials. However, for patients with locally advanced and unresectable (stages IIIB and IIIC) NSCLC chemoradiation therapy (CRT) remains the main effective treatment. It can be concurrent or sequential, depending on the performance status of the patient. The results of the PACIFIC study published in 2017 demonstrated the high clinical efficacy of using an immunotherapeutic agent (the anti PD-L1 inhibitor durvalumab) as a consolidation therapy after standard definitive CRT and made this approach as a new standard of care in real practice. This article provides an overview of scientific data on the combination of radiation and immunotherapy in the NSCLC treatment and describes the experience of the Krasnoyarsk Clinical Oncological Dispensary named after A.I. Kryzhanovsky of the durvalumab usage in this category of patients.
