Препарат Генферон® – новый подход к профилактике и лечению лучевых поражений эпителия влагалища
- Аннотация
- Статья
- Ссылки
Патогенез лучевых поражений комплексный. Проникающая радиация вызывает ионизацию внутриклеточной воды и потому поражает все без исключения ткани и органы тела. Поражается внутриклеточный аппарат: митохондрии, лизосомы, происходят разрывы хромосом и нитей дезоксирибонуклеиновой кислоты. Это серьезно нарушает функции клеток или ведет к их гибели. Наиболее чувствительны к радиации быстро делящиеся (т.е. имеющие короткий срок жизни) клетки, в связи с чем эпителиоциты, отличающиеся высокой скоростью деления, поражаются одними из первых. В результате лучевые поражения эпителия относятся к основным осложнениям лучевой терапии.
К лучевым повреждениям (осложнениям) относятся органические и функциональные изменения органов и тканей, которые требуют специального лечения. Местные повреждения характеризуются развитием изменений исключительно в зоне облучения. В зависимости от продолжительности времени, прошедшего после радиационного воздействия, они делятся на ранние и поздние. Радиобиологические исследования ряда авторов (L. Cohen, C. Orton, F. Ellis) показали, что восстановление сублетально облученных клеток происходит в течение 100 дней. Исходя из этого, лучевые повреждения, развившиеся в пределах данного срока (в течение 3 месяцев), относят к ранним. Все повреждения, появившиеся позже указанного времени, рассматриваются как поздние.
Возникновение ранних эпителиитов влагалища в случаях проведения сочетанного или контактного облучения, если брахитерапия осуществлялась с дозами низкой и средней мощности, обычно обусловлено тем, что лучевые нагрузки были больше толерантных. В то же время при использовании в качестве единственного компонента лечения внутриполостного радиационного воздействия с дозой высокой мощности или сочетании его с дистанционным, ранние эпителииты влагалища появляются даже в тех ситуациях, в которых толерантность тканей не превышается. Следовательно, по всей вероятности, брахитерапия с дозой высокой мощности сама по себе, даже в условиях применения толерантных лучевых нагрузок, может быть причиной развития ранних эпителиитов влагалища.
Как уже было сказано, при назначении лучевой терапии следует учитывать т.н. лучевую толерантность здоровых тканей. Толерантность – это предельно допустимая радиационная нагрузка, в абсолютном большинстве случаев не приводящая к необратимым изменениям в тканях. Она зависит от биологических свойств тканей, от величины поглощенной дозы и ее распределения во времени и пространстве (объем облучаемых тканей). К сожалению, в ряде случаев при лучевом лечении осложнения возникают даже тогда, когда толерантные дозы, рассчитанные по различным радиобиологическим моделям, не превышены. Местные лучевые повреждения, развивающиеся при лучевой терапии злокачественных опухолей, отличаются резистентностью к лечению различными медикаментозными средствами.
Согласно действующей на данный момент классификации, выделяют 4 степени лучевых повреждений влагалища: I – гиперемия слизистой оболочки; II – сухой эпителиит; III – экссудативный эпителиит; IV – эрозивно-язвенный кольпит.
Как результат лучевого поражения, изменяется также качественный и количественный состав влагалищной жидкости. В просвете влагалища в норме ежесуточно скапливается 0,5-2 мл жидкости, представляющей собой секрет цервикальных желез, эндометрия и эндосальпинкса, а также транссудат кровеносных и лимфатических сосудов. В норме она прозрачная, светлая, полужидкая, тягучая (слизистого характера), не имеет неприятного запаха, в ней преобладают эпителиальные клетки. В мазке наряду с эпителиальными клетками обнаруживается небольшое количество лейкоцитов (до 20 в поле зрения). Чрезвычайно важными являются защитные свойства влагалищной жидкости, обусловленные такими факторами, как наличие в ней иммуноглобулинов (sIgA, IgG), лизоцима (мурамидазы), лактоферрина, а также фагоцитирующих клеток. При лучевых поражениях отмечаются выраженные изменения состава и количества влагалищной жидкости, что влечет за собой снижение ее защитных свойств и повышение восприимчивости к урогенитальным инфекциям, в том числе вызванным условно-патогенными микроорганизмами, которые могут присутствовать в составе вагинального микробиоценоза и у здоровых женщин. Экстирпация матки с придатками по поводу рака тела матки усугубляет ситуацию, т.к. приводит к отсутствию секрета канала шейки матки и эндометрия, и влагалищная жидкость формируется только выделяемым бартолиновыми железами секретом и транссудатом влагалища.
Очевидно, что качество жизни излеченной радиотерапией от злокачественной опухоли больной во многом определяется наличием или отсутствием осложнений лучевой терапии, что актуализирует вопрос выбора средств для эффективного лечения развивающихся лучевых повреждений.
В настоящий момент с целью профилактики инфекционных осложнений и ускорения регенерации пораженного эпителия применяются местные антисептики (растворы перманганата калия, фурацилина и т.д.), антибактериальные и фунгицидные препараты (Тержинан®, Полижинакс®, Нео-Пенотран® и т.п.), средства, ускоряющие эпителизацию (метилурацил, сок алоэ и тому подобные). Однако применение этих средств не позволяет скорректировать показатели местного иммунитета и характеристики влагалищной жидкости, что повышает вероятность хронического течения патологических процессов.
Представляется перспективным местное применение препаратов интерферона, которые, наряду с прямым противовирусным, бактериостатическим, а также радиопротекторным действием, оказывают мощное иммуномодулирующее действие, повышая активность местных факторов иммунной защиты. Однако при их применении остается актуальным вопрос ускорения регенерации поврежденного в результате облучения эпителия, а также быстрого купирования неприятных ощущений, которые сопровождают подобные повреждения.
Имеются основания полагать, что решить данную проблему может включение в состав терапии лучевых поражений вагинального эпителия комбинированного препарата Генферон®.
Препарат Генферон® – новая лекарственная форма интерферона-α в виде свечей для вагинального и ректального введения. Основными компонентами препарата Генферон® являются интерферон человеческий рекомбинантный α2b, таурин и анестезин. Комбинация активных и вспомогательных веществ, входящих в состав Генферона®, обеспечивает не только сохранение активности и физических свойств препарата, но также усиление и расширение спектра действия основных его компонентов. Интерферон обладает выраженным противовирусным и иммуномодулирующим действием. Противовирусный эффект опосредован рецептор-зависимой активацией внутриклеточных ферментов 2’5’-олигоаденилатсинтазы и протеинкиназы, а также белков группы MX, ингибирующих репликацию вирусов. Иммуномодулирующее действие проявляется в активации CD-8+ цитотоксических Т-лимфоцитов, NK-клеток, усилении дифференцировки В-лимфоцитов и продукции ими антител со сменой их изотипа и повышением аффинности, активацией моноцитарно-макрофагальной системы и фагоцитоза, а также усилении экспрессии молекул MHC-I, что способствует, в первую очередь, амплификации клеточно-опосредованных реакций иммунной системы. Известны также радиопротекторные свойства интерферона. Таурин – серосодержащая аминокислота, образующаяся в организме в процессе метаболизма цистеина – широко применяется при целом ряде заболеваний. Таурин способствует нормализации метаболических процессов, обладает регенерирующими, репаративными, мембрано- и гепатопротекторными свойствами. Таурин действует и как антиоксидантное средство, непосредственно взаимодействуя с активными формами кислорода, избыточное накопление которых способствует развитию патологических процессов (воспаление, интоксикация и т.д.). Сочетание интерферона с таурином в одной лекарственной форме позволяет обеспечить широкий спектр действия препарата и пролонгировать действие интерферона. Анестезин, являясь местным анестетиком, устраняет болезненные ощущения, зуд, жжение при обострении воспаления.
С целью подтверждения клинической эффективности препарата Генферон® при лечении лучевых поражений вагинального эпителия в 2008-2009 гг. на базе 1-го радиологического отделения МГОБ №62 было проведено сравнительное рандомизированное открытое исследование.
Материалы и методы
Получающие лучевую терапию пациентки в возрасте от 18 до 70 лет (общее число пациентов – 40), с имеющимся риском возникновения лучевого поражения эпителия влагалища, были поровну распределены посредством рандомизации в одну из двух групп исследования (основную и контрольную).
Критериями включения являлись возраст пациенток от 18 до 70 лет, предполагаемое возникновение лучевого поражения эпителия шейки матки, тела матки, вульвы, влагалища при проведении лучевой терапии и возможность выполнять все процедуры исследования.
К критериям исключения относились следующие: наличие сопутствующих серьезных соматических или инфекционных заболеваний (в т.ч. ВИЧ, туберкулез и т.д.); гиперчувствительность к препаратам интерферонов или другим компонентам исследуемого препарата; манифестные формы урогенитальных инфекции (гонорея, генитальный герпес, хламидиоз и т.д.); образование лучевых язв, свищей и прочих дефектов, требующих хирургического вмешательства; наличие психоневрологических заболеваний, наркомания, алкоголизм, а также одновременное участие в других клинических исследованиях.
Включенные в исследование пациентки основной группы получали препарат Генферон® 500000 МЕ, начиная с 4-го дня лучевой терапии интравагинально 2 раза в сутки в течение 10 дней, с последующим назначением препарата в режиме 1 раз в сутки на ночь в течение последующих 10 дней.
В группу сравнения вошли 20 пациенток с наличествующим риском возникновения лучевого поражения эпителия влагалища, которые не получали препарат Генферон®.
Суммарная продолжительность участия в исследовании одного пациента составила 60 дней.
Диагноз лучевого поражения эпителия влагалища ставился на основании следующих критериев: проведение лучевой терапии злокачественных новообразований влагалища, матки и наружных половых органов, характерные изменения при гинекологическом осмотре, воспалительная картина при цитологическом исследовании мазка и характерные жалобы пациенток (боль, жжение, зуд и т.д.), оцениваемые по визуальной аналоговой шкале (ВАШ).
Пациенткам обеих групп в ходе их участия в исследовании было запрещено использование местных заживляющих/эпителизирующих средств (метилурацил, солкосерил и т.д.). Допускалось применение антисептических и обезболивающих средств по показаниям.
В ходе лечения каждой пациентке 4 раза выполнялись следующие исследования: физикальное исследование, гинекологический осмотр, цитологическое исследование полученного из влагалища биоматериала, а также субъективная оценка пациенткой своих жалоб со стороны мочеполовой системы с использованием визуальной аналоговой шкалы. Данные исследования выполнялись до начала лучевой терапии и до применения препарата Генферон® (первый визит); на 6 ± 1 день применения препарата Генферон® по достижении суммарной очаговой дозы (СОД) 14-16 Гр (второй визит); по завершении адъювантной дистанционной гамма-терапии (ДГТ) на СОД 42 Гр (третий визит) и через 1 месяц после проведенной ДГТ (четвертый визит). Пациентки из контрольной группы, не получавшие Генферон®, проходили обследования по той же схеме.
Полученные результаты и их обсуждение
1. Оценка по визуальной аналоговой шкале
Пациентки самостоятельно оценивали выраженность своих неприятных ощущений (боль, жжение, зуд и т.п.) в баллах по визуальной аналоговой шкале (ВАШ), проградуированной от 0 (отсутствие неприятных ощущений) до 6 (нестерпимые ощущения) баллов.
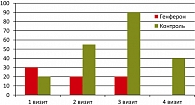
До начала лучевой терапии в основной группе 30% (6 из 20) пациенток предъявляли жалобы на зуд, неприятные ощущения в области влагалища, соответствующие 1 баллу интенсивности по ВАШ. Во время проведения лучевой терапии на СОД 14-16 Гр и 6 ± 1 день применения препарата Генферон® аналогичные жалобы наблюдались у 15% больных, у 1 пациентки (5%) они соответствовали 2 баллам по ВАШ. Таким образом, несмотря на проведение лучевой терапии, не только не отмечалось усиления выраженности жалоб, но и имело место уменьшение количества больных с неприятными ощущениями в области влагалища. При СОД 42 Гр (терапия препаратом Генферон® завершена около 6 дней назад) интенсивность жалоб не нарастала: 15% пациенток имели жалобы по ВАШ 1 балл, и одна пациентка имела жалобы 2 балла по данной шкале. Через 1 месяц после завершения лучевой терапии ни одна больная не предъявляла жалоб.
В то же время в контрольной группе уже ко второму визиту (СОД = 14-16 Гр) общее количество пациенток с жалобами увеличилось и составило 55%. К третьему визиту количество пациенток контрольной группы с жалобами (1 или 2 балла по ВАШ) увеличилось до 90% (16 пациенток). На четвертом визите (через месяц) у 8 пациенток контрольной группы сохранялись жалобы на неприятные ощущения в области влагалища, соответствующие 1 баллу по ВАШ (рисунок 1).
2. Данные гинекологического осмотра
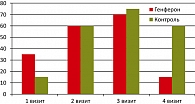
До начала лучевой терапии в основной группе (визит 1) скудные выделения наблюдались у большинства больных – 65% в опытной и 85% в контрольной группе, умеренные – у 35% и 10%, соответственно, обильные выделения отмечались у одной пациентки контрольной группы. В процессе лучевой терапии на суммарной очаговой дозе 14-16 Гр (6 ± 1 день применения препарата Генферон®) увеличилось количество пациенток с умеренными выделениями до 55%, появилась 1 пациентка с обильными выделениями (5%). Количество пациенток со скудными выделениями составило 40%. На третьем визите на СОД 40-42 Гр количество больных с умеренными выделениями оставалось прежним и составило 55%, со скудными – 30%, увеличилось количество женщин с обильными выделениями. Несмотря на то, что на этой дозе наблюдается пик лучевых реакций, значительного повышения частоты обильных выделений не отмечено. Через 1 месяц после завершения лучевой терапии (визит 4) у 85% женщин отмечены скудные выделения, умеренные – у 15%, обильных выделений не было ни у одной пациентки, что соответствует нормальной картине (рисунок 2).
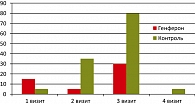
Другим объективным признаком развития лучевых реакций является гиперемия слизистой влагалища. До лечения в основной группе (визит 1) умеренная равномерная гиперемия слизистой влагалища наблюдалась у 15% женщин, что вполне естественно, т. к. у них всех имела место хирургическая травма (в анамнезе экстирпация матки с придатками по поводу рака тела матки, рака яичников). В процессе лучевого лечения на СОД 14-16 Гр, что совпадает с 6-м днем применения препарата Генферон®, гиперемия имелась у 5% пациенток (лучевая реакция не успела нарасти, а эффект препарата Генферон® уже развился). На СОД 40-42 Гр (визит 3), что соответствует ожидаемому пику лучевых реакций, гиперемия слизистой влагалища наблюдалась у 30% пациенток основной группы и была расценена как лучевая реакция легкой степени. На четвертом визите (через 1 месяц после завершения лучевой терапии) гиперемии влагалища в основной группе не отмечалось ни у одной пациентки (рисунок 3).
В контрольной группе к третьему визиту умеренные выделения наблюдались у 70%, обильные – у 5% пациенток, на четвертом визите умеренные выделения сохранялись у 60% (тогда как в опытной группе – только у 15%). Развитие местной лучевой реакции I степени, клинически проявляющееся в виде увеличения количества вагинальных выделений и развития умеренной равномерной гиперемии слизистой влагалища, на втором визите наблюдалось у 35% пациенток контрольной группы (в опытной – только у 5%), на третьем – у 80% (по сравнению с 30% в группе, получавшей Генферон®). На последнем визите гиперемия сохранялась у одной пациентки контрольной группы и отсутствовала у всех пациенток опытной.
3. Данные цитологического исследования
Основным критерием оценки являлось число лейкоцитов в исследуемых образцах (в норме у женщин во влагалищном секрете допускается присутствие до 20 лейкоцитов в поле зрения).
До начала лучевой терапии (визит 1) у 85% пациенток основной и контрольной группы наблюдалась нормальная цитологическая картина – менее 20 лейкоцитов в поле зрения, и только у 15% количество лейкоцитов превысило 20 в поле зрения. Во время второго визита на СОД 14-16 Гр значимых отклонений показателей цитограммы не было – у 80% пациенток было менее 20 лейкоцитов в поле зрения, у 20% – свыше 20. На ожидаемом пике лучевых реакций (СОД 40-42 Гр) у 60% женщин количество лейкоцитов было более 20 в поле зрения, у 40% – менее 20%. Через 30 дней после завершения лучевой терапии 90% женщин имели количество лейкоцитов менее 20 в поле зрения и, соответственно, у 10% пациенток было свыше 20 лейкоцитов в поле зрения.
Видимых различий в основной и контрольной группе по критерию содержания лейкоцитов в мазке из влагалища не отмечалось. Следует отметить, что интерферон повышает активность гранулоцитов (фагоцитарная и миграционная активность нейтрофилов), вследствие чего может способствовать повышению числа лейкоцитов в мазке. При этом повышение эффективности местных защитных механизмов под влиянием интерферона обеспечивает большую резистентность слизистой оболочки влагалища к различным патогенам в долгосрочной перспективе.
4. Состояние вагинального микробиоценоза
До лечения в основной группе (визит 1) нормальные показатели микробиоценоза влагалища наблюдались лишь у 45% больных (как указывалось ранее, у всех женщин в анамнезе присутствовала хирургическая травма, что, видимо, и явилось причиной развития дисбиотического процесса), 55% женщин имели кокковую флору. На втором визите на СОД 14-16 Гр (6 ± 1 день применения препарата Генферон®) нормальная микрофлора была уже у 55% пациенток, кокковая – у 45%. На пике ожидаемых лучевых реакций во время третьего визита на СОД 40-42 Гр отмечалось сохранение тенденции к нормализации микрофлоры влагалища за счет применения препарата Генферон®: у 60% пациенток была нормальная микрофлора, у 40% – кокковая. Через месяц после завершения лучевой терапии 85% женщин имели нормальную микрофлору и лишь 15% – кокковую.
Сопоставляя показатели вагинального микробиоценоза в контрольной и основной группах можно сделать вывод, что применение препарата Генферон® приводит к нормализации микрофлоры. К последнему визиту (через месяц после завершения лучевой терапии) нормальная микрофлора наблюдалась у 85% женщин основной группы и лишь у 45% контрольной, тогда как у 55% контрольной группы флора была представлена кокками.
5. Сопутствующие осложнения
Лучевая терапия, как правило, сопровождается лучевыми реакциями со стороны близлежащих органов, в той или иной степени подвергающихся облучению. В данном случае в зоне лучевого воздействия находятся мочевой пузырь и прямая кишка, в связи с чем лучевые осложнения со стороны этих органов рассматривались как дополнительный критерий оценки. В основной группе на дозе 26-28 Гр у 2 из 20 пациенток отмечались явления не резко выраженного цистита. В обоих случаях пациентки связывали усиление явлений цистита с приемом алкоголя. В контрольной группе явления цистита наблюдались у 7 из 20 пациенток и у 2 – явления ректита, что однозначно свидетельствует о влиянии интерферонотерапии на частоту подобных осложнений.
Заключение
При сравнительной оценке субъективных и объективных данных можно констатировать, что применение препарата Генферон® достоверно улучшает переносимость лучевой терапии, являющейся одним из основных методов лечения онкогинекологических заболеваний.
Выводы
Применение препарата «Генферон»:
- снижает частоту и степень выраженности местных лучевых реакций и осложнений лучевой терапии со стороны прилегающих органов;
- снижает вероятность развития вторичных инфекций, требующих дополнительных затрат на антибактериальную терапию;
- положительно влияет на показатели микробиоценоза влагалища;
- повышает качество жизни пациенток, подвергающихся лучевой терапии;
- позволяет избежать вынужденных перерывов в лечении (увеличения койко-дней).
Препарат Генферон® может рассматриваться в качестве средства выбора для профилактики и лечения лучевых поражений эпителия влагалища у пациенток с онкогинекологическими заболеваниями.
