Препараты сульфонилмочевины: рациональный выбор в лечении больных сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
Лечение сахарного диабета может быть успешным лишь при комплексном подходе и должно включать обучение больного, психологическую помощь, рациональное питание и повышение физической активности (изменение образа жизни), применение сахароснижающих препаратов, коррекцию факторов сердечно-сосудистого риска (дислипидемии, артериальной гипертензии, ожирения) и осуществление регулярного самоконтроля показателей гликемии, артериального давления и липидного спектра крови.
К числу важнейших нерешенных проблем современной клинической диабетологии относят низкую эффективность сахароснижающей терапии в реальной клинической практике. Действительно, целевых значений показателей углеводного обмена по данным национальных систем здравоохранения разных стран мира достигают в среднем лишь 50% больных, страдающих СД 2 типа. По этой причине современная сахароснижающая терапия, которая является наиболее важным направлением в комплексной терапии СД 2 типа, должна отвечать следующим критериям: иметь патогенетическую направленность, быть обоснованной с позиций доказательной медицины, осуществляться до цели, что предполагает раннюю фармакотерапию, раннюю рациональную комбинацию сахароснижающих препаратов и раннюю инсулинизацию, быть безопасной с точки зрения риска развития гипогликемий и сердечно-сосудистых осложнений (4, 8, 23, 27).
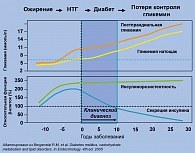
В настоящее время известно, что в основе развития СД 2 типа лежат несколько основных дефектов: снижение чувствительности инсулинозависимых тканей к действию инсулина (инсулинорезистентность), повышение продукции глюкозы печенью и нарушение глюкозозависимой секреции инсулина. Понятие «инсулинорезистентность» определяется как состояние, при котором требуется повышенное количество инсулина для нормального функционирования инсулинозависимых тканей. Поэтому развивающаяся в ответ на инсулинорезистентность гиперинсулинемия в определенной степени является адаптивным процессом, направленным на поддержание нормогликемии (6, 8). Однако в дальнейшем возникает секреторная недостаточность, снижение массы β-клеток и нарастающая инсулинопения. Таким образом, развитию СД 2 типа предшествует довольно длительный период (около 10 лет), когда нарушения углеводного обмена могут быть выявлены только при углубленном исследовании и проявляются инсулинорезистентностью и адаптивной гиперинсулинемией. При этом уровни глюкозы натощак и после еды остаются в пределах нормы. По мере развития и прогрессирования инсулинопении сначала возникают нарушения толерантности к глюкозе, которые в большинстве случаев остаются недиагностированными, а затем, при более значительном снижении секреции инсулина, развивается гипергликемия, что позволяет установить диагноз СД (рисунок 1).
Установлено, что в момент постановки диагноза СД 2 типа масса β-клеток уже снижена примерно на 50% преимущественно за счет повышения активности апоптоза, преобладающего над процессами неогенеза и репликации. Следовательно, значительное снижение секреции инсулина на момент диагностики СД 2 типа у больных обусловлено как нарушением функции, так и снижением массы панкреатических β-клеток.
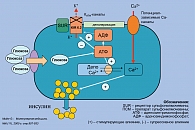
В основе секреции инсулина лежит механизм закрытия АТФ-зависимых калиевых каналов (КАТФ-каналов) сарколеммы β-клетки в ответ на поступление глюкозы в клетку, что ведет к ее деполяризации и открытию потенциалзависимых кальциевых каналов, через которые в клетку устремляются ионы кальция (рисунок 3). Повышение внутриклеточной концентрации кальция вызывает процесс высвобождения инсулина путем дегрануляции β-клеток, степень которой может быть различной, что определяет возможность значительной вариабельности скорости секреции инсулина. Это является важным механизмом регуляции функционирования β-клеток, который позволяет восстанавливать запас инсулина после воздействия гипергликемии.
При СД 2 типа длительно существующая гипергликемия приводит к десенситизации β-клеток, которая возникает не только в ответ на поступление глюкозы в клетку, но и к действию других секретогенов, а также нарушению восстановления функционального резерва β-клеток. В результате в панкреатических островках исчезают зрелые (наполненные инсулином) клетки, готовые к секреции. На фоне хронической гипергликемии механизм секреции инсулина β-клетками может нарушиться необратимо.
Кроме того, в последние годы установлено, что инсулинорезистентность сама по себе может способствовать снижению секреции инсулина, так как β-клетки имеют рецепторы к инсулину, при снижении чувствительности которых нарушается аутокринная регуляция синтеза и соответственно секреция инсулина (20).
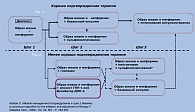
Исходя из особенностей естественного развития заболевания больным СД 2 типа патогенетически оправдано раннее назначение препаратов, улучшающих чувствительность тканей к инсулину, а также стимулирующих его секрецию. Согласно существующему алгоритму лечения больных СД 2 типа (рисунок 2), первым этапом лечения является модификация образа жизни с одновременным назначением метформина – препарата, влияющего прежде всего на механизмы центральной (повышенная продукция глюкозы печенью) и периферической (сниженная утилизация глюкозы мышцами и жировой тканью) инсулинорезистентности (4, 21). Как препарат первого выбора, метформин характеризуется высокой сахароснижающей активностью, значительной доказательной базой, безопасностью, невысокой стоимостью, положительными эффектами на массу тела и липидный профиль. Вместе с тем метформин не оказывает влияние на другой важнейший патогенетический дефект у больных СД 2 типа – нарушение секреции инсулина, в связи с чем в большинстве случаев монотерапия метформином не обеспечивает достижение целей гликемического контроля (15). Кроме того, по данным обзора S. Bolen et al. (2007), у 2 – 63% больных СД 2 типа метформин вызывает побочные эффекты со стороны ЖКТ (11), что ограничивает его клиническое использование. К другим группам сахароснижающих препаратов 1-го ряда относятся производные сульфонилмочевины, основным механизмом действия которых является стимуляция секреции инсулина, а также базальный инсулин (1, 3, 21).
К преимуществам ПСМ относят высокую сахароснижающую активность (снижение уровня HbA1 в среднем cоставляет 1-2% при монотерапии), хорошую доказательную базу, подтверждающую их эффективность и безопасность, а также низкую стоимость, определяющую доступность препарата. К основным недостаткам ПСМ относят их способность вызывать гипогликемии и прибавку массы тела (3, 9, 21).
В настоящее время ПСМ рекомендуется использовать в качестве дополнительного сахароснижающего препарата при отсутствии адекватного контроля гликемии на фоне модификации образа жизни и монотерапии метформином. Кроме того, ПСМ могут назначаться и в качестве инициирующего сахароснижающего препарата при плохой переносимости метформина или наличии противопоказаний к его назначению (3, 7).
ПСМ, применяемые в клинической практике с середины прошлого столетия, имеют единый механизм действия, но различаются по сахароснижающей активности, продолжительности действия, путям выведения и рецепторной селективности, поэтому принципиально важным для клинической практики является вопрос обоснованного выбора препарата для больных СД 2 типа.
Являясь по сути секретогенами ПСМ, так же как и глюкоза, действуют на КАТФ-каналы мембраны β-клетки, структурными компонентами которых являются специфические рецепторы сульфонилмочевины (SUR). Взаимосвязь ПСМ со специфическими мембранными рецепторами β-клетки приводит к закрытию сарколеммальных КАТФ-каналов, последующей деполяризации клеточной мембраны и активации потенциалзависимых кальциевых каналов, что сопровождается повышением внутриклеточной концентрации кальция с последующим экзоцитозом инсулина из β-клеток (10) (рисунок 3).
КАТФ-каналы состоят из 2 субъединиц: внутренней стенки канала (Kir6.2) и субъединицы рецептора SUR и обнаруживаются помимо β- клетки в различных тканях: поджелудочной железе, кардиомиоцитах, гладкомышечных клетках сосудов, головном мозге. В настоящее время установлено, что существуют разные изоформы рецептора к сульфонилмочевине: SUR-1 – в β-клетках поджелудочной железы; SUR-2A – в кардиомиоцитах; SUR-2B – в гладкомышечных клетках сосудов (16, 19).
После открытия КАТФ-каналов кардиомиоцитов в 1983 г. длительное время считалось, что сохранение сарколеммных КАТФ-каналов кардиомиоцитов открытыми при ишемии миокарда ограничивает, по описанному выше универсальному механизму, вход ионов кальция в клетку и снижает их доступность для внутриклеточного сокращения миофибрилл кардиомиоцитов, что приводит к уменьшению нагрузки на сердце и снижению потребности миокарда в кислороде. Описанный процесс, являющийся подготовкой к более выраженной ишемии, благодаря которому может значительно уменьшаться зона повреждения миокарда, получил название феномена ишемического прекондиционирования миокарда (2, 17).
Согласно ранним гипотезам, закрытие КАТФ-каналов кардиомиоцитов под влиянием неселективных ПСМ (глибенкламид, гликлазид, глимепирид, глипизид) служило основной причиной повышенного риска развития неблагоприятных сердечно-сосудистых событий у больных СД 2 типа, получающих сахароснижающую терапию. Вместе с тем эти представления противоречили результатам клинических исследований, которые продемонстрировали, что глимепирид и глибенкламид, относящиеся к неселективным ПСМ, обладали противоположными эффектами на миокард у больных СД 2 типа и ишемической болезнью сердца (ИБС).
Так, при сравнении эффектов глимепирида и глибенкламида на ишемическое прекондиционирование миокарда с помощью двойного слепого плацебо-контролируемого исследования у 45 пациентов с СД 2 типа и ИБС было показано, что у пациентов, получивших глимепирид, отмечалось уменьшение величины средней и максимальной депрессии сегмента SТ во время баллонной окклюзии на 34 и 33% соответственно, а также удлинение времени до появления болей при повторных баллонных окклюзиях по сравнению с пациентами, которым был введен глибенкламид (17).
Кроме того, перевод больных СД 2 типа с глибенкламида на 4 недельную монотерапию глимепиридом сопровождался достоверным возрастанием времени выполнения физической нагрузки до возникновения диагностически значимой депрессии сегмента ST, пикового значения ЧСС и величины двойного произведения, а также поглощения кислорода во время проведения стресс-теста. Полученные данные позволили заключить, что глимепирид повышает ишемический порог, который характеризует способность миокарда противостоять угрозе развития ишемии миокарда в условиях возрастающей потребности в кислороде. Важно отметить, что результаты исследования не могли объясняться влиянием метаболических факторов, так как существенных различий между двумя группами обследованных больных по показателям углеводного и липидного обмена не отмечалось (2).
Указанные противоречия разрешились при более глубоком изучении механизмов влияния ПСМ на развитие ишемического прекондиционирования миокарда. Оказалось, что адаптация миокарда к ишемическому воздействию является сложным и многокомпонентным процессом с участием большого числа внутриклеточных посредников и сигнальных молекул. Была обнаружена важная роль митохондриальных КАТФ-каналов в процессе подготовки миокарда к ишемии, которые под влиянием внутриклеточных протеинкиназ (тирозинкиназы, митогенактивированной протеинкиназы и особенно протеинкиназы С) сохраняются открытыми, обеспечивая защиту митохондрий и сохранение их функций по эффективному транспорту энергии между митохондриальными и миофибриллярными АТФ-азами во время периода реперфузии, способствуя уменьшению или полному исчезновению ишемии миокарда.
Современные данные о ведущей роли митохондриальных КАТФ-каналов в адаптации миокарда к ишемии позволили полностью пересмотреть концепцию клинической значимости фактора селективности современных ПСМ и объяснить различия между глимепиридом и глибенкламидом по влиянию на сердечно-сосудистую систему, установленные в некоторых клинических исследованиях.
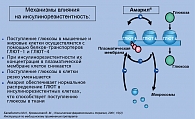
Как указывалось выше, глимепирид и глибенкламид относятся к неселективным ПСМ, так как способны связываться как с рецепторами сарколеммальных КАТФ-каналов β-клеток, так и с рецепторами сарколеммальных КАТФ-каналов кардиомиоцитов. Вместе с тем глимепирид, в отличие от глибенкламида, не блокирует функцию митохондриальных КАТФ-каналов и не оказывает негативного влияния на процессы прекондиционирования миокарда (рисунок 5), что позволяет более широко и безопасно использовать этот препарат у пациентов СД 2 типа с высоким риском сердечно-сосудистых осложнений (2).
Это особенно актуально, если учесть, что большинство пациентов с СД 2 типа имеют сочетанную патологию, такую как гипертоническая болезнь, ИБС, а также указания на перенесенный в прошлом инфаркт миокарда (6). Кроме того, данные многочисленных исследований о ведущей роли сердечно-сосудистых осложнений в структуре летальности больных СД 2 типа (13, 22, 26) служат дополнительным аргументом в пользу приоритетного выбора среди ПСМ глимепирида как препарата, не обладающего негативным влиянием на механизмы патофизиологической кардиопротекции.
Результаты крупных рандомизированных исследований показали, что тяжелые гипогликемические состояния у пациентов СД 2 типа с сопутствующей кардиальной патологией являются независимым фактором риска повышенной смертности этой категории больных (13).
Ряд сравнительных исследований продемонстрировал более низкий риск гипогликемий при использовании глимепирида по сравнению глибенкламидом. Так, по данным A. Holstein и соавт. (2001) 4-летнее проспективное наблюдение более чем 30000 больных СД 2 типа показало, что на фоне лечения глимепиридом тяжелые гипогликемии наблюдались в 6,5 раз реже, чем при лечении глибенкламидом (0,86/1000 пациентов в год против 5,6/1000 пациентов в год соответственно) (14).
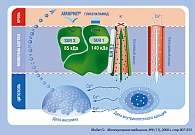
Важным отличием глимепирида от других ПСМ 2-й генерации является его способность обеспечивать у больных СД 2 типа «управляемую гликемию», основанную на более физиологичном характере стимуляции секреции инсулина при применении данного препарата (3). Так, несмотря на сходство сахароснижающего эффекта глимепирида и глибенкламида уровень инсулина в периоды между приемами пищи при применении глимепирида оказался значительно ниже. Исследования in vitro показали (рисунок 4), что глимепирид взаимодействует с низкомолекулярной субъединицей СМ-рецептора (SURx), имеющей меньшую молекулярную массу (65 кДа), а глибенкламид и другие ПСМ второго поколения – с субъединицей SUR1, имеющей большую молекулярную массу (140 кДа) (17). Установлено, что это обеспечивает в 2,5-3 раза более высокую скорость связывания и определяет раннее начало сахароснижающего эффекта, а также в 8-9 раз более высокую скорость диссоциации глимепирида со специфическим рецептором на мембране β-клетки, что приводит к более быстрому прекращению действия данного препарата по сравнению с аналогичными показателями для глибенкламида.
Перечисленные особенности молекулярного взаимодействия глимепирида с рецепторами SURx свидетельствуют о таком существенном преимуществе терапии глимепиридом по сравнению с другими ПСМ, как повышенная безопасность в отношении низкого риска развития гипогликемий, что находит подтверждение в реальной клинической практике (23). Согласно алгоритму ведения пациентов СД 2 типа (ADA/EASD, 2008), в связи с повышенным риском развития гипогликемий на фоне лечения глибенкламидом и хлорпропамидом при выборе ПСМ предпочтение следует отдавать более современным ПСМ: глимепириду и пролонгированным формам гликлазида и глипизида (21).
К другим положительным свойствам глимепирида, повышающим эффективность его влияния на углеводный обмен, относятся экстрапанкреатические эффекты, которые характеризуются улучшением чувствительности тканей к инсулину за счет увеличения количества и активности транспортеров глюкозы в адипоцитах (рисунок 5) (18, 19). В исследовании «Эффективность глимепирида и его влияние на инсулинорезистентность, адипоцитокины и атеросклероз» K. Koshiba и соавт. (2006) показал, что у больных СД 2 типа через 28 недель лечения глимепиридом, по сравнению с группой пациентов, получавших глибенкламид, существенно снизились показатели HOMA-IR, содержание в крови ФНО-α, интерлейкина-6, С-реактивного протеина, определяемого высокочувствительным методом, а также параметры, характеризующие «жесткость» сосудистой стенки. Полученные результаты позволили авторам сделать вывод о снижении под влиянием глимепирида инсулинорезистентности и активности проатерогенных факторов (18).
Экскреция глимепирида осуществляется двумя путями: 58% препарата в виде неактивных метаболитов выводится через почки, а 35% – через желудочно-кишечный тракт, что значительно снижает риск кумуляции препарата с последующим развитием гипогликемических состояний. Это позволяет использовать глимепирид у пациентов с патологией почек даже на начальных стадиях хронической почечной недостаточности.
Известно, что у пациентов, получающих ПСМ, отмечается увеличение массы тела, что относится к нежелательным эффектам терапии, так как увеличивает имеющуюся инсулинорезистентность. Популяционное исследование эффективности и переносимости глимепирида в ежедневной клинической практике, проведенное с участием более 22000 пациентов СД 2 типа в Германии, показало, что терапия глимепиридом способствовала снижению массы тела, особенно у людей с ожирением, что объясняется отсутствием значительной гиперинсулинемии на фоне приема этого препарата (24). Нейтральность в отношении влияния на вес у пациентов СД 2 типа была подтверждена при проведении мета-анализа многочисленных клинических исследований с применением глимепирида (12).
Важным качеством современного сахароснижающего препарата, которое существенно повышает приверженность пациентов с СД 2 типа к лечению, является удобство применения. Очевидно, что форма выпуска глимепирида (таблетки по 1, 2, 3, 4 мг), однократный прием препарата с рекомендуемой начальной дозой 1 мг в сутки, а также простая схема титрации (увеличение дозы на 1 мг в сутки каждую 1-2 недели до достижения целевых значений гликемии) являются предпосылками успешного применения глимепирида широким кругом больных СД 2 типа.
Заключение
Препараты сульфонилмочевины, согласно национальным и международным рекомендациям, по-прежнему остаются лекарственными препаратами 1-й линии у пациентов СД 2 типа, несмотря на развитие новых направлений в фармакотерапии этого заболевания. Учитывая существующие различия ПСМ по сахароснижающей активности, продолжительности действия, путям выведения и рецепторной селективности, большое практическое значение приобретает рациональный выбор препарата, что может существенно повысить эффективность и снизить риски лечения больных СД 2 типа.
Глимепирид (препарат Амарил®) является современным ПСМ третьей генерации, который обладает сочетанием таких качеств, как высокая сахароснижающая активность, низкий риск гипогликемий, отсутствие кардиотоксичности и нефротоксичности, нейтральность в отношении массы тела, имеет простую схему титрации и удобен для приема, что определяет обоснованность его применения у большинства больных СД 2 типа.
