Роль клинических, патоморфологических и молекулярно-генетических факторов в выживаемости больных увеальной меланомой
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Анализ данных изменений проводили в группе из 104 пациентов с УМ методом метил-чувствительного ПЦР-анализа. Все опухоли гистологически верифицированы.
Результаты. Показана статистически значимая ассоциация моносомии хромосомы 3 со смешанно-клеточным и эпителиоидно-клеточным типом УМ, вовлечением в процесс цилиарного тела, а также ассоциация делеции короткого плеча хромосомы 1 с наличием экстрабульбарного роста опухоли. Изучены общая пятилетняя выживаемость пациентов и смертность в результате метастатической болезни в группе больших УМ, а также взаимосвязь выживаемости пациентов с моносомией хромосомы 3, делецией короткого плеча хромосомы 1 и метилированием гена RASSF1A. Моносомия хромосомы 3 в клетках опухоли значимо ухудшает жизненный прогноз (p = 0,0001), делеция короткого плеча хромосомы 1 не влияет на развитие метастатической болезни, а метилирование гена RASSF1A несколько улучшает жизненный прогноз при УМ (p = 0,04).
Заключение. Установлена значимая взаимосвязь моносомии хромосомы 3 со сниженной выживаемостью пациентов, а метилирования гена RASSF1A – c лучшим жизненным прогнозом. Сочетание нескольких молекулярно-генетических аберраций (моносомия хромосомы 3 и делеция короткого плеча хромосомы 1) снижает выживаемость пациентов с УМ.
Материал и методы. Анализ данных изменений проводили в группе из 104 пациентов с УМ методом метил-чувствительного ПЦР-анализа. Все опухоли гистологически верифицированы.
Результаты. Показана статистически значимая ассоциация моносомии хромосомы 3 со смешанно-клеточным и эпителиоидно-клеточным типом УМ, вовлечением в процесс цилиарного тела, а также ассоциация делеции короткого плеча хромосомы 1 с наличием экстрабульбарного роста опухоли. Изучены общая пятилетняя выживаемость пациентов и смертность в результате метастатической болезни в группе больших УМ, а также взаимосвязь выживаемости пациентов с моносомией хромосомы 3, делецией короткого плеча хромосомы 1 и метилированием гена RASSF1A. Моносомия хромосомы 3 в клетках опухоли значимо ухудшает жизненный прогноз (p = 0,0001), делеция короткого плеча хромосомы 1 не влияет на развитие метастатической болезни, а метилирование гена RASSF1A несколько улучшает жизненный прогноз при УМ (p = 0,04).
Заключение. Установлена значимая взаимосвязь моносомии хромосомы 3 со сниженной выживаемостью пациентов, а метилирования гена RASSF1A – c лучшим жизненным прогнозом. Сочетание нескольких молекулярно-генетических аберраций (моносомия хромосомы 3 и делеция короткого плеча хромосомы 1) снижает выживаемость пациентов с УМ.
Введение
Увеальная меланома (УМ) – наиболее частая первичная внутриглазная злокачественная опухоль среди взрослого населения (рис. 1) [1]. Имеют место отдельные случаи развития УМ у детей и подростков [2, 3]. Метастатическая болезнь развивается у половины пациентов с первичной меланомой хориоидеи. Несмотря на наличие современных эффективных методов разрушения и удаления первичной УМ, а также предотвращения ее дальнейшего роста внутри глаза, включающих брахитерапию, протонно-лучевую терапию и энуклеацию, эффективных способов лечения метастатической УМ не существует [4].
Обычно УМ метастазирует в печень (95%), легкие (24%), кости (16%) и кожу (11%), но возможно развитие метастазов и в лимфатических узлах или головном мозге [5].
Прогноз и лечение пациентов с УМ зависят от распространения метастазов опухоли в печень. Медиана выживаемости после выявления метастазов в печень составляет, по разным данным, от четырех до шести месяцев. При этом годичная выживаемость не превышает 10–15% [6, 7]. Пациенты с метастазами других локализаций (легкие, кости) имеют несколько лучшую медиану выживаемости (19–28 месяцев) с годичной выживаемостью 76% [8].
На жизненный прогноз при УМ влияют следующие факторы:
- локализация опухоли в цилиарном теле (ЦТ);
- большие размеры опухоли (высота более 5 мм, диаметр основания более 15 мм);
- наличие экстрабульбарного роста;
- эпителиоидно-клеточный и смешанно-клеточный тип УМ;
- большое число митозов в клетке;
- потеря одной копии хромосомы 3 (моносомия хромосомы 3);
- удвоение хромосомы 8q;
- профиль экспрессии генов класса 2 (GEP 2) [6, 8–12].
Ряд авторов акцентируют внимание на роли молекулярно-генетических факторов, включающих как хромосомные изменения, так и мутации в генах, в определении метастатического потенциала первичной УМ [13, 14]. При анализе молекулярно-генетических маркеров жизненного прогноза при УМ в литературе обсуждается также делеция короткого плеча хромосомы 1, а метилирование гена RASSF1A хромосомы 3 рассматривают применительно к ряду других злокачественных новообразований (немелкоклеточный рак легкого, рак почек). В то же время данные о его значении в онкогенезе УМ противоречивы [9, 15].
Выраженная ассоциация молекулярно-генетического профиля УМ с метастатической болезнью способствует развитию данного вида диагностики. В ряде исследований показано, что большинство пациентов хотят знать риск развития у них метастазов независимо от того, насколько эффективно и доступно лечение [13, 16, 17]. К практической значимости молекулярно-генетических исследований следует отнести возможность проведения адъювантной терапии УМ, поскольку в такие исследования могут быть включены пациенты с высоким риском развития метастазов [13]. С учетом важности определения молекулярно-генетических аберраций для прогнозирования УМ целью данного исследования стал анализ выживаемости группы пациентов с УМ и ее корреляции с такими изменениями, как моносомия хромосомы 3, делеция короткого плеча хромосомы 1 и метилирование гена RASSF1A, а также уточнение клинических, патоморфологических и молекулярно-генетических особенностей метастатической УМ.
Материал и методы исследования
Всего обследовано 104 пациента (66 (63,4%) женщин, 38 (36,6%) мужчин) с УМ, получавших лечение в 2005–2007 гг. Возраст больных составил 22–84 года (средний возраст 53,7 ± 12,2 года). Срок наблюдения – 41–84 месяцев (60,9 ± 8,8 месяца).
У 101 (97,1%) пациента проведена энуклеация, у трех (2,9%) по показаниям – блокэксцизия опухоли. В четырех (3,9%) случаях энуклеации предшествовало органосохранное лечение (курс брахитерапии с применением Ru/Rh-офтальмоаппликаторов). По локализации выделяли меланому цилиохориоидальной зоны – 26 пациентов (25%), хориоидеи – 67 (64,4%), радужки – четыре (3,9%) и иридоцилиохориоидальной зоны – семь (6,7%) пациентов.
После энуклеации пораженного глаза биопсийный материал опухоли и относительно неповрежденной хориоидеи, а также образцы периферической крови (консервант: 0,5 М раствор ЭДТА) сохраняли при температуре -20 оС. Для исследования образцов тонкоигольной аспирационной биопсии материал собирали с цитологических препаратов.
Геномную ДНК из образцов опухолей, условно интактной хориоидеи и периферической крови выделяли с помощью протеиназы К с последующей фенол-хлороформной экстракцией. При выделении ДНК из цитологических препаратов собранный со стекла материал обрабатывали лизирующим буфером, содержащим протеиназу К. Полученный лизат использовали в качестве матрицы для постановки полимеразной цепной реакции (ПЦР).
Потерю гетерозиготности в хромосомных районах 1p36, 1р31.3, 3p25.3, 3p21.3, 3p14.2, 3q12, 3q26.3, 3q28 идентифицировали с использованием высокополиморфных маркеров D1S243, D1S2145, D1S1635, D1S407, D1S3669, D1S438, D3S1038, D3S1317, D3S1568, D3S966, D3S1300, D3S1234, D3S2459, 16xTG_3q26.31, D3S3520, D3S2398. Контролем служила ДНК лейкоцитов периферической крови.
Для определения метилирования СpG-островков промоторных областей генов применяли метод метил-чувствительной ПЦР. В качестве матрицы для ПЦР использовали ДНК из клеток УМ, предварительно гидролизованную рестриктазами HpaII (для гена RASSF1A).
Диспансерное наблюдение осуществляли в соответствии с приказом Минздрава России от 19.04.1999 № 135 один раз в три месяца в течение первого года, затем один раз в шесть месяцев в течение второго года, в дальнейшем – один раз в год во взрослом консультативно-поликлиническом отделении Московского НИИ глазных болезней им. Гельмгольца. Пациенты, которые по разным причинам не могли присутствовать на контрольном осмотре, сообщали о себе по телефону, факсу или через родственников передавали справки от онкологов и офтальмологов с места жительства. Часть данных получена путем запросов в департаменты здравоохранения по месту жительства пациентов.
Статистический анализ проводили с применением точного критерия Фишера. Для исследования выживаемости пациентов после лечения использовали статистический метод множительных оценок Каплана – Мейера, а для оценки различия между двумя выборками – двухвыборочный критерий Вилкоксона (Манна – Уитни) и регрессионную модель Кокса. Для анализа полученной информации все наблюдения разделены на два типа: цензурированные (незавершенные), в которых исход не наступил на момент окончания исследования (пациенты живы) либо пациенты выбыли из исследования (в том числе смерть от других причин), и нецензурированные (завершенные), при которых зафиксирована смерть пациента от метастатической болезни. Расчеты проводили с использованием пакета программ для Windows (Microsoft Excel, Statistica 10.1).
Результаты и их обсуждение
В период с октября 2005 г. по ноябрь 2007 г. в отделе офтальмоонкологии и радиологии Московского НИИ глазных болезней им. Гельмгольца проведена 101 энуклеация и три блокэксцизии УМ с последующим патогистологическим и молекулярно-генетическим изучением во всех исследуемых случаях. Долгосрочное наблюдение пациентов (пять лет и более) проведено во всех случаях. На основе молекулярно-генетического анализа все пациенты были разделены на три группы: первая группа – 45 (43,3%) пациентов с моносомией хромосомы 3, вторая группа – 30 (28,8%) пациентов с делецией короткого плеча хромосомы 1, третья группа – 23 (22,1%) пациента с метилированием гена RASSF1A. Группу сравнения составили 29 пациентов без исследуемых аберраций.
В 11,5% случаев (n = 12) отмечалось наличие как моносомии хромосомы 3, так и делеции короткого плеча хромосомы 1 (1p). В 5,8% случаев (n = 6) выявлены одновременно моносомия хромосомы 3 и метилирование гена RASSF1A. Сочетание делеции короткого плеча хромосомы 1 и метилирования гена RASSF1A установлено у 8,7% (n = 9) исследуемых. Наконец, сочетание трех молекулярно-генетических аберраций выявлено у двух (1,9%) пациентов. У 29 (27,9%) пациентов не зарегистрировано ни одной из исследуемых аберраций.
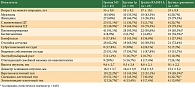
Для каждой из групп приведены клинические и патоморфологические характеристики (таблица). Статистически значимые (p < 0,05) ассоциации удалось выявить при сопоставлении пациентов из группы моносомии хромосомы 3 и гистологических типов опухоли, причем для данной группы характерно преобладание прогностически наименее благоприятных типов – смешанно-клеточного и эпителиоидно-клеточного (77,8%). Анализ ассоциаций гистологических типов УМ с опухолями из групп 1p и RASSF1A не выявил существенных отличий между различными типами УМ. Кроме того, в группе моносомии хромосомы 3 зафиксирована ассоциация с вовлечением цилиарного тела в опухолевый процесс, что расценено как неблагоприятный фактор, ухудшающий жизненный прогноз [12]. Так, в данной группе 51,1% пациентов были с цилиохориоидальной и иридоцилиохориоидальной локализацией УМ, что представляется значимым по сравнению с группами 1p, RASSF1A, а также общей когортой пациентов, в которой преобладали новообразования хориоидальной локализации без вовлечения цилиарного тела (p = 0,038). В группе пациентов с делецией короткого плеча хромосомы 1 выявлена значимая ассоциация с экстрабульбарным ростом опухоли, одним из наиболее неблагоприятных прогностических факторов, увеличивающих вероятность развития метастатической болезни [11]. По нашим данным, выживаемость в группе делеции короткого плеча хромосомы 1 не отличалась от общей выживаемости, в связи с чем данная ассоциация может носить случайный характер.
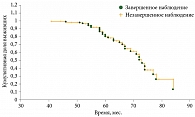
Смертность от метастатической болезни составила 30,8% (n = 32) (рис. 2). Живые на момент исследования (n = 65; 62,5%) и умершие по другим причинам (n = 7; 6,7%) составили 69,2% от общего количества пациентов в исследуемой группе.
Средний срок наблюдения в общей группе пациентов составил 60,1 ± 9,3 месяца, при этом средняя продолжительность жизни пациентов от ликвидационного хирургического лечения до гибели вследствие метастатической болезни – 62,9 ± 10,1 месяца. Следует отметить, что в исследование вошли пациенты с большими УМ (средняя высота опухоли – 9,3 ± 2,7 мм, диаметр основания – 15,7 ± 3,6 мм). Таким образом, наши данные об общей выживаемости согласуются с данными других авторов, изучавших этот вопрос [7].
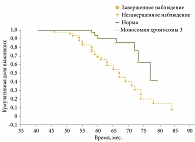
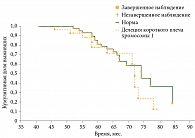
Отдельный интерес представляло изучение кумулятивной доли выживших в группе с моносомией хромосомы 3 (n = 47) и группе сравнения (n = 57) (рис. 3). Анализ полученных данных показал, что в группе моносомии хромосомы 3 смертность от метастатической болезни превысила выживаемость (53,2 против 46,8%; p = 0,002), что свидетельствовало о значимой роли моносомии хромосомы 3 в выживаемости пациентов с УМ. Аналогичные данные приводят зарубежные авторы [10, 16]. В группе сравнения выживаемость составила 87,7%, смертность – 12,3%, что более чем в четыре раза ниже по сравнению с группой моносомии хромосомы 3. Таким образом, нами подтверждена ассоциация моносомии хромосомы 3 со сниженной выживаемостью при УМ.
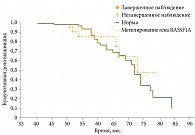
При анализе выживаемости в группе с делецией короткого плеча хромосомы 1 (n = 30) и группе сравнения (n = 74) смертность в группе 1p составила 36,7%, а в группе сравнения – 28,4% (рис. 4). Различия в выживаемости статистически незначимы (p = 0,064). Схожие данные получены при сопоставлении пациентов из группы с метилированием гена RASSF1A (n = 23) и пациентов группы сравнения (n = 81) (смертность 26,1 и 32,1% соответственно) (рис. 5). Однако следует отметить, что в отличие от группы с делецией короткого плеча хромосомы 1 данные различия статистически достоверны (p = 0,037 по регрессионной модели Кокса), что может свидетельствовать о более благоприятном характере течения опухолевого процесса в новообразованиях с метилированием гена RASSF1A.
В группе пациентов с сочетанием моносомии хромосомы 3 и делецией короткого плеча хромосомы 1 (n = 12) смертность составила 75%, что значительно превысило общую онкологическую смертность (p = 0,001). При сочетании моносомии хромосомы 3 и метилирования гена RASSF1A (n = 6) мы выявляли смертность в 2/3 случаев (67%) (p = 0,03), а при сочетании делеции короткого плеча хромосомы 1 и метилирования гена RASSF1A в девяти случаях (22,2%) (p = 0,068). Из двух пациентов, имевших все три молекулярно-генетические аберрации, один умер от метастатической болезни через 51 месяц после проведенного лечения.
Таким образом, делеция короткого плеча хромосомы 1 не оказывала существенного влияния на выживаемость пациентов с УМ, а метилирование гена RASSF1A ассоциировано с благоприятным жизненным прогнозом. Сочетание нескольких молекулярно-генетических изменений значимо ухудшало выживаемость пациентов.
Дополнительно проведено разделение пациентов на группы в зависимости от наличия (первая группа – 32 (30,8%) пациента) или отсутствия (вторая группа – 72 (69,2%) пациента) метастатической болезни. Статистически значимые различия между группами выявлены в распределении патогистологических типов опухоли. Так, в первой группе количество веретеноклеточных типов УМ, характеризующихся, согласно данным литературы [9], наиболее благоприятным течением опухолевого процесса, составило 34,3%, что на 12,9% меньше, чем во второй группе (р < 0,05). В то же время количество пациентов с неблагоприятными типами УМ (смешанно-клеточным и эпителиоидно-клеточным) составило около 2/3 (65,7%) общего количества пациентов первой группы. При этом доля эпителиоидно-клеточных УМ в обеих группах отличалась незначительно – 21,9 и 20,8% соответственно. Таким образом, наряду с подтверждением благоприятного в отношении жизненного прогноза веретеноклеточного и неблагоприятного смешанно-клеточного типа УМ не выявлено существенных отличий в частоте эпителиоидно-клеточного типа опухоли, относимого ранее к неблагоприятным [9].
В первой группе доля УМ с вовлечением в опухолевый процесс цилиарного тела (цилиохориоидальной и иридоцилиохориоидальной локализации) была достоверно выше, чем во второй (43,8 против 30,6%; р < 0,05). Данный признак, как показано в ряде исследований, относится к наиболее неблагоприятным в отношении жизненного прогноза [12].
При сопоставлении двух групп по таким клиническим признакам, как наличие пигментации, гемофтальма, вторичной отслойки сетчатки, субретинального экссудата и собственных сосудов опухоли, статистически значимые различия не выявлены. Необходимо отметить, что разница между первой и второй группой по наличию вторичной отслойки сетчатки составила 17,4% (56,2 и 73,6% соответственно). Но данное различие скорее всего носит случайный характер.
Отдельный интерес представляет ассоциация с развитием метастатической болезни такого неблагоприятного фактора, как экстрабульбарный рост опухоли. Подавляющее большинство авторов рассматривают его как фактор, значительно ухудшающий жизненный прогноз [9, 11]. Согласно нашим данным, процент УМ с наличием экстрабульбарного роста в первой группе был несколько выше, чем во второй (12,5 и 9,7% соответственно), но данные отличия статистически незначимы (p = 0,065). Размер экстрабульбарных узлов в группах различался. Так, в первой группе в трех из четырех случаев обнаружены большие узлы до 7 × 4 мм и лишь в одном случае – единичные опухолевые клетки. Во второй группе, напротив, в пяти из семи случаев наблюдались единичные узелки без значительного прорастания, а в двух случаях – небольшие очаги до 2 × 2 мм. Подобные различия могут свидетельствовать о роли размера экстрабульбарного узла в жизненном прогнозе при УМ.
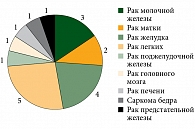
При сборе анамнеза у пациентов при обращении в клинику института учитывался такой фактор, как наличие онкологических заболеваний у ближайших родственников. Как правило, пациенты могли рассказать о заболеваниях родственников во втором или третьем поколении (родители, родные бабушки и дедушки), крайне редко в четвертом (прабабушки и прадедушки), а также родственников второго и третьего колена (дяди, тети, двоюродные и троюродные братья/сестры и т.д.). Всего отягощенный семейный анамнез по онкопатологии установлен у 19 больных. Основные виды злокачественных новообразований у родственников пациентов с УМ представлены на рис. 6.
Анализ показал, что отягощенный семейный онкологический анамнез в первой группе составил 31,2%, во второй – 12,5% (p = 0,002). Такие достоверные различия могут свидетельствовать о значимости семейного фактора в развитии метастатической болезни при УМ, однако в литературе данный фактор остается несколько недооцененным.
Наибольшие различия между двумя группами получены при анализе статуса хромосомы 3. Так, процент УМ с моносомией хромосомы 3 в первой группе превысил таковой во второй группе практически в три раза (78,1 против 27,8%; p = 0,0001). Подтверждена исключительная значимость статуса хромосомы 3 для жизненного прогноза при УМ, что согласуется с данными литературы [7, 9, 13, 15].
Несмотря на некоторое преобладание УМ с делецией короткого плеча хромосомы 1 в первой группе (34,3 против 26,4%), отличия статистически незначимы (p > 0,05). Вместе с тем процент УМ с метилированием гена RASSF1A в группах достоверно различался – 18,8 и 23,6% соответственно (p = 0,04), что свидетельствовало о протективной роли данного фактора в развитии метастазов УМ.
Отсутствие какого-либо из исследуемых молекулярно-генетических изменений выделено как отдельный прогностический фактор. В первой группе доля пациентов с отсутствием исследуемых молекулярно-генетических изменений составила 12,5%, во второй – 34,7% (p = 0,035). Однако значение данного фактора для жизненного прогноза при УМ представляется относительным, поскольку исследование проводили по ограниченному количеству молекулярно-генетических маркеров.
Заключение
В работе показана статистически значимая ассоциация моносомии хромосомы 3 со смешанно-клеточным и эпителиоидно-клеточным типом УМ, вовлеченностью в процесс цилиарного тела, а также ассоциация делеции короткого плеча хромосомы 1 с наличием экстрабульбарного роста опухоли. Изучены общая пятилетняя выживаемость пациентов и смертность в результате метастатической болезни в группе больших УМ. Показана достоверная ассоциация моносомии хромосомы 3 со сниженной выживаемостью пациентов, а метилирования гена RASSF1A – с улучшением жизненного прогноза.
Все пациенты с УМ должны быть обследованы на моносомию хромосомы 3. При ее выявлении рекомендуется проведение регулярного обследования отдаленных органов (печень, легкие) методами УЗИ, КТ, ПЭТ-КТ для определения возможных метастатических очагов.
A.Yu. Tsygankov, S.V. Saakyan, A.G. Amiryan, N.V. Sklyarova, D.V. Zaletayev
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Moscow Helmholtz Research Institute of Eye Diseases
I.M. Sechenov First Moscow State Medical University
Contact person: Aleksandr Yuryevich Tsygankov, alextsygankov1986@yandex.ru
Objective – to analyze survival of patients with uveal melanoma (UM) and its correlation with monosomy of chromosome 3, deletion of the short arm of chromosome 1 and methylation of gene RASSF1A as well as refining of clinical, pathomorphology and molecular-genetic features of metastatic UM.
Materials and methods. There were examined 104 patients with UM by using methylation-sensitive PCR. All samples of UM were histologically verified.
Results. There was found that monosomy of chromosome 3 was significantly associated with mixed-cell and epitheliod UM, affected ciliary body as well as association of deleted short arm of chromosome 1 with detected extrabulbar tumor growth. Total 5-year survival and mortality due to metastatic UM as well as relationship between survival rate and monosomy of chromosome 3, deleted short arm of chromosome 1 and methylated gene RASSF1A were assessed. It was found that monosomy of chromosome 3 in tumor cells profoundly deteriorates life prognosis (p = 0.0001), whereas deletion of short arm of chromosome 1 did not affect developing metastatic UM, and methylated gene RASSF1A slightly improved life prognosis in UM (p = 0.04).
Conclusions. There was found that monosomy of chromosome 3 was significantly linked to decreased survival rate of patients with UM, whereas methylated gene RASSF1A – with improved life prognosis. A combination of several genetic aberrations (monosomy of chromosome 3, deleted short arm of chromosome 1) decreases survival rate of patients with UM.
