Роль магнитно-резонансной томографии в выявлении ранних признаков поражения головного мозга при артериальной гипертензии
- Аннотация
- Статья
- Ссылки
- English
У пациентов среднего возраста с артериальной гипертензией (АГ) без сердечно-сосудистых и/или цереброваскулярных заболеваний в анамнезе поражение сосудов головного мозга обнаруживается в 44% случаев [1]. Для выявления ранних признаков поражения головного мозга в рамках болезни мелких сосудов может быть использована нейровизуализация с помощью различных импульсных последовательностей магнитно-резонансной томографии (МРТ) [2]. В настоящее время используют три стандартных последовательности МРТ: режимы Т1, Т2 и FLAIR [3].
В большинстве случаев очаги гиперинтенсивности в белом веществе головного мозга на Т2-взвешенных МРТ-изображениях расположены билатерально и симметрично [4], чаще отмечаются в перивентрикулярных областях и глубоких отделах белого вещества, реже – в инфратенториальных регионах головного мозга [5]. Для их оценки используют визуальные аналоговые шкалы – шкалу Фазекаса и шкалу Шелтенса [6].
У лиц пожилого и старческого возраста, страдающих АГ, при проведении МРТ помимо очагов повышенной интенсивности в белом веществе головного мозга нередко выявляются бессимптомные инфаркты, преимущественно небольших размеров с локализацией в глубоких отделах мозга (так называемые лакунарные инфаркты). Частота таких инфарктов варьируется от 10 до 30% [7]. Очаги гиперинтенсивности в белом веществе и немые инфаркты мозга в свою очередь ассоциируются с повышением риска инсульта, когнитивных нарушений и деменции [7–10].
Согласно результатам МРТ пациентов с АГ без сердечно-сосудистых заболеваний, скрытые цереброваскулярные очаги встречаются чаще, чем субклиническое поражение сердца и почек (44, 21 и 26% соответственно), при этом признаки поражения других органов-мишеней могут отсутствовать [11].
Исследование взаимосвязи артериальной гипертензии и поражений головного мозга с использованием МРТ
Влияние АГ на риск развития патологий головного мозга как органа-мишени оценивалось в нескольких крупных исследованиях [12–20].
В многоцентровом нейровизуализационном МРТ-исследовании (3C)-Dijon приняли участие 1319 человек (61,6% женщин), из них 75% страдали АГ. Средний возраст пациентов – 72,4 ± 4,1 года [12]. Период наблюдения – четыре года. На момент включения в исследование пациентам проводились трехкратное измерение артериального давления (АД) в положении сидя и МРТ головного мозга на томографе с мощностью магнитного поля 1,5 Т в стандартных последовательностях.
В группе пациентов с АГ отмечался больший объем очагов поражения в белом веществе головного мозга по сравнению с группой пациентов без АГ (р = 0,002). При этом максимальные значения объема поражения белого вещества фиксировались среди получавших антигипертензивную терапию, но не достигших целевых показателей АД по сравнению с получавшими таковую, достигшими целевых значений АД и не принимавшими ранее антигипертензивные препараты (р = 0,0009). Кроме того, была выявлена линейная зависимость между увеличением диастолического АД (ДАД) на каждые 5 мм рт. ст. и объемом поражения белого вещества головного мозга (р = 0,01). Через четыре года наблюдения у получавших антигипертензивную терапию, но не достигших целевых значений АД пациентов по-прежнему отмечался наибольший объем очагов поражения головного мозга (p < 0,01 против исходного p < 0,001).
В многоцентровом эпидемиологическом когортном исследовании ARIC изучали причины и клинические исходы атеросклероза, а также факторы сердечно-сосудистого риска у лиц среднего возраста [13]. С 1987 по 1989 г. в исследование были включены 15 792 человека (8710 женщин и 7082 мужчины) в возрасте от 45 до 64 лет. Дизайн исследования предусматривал четыре визита с периодичностью раз в три года. Во время третьего визита (1993–1995 гг.) 1920 пациентам (539 женщин, средний возраст – 62 ± 4,4 года) проведена МРТ головного мозга на томографе с мощностью магнитного поля 1,5 Т в режимах Т1, Т2, FLAIR. Очаговое поражение головного мозга оценивалось по десятибалльной шкале, где ноль – отсутствие очаговых изменений, девять – выраженные очаговые изменения. АГ обнаружена у 49% больных, из них 11% не получали антигипертензивную терапию, у 22% – достигнут целевой уровень АД на фоне приема антигипертензивных препаратов, 16% – получали антигипертензивную терапию, но не достигли целевых значений АД. На дополнительном пятом визите (2004–2006 гг.) 983 пациентам (605 женщин, средний возраст – 72 ± 4,0 года) выполнена повторная МРТ головного мозга. Установлено, что общее среднее систолическое АД (САД) служит предиктором прогрессирования поражения белого вещества головного мозга (2,6 cм3, p < 0,0001).
В кросс-секционном нейровизуализационном исследовании CARDIA анализировалась связь между сосудистыми факторами риска и ранними признаками повреждения головного мозга [14]. В 1985–1986 гг. в исследование включены 5115 пациентов от 18 до 30 лет. В 2010–2011 гг. 75% когорты обследованы повторно. Обследование предполагало трехкратное измерение АД и проведение МРТ головного мозга на томографе с мощностью магнитного поля 3 Т в режимах Т1, T2, MPRAGE, FLAIR, DTI, pCASL. В группе пациентов с АГ (n = 280, средний возраст – 50,3 ± 3,5 года) увеличение САД достоверно коррелировало с более выраженной атрофией белого вещества головного мозга (р = 0,002) и уменьшением общего объема головного мозга по сравнению с контрольной группой.
В проспективном исследовании, проведенном W.B. White и соавт., оценивалось прогрессирование очагового поражения головного мозга у 72 пожилых пациентов (средний возраст – 82 года) [15]. АГ диагностирована у 70% больных, 64% из них принимали антигипертензивную терапию. Период наблюдения составил два года. Всем пациентам проводились суточное мониторирование АД, измерение офисного АД, а также МРТ головного мозга на томографе с мощностью магнитного поля 3 Т в стандартных импульсных последовательностях.
Авторы исследования установили, что уровни офисного АД не коррелировали со степенью прогрессирования гиперинтенсивных очагов. Однако связь между отдельными показателями суточного мониторирования АД и объемом очагов в головном мозге была статистически достоверной. Так, исходно и по окончании наблюдения в группе пациентов со среднесуточным САД ≤ 135 мм рт. ст. общий объем очагов поражения белого вещества головного мозга был достоверно меньше, чем в группе пациентов со среднесуточным САД ≥ 135 мм рт. ст. (1,26 ± 0,15%, p = 0,03 против 1,96 ± 0,26%, p = 0,03).
В лонгитудинальном популяционном исследовании с участием 665 пациентов из Роттердамского исследования продемонстрировано, что на прогрессирование очагового поражения головного мозга влияет только уровень САД [16]. В группе нелеченых пациентов с АГ также отмечалось более быстрое прогрессирование объема очагов в белом веществе головного мозга по сравнению с группой пациентов, не достигших целевого АД на фоне регулярной антигипертензивной терапии (p < 0,05).
В исследование AGES-Reykjavik включены 4057 пациентов, участвовавших в популяционном исследовании Reykjavik [17]. Последнее проводилось с 1967 по 1996 г. В него отбирались лица, рожденные в 1907–1935 гг. и проживающие в Рейкьявике. Пациенты были разделены на две группы. Пациенты первой группы (n = 1365, 49% женщин, средний возраст – 51 ± 7,0 года) страдали АГ в среднем возрасте, 251 (6%) из них принимали антигипертензивную терапию. Пациенты второй группы (n = 2692, 64% женщин, средний возраст – 50 ± 6,0 года) не страдали АГ в среднем возрасте. В первой группе среднее САД составляло 148 ± 15 мм рт. ст., ДАД – 92 ± 9 мм рт. ст., во второй – 123 ± 9 и 78 ± 6 мм рт. ст. соответственно.
С 2002 по 2006 г. были получены новые данные, использованные в исследовании AGES-Reykjavik. У пациентов трехкратно измеряли АД, исследовали когнитивные функции и головной мозг (МРТ на томографе с мощностью магнитного поля 1,5 Т в последовательностях Т1, Т2, FLAIR).
Средний возраст больных первой группы составлял 77 ± 5,0 года, среднее САД – 149 ± 21 мм рт. ст., ДАД – 76 ± 10 мм рт. ст. Антигипертензивную терапию получали 82% пациентов. Средний возраст больных второй группы составлял 75 ± 5,0 года, среднее САД – 139 ± 19 мм рт. ст., ДАД – 73 ± 9 мм рт. ст. Антигипертензивные препараты принимали 53% пациентов.
У пациентов с АГ наблюдались достоверно более выраженные очаговые поражения белого вещества головного мозга (относительный риск (ОР) 1,3, 95%-ный доверительный интервал (ДИ) 1,1–1,6) и лакунарные инфаркты (ОР 1,2, 95% ДИ 1,1–1,4).
Высокие значения САД в старшей возрастной группе ассоциировались с увеличением риска лакунарных инфарктов (р = 0,01) и очагового поражения головного мозга (р = 0,002), но только для пациентов без АГ в среднем возрасте.
Высокое ДАД в старшей возрастной группе коррелировало с высоким риском очагового поражения головного мозга как у пациентов с АГ (p = 0,007), так и у пациентов без АГ в среднем возрасте (р < 0,001). Связь между значениями ДАД и лакунарными инфарктами не прослеживалась.
В исследование Z. Gaо и соавт. включены 148 пациентов (143 мужчины и пять женщин, средний возраст – 82,2 года). АГ зафиксирована у 113 (76,4%) больных, сахарный диабет второго типа – у 57 (38,5%), гиперлипидемия – у 31 (20,9%) больного [18].
В анамнезе у восьми пациентов (средний возраст – 81,3 ± 13,0 года) – геморрагический инсульт, у 63 (средний возраст – 84,4 ± 6,9 года) – ишемический инсульт, у 20 (средний возраст – 83,1 ± 6,8 года) – транзиторная ишемическая атака, у 57 (средний возраст – 79,6 ± 8,7 года) – лакунарный инсульт.
Пациентам выполнялись трехкратное измерение офисного АД и МРТ головного мозга на томографе с мощностью магнитного поля 1,5 Т в стандартных пульсовых последовательностях и режиме SWAN. Частота поражения глубинных отделов белого вещества головного мозга у пациентов с АГ оказалась достоверно выше, чем в контрольной группе – 64,6 и 42,9% соответственно, p = 0,002.
В кросс-секционное исследование J.C. Foster-Dingley и соавт. включено 220 пожилых пациентов (средний возраст – 80,7 ± 4,1 года, 125 (56,8%) женщин) [19]. Критерии включения: возраст 75 лет и старше, прием антигипертензивной терапии, наличие легких когнитивных нарушений по Краткой шкале оценки психического статуса, САД ≤ 160 мм рт. ст. Критерии исключения: деменция, ишемический инсульт или транзиторная ишемическая атака в анамнезе, инфаркт миокарда, ишемическая болезнь сердца, сердечная недостаточность, низкая ожидаемая продолжительность жизни.
До начала исследования пациентам выполнялось двукратное измерение АД, рассчитывались показатели среднего (1/3 САД + 2/3 ДАД) и пульсового (САД – ДАД) АД. Проведена МРТ головного мозга на томографе с мощностью магнитного поля 3 Т в стандартных последовательностях, а также в режимах DTI и SWI. Перивентрикулярные очаги обнаружены у 132 (60%) пациентов, субкортикальные – у 113 (51,4%), лакунарные инфаркты – у 59 (26,8%) пациентов. Достоверной корреляции между уровнями САД и/или ДАД и объемом поражения белого вещества головного мозга, наличием перивентрикулярных или подкорковых очагов, лакунарными инфарктами не отмечено.
С. Rosano и соавт. оценивали влияние САД на структуру трактов белого вещества головного мозга в когорте пожилых пациентов, принимавших участие в исследовании HEALTH ABC [20]. В лонгитудинальное когортное исследование HEALTH ABC (1997–1998) набрано 3075 пациентов в возрасте от 70 до 79 лет. Основными критериями включения в исследование стали трудность при самостоятельной ходьбе, способность пройти четверть мили или подняться на десять ступенек, отсутствие онкологических заболеваний. Пациенты должны были приходить к врачам ежегодно.
В 2006–2008 гг. только 819 пациентов, участвовавших в исследовании HEALTH ABC, смогли прийти на повторный прием. Им было предложено принять участие в исследовании Healthy Brain Project Ancillary. В исследование было включено 311 пациентов (130 (41,8%) мужчин, средний возраст – 82,9 ± 2,0 года). У 217 (69,3%) из них выявлена АГ, только 193 (62,1%) получали антигипертензивную терапию. Наблюдение продолжалось десять лет. В период исследования пациентам ежегодно двукратно измеряли АД. Кроме того, всем больным была выполнена МРТ головного мозга на томографе 3 Т в последовательностях FLAIR, MPRAGE, DTI.
Результаты исследования продемонстрировали, что увеличенные средние значения САД коррелировали с более высокой распространенностью очагового поражения белого вещества (p = 0,002). Исходное высокое пульсовое АД (ПАД) также было связано с высокой распространенностью очагов в белом веществе головного мозга (p = 0,03). При этом связь между приемом антигипертензивных препаратов и выраженностью очагового поражения белого вещества не установлена. Увеличение САД на каждые 10 мм рт. ст. повышало риск очагового поражения головного мозга примерно в десять раз (ОР 10,4, 95% ДИ 10,2–10,6, p = 0,0001). Относительно недавно у 5% больных АГ были идентифицированы очаги другого типа – микрокровоизлияния [21].
МРТ в режиме SWI/SWAN позволяет визуализировать следы мелких кровоизлияний по истечении длительного периода, отложения железосодержащих веществ в отдельных структурах головного мозга, а также контрастировать венозную кровь. Церебральные микрокровоизлияния визуализируются в виде гипоинтенсивных очагов размером 3–10 мм благодаря парамагнитным свойствам локальных депо макрофагов, содержащих гемосидерин [22].
В исследование L. Henskens и соавт. были включены 218 пациентов с АГ (50,5% мужчин, средний возраст – 52,5 ± 12,6 года). Среднее САД составляло 174 ± 24 мм рт. ст., ДАД – 104 ± 13 мм рт. ст. [23]. Пациентам проводились трехкратное измерение офисного АД в положении сидя, суточное мониторирование АД и МРТ головного мозга на томографе 1,5 Т в режимах Т1, Т2, FLAIR и SWI. Микрокровоизлияния обнаружены у 35 (16,1%) больных (95% ДИ 11,1–21,0). Пациенты с микрокровоизлияниями были старше и имели более высокие уровни офисного АД по сравнению с пациентами без микрокровоизлияний (p < 0,05).
Z. Gaо и соавт. выявили, что церебральные микрокровоизлияния у пациентов с АГ фиксировались чаще, чем у пациентов контрольной группы (51,3 и 20,0% соответственно, p = 0,001) [18]. Церебральные микрокровоизлияния коррелировали с очаговыми поражениями белого вещества головного мозга только в группе АГ (p < 0,01).
Согласно результатам исследования J.C. Foster-Dingley и соавт., у 25% пожилых пациентов с АГ отмечались церебральные микрокровоизлияния [19].
Z. Jia и соавт. оценивали связь факторов сердечно-сосудистого риска с локализацией и частотой встречаемости церебральных микрокровоизлияний [24]. В исследование были включены 393 пациента с церебральными микрокровоизлияниями (137 женщин, средний возраст – 70,7 ± 10,8 года).
Артериальная гипертензия первой степени выявлена у 141 (35,9%) пациента, второй степени – у 89 (22,6%), третьей степени – у 81 (20,6%) пациента. Сахарный диабет второго типа – у 101 (25,7%) больного. Антитромбоцитарную терапию получали 94 (23,9%) пациента. Очаговое поражение головного мозга имели 122 пациента, транзиторную ишемическую атаку перенесли 72 больных.
Участникам исследования проводилась МРТ головного мозга на томографе с мощностью магнитного поля 3 Т в последовательностях Т1, Т2, FLAIR, SWI. Увеличение САД на одно среднеквадратичное отклонение коррелировало с наличием церебральных микрокровоизлияний в области медиальной лентикулостриарной артерии (ОР 1,02, 95% ДИ 1,00–1,03, p < 0,026), латеральной лентикулостриарной артерии (ОР 1,01, 95% ДИ 1,00–1,02, p < 0,05), задней мозговой артерии (ОР 1,01, 95% ДИ 1,00–1,03, p < 0,024), таламуса (ОР 1,02, 95% ДИ 1,00–1,03, p < 0,001) и ствола (ОР 1,02, 95% ДИ 1,00–1,03, p < 0,007).
Следует отметить, что практически во всех исследованиях, посвященных данной проблеме, имелись существенные ограничения: разный возраст пациентов, наличие сопутствующих заболеваний, например сахарного диабета, транзиторных ишемических атак в анамнезе, которые оказывали влияние на полученные результаты, прием антитромботических препаратов, которые могли быть причиной или провоцирующим фактором развития церебральных микрокровоизлияний.
Клинический случай
Пациент К., 44 лет, обратился с жалобами на эпизодическое повышение АД, снижение памяти на текущие события, трудности при выполнении сложной работы.
Из анамнеза: повышение АД до 150/95 мм рт. ст. фиксировалось в течение последних трех лет при прохождении диспансеризации. Обследования и лечения по поводу АГ не получал, АД не измерял. К врачу не обращался, поскольку считал, что АД повышается из-за стресса на работе. В последние полтора месяца измеряет АД достаточно часто, его значения варьируются в пределах 150–160/90–100 мм рт. ст. При высоком, по мнению пациента, АД принимал каптоприл или нифедипин. Постоянной антигипертензивной терапии не получал.
В течение последнего полугода больному стало трудно сосредоточиваться при выполнении сложных профессиональных задач, появились забывчивость (помнит, что обещал что-то сделать, а что именно – не помнит), трудности в восприятии информации и планировании своего рабочего дня.
Пациент никогда не курил, алкоголь употребляет один раз в неделю (300–500 мл слабоалкогольных напитков (пиво)).
Семейный анамнез отягощен. Мать пациента страдала АГ (максимальные значения АД – 180/100 мм рт. ст.). В 70 лет перенесла геморрагический инсульт. Умерла в 75 лет в результате злокачественного образования желудка. Отец умер от цирроза печени.
Обследование. Соматический статус: кожные покровы чистые, обычной влажности и эластичности. Пастозность голеней и стоп. Индекс массы тела – 27,2 кг/м2, окружность талии – 93 см. Звук легких ясный, легочный. При аускультации легких – над всей поверхностью дыхание ослабленное везикулярное, хрипов нет. Частота дыхательных движений – 18 в минуту. При перкуссии выявлено смещение левой границы относительной тупости сердца влево (на 1,5 см снаружи от левой среднеключичной линии). Тоны сердца ясные, ритмичные. Частота сердечных сокращений (ЧСС) – 77 в минуту. АД – 150–152/95–98 мм рт. ст. При пальпации живот мягкий, безболезненный. Размеры печени по Курлову 9,5 × 8,0 × 7,0 см. Симптом поколачивания отрицательный с обеих сторон.
Неврологический статус: в ясном сознании, контактен, адекватен, критичен, правильно ориентирован в месте, времени и собственной личности. Черепно-мозговая иннервация интактна, выявляется хоботковый рефлекс. Парезов нет. Мышечный тонус в норме. Сухожильные рефлексы живые, D=S, зоны вызывания обычные, патологические рефлексы отсутствуют. Чувствительность не изменена. Пробы на координацию выполняет удовлетворительно. В позе Ромберга устойчив, проба Ромберга отрицательная. Походка – без особенностей. Тазовые органы контролирует.
Результаты нейропсихологического тестирования: 29 баллов по Монреальской шкале оценки когнитивных функций, дважды ошибся в серийном счете, ошибся в пробе на обобщение (на вопрос о том, что общего между часами и линейкой, ответил, что часы меряют время, а на линейке есть деления).
Тест вербальных ассоциаций. В пробе на категориальные ассоциации назвал девять животных – снижена беглость речи. Пробу на категориальные ассоциации выполнил удовлетворительно – назвал 13 слов.
Тест связи цифр и букв. Выполнил часть B за 254 секунды (норма для соответствующей возрастной группы и уровня образования – не более 106 секунд). Время выполнения части A не нарушено – 30 секунд.
Тест Струпа. Первая часть (чтение названий цветов, напечатанных черным шрифтом, Т1) – 52 секунды, вторая часть (называние цветов, Т2) – 64 секунды, третья часть (называние цвета слова, где цвет шрифта отличается от значения слова, Т3) – 188 секунд. Коэффициент интерференции (Т3-Т2) – 124 (чем больше эта разница, тем выраженнее эффект интерференции и, следовательно, ригидность (узость, жесткость) когнитивного контроля).
Общий анализ крови и мочи – без патологических изменений.
Биохимический анализ крови: креатинин – 90,9 мкмоль/л, скорость клубочковой фильтрации – 88 мл/мин/1,73 м2, калий – 4,7 ммоль/л, глюкоза натощак – 5,3 ммоль/л, общий холестерин – 4 ммоль/л, липопротеины низкой плотности – 1,3 ммоль/л, триглицериды – 0,9 ммоль/л, липопротеины высокой плотности – 1,2 ммоль/л.
Электрокардиограмма: ритм синусовый, правильный. ЧСС – 74 в минуту. Горизонтальное положение электрической оси сердца.
Эхокардиограмма: полости сердца не расширены. Стенки миокарда левого желудочка не утолщены. Глобальная систолическая функция левого желудочка сохранена (фракция выброса – 71%). Зон нарушения локальной сократительной способности миокарда не выявлено. Митральная регургитация нулевой-первой степеней. Трикуспидальная регургитация первой степени. Диастолическая функция левого желудочка не нарушена. Признаков легочной гипертензии не выявлено (среднее давление в легочной артерии – 20 мм рт. ст.).
Суточное мониторирование АД:
- среднесуточное САД – 138 мм рт. ст. (норма – менее 130 мм рт. ст.), ДАД – 82 мм рт. ст. (норма – менее 80 мм рт. ст.), ПАД – 56 мм рт. ст., ЧСС – 83 в минуту;
- среднедневное САД – 144 мм рт. ст. (норма – менее 135 мм рт. ст.), ДАД – 88 мм рт. ст. (норма – менее 85 мм рт. ст.), ПАД – 57 мм рт. ст., ЧСС – 83 в минуту;
- средненочное САД – 117 мм рт. ст. (норма – менее 120 мм рт. ст.), ДАД – 63 мм рт. ст. (норма – менее 70 мм рт. ст.), ПАД – 54 мм рт. ст., ЧСС – 84 в минуту;
- вариабельность САД днем – 13 мм рт. ст., ДАД днем – 11 мм рт. ст., САД ночью – 20 мм рт. ст., ДАД ночью – 12 мм рт. ст., тип суточного профиля – диппер, величина утреннего подъема САД – 95 мм рт. ст., ДАД – 88 мм рт. ст., скорость утреннего подъема САД – 20 мм рт. ст. в час, ДАД – 20 мм рт. ст. в час.
Триплексное сканирование сонных артерий: левая общая сонная артерия – диаметр средней части – 6,5 мм. Стенки повышенной эхогенности, средняя толщина комплекса «интима – медиа» по задней стенке – 0,78 мм. По передней стенке в области бифуркации лоцируется гетерогенная, преимущественно гипоэхогенная атеросклеротическая бляшка толщиной до 3,4 мм и протяженностью до 1,8 см с переходом в луковицу внутренней сонной артерии, стеноз до 36%. При цветовом допплеровском картировании кровоток ламинарный. Пиковая систолическая линейная скорость кровотока – 62 см/с. Правая общая сонная артерия – диаметр средней части – 6,6 мм. Стенки повышенной эхогенности, средняя толщина комплекса «интима – медиа» в луковичной части по задней стенке – 0,63 мм. По задней стенке в области бифуркации лоцируется гетерогенная атеросклеротическая бляшка с участками кальцификации толщиной до 2,3 мм и протяженностью до 1,2 см, переходящая во внутреннюю сонную артерию, стеноз до 24%. При цветовом допплеровском картировании кровоток ламинарный. Пиковая систолическая линейная скорость кровотока – 61 см/с.
Заключение: неокклюзирующие атеросклеротические бляшки в системе обеих сонных артерий на экстракраниальном уровне. Кровоток по каротидным артериям на экстракраниальном уровне сохранен. Гемодинамически значимых препятствий кровотоку по сонным артериям не обнаружено.
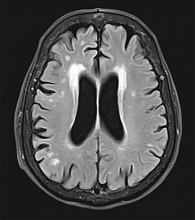
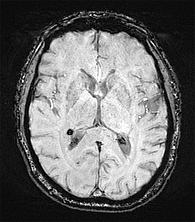
МРТ головного мозга на томографе Siemens Magnetom 3 T в последовательностях T1, T2, FLAIR, SWI (рис. 1 и 2): срединные структуры не смещены. Желудочковая система симметрична. Мамилло-понтинное расстояние не снижено. Арахноидальные пространства конвекстиальной поверхности мозга не расширены. Мозолистое тело без деформации, толщина не изменена. Ликвородинамика компенсирована. Гипофиз в турецком седле. Структура железы без очаговых изменений. Краниовертебральный переход сформирован нормально. Гиппокампы нормального объема. Негрубый лейкоареоз у передних рогов боковых желудочков по типу «шапочек». В умеренном количестве очаговые изменения в белом веществе. SWI – единичный экстравазат. Патологические сосудистые структуры не выявлены.
Заключение: болезнь мелких сосудов головного мозга, первая степень по шкале Фазекаса.
Таким образом, у пациента среднего возраста с недлительной (три года) АГ первой степени имеются поражения головного мозга: очаговые изменения в белом веществе головного мозга и единичный экстравазат. При этом другие органы-мишени не повреждены – отсутствует гипертрофия миокарда левого желудочка, скорость клубочковой фильтрации в норме.
Вывод
Пациентам с АГ нейровизуализация с помощью различных импульсных последовательностей МРТ может быть рекомендована уже на ранних стадиях заболевания для выявления ранних признаков поражения головного мозга и назначения соответствующей терапии, что позволит улучшить общий прогноз.
O.D. Ostroumova, T.M. Ostroumova, V.A. Perepelov, M.V. Velichko
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
City Polyclinic No 6, Saint Petersburg
Contact person: Olga Dmitriyevna Ostroumova, ostroumova.olga@mail.ru
The article touches upon the possibilities of magnetic resonance imaging in assessment of early brain damage in essential arterial hypertension. We provide data about the prevalence of white matter hyperintensities, lacunes and cerebral microbleeds in patients with essential arterial hypertension. The article presents a case report demonstrating target-organ brain damage in untreated middle aged patient with uncomplicated arterial hypertension.
