Роль средства ПростаДоз в предотвращении рака предстательной железы при простатической интраэпителиальной неоплазии высокой степени
- Аннотация
- Статья
- Ссылки
- English
Введение
Медицинское и научное сообщество уже в прошлом веке оценило проблему онкологических заболеваний как первостепенную. Совершенствование диагностики, разнообразие маркеров и доступность генетического анализа множат тревогу среди потенциальных пациентов.
Рак предстательной железы (РПЖ) – второе из наиболее распространенных злокачественных заболеваний и пятая из ведущих причин мужской смертности от рака по всему миру [1]. В этой связи очевидна необходимость разработки эффективных средств предотвращения развития РПЖ на клеточном уровне, способных отсрочить или предотвратить хирургическое вмешательство или химиолучевую терапию, улучшить качество жизни и уменьшить частоту инвазивных исследований при активном наблюдении.
Для простатической интраэпителиальной неоплазии высокой степени (ПИНВС) характерны атипичные выстилающие клетки секреторного эпителия в исходно имевшихся протоках и ацинусах железы [2]. В течение года с момента подтверждения ПИНВС по меньшей мере у 30% пациентов диагностируется РПЖ [3]. Поэтому именно пациентов с ПИНВС можно считать оптимальной группой для исследования эффективности превентивных средств защиты от РПЖ.
Канцерогенез РПЖ – сложный процесс, который стимулируют генетические и эпигенетические повреждения [3]. Основной вклад в развитие РПЖ вносят гормональный дисбаланс и факторы, связанные с образом жизни [4, 5]. Что касается гормонального дисбаланса, то 5-альфа-дигидротестостерон, андрогеновые рецепторы и эстрогены являются основными целями превентивной терапии РПЖ. 5-альфа-редуктаза катализирует производство дигидротестостерона, а затем с увеличением андрогенной активности дигидротестостерон активирует множество генов, вовлеченных в канцерогенез через андрогеновые рецепторы [6, 7]. Эстрогены способствуют развитию РПЖ через эстрогеновые рецепторы [8]. Ингибиторы 5-альфа-редуктазы (дутастерид, финастерид), антагонисты андрогеновых рецепторов (флутамид, бикалутамид) и блокаторы эстрогеновых рецепторов (торемифен) как химиопрепараты для предотвращения РПЖ исследованы в клинических испытаниях [9–13]. С расчетом на антиокислительную и антипролиферативную активность природных пищевых соединений также были изучены cелен, витамин Е, соевые продукты, томаты и зеленый чай и многие другие [14–16]. Большинство из этих пищевых агентов продемонстрировали незначительное влияние в отношении предотвращения РПЖ при ПИНВС, например селен и витамин Е в исследовании SELECT [17]. В другом исследовании пациенты с ПИНВС принимали в одном случае флутамид, а в другом – комбинацию ликопена, селена и катехинов, и на фоне комбинированного лечения отмечалась даже более высокая частота развития РПЖ [10, 18].
Нами уже проведен обзор широкого спектра средств, предотвращающих in vitro прогрессию РПЖ на клеточном уровне, а также изложены предварительные положительные результаты наблюдения пациентов с ПИНВС, принимавших ПростаДоз [19], что обусловило необходимость продолжения исследования. Кроме того, длительное наблюдение в большей степени соответствует продолжительности жизненного цикла клеток секреторного эпителия простаты, который составляет более двух лет [20].
Материал и методы
С февраля 2014 г. на базе клиники урологии Первого Московского государственного медицинского университета И.М. Сеченова проводится исследование возможности превентивной терапии РПЖ средством ПростаДоз. ПростаДоз фактически представляет собой квинтэссенцию компонентов, обладающих ожидаемым профилактическим эффектом в отношении развития РПЖ. Основной действующий элемент – экстракт зеленого чая TEAVIGO.
После получения предварительного согласия пациентов им выполнялась биопсия простаты по одной из доступных в клинике методик: расширенной секстантной под ультразвуковым контролем (12 биоптатов), сатурационной трансперинеальной биопсии (24–56 биоптатов), трансректальной под ультразвуковым контролем с применением данных гистосканирования, магнитно-резонансной томографии (МРТ) (когнитивный FUSION). Перед вмешательством все пациенты проходили стандартное доклиническое обследование, при повторных биопсиях обязательно выполнялось гистосканирование и/или МРТ органов малого таза с динамическим контрастным усилением. Такое дополнительное обследование соответствует клиническим рекомендациям, позволяет повысить достоверность результатов биопсии или отложить ее выполнение, провести сравнительный анализ структуры органа с течением времени.
В период с апреля 2015 г. по апрель 2017 г. в исследование включено 237 пациентов, имевших по результатам гистологического исследования ПИНВС. Пациенты были рандомизированы на две группы: основную (прием средства ПростаДоз по две капсулы в день в течение от полугода до двух лет, группа А) и контроля (наблюдение, группа В). Каждые три месяца выполнялся скрининг простатического специфического антигена (ПСА), пальцевое ректальное исследование, трансректальное ультразвуковое исследование, гистосканирование. Степень риска онкологической прогрессии была определяющим фактором выполнения повторной биопсии, которая или являлась контрольной точкой завершения исследования в случае обнаружения РПЖ, или позволяла оценить промежуточные результаты. По окончании терапии предполагалось определить гистологические изменения и выявляемость РПЖ при повторной биопсии, а также изменение уровня ПСА. Оценка проведена по группам как в целом, так и в зависимости от длительности наблюдения.
Критерием исключения пациентов при первичном наборе были прием ингибиторов 5-альфа-редуктазы, уровень ПСА выше 20 нг/мл.
Результаты
Возраст пациентов варьировался от 39 до 76 лет (медиана 63,4 года), уровень ПСА – от 2,7 до 18,4 нг/мл (медиана 6,3 нг/мл), объем предстательной железы – от 18 до 134 см3 (медиана 46,1 см3).
Средний возраст пациентов при полугодичном наблюдении составил в группе А 69,4 года (95%-ный доверительный интервал (ДИ) 59,4–73,1), в группе В – 70,8 года (95% ДИ 61,2–75,3). При наблюдении в течение года средний возраст группы А составил 64,7 года (95% ДИ 51,2–72,1), группы В – 66,2 года (95% ДИ 53,3–70,6). Средний возраст пациентов при полуторагодичном наблюдении в группе А составил 63,2 года (95% ДИ 50,3–69,4), группе В – 62,1 года (95% ДИ 49,2–67,6). При наблюдении в течение двух лет средний возраст в группе А составил 57,2 года (95% ДИ 49,1–63,9), группе В – 65,1 года (95% ДИ 52,1–69,8).
В группе А (прием ПростаДоза) содержание ПСА в среднем снизилось на 0,87 нг/мл (95% ДИ -1,66; 0,24), в группе контроля отмечено незначительное колебание его уровня в сторону повышения на 0,11 нг/мл (95% ДИ 1,6; -1,32).
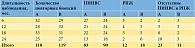
Отметку в полгода наблюдения преодолели 118 пациентов группы А и 119 пациентов группы В. Повторная биопсия выполнена 32 и 29 пациентам соответственно. Из дальнейшего наблюдения из-за выявления РПЖ исключены три пациента группы А и два пациента группы B. Отсутствие ПИНВС также послужило поводом для исключения двух пациентов группы А и трех пациентов группы В. Аналогично проводилась оценка в остальные временные промежутки, данные представлены в табл. 1. По итогам исследования РПЖ выявлен у 12 (10%) из 118 пациентов группы A и 8 (15%) из 119 пациентов группы B, исчезновение ПИНВС – у 23 (20%) и 11 (9%) соответственно.
Следует отметить, что доля пациентов с отсутствием ПИНВС и РПЖ при повторной биопсии после двухгодичного наблюдения в группе А составила 40% (10/25), в группе В – 11% (3/27). Для сравнения, при полугодичном наблюдении/приеме комплекса ПростаДоз соотношение было 6% (2/32) и 10% (3/29) соответственно.
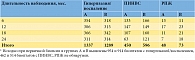
Количественный анализ биоптатов в основной (ПростаДоз) и контрольной группе в целом не выявил значимых различий. В группе А ПИНВС содержало исходно 33% (462/1416) биоптатов, по окончании исследования – 25% (450/1835). В группе В ПИНВС выявлена в 36% (514/1428) случаев исходно и 30% (596/1958) случаев после наблюдения. Однако различия оказались значимыми при сравнении результатов с длительностью исследования от полутора и двух лет: выявляемость ПИНВС при повторной биопсии в группе А составила 22% (107/484) и 17% (63/381) соответственно, тогда как в группе В – 31% (160/523) и 27% (121/453) соответственно. Подробные результаты представлены в табл. 2. Большее количество биоптатов при повторной биопсии связано с проведением исследований по показаниям, в том числе с использованием сатурационной методики.
Обсуждение
Поиск путей превентивного воздействия на носителей ПИНВС ведется уже давно, и никто не отрицает такой возможности. Однако в клинических исследованиях высокую (элиминирующую) эффективность показала только антиандрогенная терапия. Мировой опыт клинического применения микронутриентов и растительных экстрактов, тормозящих канцерогенез, не имеет четкой стандартизации и достаточного соответствия требованиям доказательной медицины. Более совершенный дизайн исследования был недостижим и в данной работе. В процессе наблюдения не удалось исключить факторы диеты и образа жизни, приема препаратов в связи с другой соматической патологией, не рассматривался фактор воспалительного процесса в простате и др. Тем не менее использование средства ПростаДоз, являющегося комбинацией экстракта плодов пальметто, селена, индол-3-карбинола, экстракта зеленого чая TEAVIGO, цинка и витамина Е, у столь значительного числа пациентов с применением гистологического контроля проведено впервые.
Наилучший эффект был достигнут у пациентов, принимавших ПростаДоз в течение двух лет: при повторной биопсии у значительной доли пациентов не выявлено ПИНВС или РПЖ. Кроме того, у пациентов в основной группе реже, чем в контрольной, диагностировался РПЖ и был ниже уровень ПСА, однако различия статистически не значимы (p > 0,05).
Исследование не преследовало цель установить достоверные различия по частоте обнаружения ПИНВС и РПЖ разными методами биопсии: расширенной секстантной под ультразвуковым контролем (12 биоптатов), сатурационной трансперинеальной биопсии (24–56 биоптатов), трансректальной под ультразвуковым контролем с применением данных гистосканирования, МРТ (когнитивный FUSION). Конечно, такая разнородность могла снизить точность сравнения, но выбор метода биопсии определялся целесообразностью достаточной точности в каждом конкретном случае во избежание ложноотрицательных результатов в диагностике РПЖ. Поэтому этот фактор не следует рассматривать как искажающий результаты исследования.
Полученные данные позволяют утверждать, что наибольшие перспективы имеет применение средства ПростаДоз при выявлении ПИНВС у пациентов среднего возраста с прогностически низким онкологическим риском. Гипотеза о предотвращении развития РПЖ при приеме этого средства не получила достоверного подтверждения, хотя выявляемость заболевания снизилась. Возможно, в дальнейшем целенаправленное исследование превентивных возможностей комплекса ПростаДоз у группы мужчин среднего (44–60 лет) или даже молодого (25–44 года) возраста позволит получить достоверные результаты.
L.M. Rapoport, D.G. Tsarichenko, T.M. Ganzha
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
Contact person: Timur Mikhaylovich Ganzha, timurmed@hotmail.com
The article presents the results of a study of a drug ProstaDoz use in patients with high-grade prostatic intraepithelial neoplasia (HGPIN), a recognized precancerous condition, to prevent the development of prostate cancer. For two years 237 patients included in the study have been divided into groups for observation and treatment (receiving drug ProstaDoz). Intermediate screening was conducted every three months, included standard scope of studies for suspected prostate cancer. As effectiveness evaluation criterion was used the result of the second prostate biopsy. The study prostate cancer was diagnosed in 10% of treatment group patients and 15% of the observation group, the disappearance of HGPIN in 20% and 9%, respectively (p > 0.05), which did not allow to confirm the hypothesis on the prevention of prostate cancer. When comparing the results in the subgroups with the study duration from a half
to two years, HGPIN detection at re-biopsy in group A were 22% and 17%, respectively, and in group B 31% and 27% (p < 0.05). Thus, the drug ProstaDoz allowed reduces the prevalence of HGPIN, making its clinical application promising in this group of patients.

