Сахарный диабет 2 типа: о чем должен быть осведомлен клиницист
- Аннотация
- Статья
- Ссылки
- English
На сегодняшний день установлено, что в основе профилактики диабетических осложнений лежит оптимальная сахароснижающая терапия с достижением целевых метаболических показателей с момента диагностики сахарного диабета 2 типа и на протяжении всей жизни. С большим сахароснижающим потенциалом и возможностью поддерживать контроль гликемии по мере прогрессирования заболевания ассоциируется терапия, одновременно воздействующая на различные нарушения.
В статье рассмотрены возможности метформина, препаратов сульфонилмочевины и их фиксированных комбинаций.
На сегодняшний день установлено, что в основе профилактики диабетических осложнений лежит оптимальная сахароснижающая терапия с достижением целевых метаболических показателей с момента диагностики сахарного диабета 2 типа и на протяжении всей жизни. С большим сахароснижающим потенциалом и возможностью поддерживать контроль гликемии по мере прогрессирования заболевания ассоциируется терапия, одновременно воздействующая на различные нарушения.
В статье рассмотрены возможности метформина, препаратов сульфонилмочевины и их фиксированных комбинаций.





Введение
В России, как и во многих странах мира, сахарный диабет (СД) 2 типа является социально значимой проблемой. Так, пациенты с СД 2 типа составляют от 85 до 90% лиц с диабетом. Прирост заболеваемости не только увеличивается из года в год, но и значительно опережает таковой других неинфекционных патологий [1, 2]. Кроме того, сахарный диабет ассоциируется с повышенным риском не только хронических осложнений, но и смерти. Установлено, что патология занимает четвертое место среди причин ранней смертности.
Согласно данным исследования NATION, общее число больных СД в России составляет 5,4%. У одной пятой населения выявлен предиабет. Доказано, что уже на этом этапе нарушения углеводного обмена отмечается высокий сердечно-сосудистый риск [3].
Согласно этиологической классификации СД, предложенной экспертами Всемирной организации здравоохранения в 1999 г., СД 2 типа может быть с преобладанием дефектов секреции инсулина и инсулинорезистентностью (ИР) или без нее, а также с преобладанием ИР и относительной инсулиновой недостаточностью. Считается, что дефекты секреции инсулина и развитие периферической ИР в значительной мере обусловлены нарушением генетического контроля.
Большое значение в развитии СД 2 типа отводится факторам риска, которые подразделяют на модифицируемые и немодифицируемые [4]. К ним относятся:
- возраст старше 45 лет;
- избыточная масса тела и ожирение (индекс массы тела ≥ 25 кг/м²);
- отягощенный семейный анамнез (родители или сибсы с СД 2 типа);
- низкая физическая активность;
- нарушение толерантности к глюкозе или гликемии натощак;
- гестационный СД или рождение крупного плода в анамнезе;
- артериальная гипертензия (≥ 140/90 мм рт. ст. или медикаментозная антигипертензивная терапия);
- холестерин липопротеинов высокой плотности ≤ 0,9 ммоль/л и/или уровень триглицеридов ≥ 2,82 ммоль/л;
- синдром поликистозных яичников;
- сердечно-сосудистые заболевания в анамнезе.
Среди ведущих факторов риска признаны избыточная масса тела и ожирение, особенно висцеральное [5, 6].
Нарушение углеводного обмена – частое явление при ожирении. Избыток жировой ткани ассоциируется с повышенной секрецией адипоцитокинов, влияющих на метаболические процессы. По мере прогрессирования ожирения не только увеличивается размер и количество адипоцитов, но и изменяется их функциональная активность. Как следствие, дисбаланс адипоцитокинов, регулирующих чувствительность рецепторов тканей к инсулину [6, 7]. Секреция адипоцитокинов, повышающих чувствительность тканей к инсулину (в частности, адипонектина), снижается, в то же время секреция адипоцитокинов, снижающих чувствительность тканей к инсулину (например, резистина, вистафина), повышается. Возрастание ИР происходит параллельно с увеличением жировой массы, особенно висцерального пула [8, 9].
Инсулинорезистентность представляет собой один из фундаментальных дефектов, приводящих к нарушению углеводного обмена [10, 11].
Диагностика нарушений углеводного обмена
К ранним нарушениям углеводного обмена относят нарушенную толерантность к глюкозе (НТГ) и нарушенную гликемию натощак (НГН). Для обозначения ранних нарушений углеводного обмена был введен термин «предиабет», чтобы подчеркнуть высокий риск развития СД 2 типа в будущем [12, 13].
При наличии факторов риска развития СД 2 типа показано определение уровня глюкозы плазмы натощак (ГПН), гликированного гемоглобина (HbA1c) или проведение перорального глюкозотолерантного теста (ПГТТ) (табл. 1) [4, 13].
Определение уровня HbA1c рекомендовано для диагностики как нарушений углеводного обмена, так и СД 2 типа (табл. 2) [13]. Он отражает среднее значение гликемии за два-три месяца.
Следует подчеркнуть, что HbA1c от 6,0 до 6,4% не является самостоятельным диагностическим критерием предиабета, таковой должен быть подтвержден наличием НГН и/или НТГ. Тем не менее данный диапазон значений позволяет стратифицировать пациентов в группу высокого риска развития СД 2 типа. Накапливается все больше доказательств высокой прогностической ценности HbA1c и в отношении сердечно-сосудистых исходов [13–15].
В метаанализе 16 исследований со средним периодом наблюдения 5,5 (2,8–12,0) года и количеством участников 44 203 человека долгосрочный риск развития СД 2 типа напрямую был связан с уровнем HbА1c [15]. Пятилетний риск развития СД 2 типа оказался максимальным (25–50%) при значениях HbА1c от 6,0 до 6,5%.
Ведение пациентов с предиабетом
Ведение пациентов с предиабетом предполагает присоединение фармакотерапии только после коррекции питания, физической активности и оценки достигнутого эффекта [16, 17].
Особый интерес в связи со сказанным могут представлять результаты исследования TULIP, проведенного N. Stefan и соавт. Работа должна была ответить на вопрос: существует ли фенотип группы риска, связанный с отсутствием реакции на немедикаментозное вмешательство? Среди исходных параметров (пол, индекс массы тела, окружность запястья, содержание жира в печени, чувствительность к инсулину, концентрация глюкозы в крови натощак и постпрандиальная гликемия) только нарушенная секреция инсулина и неалкогольная жировая болезнь печени (НАЖБП) (при наличии ИР) ассоциировались с низкой вероятностью восстановления нормального гомеостаза глюкозы [18]. Исследователи сделали вывод, что коррекция образа жизни может быть неэффективной у пациентов с предиабетом и НАЖБП.
В настоящее время наряду с немедикаментозными подходами собрана доказательная база в отношении фармакологического вмешательства, что нашло отражение в большинстве опубликованных клинических рекомендаций.
Лидирующую позицию занимает метформин. Он рекомендован лицам с предиабетом при неэффективности мероприятий по изменению образа жизни или высоком риске развития СД 2 типа [4, 12, 17]. Для профилактики развития СД 2 типа у лиц с предиабетом и дополнительными факторами риска доза препарата составляет 1000–1700 мг/сут после или во время приема пищи в два приема. На первой неделе стартовая доза метформина обычного высвобождения должна составлять 500–850 мг/сут во время ужина, со второй – увеличивается до 500–850 мг два раза в сутки (во время завтрака и ужина). При плохой переносимости метформина обычного высвобождения или низкой приверженности пациентов терапии по причине кратности приема целесообразно рекомендовать применение метформина пролонгированного действия в дозе 750 мг (по две таблетки во время ужина). На фоне такой терапии следует учитывать возможность развития дефицита витамина В12.
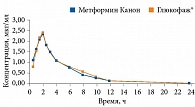
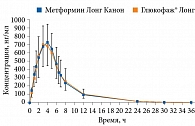
Препараты Метформин Канон, Метформин Лонг Канон (ЗАО «Канонфарма продакшн») имеют доказанную биоэквивалентность препаратам сравнения (Глюкофаж, Глюкофаж Лонг) (рис. 1 и 2). Они широко применяются в отечественной практике уже более восьми лет. Метформин Канон и Метформин Лонг Канон выпускаются в трех дозах для удобства титрации и подбора оптимальной терапевтической дозы. В июле 2020 г. препараты Метформин Канон и Метформин Лонг Канон прошли испытания, проведенные Росздравнадзором, на содержание предельно допустимых значений NMDA.
Индивидуальный подход к терапии сахарного диабета 2 типа
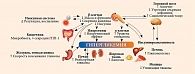
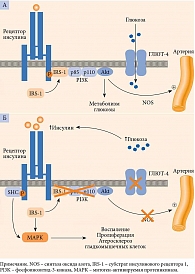
Как было отмечено ранее, в основе развития СД 2 типа лежат ИР и снижение секреции инсулина β-клетками. В дополнение к ключевым дефектам указываются нарушение функции α-клеток, дефицит продукции и/или резистентность к инкретинам, вырабатываемым в желудочно-кишечном тракте, ускоренный липолиз в жировой ткани, повышение реабсорбции глюкозы в почках и резистентность к инсулину клеток мозга, нарушение кишечной микробиоты, хроническое воспаление (рис. 3) [13, 18].
Сложный патогенетический механизм обусловливает необходимость одновременного воздействия на различные нарушения, что обеспечит хороший сахароснижающий эффект и его удержание по мере прогрессирования заболевания [8, 18].
В настоящее время в распоряжении клиницистов есть широкий спектр сахароснижающих препаратов с доказанной эффективностью и профилем безопасности. Так, неинсулиновые сахароснижающие средства представлены несколькими группами: бигуаниды (метформин), производные сульфонилмочевины (ПСМ), тиазолидиндионы (ТЗД), глиниды, агонисты рецепторов глюкагоноподобного пептида 1 (ГПП-1), ингибиторы дипептидилпептидазы 4 (ДПП-4), ингибиторы α-глюкозидазы.
Успехам в области диабетологии также способствует внедрение в клиническую практику современных алгоритмов ведения пациентов с СД 2 типа. В частности, в алгоритмах Российской ассоциации эндокринологов (РАЭ) 2019 г. подчеркнуто, что индивидуальный подход к каждому пациенту является приоритетным при выборе тактики лечения. Целевой уровень HbA1с определяется исходя из возраста пациента и его клинических характеристик (наличие атеросклеротических сердечно-сосудистых заболеваний и/или риска тяжелой гипогликемии) (табл. 3) [4].
Лечебная тактика стратифицируется в зависимости от того, насколько исходный уровень HbA1c превышает индивидуальный целевой.
При инициации лечения может быть избрана монотерапия, если значение HbA1c находится в целевом диапазоне или превышает целевой уровень менее чем на 1,0%. Комбинированная терапия рекомендуется, если значение HbA1c превышает целевое на 1,0–2,5%. При исходном уровне HbA1c выше целевого более чем на 2,5% необходимо начинать инсулинотерапию (или комбинацию инсулина с пероральными сахароснижающими препаратами). При этом в дальнейшем возможна отмена инсулина [4]. Важно также учитывать, что в определенных клинических ситуациях (наличие атеросклеротических сердечно-сосудистых заболеваний и факторов их риска, хронической сердечной недостаточности, хронической болезни почек (ХБП), ожирения, риска гипогликемий) определенные классы сахароснижающих препаратов имеют доказанные преимущества.
Эксперты Американской диабетической ассоциации (American Diabetes Association – ADA) (2020 г.) также указывают на необходимость пациент-ориентированного подхода при выборе фармакотерапии. Они подчеркивают важность учета сопутствующих сердечно-сосудистых заболеваний, риска гипогликемии и побочных эффектов на фоне лечения, его влияния на массу тела, стоимости, а также предпочтений пациента [13].
Благодаря значимым преимуществам на старте терапии приоритетным препаратом остается метформин (в отсутствие противопоказаний для приема) (табл. 4).
Метформин назначается при впервые выявленном СД 2 типа как в виде монотерапии, так и в составе рациональных комбинаций.
На фоне терапии метформином уровень HbA1c снижается на 1,0–2,0%. Вариабельность определяется исходными значениями HbA1c [18].
Воздействуя на ИР, метформин улучшает чувствительность тканей к инсулину. Инсулинорезистентность наряду с артериальной гипертензией, дислипидемией, нарушениями гемостаза является значимым фактором ускоренного атерогенеза (рис. 4), риска острых макрососудистых осложнений и высокой летальности от ишемической болезни сердца [6, 7, 19].
Фармакологические эффекты метформина обусловлены несколькими механизмами, не связанными со стимуляцией секреции инсулина β-клетками. Преобладающим является подавление гепатической продукции глюкозы, в большей степени за счет подавления глюконеогенеза [18, 20]. В основе действия метформина – уменьшение экспрессии гена, индуцирующего образование глюкозы из неуглеводных соединений за счет фосфорилирования циклического аденозинмонофосфата (cyclic Adenosine MonoPhosphate – cAMP) – коактиватора транскрипционного фактора CREB-протеина (cAMP Response Element-Binding Protein), за счет торможения поступления субстратов глюконеогенеза в гепатоциты и ингибирования ключевых ферментов глюконеогенеза (пируваткарбоксилазы, фруктозо-1,6-бифосфатазы и глюкозо-6-фосфатазы) [21].
На молекулярном уровне метформин ингибирует комплекс I дыхательной цепи митохондрий гепатоцитов, что приводит к активации аденозинмонофосфат-протеинкиназы [22], восстановлению энергетического гомеостаза путем подавления экспрессии ферментов глюконеогенеза в печени, увеличения поглощения глюкозы в скелетных мышцах и повышения чувствительности к инсулину (посредством воздействия на метаболизм жиров) [20, 21]. Кроме того, активация аденозинмонофосфат-протеинкиназы в печени сопровождается снижением синтеза триглицеридов из жирных кислот и подавлением митохондриального β-окисления, снижением экспрессии фактора некроза опухоли α и транскрипционных факторов, ответственных за синтез холестерина из ацетил-коэнзима А. Как следствие, уменьшение эффектов липотоксичности на всех уровнях, включая печень, жировую и мышечную ткань и островки Лангерганса.
Под влиянием метформина в инсулинозависимых тканях происходит стимуляция экспрессии и активности транспортеров, увеличивается транспортная емкость мембранных переносчиков глюкозы, их количество и транслокация из внутриклеточного пула на клеточную мембрану, активирование пострецепторных механизмов действия инсулина (в частности, тирозинкиназы и фосфотирозин-фосфатазы). Возрастает утилизация глюкозы скелетными мышцами и жировой тканью, что приводит к повышению чувствительности тканей к инсулину на 18–50% [20, 21].
Еще одной мишенью метформина является желудочно-кишечный тракт. Препарат замедляет скорость всасывания, повышает скорость метаболизма глюкозы, что способствует нормализации постпрандиальной гликемии [20, 22]. Метформин влияет на гомеостаз глюкозы посредством повышения концентрации ГПП-1 (см. рис. 4), что, по-видимому, обусловлено активацией Wnt-сигнальных путей в L-клетках желудочно-кишечного тракта, стимуляцией экспрессии генов, кодирующих рецепторы ГПП-1, глюкозозависимого инсулинотропного пептида в β-клетках и увеличением экспрессии генов белков-предшественников – преглюкагона, проглюкагона [20, 22, 23]. Посредством изменения метаболизма желчных кислот метформин также может стимулировать секрецию ГПП-1, выступая в качестве активатора аденозинмонофосфат-протеинкиназы, потенциально оказывать воздействие на пул желчных кислот через фарнезоидный рецептор – ключевой регулятор метаболизма глюкозы и липидов [24].
Применение метформина противодействует развитию резистентности к инсулину и, следовательно, уменьшает выраженность ее атерогенных эффектов [25].
Сбор данных о других протективных механизмах метформина в отношении сердечно-сосудистой системы продолжается. Речь, в частности, идет о его влиянии на метаболизм липидов, систему гемостаза, реологию крови, на функцию эндотелия, кардиомиоцитов и гладкомышечных клеток сосудов (табл. 5) [20, 26, 27].
Впервые благоприятное воздействие метформина на сердечно-сосудистую систему у больных СД 2 типа и ожирением было установлено в знаменитом исследовании UKPDS: снижение риска сосудистых осложнений на 32%, инфаркта миокарда на 39%, смертности от СД и общей смертности на 42 и 36% соответственно по сравнению с традиционными методами лечения в течение десятилетнего периода. Дальнейшие исследования в этой области подтвердили положительное влияние на прогноз у пациентов с СД 2 типа, получавших метформин (в монотерапии или комбинации с другими сахароснижающими препаратами) [26–28].
Метформин полностью удовлетворяет требованиям Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США к сердечно-сосудистой безопасности сахароснижающих препаратов. Однако следует учитывать, что метформин противопоказан больным с хронической сердечной недостаточностью III и IV функциональных классов или требующей госпитализации.
В силу прогрессирующего течения СД 2 типа монотерапия метформином рано или поздно становится неэффективной и перед клиницистами встает вопрос выбора оптимальной схемы лечения для каждого конкретного пациента [29]. При необходимости интенсификации лечения очередность назначения препаратов определяется с учетом рациональности комбинации и рекомендаций по персонализации. В свете последних изменений в алгоритмах лечения основной акцент делается на назначение сахароснижающих препаратов с доказанными кардио- и ренопротективными эффектами и с меньшим риском гипогликемии. При наличии у пациентов с СД 2 типа сердечно-сосудистых факторов риска (ожирения, дислипидемии, артериальной гипертензии и др.) в качестве первичной профилактики предпочтение отдается ингибиторам натрий-глюкозного котранспортера 2 (НГЛТ-2), агонистам рецепторов ГПП-1, как и в случае подтвержденных атеросклеротических сердечно-сосудистых заболеваний и ХБП 1–3а стадий. При постановке диагноза «сердечная недостаточность» приоритет отдается ингибиторам НГЛТ-2 [4, 13]. В случае противопоказаний для их назначения или плохой переносимости в качестве альтернативы применяют другие группы препаратов.
Патогенетически оправданным может быть назначение ПСМ – препаратов, стимулирующих секрецию инсулина.
Данные препараты применяются в клинической практике с середины прошлого столетия, их эффективность и безопасность также хорошо изучены [30–32].
Производные сульфонилмочевины можно комбинировать со всеми сахароснижающими препаратами, кроме инсулина короткого действия.
Высокоселективные ПСМ (глимепирид, гликлазид) сохранили свои позиции в международных алгоритмах лечения благодаря высокой эффективности (на фоне монотерапии НbА1с снижался на 1–2%), быстрому достижению сахароснижающего эффекта, невысокой цене, определяющей доступность лечения.
Несмотря на единый механизм действия, ПСМ различаются по сахароснижающей активности, рецепторной селективности, длительности действия и путям элиминации. К основным недостаткам ПСМ относят риск развития гипогликемических состояний и прибавки массы тела [4, 30]. В связи с этим вопросы безопасности такой терапии остаются актуальными.
Гипогликемия на фоне применения ПСМ является результатом стимулирования секреции инсулина, даже если концентрация глюкозы в крови низкая.
Меньший или больший риск развития гипогликемий связан с нарушением режима питания, нефизиологическими ограничениями в питании, чрезмерной физической нагрузкой, а также с фармакокинетическими и фармакодинамическими свойствами ПСМ. Высокоселективные ПСМ (глимепирид, гликлазид) предпочтительнее других ПСМ у пациентов с СД 2 типа из-за низкого риска гипогликемий и нейтральности в отношении развития сердечно-сосудистых заболеваний [31].
Комбинирование метформина и ПСМ обосновано с точки зрения воздействия на фундаментальные механизмы развития СД 2 типа. С учетом персонифицированного подхода к лечению ПСМ безопасны (нейтральны) у пациента с СД 2 типа и сердечно-сосудистыми факторами риска, атеросклеротическими сердечно-сосудистыми заболеваниями (не рекомендован глибенкламид), хронической болезнью почек (до 4-й стадии, глибенкламид не рекомендован при скорости клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м²). В случае выраженной декомпенсации сердечной недостаточности ПСМ назначают с осторожностью [4, 13].
Механизм действия этой группы препаратов основан на взаимодействии с мембранными рецепторами сульфонилмочевины 1 (Sulfonylurea Receptor 1 – SUR-1) β-клеток, связанными с аденозинтрифосфат (АТФ)-зависимыми K-каналами. ПСМ приводят к закрытию АТФ-зависимых K-каналов, деполяризации клеточной мембраны, йоны Са++ активно поступают в цитоплазму β-клеток, клетка сокращается, инсулин высвобождается в кровоток. Нарушение функции β-клеток, как известно, является важным патогенетическим звеном СД 2 типа [33].
Нарушение функции β-клеток характеризуется [34]:
- снижением или потерей первой фазы секреции инсулина;
- нарушением секреции инсулина в ответ на другие (негликемические) стимулы (аминокислоты);
- повышением уровня проинсулина;
- снижением секреции инсулина суммарно, суточно и др.
Без сомнения, нарушение функции β-клеток является генетической проблемой. Однако четких маркеров пока не установлено. Нельзя исключать влияние факторов внешней среды, ожирения, инсулинорезистентности и гиперлипидемии.
Назначение ПСМ позволяет синхронизировать работу β-клеток, предотвратить постпрандиальную гипергликемию и тем самым развитие сердечно-сосудистых осложнений.
Периферическое (экстрапанкреатическое) действие ПСМ, вероятно, обусловлено повышением инсулинемии, снижением глюкозотоксичности.
Постпрандиальная инсулинемия ассоциируется со снижением продукции глюкозы печенью и улучшением утилизации глюкозы периферическими тканями [35].
Как было отмечено ранее, ПСМ различаются селективностью связывания с SUR-1 на мембранах β-клеток и способностью диссоциировать с данным рецептором [36]. Чем выше степень сродства с SUR, тем больше препарат стимулирует АТФ-зависимые К+-каналы, тем выше эндогенная секреция инсулина β-клетками. Приоритет в выборе имеют препараты с высокой биодоступностью, со способностью быстрого взаимодействия с рецептором на β-клетке, а также с быстрой диссоциацией с рецептором. Такими свойствами обладает глимепирид, который характеризуется 100%-ной биодоступностью, практически не зависящей от приема пищи.
Уникальность глимепирида обусловлена способностью связываться с субъединицей SUR-X на мембранах β-клеток (молекулярная масса – 65 кДа), тогда как другие ПСМ связываются с субъединицей SUR-1 с молекулярной массой 140 кДа [37]. Это обеспечивает более ранний эффект глимепирида на секрецию инсулина β-клетками по сравнению с другими ПСМ. Как следствие, влияние именно на прандиальную инсулинемию и обеспечение функционирования β-клеток, приближенного к физиологическому. Высокая способность (в десять раз больше, чем у глибенкламида) к диссоциации с рецептором обеспечивает длительную сохранность функционирования β-клеток и снижение риска гипогликемий [38].
В ряде экспериментальных исследований in vivo и in vitro установлено, что соотношение «уровень инсулина/уровень гликемии» было самым низким у глимепирида. Так, общий прирост инсулина в плазме к общему снижению глюкозы в крови для глимепирида составил 0,03, для гликлазида – 0,11, глибенкламида – 0,16. Минимальная секреция инсулина, стимулированная глимепиридом, обеспечивает максимальное снижение уровня гликемии [38].
Препарат полностью метаболизируется в печени и имеет двойной путь выведения: 60% с мочой и 40% с калом, что позволяет использовать его у пациентов с умеренной почечной недостаточностью.
Действие глимепирида было изучено у пациентов с нарушением функции почек. У большинства больных со сниженной СКФ глимепирида в дозе 1–4 мг было достаточно, чтобы достичь целевых значений гликемии. Всего 1 мг/сут требовалось больным с выраженными поражениями почек (СКФ < 22 мл/мин/1,73м2). Полагают, что повышение относительного клиренса препарата при хронической болезни почек может быть связано с нарушением связывания его с белками. Установлено, что при поражении почек часть глимепирида находится в несвязанном состоянии [39]. При повторных приемах препарат не кумулируется.
В последнее время показания для применения глимепирида у больных СД 2 типа и хронической болезнью почек расширились. Несмотря на ограниченное назначение ПСМ у пациентов с ХБП, глимепирид разрешен при 4-й стадии заболевания, по некоторым данным, даже при 5-й (додиализной).
Лечение следует начинать с минимальной дозы 1 мг, при необходимости постепенно изменяя ее под контролем гликемии [40].
Важным моментом также является отсутствие различий фармакокинетики глимепирида у лиц пожилого и молодого возраста. В рекомендациях экспертов Международной федерации диабета (International Diabetes Federation – IDF) 2013 г., ADA 2014 г., Канадской диабетической ассоциации 2013 г. особое внимание уделено сахароснижающей терапии у пациентов пожилого возраста. На основании оценки безопасности четырех препаратов – глибенкламида, гликлазида, глимепирида, глипизида, используемых в лечении СД 2 типа у пожилых, приведенной экспертами IDF, глибенкламид (Глибурид) не рекомендован пациентам старше 60 лет. С учетом низкого риска гипогликемий, а также удобства применения глимепирид, наравне с гликлазидом, имеет преимущества перед другими ПСМ.
В рекомендациях IDF 2013 г., ADA 2014 г., РАЭ 2011 г., базирующихся на результатах крупномасштабных международных клинических исследований ADVANCE, ACCORD, VADT, в которых оценивалась роль сахароснижающей терапии в развитии и прогрессировании сердечно-сосудистых заболеваний, отмечено, что сердечно-сосудистые осложнения и летальный исход чаще наблюдались при интенсифицированном снижении гликемии, наличии гипогликемических эпизодов, особенно тяжелых. Глимепирид отвечает всем требованиям сердечно-сосудистой безопасности и способствует профилактике сердечно-сосудистых заболеваний [41].
Глимепирид обладает слабым сродством с АТФ-чувствительными K-каналами кардиомиоцитов и гладкомышечных клеток сосудов. С угнетением этих каналов связаны такие побочные эффекты ПСМ, как снижение коронарного кровотока и удлинение времени миокардиальной реполяризации. Благодаря этому не нарушается адаптация миокарда к условиям ишемии. Препарат также угнетает повышенную агрегацию тромбоцитов, снижая риск развития и прогрессирования сосудистых осложнений СД 2 типа [42, 43].
Глимепирид Канон (ЗАО «Канонфарма продакшн») биоэквивалентен препарату Амарил (рис. 5), обладает высокой сахароснижающей активностью и низким риском развития гипогликемических состояний.
Глимепирид Канон выпускается в дозах 1, 2, 3 и 4 мг. Это облегчает подбор индивидуальной эффективной и максимально безопасной (гипогликемия, повышение массы тела) дозы.
Гликлазид – еще один представитель ПСМ, второй генерации, обладающий большей безопасностью и терапевтической эффективностью при меньшем риске гипогликемических состояний. Гликлазид остается приоритетным ПСМ и в настоящее время. К его особенностям следует отнести высокое сродство с SUR-1 и очень низкое сродство с SUR-2. Известно, что SUR-2 имеют внепанкреатическую локализацию. Они экспрессируются на клеточных мембранах других тканей и, что очень важно, на мембранах кардиомиоцитов.
Селективность гликлазида к SUR-1 и SUR-2 различается примерно в 16 000 раз. Данное свойство гликлазида исключает его токсическое влияние на сердечно-сосудистую систему [44].
Гликлазид улучшает периферическую утилизацию глюкозы, в частности миоцитами. Это действие согласуется с посттранскрипционным воздействием гликлазида на транспортеры глюкозы, в частности глюкозный транспортер 4 (ГЛЮТ-4). Гликлазид, снижая продукцию глюкозы в печени, улучшает гликемию натощак. Длительное использование гликлазида МВ способствует сохранению массы функционирующих β-клеток [45].
Гликлазид метаболизируется в печени. Его основной метаболит не влияет на гликемию, но обладает антиоксидантным и антикоагулянтным действием, что улучшает микроциркуляцию у больных сахарным диабетом и обеспечивает дополнительные преимущества у пациентов с сердечно-сосудистыми заболеваниями. В крупномасштабном исследовании ADVANCE с участием 11 140 пациентов с СД 2 типа, имевших не менее одного дополнительного фактора риска развития сердечно-сосудистой патологии, проводилась оценка влияния интенсивного контроля гликемии на частоту микрососудистых осложнений. Более агрессивная стратегия с применением гликлазида МВ (более 70% пациентов получали препарат в максимальной дозе 120 мг/сут) способствовала тому, что средний уровень HbA1c в данной группе в конце исследования оказался на 0,67% меньше, чем в группе стандартного лечения. Гликемия натощак в среднем снизилась на 1,22 ммоль/л. Последующий анализ результатов исследования ADVANCE показал, что из 11 140 пациентов 69,7% достигли целевого гликемического контроля (HbA1c ≤ 7,0%) или снижения гликемии более чем на 10%. Лучший гликемический контроль был получен у пациентов с меньшей длительностью заболевания и с более мягким течением СД. Исследование продемонстрировало необходимость более раннего начала терапии гликлазидом для лучшего контроля диабета [46].
Дополнительный анализ данных этого исследования, представленный на конгрессе Европейской ассоциации по изучению диабета в 2010 г., продемонстрировал, что интенсивный контроль гликемии позволил не только достоверно снизить риск развития протеинурии у пациентов с клиническими проявлениями диабетической нефропатии, но и обеспечить ее регресс у 57% больных. В некоторых случаях наблюдалась ремиссия до нормоальбуминурии. Доза гликлазида у пациентов с диабетической нефропатией также доходила до 120 мг/сут.
На основании полученных данных для гликлазида было зарегистрировано новое показание для применения – профилактика сосудистых осложнений СД путем интенсивного контроля гликемии.
Необходимо также отметить, что указанное исследование послужило поводом для выпуска на фармацевтический рынок гликлазида в дозе 60 мг для более простого режима титрования и достижения максимально эффективной дозы, равной 120 мг/сут. Гликлазид Канон (ЗАО «Канонфарма продакшн») представляет собой гликлазид пролонгированного высвобождения. Препарат выпускается в дозах 30 и 60 мг. Гликлазид Канон полностью биоэквивалентен Диабетону МВ (рис. 6).
Как было сказано ранее, монотерапия при СД 2 типа редко дает ожидаемый результат. Практически две трети пациентов не достигают целевого уровня HbA1c на фоне применения одного препарата. Так, согласно результатам исследования UKPDS, через два-три года от начала терапии диетой и одним сахароснижающим препаратом только 30% больных достигали уровня HbA1c менее 7%, а спустя девять лет – только 25% [47]. В связи с этим возникает необходимость интенсифицирования сахароснижающей терапии, назначения двух и более препаратов с разными механизмами действия.
В этой связи важнейшим этапом на пути интенсификации фармакотерапии СД 2 типа стало создание фиксированных комбинаций сахароснижающих препаратов, значительно улучшающих приверженность пациентов терапии.
В целом комбинированная сахароснижающая терапия имеет ряд неоспоримых преимуществ. Во-первых, спектр действия комбинированных препаратов охватывает различные патофизиологические механизмы СД 2 типа, при этом происходит потенцирование их эффектов. Во-вторых, использование каждого компонента препарата в более низких суточных дозах по сравнению с монотерапией приводит к уменьшению частоты нежелательных явлений и улучшению переносимости лечения. Еще одним достоинством комбинированной терапии является простота титрации дозы для пациента и врача, что также повышает приверженность терапии [48].
Заключение
ЗАО «Канонфарма продакшн» более 20 лет работает на российском рынке и производит препараты для больных сахарным диабетом: Гликлазид Канон в дозах 30 и 60 мг с пролонгированным высвобождением действующего вещества, Глимепирид Канон в дозах 1, 2, 3 и 4 мг, Глидика® М (комбинация 2 мг глимепирида и 500 мг метформина), Метформин Канон в дозах 500, 850 и 1000 мг и Метформин Лонг Канон в дозах 500, 750 и 1000 мг, Метглиб® и Метглиб® Форс (комбинация метформина и глибенкламида). В состав Метглиб® входит 400 мг метформина и 2,5 мг глибенкламида, Метглиб® Форс – 500 мг метформина и 2,5/5,0 мг глибенкламида. Препарат биоэквивалентен референтному препарату Глюкованс и имеет фармакоэкономические преимущества в связи с необходимостью проведения длительного курсового лечения (рис. 7).
Препараты ЗАО «Канонфарма продакшн» по эффективности не уступают оригинальным препаратам. Кроме того, они более доступны по цене.
E.V. Biryukova, MD, PhD, Prof., S.V. Podachina, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Scientific and Practical Center
Contact person: Elena V. Biryukova, lena@obsudim.ru
Type 2 diabetes mellitus is a serious medical and social problem, caused by the epidemic growth rate of morbidity and chronic complications development leading to early disability, the decrease in the quality of life and early death of patients.
To date, it has been established that the prevention of diabetic complications is based on optimal hypoglycemic therapy with the achievement of target metabolic parameters from the moment of diagnosis of type 2 diabetes until the end of life.
With a large hypoglycemic potential and the ability to maintain glycemic control as the disease progresses, it is associated the therapy that simultaneously affects various disorders.
The article discusses the possibilities of metformin, sulfonylureas, and fixed combinations.

