Свобода от инъекций: возможности препарата упадацитиниб при ревматоидном артрите. V Евразийский конгресс ревматологов с международным участием. Сателлитный симпозиум компании «ЭббВи»
- Аннотация
- Статья
- Ссылки

Главные вызовы в терапии ревматоидного артрита cегодня
Как отметил в начале своего выступления профессор ревматологии медицинского факультета Университета Саутгемптона (Великобритания), исполнительный директор Центра клинических исследований Кристофер ЭДВАРДС, за последние тридцать лет подходы к ведению пациентов с ревматоидным артритом значительно изменились. Появились методы ранней диагностики ревматоидного артрита, разработаны надежные инструменты для оценки его активности, внедрена стратегия лечения до достижения цели (treat-to-target).
На сегодняшний день установлено, что основная роль в патогенезе ревматоидного артрита отводится активации Т- и В-лимфоцитов, обеспечивающих гуморальный иммунный ответ. Провоспалительные цитокины участвуют в персистенции воспалительного процесса в синовиальной оболочке, деструкции хряща и костной ткани. Аутоиммунное воспаление также приводит к развитию широкого спектра внесуставных органных нарушений. Речь, в частности, идет о поражении сосудов, глаз, нервной системы.
Современные препараты способны эффективно контролировать воспаление, предотвращать развитие осложнений и обеспечивать ремиссию заболевания. Основополагающими в лечении и улучшении прогноза ревматоидного артрита являются раннее назначение терапии, оптимальный выбор препаратов и строгий контроль над заболеванием. Так, в исследовании о связи между задержкой оценки состояния пациентов на раннем этапе, частотой деструкции суставов и вероятностью достижения ремиссии без назначения базисных противовоспалительных препаратов (БПВП) было показано, что отсрочка с оценкой состояния более чем на 12 недель и назначением терапии ассоциировалась с высокой частотой разрушения суставов и более длительным достижением ремиссии1. У пациентов с ревматоидным артритом применение ингибитора фактора некроза опухоли α (ФНО-α) было связано со снижением риска сердечно-сосудистых осложнений, тогда как прием преднизолона – с повышением, при этом таковое напрямую зависело от дозы2.
Доказано, что ранний тщательный контроль ревматоидного артрита (стратегия treat-to-target) обусловливает значительно более низкую активность заболевания по сравнению с рутинным наблюдением3.
Согласно современным рекомендациям экспертов Американской коллегии ревматологов (American College of Rheumatology – ACR), Европейской антиревматической лиги (Еuropean League Against Rheumatism – EULAR) и Азиатско-Тихоокеанской лиги ассоциаций ревматологов (Asia Pacific League of Associations for Rheumatology – APLAR), целью терапии ревматоидного артрита является достижение стойкой ремиссии4, 5.
Критерии для оценки достижения ремиссии ревматоидного артрита разрабатываются с 1980-х гг. Сначала применяли критерии АRА (American Rheumatologic Association), позже были разработаны критерии DAS (Disease Activity Index – индекс активности заболевания) и DAS 28, затем SDAI (Simplified Disease Activity Index – упрощенный индекс оценки активности) и CDAI (Clinical Disease Activity Index – клинический индекс оценки активности). В последние годы эксперты ACR и EULAR для оценки ремиссии рекомендуют использовать критерии Boolean. Boolean-ремиссия считается самым строгим вариантом ремиссии. Определяют число болезненных суставов ≤ 1, припухших суставов ≤ 1, общую оценку заболевания пациентом, уровень С-реактивного белка (CRP)6.
Необходимо отметить, что, согласно данным шведского регистра, более половины пациентов не достигают стойкой ремиссии к шестому месяцу терапии7. В ряде случаев находящиеся в состоянии ремиссии по критериям DAS 28, SDAI, СDAI продолжают жаловаться на такие симптомы, как боль, усталость, утренняя скованность8.
Актуальность проблемы обусловливает поиск новых эффективных терапевтических опций.
В настоящее время для лечения ревматоидного артрита используют препараты с разными механизмами действия – это БПВП (метотрексат, лефлуномид, сульфасалазин), генно-инженерные биологические препараты (ГИБП) (ингибиторы интерлейкина (ИЛ) 6, ингибиторы ФНО-α, анти-CD20 моноклональные антитела, ингибиторы ко-стимуляции Т-лимфоцитов) и таргетные синтетические противовоспалительные препараты (тсБПВП). К последним, в частности, следует отнести ингибиторы янус-киназ (JAK) (тофацитиниб, барицитиниб и упадацитиниб)9.
Ингибиторы JAK занимают особое место среди специфических препаратов, нацеленных на патогенетические звенья ревматоидного артрита. Семейство JAK включает JAK-1, JAK-2, JAK-3 и тирозинкиназу 2 (Tyrosine Kinase 2 – TYK-2). Как известно, JAK-1, JAK-2, JAK-3 и TYK-2 участвуют в передаче сигналов от цитокинов и факторов роста, в том числе задействованных в патогенезе ревматоидного артрита (ИЛ-6, ИЛ-12, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), интерферон γ и др.).
Назначение ингибиторов JAK рекомендовано пациентам с ревматоидным артритом в отсутствие эффекта от предыдущей терапии, при неадекватном ответе на метотрексат или плохих прогностических факторах, например вовлеченности многих суставов, высокой или умеренной активности заболевания5.
Согласно результатам исследования SELECT-COMPARE, ингибитор JAK упадацитиниб в сочетании с метотрексатом превосходил по эффективности терапию адалимумабом и метотрексатом у больных ревматоидным артритом умеренной и высокой активности в отношении достижения ответа по ACR 50, снижения боли и улучшения физического функционирования на 12-й неделе лечения. Через 72 недели у находившихся на комбинированной терапии упадацитинибом и метотрексатом в отличие от получавших адалимумаб и метотрексат сохранялась положительная динамика симптомов по ACR 20/50/70, достоверное достижение ремиссии по критериям DAS 28, SDAI, CDAI и Boolean10.
Подводя итог, профессор К. Эдвардс подчеркнул, что введение в схему терапии эффективных препаратов из класса ингибиторов JAK позволяет значительно расширить возможности лечения ревматоидного артрита и достигать основной цели терапии – стойкой ремиссии заболевания.
Подводя итоги конгресса EULAR – 2020
Продолжил симпозиум президент Евразийской лиги ревматологов, президент общероссийской общественной организации «Ассоциация ревматологов России», научный руководитель Научно-исследовательского института ревматологии им. В.А. Насоновой, главный внештатный специалист-ревматолог Минздрава России, академик Российской академии наук, д.м.н., профессор Евгений Львович НАСОНОВ.
Профессор Е.Л. Насонов прокомментировал итоги конгресса EULAR, состоявшегося в онлайн-формате в июне 2020 г. во Франкфурте.
Одной из актуальных тем конгресса было лечение лиц с ревматическими заболеваниями в период пандемии COVID-19. Согласно представленным данным, использование метотрексата и ГИБП, ингибиторов JAK у пациентов с воспалительными заболеваниями не увеличивало риск тяжелого течения COVID-19. Поэтому в период пандемии коронавирусной инфекции пациенты ревматологического профиля должны продолжать такое лечение11.
Кроме того, на конгрессе EULAR были представлены обобщенные данные о диагностике и лечении ревматических заболеваний на современном этапе.
Так, в исследовании TICOSPA оценивали потенциальное преимущество стратегии treat-to-target перед обычным лечением при аксиальном спондилоартрите. Доказано, что строгий контроль фармакотерапии и таргетная терапия позволили снизить активность заболевания12.
В крупном наблюдательном исследовании было установлено, что частота реактивации Herpes Zoster у пациентов с ревматоидным артритом в два раза выше, чем в популяции. Реактивация Herpes Zoster отражает дефекты клеточного иммунитета, которые могут быть связаны с возрастом и иммуносупрессией13.
Предшествующие операции на суставах, применение глюкокортикостероидов (ГКС) достоверно связаны с реактивацией вируса герпеса при ревматоидном артрите14.
Анализ данных регистра RABBIT позволил определить факторы риска развития Herpes Zoster на фоне лечения ревматических заболеваний. Среди них значимыми признаны терапия ГКС и пожилой возраст. Увеличение риска развития герпесвирусной инфекции ассоциировалось также с лечением ингибиторами JAK, ингибиторами ФНО-α, анти-В-клеточной терапией, модуляторами клеточной ко-стимуляции и ингибиторами ИЛ-6. Эти данные свидетельствуют о необходимости введения в календарь вакцинации пациентов с ревматоидным артритом прививки против Herpes Zoster15.
Результаты пяти рандомизированных клинических исследований фазы III SELECT (EARLY, NEXT, MONOTHERAPY, COMPARE, BEYOND) по оценке риска развития тяжелых инфекций у больных ревматоидным артритом на фоне разных видов терапии16, в частности у получавших упадацитиниб в дозах 15 и 30 мг, у пациентов, не получавших метотрексат, которым впервые была назначена монотерапия метотрексатом (EARLY), у резистентных к метотрексату, получавших метотрексат в комбинации с адалимумабом (COMPARE), позволили сделать следующие выводы. Частота инфекционных осложнений повышалась на фоне лечения упадацитинибом в дозе 30 мг по сравнению с дозой 15 мг. Частота развития инфекций на фоне применения упадацитиниба в дозе 15 мг оказалась аналогичной таковой при лечении адалимумабом и метотрексатом. Кроме того, при использовании упадацитиниба в любой дозе по сравнению с применением адалимумаба и метотрексата наблюдалось увеличение частоты развития инфекции, вызванной Herpes Zoster, хотя при дозе упадацитиниба 15 мг таковая была ниже. Факторами риска развития тяжелых инфекций на фоне лечения упадацитинибом признаны возраст старше 75 лет и курение.
Интерес также представляет анализ данных шведского регистра в отношении факторов риска развития тромбозов и тромбоэмболий при ревматоидном артрите, связи между развитием данных явлений и активностью заболевания. Эта проблема особенно актуальна в период пандемии COVID-19, поскольку у таких пациентов отмечается высокая частота венозных тромбозов и легочных тромбоэмболий. Выявлено, что у больных ревматоидным артритом часто наблюдались факторы риска развития тромбоза глубоких вен и легочной эмболии17.
Дополнительным фактором риска может быть неконтролируемое воспаление18.
По некоторым данным, прием ингибиторов JAK также может способствовать увеличению риска венозных тромбозов19.
Вероятность развития венозных тромбозов коррелирует с активностью ревматоидного артрита20.
Согласно данным другого регистра, ингибиторы ФНО-α снижают риск развития тромбоза у больных ревматоидным артритом.
«Эти данные носят предварительный характер и нуждаются в подтверждении в других исследованиях», – подчеркнул профессор Е.Л. Насонов.
Активность ревматоидного артрита как мощного фактора риска развития венозных тромбозов доказана и российскими учеными21.
Далее профессор Е.Л. Насонов отметил, что в настоящее время большой интерес ревматологов вызывают вопросы развития интерстициального заболевания легких при ревматоидном артрите. Считается, что у данных больных это вторая по значимости коморбидность после сердечно-сосудистой. Появление антифиброзных препаратов для лечения интерстициального заболевания легких в общей популяции может быть значимым и для пациентов с ревматоидным артритом.
По данным, обобщенным и представленным на конгрессе EULAR, корреляция между применением метотрексата и развитием интерстициального заболевания легких отсутствует22. Более того, выдвинуто мнение, что метотрексат может обладать антифибротической активностью.
Конечно, в этом контексте было бы крайне важно узнать, влияет ли лечение ингибиторами JAK на развитие и прогрессирование интерстициального заболевания легких, тем более что есть предварительные данные об их антифибротическом эффекте.
На конгрессе EULAR и ACR были представлены данные о протеомике ингибиторов JAK, в частности упадацитиниба. В рамках исследований SELECT-NEXT и SELECT-BEYOND просмотрено большое количество транскриптов РНК различных провоспалительных медиаторов. Получены данные о базовых корреляциях между хемокинами и ИЛ-6 и активностью ревматоидного артрита23.
Результаты исследований продемонстрировали, что упадацитиниб подавляет экспрессию целого ряда патогенетически значимых провоспалительных цитокинов, таких как ИЛ-6, ИЛ-15, интерфероны, ГМ-КСФ. Анализ дифференцированной экспрессии 37 белков свидетельствует о том, что лечение пациентов с ревматоидным артритом с использованием упадацитиниба приводит к нормализации доминантных сигнальных путей, зависимых и независимых от сигнализации JAK. Отмечена нормализация последующих сигнальных путей, участвующих в патогенезе ревматоидного артрита, таких как поведение лейкоцитов, Т-клеточный и воспалительный ответ. Снижение активности ряда провоспалительных цитокинов на фоне приема упадацитиниба коррелирует с положительной динамикой показателей DAS 28 и скорости оседания эритроцитов, что свидетельствует о связи между механизмом действия упадацитиниба и снижением активации макрофагов.
Таким образом, благодаря таргетному воздействию ингибиторы JAK, в частности упадацитиниб, являются перспективным классом препаратов для лечения ревматоидного артрита. Не следует забывать о необходимости персонифицированного подхода к ведению пациентов, выборе препаратов, наиболее эффективных и безопасных для конкретного пациента, констатировал докладчик.
Резистентность к терапии при ревматоидном артрите: анализ причин и путей преодоления
Заведующий кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда Северо-Западного государственного медицинского университета им. И.И. Мечникова (СЗГМУ им. И.И. Мечникова), главный научный консультант СЗГМУ им. И.И. Мечникова, первый вице-президент общероссийской общественной организации «Ассоциация ревматологов России», главный ревматолог Северо-Западного федерального округа и Ленинградской области, академик Российской академии наук, д.м.н., профессор Вадим Иванович МАЗУРОВ отметил, что в последние годы распространенность ревматических заболеваний в Российской Федерации увеличилась24.
Высокая заболеваемость ревматоидным артритом, сложность патогенетических механизмов и тяжесть течения делают его терапию серьезной задачей не только для ревматологов, но и для специалистов смежных областей.
Несмотря на успехи современной фармакологии, многие пациенты не отвечают на лечение. Известно, что неэффективность терапии может быть как первичной, так и вторичной. Показателями первичной неэффективности являются отсутствует ответа через три месяца, а также недостижение целевых значений через шесть месяцев. Вторичная неэффективность характеризуется наличием рецидивов в период поддерживающей терапии. В связи с этим интересным представляется опрос ревматологов из 33 стран, в том числе из России, подготовленный по инициативе EULAR, в отношении характеристик рефрактерного ревматоидного артрита. Большая часть ревматологов считает, что рефрактерный ревматоидный артрит определяется по DAS 28 более 3,2 балла и при признаках воспаления25.
Кроме того, участники опроса давали определение рефрактерного ревматоидного артрита, связанного с предшествующей терапией. По мнению большинства, отсутствие эффекта при назначении более двух БПВП и более двух или трех ГИБП позволяет утверждать о рефрактерном ревматоидном артрите.
В настоящее время опубликовано несколько исследований по оценке ответа пациентов на лечение ГИБП с разными механизмами действия через 6–12 месяцев. Так, в клиническом исследовании ATTRACT анализировали эффективность инфликсимаба, в DEO 19 – адалимумаба, в RADIATE − тоцилизумаба, REFLEX – ритуксимаба, ATTAIN – абатацепта. Обобщенные данные свидетельствуют, что менее 50% пациентов с ревматоидным артритом отвечают на лечение по ACR 2026–30.
Далее профессор В.И. Мазуров акцентировал внимание участников симпозиума на факторах, которые ассоциируются с недостаточным ответом на лечение. Среди них наиболее значимыми являются коморбидные состояния, в частности ожирение, и курение. Как известно, метаболический синдром, ожирение, сахарный диабет в значительной степени ухудшают течение не только хронических воспалительных заболеваний, но и инфекций, которые развиваются на фоне иммуновоспалительного процесса. Согласно результатам исследований, серонегативность также связана с более низким ответом на лечение противоревматическими препаратами31.
На эффективность терапии влияет и длительность интервалов между приемами пациентов1.
Высокая частота обострений отмечается у пациентов с плохой приверженностью к приему противоревматических препаратов32.
Среди предикторов отмены лечения первым ингибитором ФНО-α в течение первого года указывают курение, внесуставные проявления и болевой синдром. Эти же причины связывают с недостаточной эффективностью проводимой терапии33.
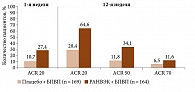
На сегодняшний день в ряде исследований рассматривается возможность перевода пациентов с ГИБП на ингибиторы JAK, при неэффективности первых. Так, в исследование SELECT-BEYOND были включены больные ревматоидным артритом умеренной и высокой активности и недостаточным ответом на терапию ГИБП. Показано, что назначение упадацитиниба (РАНВЭК) в дозе 15 мг/сут в комбинации с БПВП позволяло достигать ответа по ACR 20/50/70 уже на первой неделе лечения (рис. 1)34.
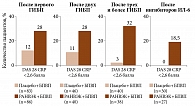
Терапия упадацитинибом в сочетании с БПВП оказалась более эффективной, чем прием плацебо в комбинации с БПВП. Превосходящий терапевтический ответ на 12-й и 24-й неделях наблюдался у значительно большей доли пациентов, получавших упадацитиниб. К 24-й неделе в группе терапии упадацитинибом и БПВП отмечался достоверно более значимый результат в отношении частоты достижения клинической ремиссии (DAS 28 CRP менее 2,6 балла), причем независимо от предшествующего применения ГИБП с разными механизмами действия и их количества (рис. 2).
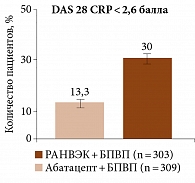
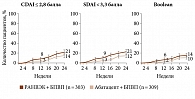
Дизайн многоцентрового рандомизированного двойного слепого исследования фазы III SELECT-CHOICE предполагал сравнение эффективности комбинаций «упадацитиниб + БПВП» и «абатацепт + БПВП» у пациентов с ревматоидным артритом и недостаточным ответом на ГИБП. На 12-й неделе измерение первичной конечной точки (изменение по DAS 28 CRP относительно исходного уровня) свидетельствовало о не меньшей эффективности упадацитиниба в дозе 15 мг/сут по сравнению с эффективностью абатацепта. Доля достигших ремиссии по DAS 28 CRP, CDAI и SDAI и Boolean была выше среди получавших упадацитиниб (РАНВЭК) (рис. 3 и 4)35.
В рандомизированном клиническом исследовании фазы III SELECT-COMPARE сравнивали эффективность упадацитиниба с плацебо и адалимумабом на фоне терапии метотрексатом у больных ревматоидным артритом с недостаточным ответом на предшествующую терапию. Дизайн исследования предполагал переход на терапию спасения. В отсутствие ответа с 14-й по 26-ю неделю пациентов переключали на другой активный препарат. Получавших плацебо и адалимумаб переводили на упадацитиниб, принимавших упадацитиниб – на адалимумаб10.
Субанализ результатов исследования SELECT-COMPARE продемонстрировал, что при недостаточном терапевтическом ответе на ингибитор JAK и метотрексат переключение на ГИБП адалимумаб повышало эффективность лечения без изменения безопасности36.
В заключение профессор В.И. Мазуров отметил, что упадацитиниб является новым методом лечения пациентов с ревматоидным артритом. Современные данные свидетельствуют о возможности применения ингибиторов JAK в терапии ревматоидного артрита при неэффективности генно-инженерной биологической терапии.
Первый опыт применения упадацитиниба в реальной клинической практике
Практический руководитель Центра терапии генно-инженерными биологическими препаратами клиники им. Э.Э. Эйхвальда СЗГМУ им. И.И. Мечникова, к.м.н. Рузанна Рамиловна САМИГУЛЛИНА рассказала о первом опыте применения упадацитиниба в российской клинической практике.
Результаты исследований клинической программы SELECT позволили сделать вывод, что терапия упадацитинибом (РАНВЭК) ассоциируется с достоверно более высокой частотой ремиссии по всем основным индексам, включая Boolean, чем применение адалимумаба в сочетании с метотрексатом. Упадацитиниб продемонстрировал неизменную частоту в обеспечении ремиссии независимо от предшествующей терапии БПВП, метотрексатом, ГИБП. Он оказался эффективным как в комбинации с метотрексатом, так и в виде монотерапии. В рамках исследований на фоне терапии упадацитинибом отмечено нарастание уровня ремиссии со второй недели с сохранением в течение года34, 37, 38.
В связи со сказанным особый интерес могут представлять данные отечественной клинической практики. Так, в Центре терапии ГИБП клиники им. Э.Э. Эйхвальда под наблюдением находилось 11 пациентов с ревматоидным артритом, которые ранее уже получали ГИБП и БПВП. Им была назначена терапия препаратом РАНВЭК в комбинации с БПВП или в виде монотерапии. Это лица старшего возраста (63–70 лет) с длительным течением и высокой активностью ревматоидного артрита. Восемь из них ранее получали ритуксимаб, двое – инфликсимаб. У одной пациентки в анамнезе неэффективность абатацепта.
Среди сопутствующих заболеваний превалировала артериальная гипертензия (у двух пациентов).
Длительность ревматоидного артрита – от четырех до 36 лет.
Активность заболевания по DAS 28 CRP признана умеренной и высокой. Выраженность боли по визуальной аналоговой шкале (ВАШ) – в среднем семь баллов.
Через месяц на фоне применения препарата РАНВЭК у всех пациентов уменьшилось количество болезненных и припухших суставов, независимо от предшествующей терапии (таблица).
Все больные отметили уменьшение боли по ВАШ. Так, у пациентов, ранее получавших ритуксимаб и инфликсимаб, на фоне комбинированной терапии РАНВЭК и БПВП и монотерапии РАНВЭК выраженность боли по ВАШ снизилась до трех баллов. Пациентка, ранее получавшая абатацепт, к четвертой неделе терапии препаратом РАНВЭК полностью прекратила прием нестероидных противовоспалительных препаратов. При этом боль снизилась на 30%.
По словам Р.Р. Самигуллиной, в течение первого месяца использования упадацитиниба серьезные нежелательные явления отсутствовали.
Переносимость терапии РАНВЭК была удовлетворительной. Профиль безопасности был таким же.
Оценка активности заболевания по DAS 28 CRP запланирована через три месяца терапии. Тогда же будет дана оценка профиля безопасности.
Заключение
Ингибиторы JAK воздействуют на эффекты провоспалительных цитокинов, играющих важную роль в патогенезе ревматоидного артрита.
В настоящее время ингибиторы JAK включены в международные рекомендации по лечению ревматоидного артрита.
Представитель ингибиторов JAK упадацитиниб продемонстрировал высокую эффективность как в монотерапии, так и в комбинированной терапии с метотрексатом и БПВП.
В ряде масштабных рандомизированных клинических исследований показана эффективность упадацитиниба в достижении ремиссии и замедлении рентгенологического прогрессирования ревматоидного артрита, уменьшении боли и улучшении качества жизни пациентов.

