Тагриссо: новые возможности таргетной терапии больных немелкоклеточным раком легкого (НМРЛ) с подтвержденным статусом мутации Т790М в гене EGFR. XXI Российский онкологический конгресс. Сателлитный симпозиум компании «АстраЗенека»
- Аннотация
- Статья
- Ссылки





Основные вехи в диагностике и лечении пациентов с НМРЛ EGFRm
Появление новых знаний о молекулярных механизмах онкогенеза способствовало разработке лекарственных средств, направленных на подавление опухолевого процесса. Как отметил Сергей Алексеевич ТЮЛЯНДИН, д.м.н., профессор, заместитель директора, заведующий отделением клинической фармакологии Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина, председатель Российского общества клинической онкологии (RUSSCO), первые успехи в лечении больных немелкоклеточным раком легкого (НМРЛ) с мутациями в гене рецептора эпидермального фактора роста (EGFR) связаны с применением таргетных препаратов.
Впервые мутации в гене EGFR были обнаружены в 2004 г. у пациентов, ответивших на таргетную терапию гефитинибом (Ирессой). Тогда было установлено, что препарат Иресса эффективно блокирует тирозинкиназу мутированного EGFR и увеличивает медиану выживаемости без прогрессирования (ВБП) до десяти месяцев, медиану общей выживаемости – до 20 месяцев1–5. Подтверждение тому – результаты исследования IPASS, продемонстрировавшие преимущество Ирессы перед двухкомпонентной химиотерапией при НМРЛ с мутациями в гене EGFR5. В августе 2011 г. препарат Иресса был одобрен Министерством здравоохранения и социального развития РФ в качестве терапии пациентов с местнораспространенным или метастатическим НМРЛ с мутациями в гене EGFR.
Мутации в гене EGFR стали рассматривать как прогностический маркер чувствительности НМРЛ к таргетной терапии препаратом Иресса. По инициативе компании AstraZeneca в 2010 г. началось наблюдательное исследование EPICLIN для оценки частоты встречаемости мутаций в гене EGFR у пациентов с распространенным немелкоклеточным раком легкого в Российской Федерации. В 2011 г. стартовала программа по совершенствованию молекулярной диагностики в Российской Федерации, в рамках которой осуществляется молекулярно-генетическое тестирование на определение мутаций в гене EGFR6.
В настоящее время тестирование мутаций гена EGFR проводится в 22 молекулярно-генетических лабораториях онкологических учреждений 85 российских регионов. С 2011 г. в нашей стране протестировано около 30 000 больных распространенным НМРЛ на наличие мутаций в гене EGFR7.
По словам профессора С.А. Тюляндина, с появлением на фармацевтическом рынке препарата Иресса (гефитиниб) возможности лечения больных НМРЛ с мутацией в гене EGFR значительно расширились. Однако эффект ингибиторов тирозинкиназы (ИТК) EGFR первого и второго поколения, к сожалению, не так продолжителен, как хотелось бы. К ИТК EGFR первого и второго поколения примерно через 8–14 месяцев развивается резистентность опухолевых клеток, в 60% случаев обусловленная вторичной мутацией Т790М в гене EGFR8–10. В результате вторичной мутации меняется пространственная структура белка, противоопухолевый препарат утрачивает способность связываться и ингибировать активность тирозинкиназы. Назрела острая необходимость создания препаратов, способных работать даже в случае появления опухолевого клона с вторичной мутацией резистентности. Таким препаратом стал осимертиниб (Тагриссо). Осимертиниб блокирует тирозинкиназу рецептора EGF как при наличии активирующих мутаций (del19 или L858R), так и при мутации Т790М в гене EGFR, отвечающей за резистентность к ИТК EGFR первого и второго поколения11–15.
В октябре 2017 г. препарат Тагриссо (осимертиниб) был зарегистрирован в России для лечения пациентов с местнораспространенным или метастатическим НМРЛ с мутацией Т790М в гене EGFR. «Мы ежегодно обновляем клинические рекомендации. Скорее всего в 2018 г. в новые рекомендации Российского общества клинической онкологии будет включен и осимертиниб», – уточнил профессор С.А. Тюляндин в заключение.
Меняя алгоритмы терапии НМРЛ EGFRm через инновации в молекулярной диагностике
Выявление мутации в гене EGFR в качестве будущей мишени для препарата гефитиниб можно с полным основанием считать одним из главных событий в клинической онкологии последнего десятилетия. На это в начале выступления обратил внимание заведующий отделом биологии опухолевого роста Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова, д.м.н., профессор кафедры онкологии Северо-Западного университета им. И.И. Мечникова, руководитель кафедры медицинской генетики Санкт-Петербургского государственного педиатрического медицинского университета, член-корреспондент РАН Евгений Наумович ИМЯНИТОВ.
ИТК EGFR, к которым относится гефитиниб, блокируют АТФ-связывающий домен EGFR и тем самым ингибируют передачу сигнала от этого рецептора. ИТК EGFR высокоэффективны в отношении опухолей с мутацией в киназном домене рецептора, кодируемом экзонами 18–21 гена EGFR. Выявление пациентов с генетическими альтерациями EGFR приобрело новое значение после того, как в нескольких исследованиях была показана высокая для НМРЛ эффективность монотерапии ИТК у пациентов с выявленной мутацией в гене EGFR. В исследовании V.M. Moiseyenko и соавт., посвященном оценке эффективности гефитиниба в первой линии терапии, у всех пациентов с аденокарциномой легкого и мутациями в гене EGFR наблюдались ответ на терапию или стабилизация процесса16. Это свидетельствовало о том, что определение мутаций в гене EGFR – необходимый тест при отборе больных НМРЛ для назначения ИТК EGFR.
Следует отметить, что к наиболее частым мутациям относятся делеции в 19-м экзоне (46%) и точечная мутация L858R в 21-м экзоне (37,5%). Остальные мутации EGFR встречаются намного реже.
До недавнего времени стандартные подходы к лечению больных раком легкого предусматривали cмену препаратов в случае прогрессирования опухолевого процесса. Общая продолжительность жизни пациентов, получавших химиотерапию после прогрессирования, достигала 14 месяцев. В то же время у больных, продолжавших на фоне прогрессирования заболевания лечение гефитинибом, общая выживаемость превышала 29 месяцев17.
Таким образом, благодаря появлению гефитиниба и обнаружению мутаций EGFR догмы в онкологии, долгое время казавшиеся незыблемыми, были пересмотрены. В частности, изменился подход к назначению и отмене таргетных препаратов. Однако, несмотря на высокую частоту объективных ответов (ЧОО) и длительную по сравнению с химиотерапией ВБП, у пациентов через 8–14 месяцев отмечается прогрессирование болезни на фоне ИТК EGFR8–10. Наиболее частой причиной резистентности (свыше 50% случаев) считается вторичная мутация в гене EGFR – Т790М.
Тагриссо – новый ИТК EGFR для таргетной терапии НМРЛ с мутацией Т790М в гене EGFR. Он избирательно действует как при активирующих мутациях в гене EGFR, так и при мутации резистентности Т790М18. Следовательно, Тагриссо – препарат двойного действия, который ингибирует тирозинкиназу рецептора EGF при исходной мутации и модифицированной вследствие мутации резистентности формы рецептора19.
В исследовании P.A. Jänne и соавт. (2015 г.) продемонстрирована эффективность осимертиниба у больных раком легкого с резистентностью к гефитинибу, эрлотинибу или афатинибу. У пациентов с мутацией Т790М осимертиниб показал высокую эффективность20.
Таким образом, молекулярно-генетическое тестирование для определения мутационного статуса после прогрессирования заболевания на ИТК EGFR является на данный момент неоспоримой составляющей алгоритма лечения пациента с распространенным НМРЛ21, 22. По мнению Е.Н. Имянитова, оптимальной опцией в данной ситуации будет жидкостная биопсия, основанная на анализе циркулирующей опухолевой ДНК в плазме крови23, 24. Трудности проведения подобного теста связаны с недостаточной чувствительностью метода, непривычной для врачей пробоподготовкой, требующей отработки логистики забранного материала. Золотым стандартом остается повторная биопсия, но ее применение ограниченно, поскольку может быть связано со сложностями технического характера из-за мало доступной локализации опухоли либо метастаза и/или тяжелого состояния больного25. Кроме того, данный метод не учитывает возможность опухолевой гетерогенности8.
Жидкостная биопсия малоинвазивна и может использоваться для определения молекулярно-генетического профиля опухоли у больных НМРЛ с приобретенной резистентностью к ИТК EGFR. При выявлении мутации Т790М в плазме пациенту назначают ИТК EGFR третьего поколения. Отсутствие мутации Т790М следует подтвердить или опровергнуть на основании результатов биопсии. Положительный результат на наличие мутации Т790М служит основанием для назначения осимертиниба, отрицательный – для проведения химиотерапии или альтернативной терапии7.
Резюмируя сказанное, профессор Е.Н. Имянитов подчеркнул:
- выявление мутации Т790М на момент прогрессирования НМРЛ имеет большое клиническое значение;
- высока вероятность, что молекулярно-генетический анализ плазмы окажется информативным;
- обязателен тест на исходную драйверную мутацию (del19 или L858R) в гене EGFR для контроля.
В случае неинформативности тестирования плазмы рекомендуется молекулярно-генетический анализ гистологического или цитологического образца опухоли.
Резистентность к ИТК EGFR: пути решения и новые возможности
Целесообразность назначения таргетной терапии больным НМРЛ с выявленными мутациями сомнений не вызывает. Профессор Federico Cappuzzo (Италия) рассмотрел эффективную опцию первой линии терапии метастатического НМРЛ, последовательность применения лечебных подходов, оптимальный вариант терапии НМРЛ с метастазами в центральной нервной системе (ЦНС), проанализировал возможность сочетания таргетной терапии и иммунотерапии.
Несомненно, в отличие от химиотерапии ИТК EGFR первого и второго поколения, к которым относятся гефитиниб, эрлотиниб и афатиниб, демонстрируют более высокую эффективность при НМРЛ с мутациями в гене EGFR в отношении ВБП, ЧОО и общей выживаемости (ОВ). Это подтверждается результатами многочисленных исследований III фазы, продемонстрировавшими преимущество ИТК EGFR перед химиотерапией2, 26.
Какой препарат предпочтителен? В сравнительном исследовании Y. Urata и соавт. (2016 г.)27 сравнивали эффективность гефитиниба и эрлотиниба во второй линии терапии у пациентов с поздними стадиями НМРЛ. Подавляющее большинство больных (71%) имели мутации в гене EGFR. Данные показали сопоставимую эффективность двух препаратов по показателям ОВ и ВБП независимо от статуса мутации в гене EGFR.
В исследовании LUX-Lung 7 сравнивали эффективность афатиниба и гефитиниба28. Значимых различий между препаратами в увеличении ЧОО и ОВ не получено. Важно, что эффективность препаратов была сопоставимой у пациентов с делециями в 19-м экзоне гена EGFR. Сравнение профилей токсичности препаратов выявило более высокую частоту случаев кожной сыпи и диареи в группе афатиниба и повышение уровней трансаминаз в группе гефитиниба.
Таким образом, все три препарата характеризуются схожей эффективностью у больных НМРЛ с мутациями в гене EGFR, но разным профилем токсичности.
Как уже отмечалось, известно несколько механизмов резистентности к ИТК EGFR первого и второго поколения. В меньшей степени это может быть обусловлено трансформацией в мелкоклеточный рак, амплификацией МЕТ или HER2, в большей степени (до 60%) – мутацией в гене EGFR Т790М8–10.
Чтобы выбрать оптимальную терапевтическую опцию, необходимо определить мутационный статус у больного. Стандартом является биопсия, которую при прогрессировании рака легкого выполнить непросто. Минимальной инвазивностью характеризуется жидкостная биопсия. Согласно последним рекомендациям NCCN (National Comprehencive Cancer Network – Национальная всеобщая онкологическая сеть), при отрицательном результате молекулярно-генетического анализа плазмы рекомендовано проведение биопсии опухоли и молекулярно-генетическое тестирование полученного при биопсии материала21.
На борьбу с резистентностью, обусловленной мутацией Т790М в гене EGFR, направлен осимертиниб – необратимый ИТК EGFR, действующий и при активирующих мутациях в гене EGFR, и при мутации резистентности Т790М. Препарат продемонстрировал хорошую эффективность в доклинических испытаниях: на фоне его применения отмечалось уменьшение опухоли в ксенотрансплантатных моделях с мутациями EGFRm и Т790М in vivo19.
Клиническую эффективность осимертиниба у больных НМРЛ с активирующей мутацией в гене EGFR и резистентностью к ИТК EGFR первого и второго поколения, обусловленной мутацией Т790М, изучали в рандомизированных исследованиях AURA (I–III фазы). Осимертиниб продемонстрировал высокую эффективность и хорошую переносимость у больных с резистентностью НМРЛ к ИТК EGFR первого и второго поколения вследствие мутации Т790М. Кроме того, осимертиниб достоверно увеличивал медиану ВБП по сравнению со стандартной химиотерапией18.
Осимертиниб признан стандартом второй линии терапии у больных НМРЛ с активирующей мутацией гена EGFR и резистентностью к ИТК EGFR первого и второго поколения вследствие мутации Т790М21, 22.
В реальной клинической практике после стандартной терапии ИТК EGFR первой линии 2/3 пациентов во второй линии получают химиотерапию или симптоматическую терапию и только 1/3 больных – осимертиниб. Следовательно, эффективная терапевтическая опция применяется у небольшой группы больных.
У больных НМРЛ с мутациями в гене EGFR в 40–50% случаев развиваются метастазы в головном мозге, что негативно влияет на качество и продолжительность их жизни29, 30. В связи с этим не лишним будет напомнить еще одну особенность осимертиниба: в отличие от гефитиниба, эрлотиниба и афатиниба он способен проникать через гематоэнцефалический барьер и высокоэффективен при метастазах в головном мозге13, 19, 31–33. В исследовании AURA3 показана способность осимертиниба эффективнее по сравнению с химиотерапией увеличивать медиану ВБП у больных с метастазами в ЦНС (8,5 против 4,2 месяца)34.
К новым методикам лечения НМРЛ относится применение ингибиторов иммунных контрольных точек, одним из биомаркеров эффективности которых считается экспрессия PD-L1. Между тем PD-L1 зачастую не экспрессируется при наличии активирующих мутаций в гене EGFR. По мнению профессора F. Cappuzzo, с практической точки зрения пациенту с мутациями в гене EGFR прежде всего следует назначать терапию ИТК EGFR, а иммунотерапию использовать в качестве дополнительной опции.
Подводя итог, профессор F. Cappuzzo подчеркнул, что осимертиниб – новый стандарт терапии для больных НМРЛ с мутациями в гене EGFR и мутацией резистентности Т790М. Препарат эффективен при метастазах в головном мозге. Оптимальная последовательность назначения ИТК EGFR требует дополнительного изучения.
Программа клинических исследований Тагриссо (осимертиниба)
Медицинской директор по науке направления «Онкология» глобального подразделения по исследованиям и разработкам компании «АстраЗенека» (Великобритания) Юрий Эдуардович РУКАЗЕНКОВ ознакомил участников симпозиума с результатами доклинических и клинических исследований эффективности и безопасности осимертиниба, послужившими основанием для регистрации препарата в США, Европе и России.
Осимертиниб является пероральным необратимым ИТК EGFR – первым ИТК EGFR третьего поколения для лечения больных местнораспространенным или метастатическим раком легкого с мутацией Т790М в гене EGFR с прогрессированием заболевания на фоне терапии ИТК EGFR. В большинстве случаев резистентность НМРЛ к терапии обусловлена вторичной мутацией в гене EGFR вследствие замены треонина метионином в позиции 790 в 20-м экзоне. В результате более громоздкая метиониновая цепь создает стерическое препятствие и мешает доступу к участку связывания АТФ, что обеспечивает устойчивость клеток опухоли к воздействию ИТК EGFR. Кроме того, T790M повышает аффинитет рецептора к АТФ, поскольку эрлотиниб и гефитиниб обратимо связываются с EGFR и конкурируют с АТФ за связывание с тирозинкиназным доменом рецептора. Повышенный аффинитет к АТФ приводит к снижению активности ИТК. Химическая структура осимертиниба отличается от таковой ИТК EGFR первого и второго поколения19.
В доклинических исследованиях особое внимание уделялось поиску оптимальной структуры молекулы для того, чтобы препарат селективно воздействовал на тирозинкиназу как в клетках с активирующими мутациями в гене EGFR, так и в клетках с мутацией резистентности Т790М. Кроме того, была определена наиболее эффективная доза осимертиниба, обеспечившая уменьшение опухоли в ксенотрансплантатных моделях с мутациями EGFRm и Т790М in vivo19. После фармакокинетического расчета была выбрана минимальная доза осимертиниба 20 мг.
Исследование AURA, стартовавшее в 2013 г., включало исследование I фазы (когорты эскалации доз и экспансии доз) и II фазы (когорта исследования терапевтической дозы)12. В когортах эскалации и экспансии доз исследовали безопасность, переносимость, эффективность и фармакокинетику осимертиниба у пациентов с НМРЛ EGFRm или предшествующей пользой от ИТК EGFR в разных дозах: от 20 до 240 мг. Значительное уменьшение опухоли имело место во всех когортах больных НМРЛ даже при использовании препарата в минимальной дозе 20 мг. Согласно результатам исследования I фазы AURA, доза 80 мг была определена как наиболее безопасная и эффективная. Полученные данные послужили основанием для проведения исследования II фазы. Когорта исследования терапевтической дозы включала в том числе больных НМРЛ с резистентностью к ИТК EGFR. Тестирование на определение статуса мутации Т790М являлось обязательным и проводилось централизованно. В исследовании AURA II фазы (AURA extension (n = 201) и AURA2 (n = 210))11 оценивали безопасность (по общим критериям терминологии Национального института рака (CTCAE), версия 4.0) и эффективность осимертиниба 80 мг один раз в сутки у больных распространенным НМРЛ с наличием мутации гена EGFR с развившейся резистентностью к ИТК EGFR.
Объединенные результаты исследований II фазы продемонстрировали высокую терапевтическую эффективность препарата Тагриссо: медиана ВБП составила 11 месяцев, ЧОО – 66%, медиана длительности ответа – 12,5 месяца, что послужило основанием для получения неполной лицензии на препарат в США и других странах. Сыпь, диарея, сухость кожи и паронихия были наиболее распространенными нежелательными явлениями – 167 (41%), 157 (38%), 125 (30%) и 118 (29%) пациентов соответственно. Такие нежелательные явления, как интерстициальная пневмония, увеличение интервала QT, зарегистрированы менее чем в 1–2% случаев35.
В рандомизированном исследовании III фазы AURA318, 34 сравнивали осимертиниб и платиносодержащую химиотерапию у больных НМРЛ с подтвержденным статусом мутации Т790М в гене EGFR при прогрессировании на ИТК EGFR в первой линии терапии. Критериями включения в исследование были возраст 18 лет и старше, гистологически или цитологически подтвержденный НМРЛ, местнораспространенный или метастатический НМРЛ, радиологически подтвержденная прогрессия заболевания на первой линии терапии ИТК EGFR, без дальнейшего лечения, подтвержденный статус мутации Т790М. К участию допускались пациенты с наличием стабильных бессимптомных метастазов в ЦНС. 419 пациентов в соотношении 2:1 были рандомизированы в группу осимертиниба (n = 279) и группу химиотерапии (комбинация пеметрекседа с препаратами платины) (n = 140)18, 34.
Пациенты в группе химиотерапии могли перейти на осимертиниб 80 мг один раз в сутки после радиологически подтвержденного прогрессирования заболевания на основании критериев оценки ответа солидных опухолей (RECIST) версии 1.1.
Демографические и прочие исходные характеристики были сбалансированы между группами. Более 30% больных каждой группы имели метастазы в ЦНС.
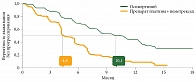
Медиана ВБП (первичная конечная точка) по оценке исследователя составила 10,1 месяца(95%-ный доверительный интервал (ДИ) 8,3–12,3) в группе осимертиниба и 4,4 месяца (95% ДИ 4,2–5,6) в группе химиотерапии (отношение рисков (ОР) 0,30; 95% ДИ 0,23–0,41; p < 0,001).
Преимущество в группе осимертиниба по показателю ВБП отмечалось во всех подгруппах (ОР < 0,50 для каждой подгруппы) (рис. 1).
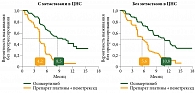
Анализ в подгруппах показал более значимое увеличение медианы ВБП у больных с метастазами в ЦНС – 8,5 месяца (95% ДИ 6,8–12,3) в группе осимертиниба и 4,2 месяца (95% ДИ 4,1–5,4) в группе химиотерапии (ОР 0,32; 95% ДИ 0,21–0,49).
Аналогичная тенденция наблюдалась у пациентов без метастазов в ЦНС: 10,8 против 5,6 месяца (рис. 2).
ЧОО составила 71% в группе осимертиниба и 31% в группе химиотерапии, медиана продолжительности ответа – 9,7 и 4,1 месяца соответственно34. Осимертиниб по сравнению с химиотерапией показал лучшую переносимость и профиль безопасности, о чем свидетельствовала частота нежелательных явлений 3–4-й степени: 23 против 47%18, 34.
На основании результатов исследования AURA3 ученые пришли к заключению:
- осимертиниб имеет статистически значимое преимущество по эффективности перед платиносодержащей химиотерапией (ОР ВБП 0,30; 95% ДИ 0,23–0,41; р < 0,001; медиана ВБП по оценке исследователя – 10,1 против 4,4 месяца; ЧОО – 71 против 31%; отношение шансов 5,39; 95% ДИ 3,47–8,48; р < 0,001);
- осимертиниб эффективен у пациентов как с метастазами, так и без метастазов в ЦНС;
- осимертиниб ассоциируется с более низкой частотой нежелательных явлений 3–4-й степени по сравнению с режимом, включающим пеметрексед и препарат платины.
Сказанное позволяет рассматривать осимертиниб в качестве нового стандарта терапии НМРЛ с подтвержденным статусом мутации Т790М после прогрессирования заболевания на фоне терапии ИТК EGFR первого и второго поколения.
В заключение Ю.Э. Руказенков отметил, что результаты исследования AURA3 послужили основанием для регистрации препарата Тагриссо во многих странах мира, в том числе в России34.
Новые алгоритмы терапии и передовая практика: лечение пациентов с приобретенной резистентностью к ИТК EGFR
Так называемый генетический портрет аденокарциномы легких в европейской популяции представлен мутациями в гене EGFR в 18–20% случаев, в азиатской популяции – в 50–60%36. По данным Владимира Михайловича МОИСЕЕНКО, руководителя Санкт-Петербургского клинического научно-практического центра специализированных видов медицинской помощи (онкологического), заслуженного врача РФ, д.м.н., профессора, в Санкт-Петербурге 19,8% больных аденокарциномой имеют мутацию в гене EGFR.
Результаты ряда клинических исследований, избирательно включавших больных с мутацией в гене EGFR, показали практически 100-процентную ЧОО на терапию препаратом Иресса. Это подтверждают и данные исследования V.M. Moiseyenko и соавт. У 25 больных НМРЛ с мутациями в гене EGFR (del19 и L858R) медиана ВБП достигала 262 дня, а медиана ОВ – 474 дня16. M.G. Kris и соавт. (2014 г.) пришли к выводу, что терапия ИТК EGFR в первой линии у пациентов с геномными нарушениями более чем на год увеличивает медиану ОВ37.
Установлено, что у больных НМРЛ с мутациями в гене EGFR после года терапии ИТК EGFR (медиана ВБП – 8–13,6 месяца) развивается резистентность к терапии, чаще связанная с мутацией Т790М (51–68%). Как уже отмечалось, вторичная мутация Т790М в гене EGFR сопровождается повышением сродства рецептора к АТФ с последующей потерей активности ИТК EGFR первого поколения38. Кроме того, Т790М не позволяет ИТК EGFR связываться с рецептором EGF, поскольку более громоздкая метиониновая цепь создает стерическое препятствие и мешает доступу к участку связывания АТФ19, 39, 40. В этой ситуации активность проявляет препарат Тагриссо (осимертиниб).
Препарат Тагриссо активен как при активирующих мутациях, так и при мутации резистентности Т790М в гене EGFFR. Важно, что Тагриссо демонстрирует очень низкую активность (в 200 раз ниже) в отношении дикого типа рецептора EGF, что обусловливает лучший профиль переносимости19.
В рандомизированном исследовании III фазы AURA3 сравнивали эффективность и безопасность осимертиниба и двухкомпонентной химиотерапии у пациентов с НМРЛ и подтвержденным статусом EGFR Т790М. Результаты терапии осимертинибом оказались впечатляющими: на фоне применения препарата медиана ВБП в 2,5 раза превысила таковую при использовании химиотерапии18, 34.
В настоящее время препарат Тагриссо входит в международные стандарты лечения больных НМРЛ EGFRm с резистентностью к ИТК EGFR вследствие мутации Т790М21, 22.
Определение механизма приобретенной резистентности вошло в последние рекомендации NCCN и RUSSCO (2017 г.)21, 41. Проводить молекулярно-генетическое тестирование на наличие мутации Т790М при первых признаках прогрессирования НМРЛ с мутациями в гене EGFR на фоне применения ИТК EGFR первого и второго поколения рекомендуется с использованием образцов плазмы (жидкостная биопсия) и образцов ткани (повторная биопсия). С октября 2017 г. тестирование на наличие мутации Т790М на территории Российской Федерации доступно в рамках программы RUSSCO «Совершенствование молекулярно-генетической диагностики в РФ»7, 41.
Следует отметить, что пациенты уже имели возможность получать препарат Тагриссо в рамках программы раннего доступа, стартовавшей в нашей стране в ноябре 2016 г. В ней участвовали около 50 больных НМРЛ T790M EGFRm из медицинских центров 12 российских городов. Ученые, используя осимертиниб при НМРЛ с мутацией Т790М, убедились в его эффективности в условиях реальной клинической практики.
Профессор В.М. Моисеенко рассмотрел клинический случай.
У пациентки 53 лет с выявленным раком верхней доли правого легкого (Т4N2М1a) молекулярно-генетическое тестирование позволило выявить мутацию в гене EGFR – делецию в 19-м экзоне. Больная жаловалась на одышку, боль и кашель. После месячной терапии гефитинибом симптомы плеврита, болевой синдром, одышка были купированы. Кроме того, первичная опухоль значительно уменьшилась в размерах. Положительная тенденция в отношении опухолевого процесса отмечалась и через три месяца терапии гефитинибом и сохранялась на протяжении 21 месяца.
Спустя 21 месяц были обнаружены метастатическое поражение грудной стенки, метастазы в печени и увеличение первичного опухолевого очага. Результаты биопсии из метастатического очага в грудной стенке подтвердили наличие мутации Т790М. В Министерство здравоохранения РФ был направлен запрос о разрешении ввоза на территорию РФ препарата для конкретной больной. Через два месяца (за это время метастатический процесс в печени быстро прогрессировал) была начата терапия осимертинибом (Тагриссо).
Через два месяца терапии осимертинибом отмечались значимое уменьшение метастазов в печени и улучшение общего состояния пациентки. Она принимает осимертиниб уже шесть месяцев, самочувствие хорошее.
Какова оптимальная последовательность терапии НМРЛ с мутациями в гене EGFR? По словам профессора В.М. Моисеенко, алгоритм лечения предусматривает назначение ИТК EGFR первого или второго поколения с эффектом в среднем 8–13,6 месяца до прогрессирования42–48 и после подтверждения мутации Т790М назначение препарата Тагриссо, который позволит увеличить ВБП еще в среднем на десять месяцев. Фактически речь идет о дополнительных 23–24 месяцах жизни больных раком легкого. Это колоссальный прогресс, особенно по сравнению с прежними пятью-шестью месяцами ожидаемой продолжительности жизни при раке легкого на фоне химиотерапии. В настоящее время рассматривается возможность применения ИТК EGFR третьего поколения, к которым относится осимертиниб, в качестве первой линии терапии, что может увеличить ВБП до 22 месяцев, а вместе с последующей химиотерапией – до 27 месяцев.
Профессор В.М. Моисеенко акцентировал внимание еще на одном преимуществе препарата Тагриссо – удобной форме дозирования. Тагриссо – это одна таблетка 80 мг, которая применяется перорально один раз в сутки независимо от приема пищи14. При необходимости таблетку можно растворить в воде или ввести через назогастральный зонд.
Резюмируя сказанное, докладчик констатировал, что появление новых таргетных препаратов и переход с одного вида терапии на другой способствуют трансформации НМРЛ с мутациями в хроническое заболевание, что существенно увеличивает продолжительность жизни больных и улучшает ее качество.
Заключение
Проведение молекулярно-генетической диагностики опухоли у пациентов с НМРЛ в дополнение к гистологическому исследованию позволяет спрогнозировать течение и прогноз заболевания и выбрать оптимальную тактику лечения, а именно использовать молекулярно направленные препараты.
Препарат Тагриссо (осимертиниб) – первый необратимый ингибитор тирозинкиназы EGFR третьего поколения для лечения больных местнораспространенным или метастатическим немелкоклеточным раком легкого с мутацией Т790М в гене EGFR.
Препарат Тагриссо высокоэффективен у пациентов с резистентностью к ИТК EGFR первого и второго поколения вследствие мутации T790M.Тагриссо характеризует благоприятные профили безопасности и переносимости.
Согласно результатам клинических исследований, при использовании осимертиниба (Тагриссо) у пациентов с распространенным или метастатическим раком легкого и выявленной мутацией Т790М в гене EGFR, в том числе у пациентов с метастазами в головном мозге, медиана ВБП в два раза превышает таковую при химиотерапии.
Таким образом, появление в арсенале онкологов высокоэффективного таргетного препарата Тагриссо (осимертиниба) открывает новую страницу в истории лечения рака легкого.

