Тандем алоглиптина и пиоглитазона – новый союз в борьбе с сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English
Повышенный риск развития сердечно-сосудистых осложнений по большей части обусловлен нарушениями липидного обмена, артериальной гипертензией, хроническим внутрисосудистым воспалением и проатеротромботическим состоянием. Вклад гипергликемии определенно меньше. При этом он различается у пациентов с разными типами сахарного диабета.
Известно, что со временем гликемический контроль на фоне монотерапии пероральными сахароснижающими препаратами постепенно утрачивается, что побуждает использовать комбинированную терапию и «новые» антидиабетические средства, которые, к сожалению, могут быть недоступны или неприемлемы для некоторых пациентов. Однако по ряду причин интенсификация терапии нередко запаздывает на несколько лет, что может приводить к необратимым последствиям.
На сегодняшний день становятся крайне важными намеренный уход от клинической инертности, как можно более раннее начало использования фиксированных комбинаций двух сахароснижающих препаратов с комплементарным механизмом действия и благоприятным профилем безопасности, а также фокус на замедлении прогрессирования СД 2 типа и сохранении функции β-клеток.
Инкретин-направленная терапия с использованием ингибиторов дипептидилпептидазы 4 или агонистов рецепторов глюкагоноподобного пептида 1 в комбинации с другими сахароснижающими препаратами, метформином и/или пиоглитазоном, представляется привлекательным вариантом ранней интенсификации лечения, который позволит отсрочить назначение инсулина.
Повышенный риск развития сердечно-сосудистых осложнений по большей части обусловлен нарушениями липидного обмена, артериальной гипертензией, хроническим внутрисосудистым воспалением и проатеротромботическим состоянием. Вклад гипергликемии определенно меньше. При этом он различается у пациентов с разными типами сахарного диабета.
Известно, что со временем гликемический контроль на фоне монотерапии пероральными сахароснижающими препаратами постепенно утрачивается, что побуждает использовать комбинированную терапию и «новые» антидиабетические средства, которые, к сожалению, могут быть недоступны или неприемлемы для некоторых пациентов. Однако по ряду причин интенсификация терапии нередко запаздывает на несколько лет, что может приводить к необратимым последствиям.
На сегодняшний день становятся крайне важными намеренный уход от клинической инертности, как можно более раннее начало использования фиксированных комбинаций двух сахароснижающих препаратов с комплементарным механизмом действия и благоприятным профилем безопасности, а также фокус на замедлении прогрессирования СД 2 типа и сохранении функции β-клеток.
Инкретин-направленная терапия с использованием ингибиторов дипептидилпептидазы 4 или агонистов рецепторов глюкагоноподобного пептида 1 в комбинации с другими сахароснижающими препаратами, метформином и/или пиоглитазоном, представляется привлекательным вариантом ранней интенсификации лечения, который позволит отсрочить назначение инсулина.


Введение
Сахарный диабет (СД) 2 типа представляет собой серьезное хроническое постоянно прогрессирующее заболевание, распространенность которого стремительно возрастает во всем мире. Согласно данным экспертов Всемирной организации здравоохранения, в 2019 г. было зарегистрировано 463 млн пациентов с СД, к 2045 г. их число может увеличиться до 700 млн. При этом от 90 до 95% взрослых страдают СД 2 типа. Данное состояние связано с нарушением метаболического ответа на инсулин (инсулинорезистентностью), в результате чего развивается гипергликемия – стойкое увеличение содержания глюкозы крови [1, 2].
У пациентов с СД 2 типа отмечается двух-четырехкратное увеличение вероятности развития сердечно-сосудистых осложнений по сравнению с пациентами, не страдающими СД 2 типа. Речь, в частности, идет о макрососудистых осложнениях, которые обусловлены развитием атеросклероза артериальных сосудов и последующими атеротромбозом или тромбоэмболией.
К таким осложнениям относятся ишемическая болезнь сердца, острый коронарный синдром – группа клинических признаков или симптомов, позволяющих заподозрить нестабильную ишемическую болезнь сердца или инфаркт миокарда и инсульт.
Помимо инсулинорезистентности у большинства пациентов с СД 2 типа отмечаются сопутствующие метаболические расстройства, которые сами по себе относятся к факторам сердечно-сосудистого риска. Считается, что высокий риск развития сердечно-сосудистых осложнений при СД 2 типа обусловлен нарушением липидного обмена (повышением атерогенной фракции липидов крови), артериальной гипертензией (хроническим повышением артериального давления), хроническим внутрисосудистым воспалением и протромботическим состоянием (склонностью к тромбозу вследствие нарушения свертывающей системы крови) [3, 4].
Вклад гипергликемии в сердечно-сосудистый риск значительно меньше и существенно различается у пациентов с разными типами диабета. Так, в долгосрочном (18 лет) наблюдательном исследовании A. Juutilainen и соавт. было показано, что у пациентов с СД 1 типа увеличение уровня HbA1c на 1% повышало риск сердечно-сосудистой смертности на 53%, у страдающих СД 2 типа – только на 7,5% [5]. На основании этих наблюдательных данных можно ожидать, что снижение уровня HbA1c на 1–2% приведет к изменению риска сердечно-сосудистой смертности у пациентов с СД 2 типа только в долгосрочной перспективе, что крайне затрудняет проведение новых исследований на этот счет.
Кроме того, необходимо учитывать постепенную утрату гликемического контроля на фоне монотерапии пероральными сахароснижающими препаратами (ПССП), что требует использования комбинированной терапии как можно раньше и применения «новых» антидиабетических средств, которые, к сожалению, могут быть недоступны или неприемлемы для некоторых пациентов.
Исследование PANORAMA (кросс-секционный анализ данных по гликемическому контролю, собранных у 5817 пациентов с СД 2 типа, проживающих в странах Европейского союза) показало, что усложнение схем терапии и переход на инъекционные сахароснижающие препараты приводили к уменьшению не только приверженности пациентов лечению, но и вероятности достижения продолжительного гликемического контроля. Было установлено, что на инсулинотерапии достижение целевого уровня гликированного гемоглобина (HbA1c) крайне проблематично. Только 37,4% пациентов могли достичь HbA1c менее 7%, что естественно должно было интерпретироваться как драматически низкий уровень [6].
Патогенез СД 2 типа наряду с инсулинорезистентностью включает нарастающее снижение функции β-клеток поджелудочной железы (рис. 1). Эти нарушения можно ослабить, воздействуя на чувствительность к инсулину клеток печени, мышц и жировой ткани, а также корректируя дефицит инкретиновых гормонов – глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП). ГПП-1 и ГИП – гормоны кишечника, продукция которых начинается после приема пищи. Данные инкретины относятся к главным стимуляторам секреции инсулина β-клетками. В условиях СД 2 типа их продукция и эффекты нарушаются. К сожалению, пока невозможно полностью остановить постепенное снижение функции β-клеток при СД 2 типа, однако отдельные классы сахароснижающих препаратов продемонстрировали способность частично замедлять прогрессирование недостаточности функции β-клеток в совокупности с другими эффектами в зависимости от механизмов действия [7].
История класса тиазолидиндионов
Троглитазон – первый тиазолидиндион, зарегистрированный Управлением по контролю качества пищевых продуктов и лекарственных средств США (Food and Drug Administration – FDA). В исследованиях препарата показано, что он увеличивает чувствительность тканей к инсулину и улучшает функцию β-клеток при СД 2 типа, а также при нарушении толерантности к глюкозе (НТГ) у лиц с предиабетом. Было также продемонстрировано, что троглитазон уменьшает эндотелиальную дисфункцию при ожирении и СД 2 типа, индуцирует овуляцию при синдроме поликистозных яичников и эффективен при липодистрофии. Троглитазон также вызывает перераспределение жира из висцерального жирового депо в подкожное и снижает уровни воспалительных адипокинов и свободных жирных кислот, одновременно повышая уровень адипонектина в плазме крови. Таким образом, троглитазон имеет много общих положительных эффектов с пиоглитазоном (ПИО) и росиглитазоном (РОСИ). Однако в 1997 г. эксперты FDA отозвали регистрационное удостоверение троглитазона в США в связи с получением данных о гепатотоксичности. Позднее выяснилось, что идиосинкразическое токсическое поражение печени, наблюдаемое при применении троглитазона, не класс-эффект тиазолидиндионов. В частности, была опубликована информация о том, что концентрация аланинаминотрансферазы превышала верхнюю границу нормы более чем в десять раз у 0,68% пациентов с диабетом, получавших троглитазон, по сравнению с пациентами, получавшими пиоглитазон или росиглитазон [8].
Действие росиглитазона было аналогично действию пиоглитазона и троглитазона и характеризовалось рядом положительных эффектов в отношении чувствительности клеток к инсулину, β-клеточной функции, пролонгированного гликемического контроля, функции эндотелия и метаболических процессов в адипоцитах. Из-за опасений в отношении риска развития сердечно-сосудистых осложнений применение росиглитазона в США было ограничено, а в европейских и других странах отозвано регистрационное удостоверение препарата. В 2007 г. в ходе метаанализа, проведенного S. Nissen, выявлено повышение частоты развития сердечно-сосудистых осложнений у пациентов с диабетом, получавших росиглитазон. В 2010 г. в результате проведенного анализа FDA было установлено, что терапия росиглитазоном связана с 40%-ным увеличением относительного риска (ОР) достижения комбинированной конечной точки, частоты развития первичных тяжелых сердечно-сосудистых нежелательных явлений (Major Adverse Cardiovascular Event – MACE), таких как сердечно-сосудистая смерть, инфаркт миокарда, инсульт, и 80%-ным увеличением риска инфаркта миокарда, что привело к отзыву регистрационного удостоверения росиглитазона в США и запрету его применения в клинической практике. Современные литературные обзоры свидетельствуют, что применение росиглитазона неизменно связано с увеличением риска сердечно-сосудистых осложнений, тогда как применение пиоглитазона, наоборот, приводит к достоверному снижению риска осложнений со стороны сердечно-сосудистой системы [8].
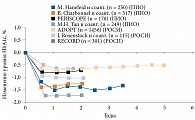
Тиазолидиндионы – мощные сенсибилизаторы инсулина на уровне печени, мышц, адипоцитов, островковых клеток поджелудочной железы. Тиазолидиндионы сохраняют функцию β-клеток при СД 2 типа, вызывая стойкое снижение уровня HbA1c в течение продолжительного периода времени. В семи долгосрочных (более полутора лет) двойных слепых проспективных рандомизированных клинических исследованиях (РКИ) тиазолидиндионы способствовали устойчивому снижению уровня HbA1c, продолжавшемуся в течение пяти-шести лет (рис. 2).
Такой продолжительный период эффективности является следствием комплексного воздействия тиазолидиндионов на базовые звенья патогенеза СД 2 типа – дисфункцию β-клеток и инсулинорезистентность.
У пациентов с СД 2 типа и исходным уровнем HbA1c 8,0–8,5% можно ожидать его снижения на 1,0–1,5% через шесть месяцев терапии тиазолидиндионами. Тиазолидиндионы зарегистрированы для применения в качестве моно-, а также в качестве комбинированной терапии СД 2 типа с другими ПССП, агонистами рецепторов ГПП-1 и инсулином [7, 8].
Устойчивое длительное снижение уровня HbA1c вследствие применения тиазолидиндионов [9] контрастирует с эффектами, отмеченными на фоне терапии производными сульфонилмочевины (ПСМ) и метформином (МЕТ). Так, при их приеме после начального (через один-два года) снижения значений HbA1c наблюдалось их постепенное прогрессирующее повышение, связанное с β-клеточной недостаточностью.
Пиоглитазон замедляет прогрессирование β-клеточной недостаточности. Оказывая как прямое, так и косвенное протективное влияние на β-клетки, он препятствует переходу предиабета в СД 2 типа. Так, в крупных рандомизированных клинических исследованиях ACT NOW и IRIS (медианные периоды наблюдения – 2,4 и 4,8 года) выявлено статистически достоверное снижение риска развития сахарного диабета на 72 и 52% соответственно в группе ПИО по сравнению с группой плацебо. Аналогичное профилактическое действие продемонстрировали рамиприл и росиглитазон в исследовании DREAM. Риск развития СД 2 типа снизился на 62% в течение четырех лет терапии РОСИ [8, 10, 11].
Согласно результатам шести крупных РКИ, тиазолидиндионы как класс не только сенсибилизировали ткани к действию инсулина, но и сохраняли функцию β-клеток поджелудочной железы. Поэтому пиоглитазон важно рассматривать не только как сахароснижающий препарат, но и как препарат, модифицирующий течение и прогрессирование диабета. Инсулинорезистентность тесно связана с нарушением липидного обмена и часто приводит к развитию дислипидемии. Отложение жира в артериях вызывает атерогенез. Накопление жира в висцеральных депо ассоциируется с развитием ишемической болезни сердца и острого коронарного синдрома, в β-клетках – с ухудшением секреции инсулина и некрозом [12–16].
В ответ на повышение концентрации глюкозы в плазме крови β-клетки реагируют увеличением секреции инсулина, поэтому индекс секреции инсулина (ΔI/ΔG, где Δ – изменение относительно исходного уровня, I – инсулин, а G – глюкоза) используется для оценки функции β-клеток и зависит от тяжести инсулинорезистентности.
Отношение индекса скорости секреции инсулина (ΔI/ΔG) к индексу инсулинорезистентности (IR) (ΔI/ΔG : IR) – индекс распределения или диспозиции признан золотым стандартом оценки функции β-клеток, который не должен приравниваться или интерпретироваться исключительно как инсулиновый ответ (отклик) плазмы [8].
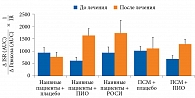
Тиазолидиндионы усиливают функцию β-клеток (секреция инсулина/индекс IR) у пациентов с впервые выявленным СД 2 типа, ранее не получавших ПССП, и у лиц с СД 2 типа, длительно принимавших ПСМ (рис. 3).
В исследовании ACT NOW улучшение индекса диспозиции было самым сильным предиктором предотвращения развития СД 2 типа.
Аналогичные результаты получены в исследованиях TRIPOD (троглитазон для профилактики диабета) и PIPOD (пиоглитазон для профилактики диабета), в которых риск развития диабета у женщин с гестационным диабетом снизился на 52 и 62% соответственно в группах терапии тиазолидиндионами [16, 17]. Согласно данным исследования CANOE, применение в комбинации низких доз росиглитазона (4 мг/сут) и метформина (1000 мг/сут) снижало конверсию предиабета в диабет на 70%.
В исследованиях in vivo и in vitro на островковых клетках поджелудочной железы человека и грызунов установлено, что тиазолидиндионы оказывали стойкое защитное воздействие на функцию β-клеток [15].
В исследовании R.A. DeFronzo и соавт. с оценкой индекса диспозиции показано, что тиазолидиндионы достоверно улучшали функцию β-клеток у пациентов с СД 2 типа [18].
Улучшение функции β-клеток на фоне терапии тиазолидиндионами объясняется:
- активацией γ-рецепторов, активируемых пероксисомными пролифераторами (Peroxisome Proliferator-Activated Receptor – PPAR), увеличением экспрессии глюкозного транспортера 2, глюкокиназы и фактора транскрипции панкреатодуоденального гомеобокса 1;
- снижением внутриклеточных уровней токсичных липидных метаболитов;
- инсулин-сенсибилизирующим эффектом в мышцах и печени, снижающим инсулин и, следовательно, секрецию амилина (продукты разложения амилина токсичны для β-клеток, способность тиазолидиндионов защищать островковые клетки от амилиновой токсичности опосредуется через PI3-киназозависимый путь);
- коррекцией дефекта передачи сигналов инсулина через киназы IRS-1 и PI3-путь, что приводит к усилению секреции инсулина [8].
Пиоглитазон и атеросклеротические сердечно-сосудистые события
Молекулярная этиология инсулинорезистентности связана с развитием атеросклеротических сердечно-сосудистых заболеваний посредством ингибирования синтеза оксида азота (эндотелиальная дисфункция) и стимулирования сигнального пути митоген-активируемой протеинкиназы (Mitogen-Activated Protein Kinase – MAPK).
Инсулинорезистентные состояния, такие как СД 2 типа, ассоциируются с рядом нарушений со стороны факторов свертывания крови, включая повышенное содержание протромботического адипокина ингибитора активатора плазминогена 1 (Plasminogen Activator Inhibitor 1– PAI-1) и фибриногена, а также повышенную реактивность тромбоцитов, которые являются важными факторами риска возникновения сердечно-сосудистых заболеваний.
Ожирение, которое также представляет собой инсулинорезистентное состояние, – основной фактор, ответственный за современную эпидемию диабета, а также значимый фактор риска возникновения сердечно-сосудистых заболеваний. Отложение жира в стенках артерий вызывает воспаление, напрямую способствующее атерогенезу и эндотелиальной дисфункции, которая связана с ускоренным развитием атеросклероза и резистентностью к инсулину.
Избыточное накопление жира в адипоцитах провоцирует воспалительные процессы, усиливает секрецию провоспалительных и протромботических цитокинов (фактора некроза опухоли α, PAI-1, резистина), которые стимулируют атерогенез, усиливают инсулинорезистентность, а также подавляют секрецию антиатерогенного адипокина адипонектина. Измененная топография жира, особенно избыточное накопление висцерального жира, тесно связана с возникновением атеросклеротических сердечно-сосудистых заболеваний и инсулинорезистентностью. Тиазолидиндионы – единственные истинные инсулин-сенсибилизирующие антидиабетические препараты.
Установлено, что по меньшей мере один препарат этого класса – пиоглитазон снижает частоту развития сердечно-сосудистых осложнений и замедляет атеросклеротические процессы у пациентов с СД 2 типа и высоким сердечно-сосудистым риском [19].
Тиазолидиндионы обеспечивают небольшое, но стойкое снижение как систолического, так и диастолического артериального давления. Так, прием пиоглитазона в дополнение к глимепириду или метформину способствовал снижению артериального давления на 3–5 мм рт. ст. через 12 месяцев терапии.
Пиоглитазон продемонстрировал защитное действие при оценке различных биомаркеров атеросклероза и косвенных маркеров сердечно-сосудистых заболеваний. У пациентов с СД 2 типа ПИО снижал уровень циркулирующих провоспалительных медиаторов, включая C-реактивный белок, интерлейкин 6, фактор некроза опухолей CD40L, моноцитарный хемоаттрактантный белок 1 и матриксную металлопротеиназу 9. Пиоглитазон также ассоциировался с многократным повышением уровня адипонектина, оказывающего защитное воздействие на сосуды, а также со снижением протромботического состояния, свойственного для СД 2 типа, уменьшая экспрессию PAI-1.
Клиническая значимость приведенных данных подтверждается данными об улучшении функции эндотелия, уменьшении толщины комплекса «интима –медиа» сонных артерий и стеноза после постановки коронарных стентов у пациентов, получавших ПИО.
Кроме того, тиазолидиндионы могут улучшать системные уровни и функциональную активность ангиогенных эндотелиальных клеток-предшественниц, которые относятся к независимым прогностическим факторам сердечно-сосудистых событий и смерти [20, 21].
Большое количество данных свидетельствуют о выраженном защитном эффекте ПИО в отношении развития сердечно-сосудистых осложнений, связанных с коронарным или церебральным атеросклерозом. Уже в 2005 г. в исследовании PROactive была доказана роль пиоглитазона в снижении риска развития комбинированной конечной точки, включавшей смерть от всех причин, нефатальный инфаркт миокарда и нефатальный инсульт, на 16% у пациентов с СД 2 типа и высоким сердечно-сосудистым риском (ОР 0,84 при 95%-ном доверительном интервале (ДИ) 0,72–0,98). На сегодняшний день этот некогда недооцененный результат привлекает к себе все больше внимания, так как новые РКИ и крупные обсервационные программы подтверждают кардиопротективные эффекты ПИО в различных клинических ситуациях [22, 23].
В 2017 г. метаанализ девяти РКИ в отношении лиц с сердечно-сосудистыми заболеваниями и без них (n = 12 026) показал, что пиоглитазон снижал риск больших неблагоприятных сердечно-сосудистых событий (MACE) как у пациентов с предиабетом и инсулинорезистентностью, так и у пациентов с диабетом – на 23% (0,77 (ДИ 0,64–0,93)) и 17% (0,83 (ДИ 0,72–0,97)) соответственно. Полученные результаты были подтверждены данными метаанализа десяти РКИ у пациентов с установленным сердечно-сосудистым заболеванием (n = 10 095). В частности, прием ПИО ассоциировался со снижением риска наступления повторного MACE на 26% (0,94 (ДИ 0,69–0,92)). Проведенный в 2020 г. всеобъемлющий метаанализ 26 РКИ (n = 19 645), включавший результаты исследований TOSCA.IT, PPAR и PRIDE, в отношении популяции с диабетом и предиабетом, а также с факторами риска развития сердечно-сосудистых заболеваний подтвердил уменьшение риска достижения MACE на 20% (0,80 (ДИ 0,71–0,89)). Аналогичная тенденция наблюдалась для двух отдельных компонентов MACE, нефатального инфаркта миокарда и нефатального инсульта, – снижение риска на 20% (0,80 (ДИ 0,64–0,95)) и 19% (0,81 (ДИ 0,67–0,94)) соответственно. Кардиопротективные эффекты ПИО были подтверждены как у пациентов с предиабетом (0,8 (ДИ 0,6–0,9)), так и у больных диабетом (0,8 (ДИ 0,7–1,0)) [24]. Польза от применения пиоглитазона для вторичной профилактики была неизменно выше, чем для первичной. Однако групповые различия между пациентами с установленным сердечно-сосудистым заболеванием и без него не были статистически значимыми. Примечательно, что ингибиторы натрий-глюкозного котранспортера 2 (НГЛТ-2) и агонисты рецепторов ГПП-1, которые на сегодняшний день признаны в качестве предпочтительных методов терапии, так как воздействуют не только на течение диабета, но и на сердечно-сосудистый риск, показали сходный по величине эффект в отношении MACE. Для ингибиторов НГЛТ-2 указанный риск снизился на 14% (ОР 0,86), хотя у канаглифлозина и эртуглифлозина незначимо, для агонистов рецепторов ГПП-1 – на 16% (ОР от 0,74 до 0,88). Недавний всеобъемлющий зонтичный метаанализ еще раз подтвердил полученные ранее данные. Эффект в снижении MACE на фоне терапии ПИО оказался сопоставимым с эффектом, который отмечался при использовании новых и более дорогих как для пациента, так и для системы здравоохранения препаратов, совершивших не так давно революцию в лечении СД 2 типа.
При рациональном назначении и подборе правильной дозы пиоглитазон можно и нужно расценивать как экономически выгодный кардиопротективный препарат в арсенале эндокринолога [23].
Кардиопротективные эффекты пиоглитазона
Исследование PROactive
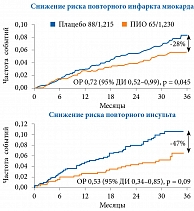
PROactive представляет собой крупномасштабное проспективное рандомизированное двойное слепое исследование вторичной профилактики макрососудистых осложнений на фоне применения ПИО у 5238 пациентов с СД 2 типа и сердечно-сосудистыми заболеваниями в анамнезе. Примерно 50% участников исследования перенесли инфаркт миокарда, 25% – инсульт, 25% страдали заболеванием периферических артерий. Терапию пиоглитазоном или плацебо проводили в дополнение к оптимальному стандартному лечению диабета, которое включало сахароснижающие, антигипертензивные, липид-снижающие и антитромботические препараты. При анализе первичной комбинированной конечной точки (смерть от всех причин, нефатальный инфаркт миокарда, острый коронарный синдром, инсульт, высокая ампутация нижней конечности и коронарная реваскуляризация или реваскуляризация нижней конечности) за три года наблюдения в группе ПИО зафиксировано статистически незначимое снижение риска ее наступления – на 10%. Однако в отношении риска достижения MACE (смерть от сердечно-сосудистых причин, нефатальный инфаркт миокарда и нефатальный инсульт) отмечено статистически значимое снижение – на 18% (ОР 0,82 (95% ДИ 0,70–0,97)) [25]. Более того, у пациентов с инфарктом миокарда в анамнезе пиоглитазон достоверно сокращал риск возникновения повторного инфаркта миокарда на 28% и острого коронарного синдрома на 38% [26]. У пациентов с инсультом в анамнезе ПИО уменьшал риск развития повторного инсульта на 47% [27]. У лиц с заболеванием периферических артерий в анамнезе наблюдалась более высокая частота наступления событий, относящихся к первичной конечной точке, основной вторичной конечной точке, смерти от всех причин (p < 0,0001 во всех случаях) и инсульта (p = 0,0175) по сравнению с пациентами без заболеваний периферических артерий в анамнезе. У пациентов с исходным заболеванием периферических артерий, относящихся к группе очень высокого сердечно-сосудистого риска, положительное влияние ПИО не выявлено. Необходимо отметить, что на общий результат исследования PROactive могло повлиять слишком большое количество пациентов с заболеванием периферических артерий, включенных в выборку для анализа. Метаанализ результатов исследования показал, что при исключении из анализа 1274 пациентов с исходным заболеванием периферических артерий частота возникновения событий, относящихся к первичной конечной точке, была значимо ниже среди получавших ПИО, чем среди принимавших плацебо (p = 0,01) (рис. 4) [25–27].
Исследование IRIS
Кардиопротективные свойства пиоглитазона могут объясняться как сахароснижающими, так и плейотропными эффектами, например улучшением липидного обмена.
Может ли пиоглитазон снизить риск развития последующих сердечно-сосудистых событий в популяции пациентов без диабета, оставалось неизвестным до получения результатов исследования IRIS.
Исследователи предположили, что пиоглитазон способен снизить частоту случаев повторного инсульта и инфаркта миокарда после перенесенного ишемического инсульта или транзиторной ишемической атаки у пациентов с предиабетом и инсулинорезистентностью.
Терапия, направленная на инсулинорезистентность, рассматривалась как обоснованное вмешательство, поскольку могла положительно повлиять на частоту сердечно-сосудистых событий и сердечно-сосудистые факторы риска вне зависимости от наличия или отсутствия нарушений углеводного обмена (рис. 5 и табл. 1).
IRIS – международное многоцентровое двойное слепое рандомизированное плацебоконтролируемое исследование, в котором приняло участие 3876 пациентов с инсулинорезистентностью, недавно (шесть месяцев и менее) перенесших инсульт или транзиторную ишемическую атаку. Больные были рандомизированы на группы ПИО или плацебо. Инсулинорезистентность определялась по гомеостатической модели для оценки инсулинорезистентности (Homeostasis Model Assessment of Insulin Resistance – HOMA-IR), HOMA-IR более 3,0. Первичная конечная точка представляла собой время до развития фатального или нефатального инсульта или инфаркта миокарда. Ко вторичным конечным точкам относились фатальный или нефатальный инсульт, развитие острого коронарного синдрома, СД 2 типа, когнитивной дисфункции, госпитализация по поводу сердечной недостаточности и смерть от всех причин.
Пациенты получали ПИО или плацебо в течение 4,8 года.
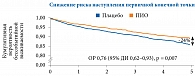
В группе ПИО по сравнению с группой плацебо наблюдалось достоверное снижение риска наступления первичной конечной точки (инсульта или инфаркта миокарда) на 24% (ОР 0,76 (95% ДИ 0,62–0,93); p = 0,007) [27–29].
Пациенты, получавшие терапию пиоглитазоном в исследовании IRIS, имели существенно меньший риск развития новых случаев СД 2 типа – 3,8 против 7,7% принимавших плацебо (ОР 0,48 (95% ДИ 0,33–0,69); p < 0,001) [30]. Пиоглитазон уменьшал значения глюкозы натощак, HOMA-IR, триглицеридов, увеличивал содержание липопротеинов высокой плотности (ЛПВП). Терапия пиоглитазоном также приводила к снижению систолического и диастолического артериального давления.
Важно отметить, что не было выявлено существенной разницы в частоте случаев развития сердечной недостаточности при приеме пиоглитазона и плацебо. Это может быть связано с тем, что из исследования IRIS исключали пациентов с сердечной недостаточностью в анамнезе, а также позволялось использовать сниженные дозы пиоглитазона при появлении отеков, одышки, слабости или увеличении массы тела. Средняя суточная доза пиоглитазона в течение года составляла от 29 до 40 мг [27–31].
Исследования CHICAGO и PERISCOPE
В двух дополнительных РКИ оценивалось влияние пиоглитазона на прогрессирование атеросклероза.
В исследовании CHICAGO анализировалась толщина комплекса «интима – медиа» сонной артерии – важного предиктора возникновения сердечно-сосудистых осложнений. У 462 пациентов с СД 2 типа и атеросклерозом ПИО в отличие от глимепирида замедлял утолщение комплекса «интима – медиа» сонных артерий в течение 18-месячного периода терапии. Этот эффект был сходным во всех подгруппах, выделенных на основании возраста, пола, систолического артериального давления, продолжительности сахарного диабета, индекса массы тела, уровня HbA1c и применения статинов [32].
В исследовании PERISCOPE оценивалось изменение процентного объема атеросклеротической бляшки у 360 пациентов с СД 2 типа и ишемической болезнью сердца, получавших терапию либо ПИО, либо глимепиридом. Для этого использовали внутрисосудистое ультразвуковое исследование. В группе пиоглитазона зафиксирована значимо более низкая скорость прогрессирования коронарного атеросклероза [33].
Влияние пиоглитазона на микроальбуминурию и сердечно-сосудистые исходы при хронической болезни почек
Роль пиоглитазона в снижении микроальбуминурии и риска сердечно-сосудистых исходов у пациентов с СД 2 типа и хронической болезнью почек (ХБП) оценивалась в исследованиях QUARTET. Так, ПИО способствовал устойчивому снижению микроальбуминурии, оцениваемой по соотношению альбумина и креатинина. Данного эффекта не наблюдалось при использовании МЕТ или ПСМ.
Известно, что у пациентов с СД и ХБП особенно высок риск развития сердечно-сосудистых осложнений.
Эффект ПИО по сравнению с эффектом плацебо у пациентов с ХБП (расчетная скорость клубочковой фильтрации < 60 мл/мин/1,73 м2) определяли и в ходе ретроспективного анализа результатов исследования PROactive. ХБП диагностирована у 597 (12%) пациентов из 5154 принимавших участие в исследовании PROactive, в отношении которых имелись данные о скорости клубочковой фильтрации. В группе с ХБП достижение первичной комбинированной конечной точки регистрировалось чаще, чем в группе без ХБП, – 27,5 против 19,6% случаев соответственно (p < 0,0001). У пациентов с ХБП также наблюдалась более высокая вероятность достижения основной вторичной комбинированной конечной точки (смертность от всех причин, инфаркт миокарда или инсульт). Однако у пациентов с ХБП, получавших ПИО, вероятность достижения основной вторичной комбинированной конечной точки была меньше (ОР 0,66 (95% ДИ 0,45–0,98)), но такой связи не наблюдалось у пациентов с лучшей функцией почек [34].
В ходе ретроспективного анализа выборки, состоявшей из 5290 пациентов с СД, недавно переведенных на гемодиализ, в группе тиазолидиндионов установлено снижение риска смерти от всех причин на 35% (ОР 0,65 (95% ДИ 0,48–0,87)). Уменьшение риска смерти от всех причин было еще более выраженным (-47%) среди пациентов, которые получали тиазолидиндионы без инсулина (0,53 (ДИ 0,31–0,89); p < 0,02). Защитный эффект не наблюдался у пациентов, получавших как тиазолидиндионы, так и инсулин (0,82 (ДИ 0,43–1,55)).
Несмотря на положительные результаты у пациентов с ХБП и терминальной стадией почечной недостаточности, а также отсутствие риска развития гипогликемий, ПИО с осторожностью следует применять при ХБП четвертой и пятой стадий в связи с риском задержки воды и натрия (Na), а также развития сердечной недостаточности [34, 35].
Безопасность пиоглитазона
Применение пиоглитазона в клинической практике ограниченно из-за риска возникновения дозозависимых нежелательных явлений, включая увеличение массы тела и появление периферических отеков.
В исследовании PROactive масса тела в среднем увеличилась на 3,6 кг. Однако, согласно результатам ретроспективного анализа данных исследования PROactive, именно повышение массы тела, а не ее снижение было сопряжено с улучшением выживаемости среди пациентов, получавших пиоглитазон [36]. Несмотря на то что в некоторых случаях увеличение массы тела может представлять существенную проблему, результаты недавно проведенного крупного наблюдательного исследования показали, что увеличение массы тела лишь в редких случаях является причиной отмены терапии ПИО (у 118 (менее 1%) пациентов из 12 772) [37, 38].
Отеки отмечались примерно у 5% больных, получавших пиоглитазон в виде монотерапии или в составе пероральной комбинированной терапии, и 10% пациентов, принимавших тиазолидиндионы в комбинации с инсулином. Известно, что частота возникновения отеков может быть несколько выше у пациентов с противопоказаниями к применению пиоглитазона. Однако в недавно проведенном крупном наблюдательном исследовании было показано, что отеки в редких (121 (менее 1%) из 12 772) случаях стали причиной отмены терапии ПИО [38].
В исследовании PROactive 5,7 и 4,1% пациентов, получавших пиоглитазон и плацебо соответственно, были госпитализированы по поводу застойной сердечной недостаточности [39]. Тем не менее показатели смертности вследствие застойной сердечной недостаточности не увеличились – 0,96 и 0,84%. Кроме того, среди пациентов с тяжелой застойной сердечной недостаточностью частота развития комбинированной конечной точки, включавшей смерть, инфаркт миокарда или инсульт, была достоверно меньше в группе пиоглитазона, чем в группе плацебо, – 34,9 и 47,2% (ОР 0,64 (95% ДИ 0,436–0,946); p = 0,025). После госпитализации по поводу сердечной недостаточности не было отмечено разницы между группами в среднем количестве дней, проведенных в стационаре, – 11 в обеих группах (p = 0,682), а также в среднем количестве дней, проведенных в отделении интенсивной терапии, – четыре в группе ПИО и три в группе плацебо (p = 0,584).
Механизм, ответственный за развитие таких осложнений, как отек и застойная сердечная недостаточность, вероятно, включает задержку жидкости и увеличение объема циркулирующей крови.
В исследованиях, выполненных на животных моделях, установлено, что вызываемая пиоглитазоном активация PPAR-γ в дистальных отделах нефронов увеличивает реабсорбцию натрия через Na+-каналы эпителия. Развитию отека также способствуют усиленная вазодилатация, так как пиоглитазон может ингибировать кальциевые каналы L-типа, и повышение проницаемости капилляров [37].
В исследовании PROactive было выявлено не имеющее статистической значимости увеличение числа пациентов (16 в группе пиоглитазона и 6 в группе плацебо; p = 0,069), у которых развился рак мочевого пузыря [22]. До раскрытия слепой схемы сторонние эксперты пришли к заключению, что 11 случаев не могут быть связаны с терапией (из-за последовательности воздействия лекарственного препарата и постановки диагноза «рак» во времени). Оставшиеся случаи между группами терапии были распределены следующим образом: шесть случаев в группе пиоглитазона и три случая в группе плацебо (p = 0,309). Следует отметить, что в группе пиоглитазона было зарегистрировано значимо меньшее количество случаев развития рака молочной железы – 3 против 11 (p = 0,034). Однако общая частота возникновения онкологических заболеваний была сходной между группами. Кроме того, после десяти лет последующего наблюдения частота возникновения новых случаев рака мочевого пузыря была аналогичной у получавших пиоглитазон и плацебо – 27 и 26 соответственно [40].
После получения результатов исследования PROactive эксперты FDA потребовали, чтобы производитель пиоглитазона инициировал проспективное исследование по оценке связи между приемом пиоглитазона и развитием рака мочевого пузыря.
Промежуточный анализ результатов десятилетнего исследования, включавшего 193 099 пациентов, не выявил значимой связи между терапией ПИО и возникновением рака мочевого пузыря (ОР 1,2 (95% ДИ 0,9–1,5)). При этом значение p было незначимым (НЗ). У получавших препарат по меньшей мере в течение двух лет указанный риск был немного выше (ОР 1,4 (95% ДИ 1,0–2,0)) [41]. Анализ чувствительности показал, что нейтральный эффект присутствовал независимо от дозы и продолжительности терапии (ОР 1,06 (95% ДИ 0,89–1,26); p = НЗ). В многонациональной когорте, включающей 1,01 млн пациентов с СД 2 типа, при более чем 5,9 млн пациенто-лет экспозиции ОР для развития рака мочевого пузыря при применении ПИО и РОСИ составляло 1,01 и 1,00 соответственно (p = НЗ в обоих случаях) [41].
Согласно недавно опубликованным результатам исследования IRIS, в группе пиоглитазона не было выявлено увеличения частоты возникновения рака мочевого пузыря – 0,6 против 0,4% в группе плацебо (p = 0,37) [28].
Несмотря на новые данные, эксперты FDA по-прежнему предупреждают о наличии риска развития рака мочевого пузыря и не рекомендуют использовать пиоглитазон у больных диабетом с активным раком мочевого пузыря или раком мочевого пузыря в анамнезе [42].
Эпидемиологические данные и данные клинических исследований указывают на то, что тиазолидиндионы увеличивают риск переломов костей, преимущественно у женщин пожилого возраста. Такой риск по величине сходен с риском, наблюдаемым при применении других часто используемых классов лекарственных препаратов [43]. Повышение частоты переломов прежде всего касается дистальных отделов верхних и нижних конечностей. По некоторым данным, также существует повышенный риск переломов бедра [43, 44].
При ретроспективном анализе нежелательных явлений, возникавших в ходе исследования PROactive, частота переломов костей была повышена на 5,1% у женщин, получавших пиоглитазон, и на 2,5% у женщин, получавших плацебо. Согласно проведенным расчетам, избыточный риск возникновения переломов среди пациенток, принимавших ПИО, составил 0,5 на 100 пациенто-лет терапии. У мужчин не наблюдалось увеличения частоты переломов. Переломы были зарегистрированы у 1,7% получавших пиоглитазон и 2,1% использовавших плацебо [45].
Метаанализ десяти РКИ с участием 13 715 пациентов, включая получавших РОСИ или ПИО, выявил общее повышение риска переломов при использовании тиазолидиндионов по сравнению с приемом плацебо или активного препарата сравнения (ОР 1,45 (95% ДИ 1,18–1,79); p < 0,001) [46].
Механизм, обусловливающий возникновение переломов костей в связи с использованием тиазолидиндионов, остается неясным. В качестве возможных причин указывают нарушение как формирования костной ткани, так и ее резорбции. Тиазолидиндионы оказывают влияние на дифференцировку мезенхимальных стволовых клеток, что приводит к усилению адипогенеза за счет снижения образования остеобластов [47]. Необходимо отметить, что в настоящее время не существует ограничения для использования тиазолидиндионов по причине риска переломов. Тем не менее считается целесообразным контроль плотности костной ткани у пациенток, получающих терапию тиазолидиндионами, и ограничение их применения при низкой плотности костной ткани [37].
Увеличения риска переломов на фоне терапии ингибиторами дипептидилпептидазы 4 (ДПП-4) не отмечено, поэтому при одновременном применении с пиоглитазоном дополнительного увеличения риска переломов не ожидается.
На основании результатов доклинических исследований на животных моделях было высказано предположение о возможном защитном влиянии ингибиторов ДПП-4 на костную ткань при одновременном применении с ПИО. Назначение вилдаглиптина крысам с СД 2 типа способствовало восстановлению плотности костной ткани, объема и толщины губчатой кости, то есть показателей, уменьшающихся при терапии пиоглитазоном. Большая часть нежелательных явлений, ассоциированных с применением пиоглитазона, приходится на переломы костей и, возможно, носит дозозависимый характер. Поэтому применение низких доз пиоглитазона в сочетании с ингибиторами ДПП-4 может быть дополнительным преимуществом в отношении снижения риска указанного побочного эффекта [48].
Польза и риски, связанные с терапией пиоглитазоном, представлены в табл. 2 [49].
Инкретин-направленная терапия
На инкретиновый эффект приходится практически 70% всей секреции инсулина, выделяемого после приема пищи или во время проведения перорального глюкозотолерантного теста у лиц с нормальной толерантностью к глюкозе. При этом более 90% инкретинового эффекта реализуется с помощью ГПП-1 и ГИП. ГПП-1 секретируется из L-клеток в дистальных отделах тонкой и толстой кишки в ответ на смешанную пищу (глюкоза или жир). Циркулирующие концентрации ГПП-1 повышаются в течение нескольких минут после приема пищи. Поступление пищи в проксимальный отдел желудочно-кишечного тракта инициирует нейрональные сигналы, которые и стимулируют секрецию ГПП-1.
ГПП-1 обеспечивает нормальный гомеостаз глюкозы через повышение секреции инсулина, подавление секреции глюкагона, задержку опорожнения желудка и снижение чувства голода [50–52].
ГИП секретируется К-клетками слизистой оболочки тонкой кишки также в ответ на прием пищи. Однако данный инкретин в отличие от ГПП-1 не ингибирует секрецию глюкагона, не замедляет опорожнение желудка, не снижает количество потребляемой пищи и не способствует потере веса.
Как ГПП-1, так и ГИП быстро действуют в ответ на прием пищи. Столь же быстро они разрушаются под действием ДПП-4, которая присутствует в плазме крови и на всех клеточных мембранах. Период полураспада секретируемых ГПП-1 и ГИП составляет две-три минуты [53].
По мере прогрессирования нарушений углеводного обмена (предиабета в СД 2 типа) секреция ГПП-1 снижается и возникает устойчивость β-клеток к глюкозозависимому стимулирующему эффекту ГПП-1 и ГИП на секрецию инсулина. При СД 2 типа вклад инкретиновых гормонов в инсулиновый ответ может снижаться до 36%.
С терапевтической точки зрения уровень циркулирующего ГПП-1 можно повысить благодаря введению аналога ГПП-1, устойчивого к разрушению ДПП-4, или ингибитора ДПП-4 [54–59].
Установлено, что инсулинотропное действие ГПП-1 зависит от уровня глюкозы. Для того чтобы ГПП-1 усилил секрецию инсулина, концентрация глюкозы в плазме должна быть более 5,0 ммоль/л. В отличие от ГПП-1 производные сульфонилмочевины стимулируют секрецию инсулина независимо от концентрации глюкозы в крови. В клинических условиях это приводит к повышению риска развития гипогликемий. ГПП-1 не вызывает значительной гипогликемии [60–64].
В дополнение к прямой стимуляции секреции инсулина ГПП-1 активирует транскрипцию генов, связанных с биосинтезом инсулина, тем самым восстанавливая запасы инсулина в β-клетках для последующего высвобождения. Поэтому особый интерес могут представлять результаты исследований на животных, свидетельствующих, что ГПП-1 стимулирует неогенез островков, усиливает репликацию, подавляет апоптоз и вызывает увеличение массы β-клеток [50].
Еще один важный эффект ГПП-1 отмечен в отношении уровня глюкагона. Уже более 30 лет назад установлено, что уровень глюкагона в плазме крови натощак повышен при СД 2 типа и что его секреция не подавляется соразмерно принятой углеводной или смешанной пищи, даже может повышаться [65–67]. Это отклонение проявляется еще до постановки диагноза «диабет» и наблюдается у лиц с предиабетом. Гиперглюкагонемия в состоянии голодания приводит к избыточной продукции глюкозы печенью (глюконеогенезу) и повышению уровня глюкозы плазмы натощак, а нарушение подавления уровня глюкагона в плазме после приема пищи – к постпрандиальной гипергликемии.
Главная физиологическая роль глюкагона заключается в противодействии действию инсулина и повышении продукции глюкозы печени для защиты от гипогликемии и восстановления нормогликемии.
ГПП-1 подавляет неадекватную гиперсекрецию глюкагона после приема пищи непосредственно через собственные рецепторы на α-клетках, опосредованно через стимуляцию секреции инсулина. Абсолютный вклад каждого компонента еще обсуждается. Этот глюкозозависимый ингибирующий эффект ГПП-1 на секрецию глюкагона снижает продукцию глюкозы в печени и уменьшает постпрандиальный уровень глюкозы в плазме [68–73].
Поскольку период полураспада ГПП-1 чрезвычайно короткий, его применение в лечении пациентов с СД 2 типа нецелесообразно. Как было отмечено ранее, для преодоления деградации ГПП-1 под действием ДПП-4 разработаны два подхода [74]:
- изменение пептидной структуры ГПП-1, чтобы обеспечить активацию рецептора ГПП-1;
- применение ингибиторов ДПП-4, чтобы увеличить содержание ГПП-1 в тканях до нормальных физиологических уровней.
Алоглиптин
Ингибитор ДПП-4 алоглиптин (АЛО) (Випидия®) одобрен во многих странах мира, включая США и Европейский союз, для лечения СД 2 типа. Доступны также и широко применяются комбинации фиксированных доз алоглиптина с метформином (Випдомет®) и алоглиптина с пиоглитазоном (Инкресинк®) [75]. Клинические исследования продемонстрировали улучшение гликемического контроля и функции β-клеток островков Лангерганса, хорошую переносимость, а также отсутствие увеличения массы тела при использовании ингибиторов ДПП-4 [76].
Алоглиптин – высокоселективный ингибитор ДПП-4. Селективность алоглиптина по отношению к ДПП-4 в 10 тыс. раз выше, чем к другим типам ДПП. Это наибольший показатель среди других представителей данного класса. Терапевтические дозы алоглиптина ингибируют ДПП-4 плазмы более чем на 80% с сохранением эффекта в течение 24 часов. При этом концентрация ГПП-1 в плазме крови повышается в два-три раза [77].
Фармакокинетические параметры алоглиптина сходны у здоровых лиц и пациентов с СД 2 типа.
Биодоступность алоглиптина составляет 100%, не изменяясь после приема жирной пищи. Именно поэтому препарат можно назначать без учета приема пищи.
Алоглиптин хорошо распределяется в тканях и достигает пиковых концентраций в плазме крови через один-два часа после приема.
Средний конечный период полураспада составляет примерно 21 час. Алоглиптин только на 20% связывается с белками в плазме крови.
Препарат не подвергается интенсивному метаболизму, большая часть (60–71%) дозы выводится из организма с мочой в неизмененном виде. Алоглиптин выпускается в дозах 6,25, 12,5 и 25 мг.
Для пациентов с нормальной функцией почек или легкой почечной недостаточностью (скорость клубочковой фильтрации более 50 мл/мин/1,73 м2) рекомендована доза 25 мг/сут. Для пациентов с умеренным или тяжелым нарушением функции почек или терминальной стадией ХБП необходима коррекция дозы. Так, при скорости клубочковой фильтрации более 30 мл/мин/1,73 м2, но менее 50 мл/мин/1,73 м2 показана доза 12,5 мг/сут, при скорости клубочковой фильтрации менее 30 мл/мин/1,73 м2 – 6,25 мг/сут [78].
Следует подчеркнуть, что АЛО в дозе 6,25 мг в России не зарегистрирован.
Исследование кардиобезопасности алоглиптина и возможности кардиопротекции
В исследовании EXAMINE оценивалось влияние АЛО, принимаемого в дополнение к стандартной терапии СД 2 типа, за исключением ингибиторов ДПП-4 и агонистов рецепторов ГПП-1, на сердечно-сосудистые исходы у 5380 пациентов, недавно перенесших острый коронарный синдром. Частота достижения MACE (сердечно-сосудистая смерть, нефатальный инфаркт миокарда или нефатальный инсульт) оказалась сходной между группами алоглиптина и плацебо – 11,3 и 11,8% случаев соответственно (ОР 0,96). Верхняя граница одностороннего повторно выбранного ДИ 1,16 (p < 0,001) для non-inferiority.
Вторичные и post hoc-анализы результатов исследования EXAMINE подтвердили эти выводы, продемонстрировав отсутствие значимых различий между пациентами, получавшими АЛО и плацебо, по пятикомпонентным комбинированным конечным сердечно-сосудистым точкам (сердечно-сосудистая смерть, инсульт, инфаркт миокарда, нестабильная стенокардия и коронарная реваскуляризация (p = 0,72)), госпитализациям по поводу сердечно-сосудистых заболеваний (p = 0,70) и смертности от всех причин (ОР 0,88 (95% ДИ 0,71–1,09)).
В другом субанализе показатели сердечно-сосудистой смертности (p = 0,01) и смертности от всех причин (p = 0,033) были достоверно ниже в группе АЛО по сравнению с группой плацебо у пациентов, получавших либо МЕТ, либо ПСМ [78–81].
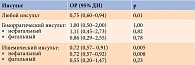
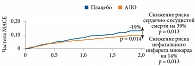
В 2020 г. J.P. Ferreira и соавт. при проведении субанализа результатов исследования EXAMINE в подгруппе пациентов со скоростью клубочковой фильтрации 60 мл/мин/1,73 м2 и более отметили статистически значимое снижение риска MACE (сердечно-сосудистая смерть, нефатальный инсульт и нефатальный инфаркт миокарда) на 19% (ОР 0,81 (95% ДИ 0,65–0,99); р = 0,014) в группе АЛО по сравнению с группой плацебо (рис. 6) [82].
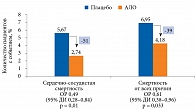
В другом субанализе результатов исследования EXAMINE, проведенном W.B. White и соавт. в 2018 г., сравнивались эффективность и безопасность добавления АЛО и плацебо к двум ПССП (МЕТ и ПСМ). Добавление алоглиптина привело не только к дополнительному снижению уровня HbA1c на 0,5%, но и к достоверному снижению риска сердечно-сосудистой смерти и смерти от всех причин на 51% (ОР 0,49 (ДИ 95% 0,28–0,84); p = 0,01) и 39% (0,61 (95% ДИ 0,38–0,96); p = 0,033) соответственно (рис. 7) [83].
Изучение эффективности алоглиптина
Алоглиптин изучался как в монотерапии, так и в комбинации с другими сахароснижающими препаратами у больных СД 2 типа с уровнем HbA1c от 7 до 10%.
Суммарно в двойные слепые плацебоконтролируемые клинические исследования фаз II и III, включая исследование EXAMINE, проведенные для оценки гликемического контроля и безопасности АЛО, было включено 14 779 пациентов с СД 2 типа [84].
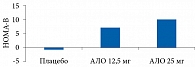
В рандомизированном двойном слепом плацебоконтролируемом исследовании фазы III R.A. DeFronzo и соавт. распределили 329 пациентов с СД 2 типа и неадекватным гликемическим контролем (средний исходный уровень HbA1c – 7,9%) на группы терапии 12,5 мг алоглиптина (n = 133), 25 мг алоглиптина (n = 131) или плацебо (n = 65) [85]. Режим применения препаратов был следующим: один раз в день в течение 26 недель. Средний уровень HbA1c достоверно снизился при приеме 12,5 мг (-0,56%; p = 0,001) или 25 мг (-0,59%; p = 0,001) алоглиптина по сравнению с применением плацебо (-0,02%). Снижение глюкозы плазмы натощак было достоверно более значимым при использовании алоглиптина (p = 0,001). Монотерапия алоглиптином сопровождалась улучшением функции β-клеток, о чем свидетельствовало повышение индекса HOMA-В (рис. 8 и табл. 3).
Новая фиксированная комбинация алоглиптина и пиоглитазона – препарат Инкресинк
Из восьми патофизиологических нарушений при СД 2 типа комбинация алоглиптина и пиоглитазона улучшает как минимум шесть (рис. 9) [7–9, 86, 87]:
- усиливает действие инкретинов;
- повышает секрецию инсулина;
- снижает секрецию глюкагона;
- увеличивает поглощение глюкозы мышцами;
- снижает избыточную секрецию глюкозы печенью;
- снижает липолиз и уровень свободных жирных кислот и триглицеридов в плазме крови.
Алоглиптин эффективно повышает уровень ГПП-1, что приводит к улучшению функции β-клеток с увеличением секреции инсулина и снижением уровня глюкагона в плазме. Пиоглитазон – мощный сенсибилизатор инсулина, который воздействует на мышцы и адипоциты в периферических тканях, а также на печень.
Алоглиптин совместно с пиоглитазоном оказывает аддитивный эффект, улучшая показатели HbA1c и снижая уровень глюкозы плазмы крови [7–9, 86, 87].
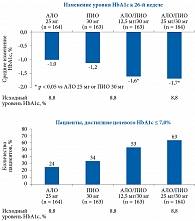
В исследовании J. Rosenstock и соавт. у 655 пациентов без предшествующей сахароснижающей терапии (средний исходный уровень HbA1c – 8,8%), рандомизированных для получения АЛО 25 мг, ПИО 30 мг, АЛО 12,5 мг с ПИО 30 мг или АЛО 25 мг с ПИО 30 мг, совместное назначение алоглиптина 25 мг и пиоглитазона 30 мг привело к статистически достоверному снижению уровня HbA1c относительно исходного уровня и уровней, достигнутых в группах монотерапии [88]. Назначение комбинации алоглиптина 25 мг и пиоглитазона 30 мг через 26 недель способствовало снижению уровня HbA1c в среднем на 1,7%. Применение указанной комбинации также позволило большему числу пациентов достичь целевых значений HbA1c (рис. 10).
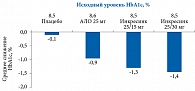
На фоне фиксированной комбинации Инкресинк® 63% пациентов достигли уровня HbA1c менее 7%. При этом у пациентов с исходным уровнем HbA1c более 8,5% на фоне комбинации АЛО и ПИО среднее снижение показателя составило 2,1%.
Ожидаемо комбинация препаратов обеспечивала более выраженное улучшение гликемического контроля, чем монотерапия пиоглитазоном и алоглиптином. При этом в целом переносимость и монотерапии, и комбинированной терапии была хорошей [88, 89].
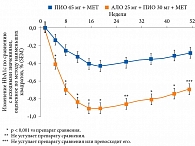
Другое РКИ, проведенное E. Bosi и соавт., включало пациентов с СД 2 типа, уже получавших метформин и пиоглитазон [90]. Участников исследования рандомизировали в группу АЛО или ПИО 45 мг. Продолжительность наблюдения составила 52 недели. Добавление в схему лечения алоглиптина по сравнению с увеличением дозы пиоглитазона до 45 мг способствовало более выраженному снижению уровня HbA1c – 0,70 и 0,29% соответственно. Через 52 недели закономерно большее число пациентов из группы АЛО достигли целевого уровня HbA1c (рис. 11).
И наконец, самым большим РКИ было исследование R.A. DeFronzo и соавт. [91]. В нем приняли участие 1554 пациента с СД 2 типа, находившихся на монотерапии МЕТ. Исходный уровень HbA1c в данной популяции составлял от 7,5 до 10%. К исходной терапии метформином добавляли пиоглитазон в разных дозах, алоглиптин или комбинацию алоглиптина и пиоглитазона. При назначении комбинации алоглиптина 25 мг и пиоглитазона 30 мг снижение уровня HbA1c было более выраженным, чем при использовании пиоглитазона в разных дозах или алоглиптина. Так, в данной группе значения HbA1c в среднем уменьшились на 1,4%.
В исследовании также оценивалась функция β-клеток по соотношению «проинсулин/инсулин» и индексу HOMA-В. Назначение комбинации АЛО и ПИО сопровождалось статистически значимо более выраженным улучшением показателей функции β-клеток по сравнению с монотерапией ПИО. Следует отметить, что комбинация АЛО и ПИО характеризовалась хорошей переносимостью. Частота нежелательных явлений была сходной между группами монотерапии пиоглитазоном и комбинированной терапии алоглиптином и пиоглитазоном [91] (рис. 12).
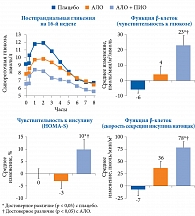
В двойном слепом плацебоконтролируемом исследовании D.H. Van Raalte и соавт. было продемонстрировано, что комбинированная терапия АЛО и ПИО достоверно улучшала функции β-клеток (p < 0,001 по сравнению с плацебо), а также секрецию инсулина натощак (р = 0,001 по сравнению с плацебо) [92]. На фоне монотерапии АЛО также отмечалось улучшение функции β-клеток, но менее выраженное. За 16 недель наблюдения комбинированная терапия АЛО и ПИО привела к снижению уровня HbA1c на 0,9% по сравнению с исходным уровнем (6,7 ± 0,1%), монотерапия АЛО – на 0,4% (р < 0,001). Динамика снижения уровня глюкозы в плазме крови натощак также была более выраженной в группе комбинированной терапии (р < 0,001).
В данном исследовании впервые было продемонстрировано, что комбинированная терапия алоглиптином и пиоглитазоном улучшает функцию островковых клеток по сравнению с монотерапией алоглиптином или плацебо у пациентов с неосложненным СД 2 типа и с гликемией чуть выше целевого значения при приеме одного ПССП. Чувствительность к инсулину улучшалась сильнее в группе комбинированной терапии алоглиптином и пиоглитазоном (рис. 13). Комбинированная терапия также характеризовалась благоприятным профилем переносимости без увеличения числа нежелательных явлений [92].
Таким образом, благодаря одновременному устранению множественных дефектов СД 2 типа комбинированная терапия препаратом Инкресинк® позволит устойчиво и безопасно контролировать гликемию в отличие от монотерапии.
Заключение
Комбинация АЛО и ПИО (препарат Инкресинк®) устраняет многочисленные метаболические дефекты, ассоциированные с развитием СД 2 типа. Что касается дефекта на уровне β-клеток, то ПИО снижает липотоксичность и оказывает прямое воздействие через PPAR-γ, увеличивая секрецию инсулина и облегчая работу β-клеток, АЛО улучшает функцию β-клеток, увеличивая секрецию инсулина и снижая секрецию глюкагона в ответ на повышенный уровень глюкозы в плазме крови. Комбинация алоглиптина и пиоглитазона обеспечивает аддитивный эффект в отношении снижения уровня HbA1c и глюкозы плазмы натощак. При этом риск развития гипогликемий сходен с таковым при приеме плацебо. Монотерапия алоглиптином не влияет на массу тела, тогда как комбинированная терапия алоглиптином и пиоглитазоном ассоциируется с прибавкой веса на 1–3 кг в течение первого года. Ослабить этот нежелательный эффект может соблюдение диеты.
Комбинированная терапия препаратом Инкресинк® также снижает уровень высокочувствительного C-реактивного белка и повышает уровень адипонектина.
Комбинация АЛО и ПИО устраняет инсулинорезистентность и улучшает функцию островковых клеток у пациентов с СД 2 типа, обладает благоприятным профилем безопасности, обеспечивает стойкое и продолжительное снижение уровня HbA1c с крайне низким риском развития гипогликемий.
К преимуществам комбинации АЛО и ПИО следует отнести комплаентный режим приема – один раз в день.
Фиксированная комбинация алоглиптина и пиоглитазона может помочь обратить вспять прогрессирование патофизиологических процессов при СД благодаря мультимодальному механизму действия. С учетом нарративной тенденции в управлении СД 2 типа крайне важно не только принимать во внимание существование подобного комбинированного подхода, но и внедрять его в повседневную клиническую практику.
A.M. Mkrtumyan, MD, PhD, Prof., Head of Endocrin and Metabolic Disorders Department of MCRC named after A.S. Loginov, Ya.A. Belolipetsky
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Scientific and Practical Center
JSC ‘Nizhpharm’ (STADA Arzneimittel AG), Moscow
Contact person: Ashot M. Mkrtumyan, vagrashot@mail.ru
Type 2 diabetes mellitus (DM) is the chronic progressive violation of carbohydrate metabolism, the prevalence of which is rapidly increasing. Patients with diabetes type 2 have a two – to four-fold increase in the likelihood of developing cardiovascular complications compared to patients without diabetes type 2. Most of these patients have insulin resistance and concomitant metabolic disorders, which in themselves belong to cardiovascular risk factors.
The increased risk of cardiovascular complications is mainly due to lipid metabolism disorders, arterial hypertension, chronic intravascular inflammation and proatherothrombotic condition. The contribution of hyperglycemia is definitely less. At the same time, it differs in patients with different types of diabetes mellitus.
It is known that over time, glycemic control against the background of monotherapy with oral hypoglycemic drugs is gradually lost, which encourages the use of combination therapy and ‘new’ antidiabetic agents, which, unfortunately, may not be available or unacceptable for some patients. However, for a number of reasons, the intensification of therapy is often delayed by several years, which can lead to irreversible consequences.
Today, it is becoming extremely important to intentionally avoid clinical inertia, to start using fixed combinations of two hypoglycemic drugs with a complementary mechanism of action and a favorable safety profile as early as possible, as well as focus on slowing the progression of diabetes type 2 and preserving the function of beta cells.
Incretin-directed therapy using dipeptidyl peptidase 4 inhibitors or glucagon-like peptide 1 receptor agonists in combination with other hypoglycemic drugs, and metformin and/or pioglitazone, seems to be an attractive option for early intensification of treatment, which will delay the appointment of insulin.

