Терапия сопровождения и предупреждения нежелательных реакций у больных туберкулезом легких
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Нежелательные реакции изучали у 76 пациентов, принимавших Фосфоглив (основная группа), и 68 пациентов, получавших Эссенциале форте Н (группа сравнения). Все больные находились на режиме I химиотерапии.
Результаты. Через два месяца терапии в основной группе нежелательные реакции легкой степени (по международной шкале СТСАЕ) отмечались в 16 (21,1%) случаях (95%-ный доверительный интервал (ДИ) 12,5–31,9), средней степени – в восьми (10,5%) (95% ДИ 4,7–19,7), в группе сравнения – в 17 (25,0%) (95% ДИ 15,3–37,0) и 15 (22,1%) случаях (95% ДИ 12,9–33,7) соответственно. Кроме того, в группе сравнения у четырех (5,9%) пациентов (95% ДИ 1,6–14,4) отмечались тяжелые нарушения. Спустя четыре месяца лечения в основной группе нежелательные реакции легкой степени были зарегистрированы лишь у восьми пациентов, в группе сравнения – у 18 (26,4%) (95% ДИ 16,5–38,5), средней степени – у семи (10,3%) (95% ДИ 4,2–20,1). На фоне лечения как через два, так и через четыре месяца в группе сравнения состояние системы свободнорадикального окисления свидетельствовало о сохранявшейся высокой активности. В основной группе уже через два месяца соответствующие показатели нормализовались. В основной группе терапия оказалась более эффективной, чем в группе сравнения: спустя четыре месяца лечения полости распада сохранялись у 6,6 (95% ДИ 2,2–14,7) и 25% пациентов (95% ДИ 15,3–37,0) соответственно (p < 0,05).
Материал и методы. Нежелательные реакции изучали у 76 пациентов, принимавших Фосфоглив (основная группа), и 68 пациентов, получавших Эссенциале форте Н (группа сравнения). Все больные находились на режиме I химиотерапии.
Результаты. Через два месяца терапии в основной группе нежелательные реакции легкой степени (по международной шкале СТСАЕ) отмечались в 16 (21,1%) случаях (95%-ный доверительный интервал (ДИ) 12,5–31,9), средней степени – в восьми (10,5%) (95% ДИ 4,7–19,7), в группе сравнения – в 17 (25,0%) (95% ДИ 15,3–37,0) и 15 (22,1%) случаях (95% ДИ 12,9–33,7) соответственно. Кроме того, в группе сравнения у четырех (5,9%) пациентов (95% ДИ 1,6–14,4) отмечались тяжелые нарушения. Спустя четыре месяца лечения в основной группе нежелательные реакции легкой степени были зарегистрированы лишь у восьми пациентов, в группе сравнения – у 18 (26,4%) (95% ДИ 16,5–38,5), средней степени – у семи (10,3%) (95% ДИ 4,2–20,1). На фоне лечения как через два, так и через четыре месяца в группе сравнения состояние системы свободнорадикального окисления свидетельствовало о сохранявшейся высокой активности. В основной группе уже через два месяца соответствующие показатели нормализовались. В основной группе терапия оказалась более эффективной, чем в группе сравнения: спустя четыре месяца лечения полости распада сохранялись у 6,6 (95% ДИ 2,2–14,7) и 25% пациентов (95% ДИ 15,3–37,0) соответственно (p < 0,05).




Лечение туберкулеза легких представляет сложную задачу и в большинстве случаев зависит от переносимости химиотерапии. Развитие нежелательных реакций (НР) со стороны различных органов и систем неизбежно приводит к прерыванию или прекращению приема противотуберкулезных препаратов. Целесообразность терапии сопровождения, способной предупреждать развитие и снижать частоту и выраженность НР, на фоне химиотерапии не вызывает сомнений. НР часто наблюдаются со стороны органов желудочно-кишечного тракта, особенно печени [1–5].
Противотуберкулезные препараты, характеризующиеся более выраженной токсичностью, в той или иной степени вызывают поражение печени. При этом активация свободнорадикального окисления (СРО) служит главным пусковым патогенетическим механизмом, разрушающим мембраны клеток печени при возникновении НР на фоне противотуберкулезной терапии [6].
Для купирования гепатотоксического действия противотуберкулезных препаратов применяются различные лекарственные средства [2, 4, 5, 7, 8]. Однако, по нашему мнению, одним из наиболее перспективных средств, позволяющих предупредить развитие, а также снизить частоту и выраженность НР, является Фосфоглив – соединение фосфатидилхолина (ФХ) и тринатриевой соли глицирризиновой кислоты (ГК). Включение Фосфоглива в терапию сопровождения у больных туберкулезом наиболее оправданно, поскольку препарат обладает уникальным сочетанным действием и влияет на различные звенья цитотоксических и иммунопатологических состояний, что скорее всего связано в большей степени с его воздействием на свободнорадикальные процессы [9–12].
ФХ (действующее вещество фосфолипидов) – основной структурный элемент клеточных и внутриклеточных мембран, восстанавливающий их структуру и функции при повреждении и оказывающий цитопротективный эффект. ФХ ингибирует формирование соединительной ткани, снижая риск возникновения фиброза и цирроза печени.
ГК обладает иммуномодулирующим, противовоспалительным, гепатопротективным действием, а также антиоксидантной активностью, обусловленной ингибированием протеинкиназы С, усиливающей перекисное окисление липидов (ПОЛ) через фосфорилирование 5-липоксигеназы. Связываясь с прооксидантом простагландином E2, ГК инактивирует ферменты, инициирующие ПОЛ в клетках печени, и снижает уровень сывороточных трансаминаз. Ее антиоксидантные свойства объясняются особенностями химического строения молекулы – концевым расположением глюкуроновой кислоты в углеводной цепи молекулы гликозида [9, 13, 14].
Таким образом, Фосфоглив относится к препаратам, сочетающим в себе механизмы действия двух биологически активных природных соединений (ФХ и ГК) с мембранопротективным, противовоспалительным и антиоксидантным эффектами.
Цель исследования – оценить эффективность препарата Фосфоглив в схеме терапии сопровождения и предупреждения НР у больных с впервые выявленным туберкулезом легких с подтвержденной лекарственной чувствительностью микобактерий туберкулеза (МБТ).
Материал и методы исследования
Научное наблюдательное исследование проведено на базе ГБУ РО «Противотуберкулезный клинический диспансер» г. Ростова-на-Дону. В исследовании участвовали 144 пациента с впервые выявленным туберкулезом легких с сохраненной чувствительностью к противотуберкулезным препаратам. Всем пациентам назначали лечение по режиму I химиотерапии (интенсивная фаза), согласно приказу Минздрава России от 29 декабря 2014 г. № 951.
Больные были разделены на две группы – основную и группу сравнения. 76 пациентов основной группы получали Фосфоглив в качестве терапии сопровождения по две капсулы три раза в день в течение четырех месяцев. 68 пациентам группы сравнения назначали Эссенциале форте Н по две капсулы три раза в день.
Критериями исключения являлись возраст младше 18 лет, беременность, контакт с больными туберкулезом с подтвержденной лекарственной устойчивостью в анамнезе, установленная лекарственная устойчивость выделяемых МБТ, алкоголизм, наркомания в анамнезе, тяжелая сопутствующая патология, ВИЧ-инфекция.
Распределение по клиническим формам туберкулеза было следующим. Преобладал инфильтративный туберкулез – 52 (68,4%) пациента основной группы и 46 (67,7%) больных группы сравнения. Диссеминированный туберкулез зарегистрирован у 24 (31,6%) больных основной группы и 22 (32,3%) пациентов группы сравнения.
До начала лечения пациентам обеих групп проводили клиническое, инструментально-лабораторное обследование, включавшее биохимический анализ крови (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), гамма-глутамилтрансфераза (ГГТФ), общий билирубин, щелочная фосфатаза), лучевые методы (рентгенография, спиральная компьютерная томография органов грудной клетки), микробиологические методы (световая и люминесцентная микроскопия мазка мокроты, посев на среду Левенштейна – Йенсена и ВАСТЕС MGIT 960), молекулярно-генетические методы – TB-Биочип, оценку состояния системы СРО и антиоксидантной защиты (определение активности каталазы плазмы крови, каталазы эритроцитов, миелопероксидазы в нейтрофилах, интенсивность хемилюминесценции плазмы крови). Показатели контролировали спустя два и четыре месяца лечения. Мониторинг и оценку тяжести НР проводили по международной пятибалльной шкале СТСАЕ [15]. Данные представляли с учетом общепринятых рекомендаций [16]. Статистическую обработку полученных данных осуществляли с использованием программы Microsoft Office Excel 2010. Рассчитывали среднее значение исследуемых показателей – М для абсолютных величин и Р – для относительных, доверительный интервал (ДИ) для абсолютных и относительных показателей методом Клоппера – Пирсона. Уровень статистической значимости различий (р) для абсолютных и относительных величин определяли с помощью теста Манна – Уитни. Различия считались достоверными при р < 0,05.
Результаты и обсуждение
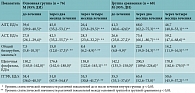
До начала лечения в основной группе общая слабость отмечалась у 63 (81,6%) пациентов (95% ДИ 71,0–89,6), снижение аппетита – у 45 (59,2%) (95% ДИ 47,3–70,4), в группе сравнения – у 56 (82,4%) (95% ДИ 71,2–90,5) и 37 (53,0%) больных (95% ДИ 40,5–65,2) соответственно. Дефицит массы тела зарегистрирован у 37 (48,6%) больных основной группы (95% ДИ 37,0–60,4) и 30 (44,1%) – группы сравнения (95% ДИ 32,1–56,7). Через два месяца лечения в обеих группах зафиксировано достоверное уменьшение общей слабости, а в основной группе – частоты снижения аппетита и дефицита массы тела. В обеих группах отмечались признаки гепатотоксических реакций. Восемь (10,5%) пациентов основной группы (98% ДИ 4,7–19,7) предъявляли жалобы на тошноту и боль в животе. В группе сравнения у 17 (25,0%) больных (95% ДИ 15,3–37,0) наблюдалась тошнота, у 14 (20,6%) (95% ДИ 11,7–32,1) – боль в животе, у шести (8,8%) – рвота (95% ДИ 3,3–18,2).
Через четыре месяца лечения в основной группе отмечалось значительное улучшение клинических симптомов. Общая слабость сохранялась лишь у шести (7,9%) пациентов (95% ДИ 3,0–16,4), дефицит массы тела – у трех (4,0%) (95% ДИ 0,82–11,1). Нарушения аппетита, тошнота, рвота, боль в животе не выявлены ни у одного пациента. В то же время в группе сравнения жалобы на слабость сохранялись у 17 (25,0%) больных (95% ДИ 15,3–37,0), снижение аппетита и массы тела отмечалось у 14 (20,6%) больных (95% ДИ 11,7–32,1). Имели место признаки гепатотоксических реакций: тошнота у 13 (19,1%) пациентов (95% ДИ 10,6–30,5), боль в животе – у четырех (5,9%) (95% ДИ 1,6–14,4), рвота – у трех (4,4%) больных (95% ДИ 0,9–12,4) (табл. 1).
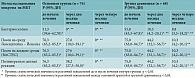
До начала лечения в обеих группах у большинства пациентов отмечались преимущественно нормальные показатели биохимического исследования крови. Незначительное повышение трансаминаз и щелочной фосфатазы у шести (7,9%) пациентов основной группы (95% ДИ 3,0–16,4) и четырех (5,9%) больных группы сравнения (95% ДИ 1,6–14,4) могло быть обусловлено влиянием на печеночную паренхиму туберкулезной интоксикации. Значения общего билирубина и ГГТФ находились в пределах нормы. Через два месяца лечения в основной группе наблюдалось незначительное повышение уровней АСТ, общего билирубина, щелочной фосфатазы, ГГТФ. В группе сравнения повышение аналогичных показателей было достоверно более значимым (табл. 2).
В основной группе НР легкой степени (по международной шкале СТСАЕ) на противотуберкулезные препараты зарегистрированы в 16 (21,1%) случаях (95% ДИ 12,5–31,9), средней степени – в восьми (10,5%) (95% ДИ 4,7–19,7). Выраженность побочных реакций не требовала отмены противотуберкулезной химиотерапии. В то же время в группе сравнения пациентов с НР на противотуберкулезные препараты было значительно больше: нарушения легкой степени выявлены в 17 (25,0%) случаях (95% ДИ 15,3–37,0), средней степени – в 15 (22,1%) (95% ДИ 12,9–33,7), тяжелые нарушения – в четырех (5,9%) (95% ДИ 1,6–14,4). В шести (8,8%) случаях (95% ДИ 3,3–18,2) потребовалась отмена противотуберкулезных препаратов для восстановления функции печени (табл. 3).
Через четыре месяца лечения в основной группе уровни печеночных трансаминаз, билирубина, щелочной фосфатазы и ГГТФ достоверно снизились, достигнув у большинства больных нормальных значений. НР легкой степени (незначительное повышение уровней АЛТ и АСТ) зарегистрированы лишь у восьми пациентов. В группе сравнения нарушения легкой степени сохранялись у 18 (26,4%) больных (95% ДИ 16,5–38,5), средней степени – у семи (10,3%) (95% ДИ 4,2–20,1). Тяжелые НР на противотуберкулезные препараты в обеих группах отсутствовали (табл. 2 и 3).
На фоне проводимого лечения как через два, так и через четыре месяца в группе сравнения состояние системы СРО и антиоксидантной защиты достоверно не изменилось. Интенсивность хемилюминесценции плазмы крови и активность миелопероксидазы оставались повышенными, что свидетельствовало о сохранявшейся высокой активности СРО. Активность каталазы в эритроцитах практически не изменилась, оставалась сниженной, что говорило о низком уровне антиоксидантной защиты. Повышенный уровень каталазы плазмы свидетельствовал о разрушении клеточных мембран (каталаза является внутриклеточным ферментом). Процесс прооксидации преобладал над антиоксидантным процессом, что приводило к повреждению мембран гепатоцитов и клинически проявлялось в более частом возникновении выраженных нежелательных гепатотоксических реакций. Для их купирования приходилось прерывать курс лечения. Как следствие – более медленное рассасывание инфильтрации и сохранение деструкции легочной ткани и бактериовыделения.
В основной группе на фоне проводимого лечения уже через два месяца отмечалось достоверное умеренное снижение интенсивности хемилюминесценции плазмы и активности миелопероксидазы, что свидетельствовало об уменьшении активности воспаления. Через четыре месяца показатели слегка превысили норму. Кроме того, отмечалась положительная динамика показателей антиоксидантной защиты: активность каталазы в эритроцитах возросла, а каталазы плазмы крови снизилась, что могло быть следствием уменьшения повреждающего действия активных форм кислорода и стабилизации клеточных мембран и клинически способствовало лучшей переносимости противотуберкулезной терапии, более быстрому закрытию полостей распада и абациллированию (табл. 4).
До начала лечения по выраженности инфильтрации, частоте деструкции и отсева сравниваемые группы достоверно не различались. Распространенный процесс с поражением более двух сегментов отмечался у большинства пациентов – 52 (68,4%) случая (95% ДИ 56,8–78,6) в основной группе и 49 (72,1%) (95% ДИ 59,9–82,3) в группе сравнения, распад легочной ткани – 56 (73,7%) (95% ДИ 62,3–83,1) и 51 (75,0%) случай (95% ДИ 63,0–84,7) соответственно. Через два месяца лечения частота деструкции в основной группе достоверно снизилась в 1,9 раза, признаки распада легочной ткани зафиксированы в 29 (38,2%) случаях (95% ДИ 27,3–50,0). В группе сравнения аналогичные показатели составили 1,4 раза (до 52,9%) (95% ДИ 40,5–65,2) и 36 случаев.
Через четыре месяца лечения в основной группе признаки мелкой деструкции определялись лишь у пяти (6,6%) пациентов (95% ДИ 2,2–14,7). В группе сравнения распад легочной ткани сохранялся у 17 (25,0%) больных (95% ДИ 15,3–37,0) (табл. 5).
До начала лечения бактериовыделение наблюдалось у 58 (76,3%) пациентов основной группы (95% ДИ 65,2–85,3) и 51 (75,0%) пациента группы сравнения (95% ДИ 63,0–84,7). Методом световой бактериоскопии МБТ выявлены у 39 (51,3%) пациентов основной группы (95% ДИ 39,6–62,7) и 38 (55,8%) больных группы сравнения (95% ДИ 43,3–67,9).
Через два месяца терапии выделение МБТ снизилось в обеих группах. В основной бактериовыделение, выявляемое посевом на жидкие и плотные питательные среды и молекулярно-генетическим методом, сохранялось у 29 (38,2%) пациентов (95% ДИ 27,3–50,0), в группе сравнения – у 30 (44,2%) больных (95% ДИ 32,1–56,7). У семи (10,3%) пациентов группы сравнения (95% ДИ 4,2–20,1) МБТ определялись в мазках.
Через четыре месяца лечения у всех пациентов основной группы зафиксировано полное прекращение бактериовыделения. У семи (10,3%) пациентов группы сравнения (95% ДИ 4,2–20,1) выделение МБТ сохранялось (табл. 6).
Таким образом, Фосфоглив положительно влияет на проявление двух ведущих синдромов лекарственного повреждения печени – цитолитического и холестатического, о чем свидетельствует снижение индикаторных печеночных ферментов.
Определение уровня показателей процессов СРО в организме позволяет раскрыть влияние Фосфоглива на ключевые механизмы повреждения печени в ходе терапии противотуберкулезными препаратами – окислительный стресс и воспаление и свидетельствует об антиоксидантном и противовоспалительном эффектах Фосфоглива, что сопровождается снижением НР со стороны печени (прежде всего с проявлениями цитолиза).
Выводы
Применение Фосфоглива в составе комплексной терапии больных активным туберкулезом легких способствует снижению частоты и выраженности нежелательных реакций и сохранению непрерывности курса лечения, что может быть связано с антиоксидантным, противовоспалительным и мембраностабилизирующим действием препарата.
Включение Фосфоглива в схему комплексной терапии больных инфильтративным туберкулезом легких способствует повышению эффективности лечения, о чем свидетельствуют показатели рассасывания инфильтрации, закрытия полостей распада, абациллирования.
L.A. Shovkun, MD, PhD, Prof., D.A. Kudlay, MD, PhD, Prof., N.Yu. Nikolenko, Ye.D. Campos, PhD, I.M. Franchuk
Rostov State Medical University
Institute of Immunology of FMBA of Russia
Moscow Сity Scientific and Practical Center for Tuberculosis Control of the Department of Health of Moscow
Contact person: Lyudmila A. Shovkun, lshovkun@mail.ru
Objective of the study – to evaluate the effectiveness of the use of the drug Phosphogliv for the accompanying and prevention therapy of adverse reactions in patients with newly diagnosed pulmonary tuberculosis with confirmed drug sensitivity to mycobacterium tuberculosis.
Material and methods. Adverse reactions were studied when Phosphogliv was prescribed in 76 patients and in the comparison group in 68 patients who received Essentiale forte N, all patients were on chemotherapy regimen I.
Results. After 2 months in the main group, mild adverse reactions (according to the international scale STSAE), had 16 (21.1%) patients (95% CI 12.5–31.9), moderate severity – 8 (10.5%) patients (95% CI 4.7–19.7); in the comparison group – mild – 17 (25.0%) patients (95% CI 15.3–37.0), moderate – 15 (22.1%) patients (95% CI 12.9–33.7), 4 (5.9%) patients (95% CI 1.6–14.4) had severe disorders. After 4 months of treatment in the main group, mild adverse reactions were detected only in 8 patients, in the comparison group – in 18 (26.4%) patients (95% CI 16.5–38.5), moderate degree – in 7 (10.3%) patients (95% CI 4.2–20.1). During treatment, both after 2 and 4 months, in the comparison group, the state of the free radical oxidation system indicated a continuing high activity. In the main group after 2 months the indicators returned to normal. In patients of the main group, higher efficacy of treatment of pulmonary tuberculosis was established compared with the comparison group: after 4 months of treatment, the cavities preserved in 6.6% (2.2–14.7) and 25.0% (15.3–37.0), respectively (p < 0.05).
