Тяжелый атопический синдром. Бронхиальная астма и атопический дерматит – две истории с одним главным героем. 15-й Международный междисциплинарный конгресс по аллергологии и иммунологии. Сателлитный симпозиум компании «Санофи»
- Аннотация
- Статья
- Ссылки







Почему нужно помнить о связи тяжелой бронхиальной астмы и атопического дерматита
Симпозиум открыла заместитель директора и главный врач ФГБУ «ГНЦ Институт иммунологии» ФМБА России, д.м.н., профессор Наталья Ивановна ИЛЬИНА. Она отметила, что в современной клинической практике группа пациентов с сочетанной патологией – наличием бронхиальной астмы (БА) и распространенного атопического дерматита (АтД) требует особого терапевтического подхода и высокой фармакологической нагрузки.
Благодаря успехам молекулярной и фундаментальной биологии, расшифровке патофизиологических механизмов ряда заболеваний возник новый термин «иммуноопосредованные воспалительные заболевания» (ИОВЗ). Под ИОВЗ понимают группу болезней, характеризующихся нарушением иммунной регуляции, формированием хронического воспаления и повреждением тканей. Выделяют заболевания, ассоциированные с Т-лимфоцитами – Т-хелперами первого типа (Th1) и Т-хелперами второго типа (Th2), и заболевания, связанные с другими воспалительными цитокинами. К заболеваниям, ассоциированным с Тh1, относят болезнь Крона, псориаз, сахарный диабет 1-го типа, саркоидоз, ревматоидный артрит, анкилозирующий спондилит, системную красную волчанку, гигантоклеточный артериит, увеит, к Тh2-ассоциированным заболеваниям – БА, аллергию, легочный фиброз, язвенный колит и т.д. В свою очередь с воспалительными цитокинами связывают развитие хронической обструктивной болезни легких, остеоартрита.
Как известно, острое воспаление – естественная реакция организма на внедрение патогена или аллергена, направленная на его элиминацию. Если по той или иной причине патоген не элиминируется, воспаление персистирует, организм перестает распознавать собственные белки. В этом случае развиваются хронические ИОВЗ, характеризующиеся гиперэкспрессией провоспалительных цитокинов. Характер нарушения цитокиновой регуляции может быть отличительным признаком отдельного патологического процесса.
Концепция развития ИОВЗ имеет огромное значение. Понимание, что внешне несвязанные заболевания могут иметь общую этиологию и молекулярно-клеточные механизмы, призвано кардинальным образом изменить стратегию терапии. В настоящее время появляются новые концепции в лечении ИОВЗ, основанные:
- на блокировании ключевых цитокинов;
- подавлении миграции или активации патогенетических Т-клеток и других иммунных клеток;
- изменении направления дифференцировки определенных субклонов Т-клеток с использованием моноклональных антител, рекомбинантных белков, олигонуклеотидов и других типов препаратов. Моноклональные антитела, связываясь со специфическими молекулярными мишенями, блокируют эффекторный белок или клеточный рецептор.
В основе производства биологических препаратов лежат биологические процессы. Препараты подразделяют на три типа:
- вещества, которые почти идентичны ключевым сигнальным белкам организма, например инсулин, эритропоэтин, гормоны роста;
- моноклональные антитела, сходные с антителами, которые используются собственной иммунной системой, однако их структура спланирована специально для того, чтобы имитировать или блокировать определенное вещество организма либо воздействовать на клетки определенного типа;
- рецепторы, имитирующие биологическую функцию существующих в организме рецепторов.
Говоря о фармакокинетике и фармакологических свойствах данных препаратов, следует отметить их высокую селективность и незначительное количество побочных эффектов. Опыт применения уже существующих и зарегистрированных моноклональных антител при аллергическом рините, БА и АтД свидетельствует о том, что при высокой эффективности они достаточно безопасны. Препарат дупилумаб – рекомбинантное моноклональное антитело, идентичное человеческому, блокирующее передачу сигналов интерлейкина (ИЛ) 4 и ИЛ-13 путем специфического связывания с альфа-субъединицей рецептора интерлейкина 4 (ИЛ-4Rα), общей для рецепторных комплексов ИЛ-4 и ИЛ-13.
В клинических исследованиях III фазы подтверждена высокая эффективность и безопасность препарата дупилумаб при БА и АтД у детей и взрослых.
Профессор Н.И. Ильина подчеркнула, что клинические исследования методов биологической терапии, в частности дупилумаба, при БА и АтД продолжаются. Но уже сегодня можно утверждать, что новые терапевтические опции дают возможность не только локально, но и системно воздействовать на аллергическое воспаление.
Прорыв в лечении атопического дерматита – долгосрочная эффективность и безопасность дупилумаба
По словам заведующей отделением аллергии и иммунопатологии кожи ФГБУ «ГНЦ Институт иммунологии» ФМБА России, д.м.н., профессора Елены Сергеевны ФЕДЕНКО, аллергическими заболеваниями страдают 30% населения планеты. Прежде всего это БА, заболевания кожи, в частности АтД, пищевая аллергия, анафилаксия, полипозный риносинусит1. В основе развития данных заболеваний лежит единый патофизиологический механизм, а именно Th2-опосредованное иммунное воспаление. Ключевую роль в Th2-воспалении играют цитокины ИЛ-4 и ИЛ-132.
Атопический дерматит – многофакторное заболевание, имеющее в своей основе генетическую предрасположенность к аллергическим заболеваниям, сложный иммунный механизм развития воспаления в органе-мишени – коже и характеризующееся типичными клиническими проявлениями в виде высыпаний, ксероза3.
АтД сопровождается сильнейшим кожным зудом. При тяжелых формах заболевания развивается вторичная инфекция – бактериальная, грибковая или вирусная. По данным мировой статистики, АтД страдают 15–30% детского населения, 2–10% – взрослого. 15% больных АтД – пациенты с очень тяжелым течением заболевания.
В зависимости от возраста выделяют несколько фенотипов АтД: младенческий (три месяца – два года), детский (2–12 лет), подростковый и взрослый (12 лет и старше). По степени тяжести АтД подразделяют на легкий, среднетяжелый, тяжелый и крайне тяжелый. Выделяют аллергический, неаллергический и аутоиммунный АтД. Он может быть ассоциирован с респираторными проявлениями, такими как аллергический ринит, БА, а также с пищевой аллергией.
Сегодня ни у кого не вызывает сомнений, что АтД – хроническое системное заболевание, развивающееся на фоне активации иммунной системы. У 46% больных АтД встречаются другие аллергические заболевания, в частности аллергический ринит и БА. Кроме того, пациенты с АтД нередко имеют сопутствующие заболевания других органов и систем (желудочно-кишечный тракт, сердечно-сосудистая система)4.
Инфекции у больных АтД часто приобретают распространенный характер и протекают тяжелее, чем у здоровых лиц. По данным американского исследования, у взрослых больных АтД повышен риск кожных, респираторных и системных инфекций5. При этом у пациентов с АтД нередко выявляются герпетическая инфекция, рожистое воспаление, вирус простого герпеса. Среди респираторных инфекций аспергиллез и туберкулез у больных АтД обнаруживаются чаще, чем в других популяциях. АтД ассоциирован с развитием полиорганных системных инфекций: энцефалита, эндокардита, инфекционной артропатии, метициллинрезистентного золотистого стафилококка и др. Риск развития кожных (импетиго, контагиозный моллюск, вирус простого герпеса, кожные бородавки) и системных (отит, пневмония, стрептококковая и стафилококковая инфекции) инфекций у больных АтД с сопутствующими аллергическим ринитом и БА почти в два раза выше, чем у пациентов без сопутствующих заболеваний.
Последние данные популяционных исследований свидетельствуют, что тяжелый АтД ассоциирован с постоянным риском развития сердечно-сосудистой патологии, в том числе инфаркта миокарда6.
Как известно, в патогенезе АтД ведущая роль принадлежит генетически детерминированному доминированию иммунного ответа по Th2-типу. При АтД CD4+ Т-лимфоциты в пораженных и непораженных участках кожи активно секретируют Th2-цитокины, влияющие на функцию эпидермального барьера и способствующие дисрегуляции иммунной системы. Как уже отмечалось, повышенная экспрессия цитокинов ИЛ-4 и ИЛ-13 в эпидермисе индуцирует развитие выраженного аллергического воспаления и основных симптомов АтД.
Сегодня рассматриваются три основные концепции терапии АтД:
- повышение устойчивости к воздействию специфических антигенов;
- подавление Th2-направленного иммунного ответа;
- воздействие на определенные мишени, участвующие в развитии воспаления.
Профессор Е.С. Феденко отметила, что XXI в. называют веком персонализированной медицины, главный принцип которой – лечить не болезнь, а больного. Таргетная терапия направлена на определенные иммунопатогенетические механизмы заболевания. Мишенями таргетной терапии являются патогенетические процессы, белки, молекулы, сигналы, установление которых стало возможным благодаря расширению знаний о молекулярных механизмах развития заболевания.
Первым в мире таргетным биологическим препаратом для лечения АтД стал дупилумаб – он был одобрен в США и Евросоюзе в 2017 г., а также зарегистрирован 4 апреля 2019 г. в России.
Дупилумаб (Дупиксент®) – рекомбинантное моноклональное антитело, идентичное человеческому, которое блокирует альфа-субъединицу рецептора ИЛ-4, общую для рецепторов ИЛ-4 и ИЛ-13. Как следствие – нарушается передача сигнала по пути JAK/STAT (Janus Kinase/Signal Transducer and Activator of Transcription) и приостанавливается экспрессия большинства генов, вовлеченных в патогенез АтД.
Препарат Дупиксент® вводится подкожно. Рекомендуемая доза у взрослых больных АтД: начальная доза – 600 мг (две инъекции по 300 мг), далее – 300 мг каждые две недели. В зависимости от индивидуального терапевтического ответа можно увеличить кратность применения до одного раза (300 мг) в неделю. Преимуществом препарата Дупиксент® является удобство применения. Раствор для подкожного введения помещен в шприц, готовый к использованию.
В настоящее время продолжается реализация программы клинических исследований фазы III использования препарата дупилумаб у детей и взрослых с АтД. Завершено исследование у детей с АтД в возрасте 12–18 лет. Идет набор пациентов в возрасте от шести месяцев до шести лет, 6–12 лет, от шести месяцев до 18 лет для участия в трех исследованиях. Исследования с участием взрослых пациентов со среднетяжелым и тяжелым АтД к настоящему моменту завершены.
Эффективность и безопасность препарата Дупиксент® у больных АтД оценивали в масштабном 52-недельном исследовании CHRONOS7. В него были включены 740 пациентов с неконтролируемым среднетяжелым и тяжелым АтД. Больные были рандомизированы на три группы. Пациенты первой группы получали плацебо один раз в неделю, пациенты второй – дупилумаб 300 мг один раз в две недели, третьей – дупилумаб 300 мг один раз в неделю. В ходе исследования пациентам всех групп разрешалось применять топические глюкокортикостероиды (ТГКС). Топические препараты средней активности наносили один раз в сутки на область активных изменений кожи, ТГКС низкой активности – на чувствительные участки. При достижении контроля симптомов АтД топические ГКС низкой активности рекомендовалось применять один раз в сутки в течение семи дней с последующей отменой. При усилении симптомов проводили экстренную терапию ТГКС высокой или сверхвысокой активности или системную терапию.
Исходно большинство пациентов, включенных в исследование CHRONOS, имели сопутствующие аллергические заболевания. Во всех группах 37–41% пациентов с АтД страдали БА. Кроме того, у пациентов встречались пищевая аллергия, аллергический ринит, аллергический риноконъюнктивит, крапивница, хронический риносинусит, полипы носа.
Результаты исследования продемонстрировали эффективность и безопасность терапии дупилумабом в сочетании с ТГКС. Зафиксировано значимое и стойкое увеличение частоты ответа на терапию дупилумабом по шкале IGA (Investigator’s Global Assessment). Через 16 недель лечения дупилумабом у больных АтД отмечалось полное или частичное очищение кожи. Эффект сохранялся в течение всего периода применения препарата (рис. 1).
Применение дупилумаба ассоциировалось с более частым достижением улучшения по шкале EASI (Eczema Assessment Severity Index) на 75% (EASI-75) к 16-й и 52-й неделе терапии. Показано стойкое увеличение частоты достижения показателей по шкале EASI на 50/75/90 в течение 52 недель терапии дупилумабом (рис. 2).
На фоне терапии дупилумабом зафиксировано уменьшение интенсивности кожного зуда по шкале NRS (Numeric Rating Scale) уже на второй неделе лечения. Начало терапевтического эффекта дупилумаба было быстрым, а положительная динамика сохранялась на протяжении всего периода наблюдения (рис. 3).
Отмечалось положительное влияние дупилумаба на восстановление эпидермального барьера на протяжении 16 недель. В течение 52 недель неотложная помощь потребовалась меньшему количеству пациентов, получавших дупилумаб, по сравнению с больными, принимавшими плацебо. Переносимость дупилумаба была хорошей, профиль безопасности, который оценивался за 52 недели, соответствовал профилю безопасности за 16-недельный период.
Таким образом, терапия дупилумабом у взрослых пациентов со среднетяжелым и тяжелым АтД способствовала быстрому и устойчивому снижению выраженности симптомов, а также существенному улучшению качества жизни. Через 16 недель равнозначные первичные конечные точки (оценка по шкале IGA (0,1) и показатель EASI-75) были достигнуты при использовании обоих режимов дозирования препарата. Зарегистрировано значимое уменьшение чувства зуда, а также симптомов тревожности и депрессии. Эффективность препарата сохранялась на протяжении 52-недельного периода лечения. Полученные данные свидетельствуют о высокой эффективности и хорошей переносимости дупилумаба у пациентов со среднетяжелым и тяжелым АтД.
Подводя итог, профессор Е.С. Феденко подчеркнула, что дупилумаб коренным образом изменил концепцию длительного контроля над АтД, открыл новую эру эффективной и безопасной таргетной терапии среднетяжелого и тяжелого дерматита и тяжелой БА.
Как помочь тяжелым пациентам с атопическим дерматитом в отсутствие ответа на иммунодепрессанты
Тему лечения пациентов с тяжелым течением АтД продолжила старший научный сотрудник отделения аллергологии и иммунопатологии кожи ФГБУ «ГНЦ Институт иммунологии» ФМБА России, к.м.н. Ольга Гурьевна ЕЛИСЮТИНА. По ее словам, последние годы наблюдается увеличение частоты развития тяжелых форм АтД, резистентных к стандартной терапии. Результаты эпидемиологических исследований показывают, что доля таких пациентов неуклонно растет, практически 50% больных АтД имеют среднетяжелое и тяжелое течение заболевания8, 9.
Атопический дерматит влияет на все сферы деятельности и качество жизни. Постоянная боль, зуд, нарушения сна, депрессивное состояние могут сопровождать пациентов на протяжении всей жизни. Сегодня принята концепция ступенчатого лечения АтД. Выбор терапии зависит от степени тяжести, продолжительности АтД и уже назначенной терапии.
Тяжелое течение АтД требует проведения системной терапии. Согласно консенсусным международным рекомендациям Европейской ассоциации дерматовенерологов, принятым в 2018 г., при тяжелом АтД показана системная иммуносупрессивная терапия: циклоспорин А, системные ГКС. На этой стадии лечения проводится также PUVA-терапия10. Рекомендовано также использование препаратов, не зарегистрированных в России. По данным французских исследователей, всего 42% пациентов с АтД, среднетяжелого и тяжелого течения получали системную терапию в течение 14 лет наблюдения. Только топические средства получали 58% пациентов. И в том и другом случае контроль симптомов АтД был недостаточным11.
По данным европейских исследователей, пациенты с АтД часто получают системную терапию циклоспорином А (80%), пероральные ГКС – лишь в 7% случаев, другие иммунодепрессанты, применяемые вне показаний, – в 13% случаев12.
В силу противовоспалительных и иммуносупрессивных эффектов системные ГКС широко используются при дерматологических заболеваниях. Однако применение пероральных ГКС при АтД ограниченно, поскольку эффективность и безопасность системной терапии АтД не были в достаточной мере доказаны в клинических исследованиях. Рекомендованная продолжительность пульс-терапии АтД пероральными ГКС составляет 2–4 дня, при снижении дозы – 2–4 недели. Прекращение приема системных ГКС нередко сопровождается рецидивом заболевания. При длительной терапии пероральными системными ГКС повышается риск нежелательных побочных эффектов, таких как глаукома, диабет, гипертония, остеопороз, синдром Кушинга, язва желудка13, 14.
Циклоспорин А считается препаратом первого ряда у пациентов с АтД, которым показана системная терапия. Это единственный одобренный в России и странах Европы иммуносупрессивный препарат для лечения пациентов с АтД. Рекомендованный период применения циклоспорина А – 3–6 месяцев, в отдельных случаях – до двух лет. Однако применение циклоспорина А часто сопровождается развитием серьезных побочных эффектов. По разным данным, 14–21% пациентов прекращают лечение из-за нежелательных явлений. Нередко развиваются нефротоксичность, гипертония, тремор, головная боль, парестезия, тошнота, диарея, миалгия, нарушается электролитный баланс10. В связи с этим при использовании циклоспорина А требуется мониторинг лабораторных показателей, в том числе органспецифичной токсичности15.
В некоторых случаях терапия циклоспорином А неэффективна. Показано, что 7–13% пациентов с АтД прекращают лечение циклоспорином из-за отсутствия или недостаточного ответа на терапию16.
Таким образом, применение циклоспорина ограничено, с одной стороны, противопоказаниями, которые связаны с нарушениями функции почек и артериальной гипертензией, с другой – краткосрочным терапевтическим эффектом. Почти в половине случаев спустя две недели после окончания терапии циклоспорином А наблюдается рецидив заболевания17.
Системную терапию следует применять до достижения эффекта, но не более полугода. В настоящее время консенсус в отношении очередности применения препаратов системной терапии, начальной дозы и прерывания лечения не достигнут. При использовании системной терапии необходимы контроль лабораторных показателей и регулярная оценка распространенности и тяжести заболевания.
В последние годы отмечается недостаточный контроль заболевания у больных со среднетяжелым течением АтД. Так, опубликованы данные американских исследователей, которые проанализировали работу более 200 врачей и наблюдали свыше 1000 пациентов с АтД. Неудовлетворительный контроль АтД у больных со среднетяжелым и тяжелым течением, по оценке врачей, зарегистрирован в 58,7% случаев, удовлетворительный – лишь в 41,3% случаев. При этом данные опроса различаются в отношении среднетяжелого и тяжелого АтД. Среднетяжелый АтД контролируется в 62,2% случаев, тяжелый АтД не контролируется в 76,6% случаев. Исследователи оценивали также контроль заболевания в зависимости от вида системной терапии по мнению врача. В 83,4% случаев лечения системными ГКС не достигнуто удовлетворительного результата. В отношении применения любых системных иммуносупрессантов неудовлетворительный контроль АтД составил 53,4%18.
Докладчик представила клинический случай тяжелого АтД. Пациент 29 лет с персистирующим течением АтД с трехмесячного возраста, с кратковременными периодами относительной ремиссии в летнее время. Период относительной ремиссии с 10 до 17 лет. После 17 лет течение заболевания резко ухудшилось, возникали рецидивы пиодермии. Пациент неоднократно был госпитализирован (до шести раз в год), получал курсы системных ГКС (парентерально, перорально), системную антибактериальную терапию, наружную терапию топическими ГКС, эмоленты – с кратковременным эффектом. В возрасте пяти лет наблюдалась пищевая аллергия, с пяти лет – приступы затрудненного дыхания. Тяжелое течение АтД и наличие сопутствующих аллергических заболеваний послужили основанием для присвоения пациенту в детстве группы инвалидности. Диагноз БА и аллергического риноконъюнктивита установлен в семь лет. Среди других заболеваний – сопутствующие рецидивирующие инфекции кожи, пиодермия, герпесвирусная инфекция, хронический гастрит, дискинезия желчевыводящих путей, хронический тонзиллит.
Под наблюдением специалистов ФГБУ «ГНЦ Институт иммунологии» больной находится с 21 года. При поступлении отмечались обширное поражение кожи, экзема, инфильтрация, нарушение сна, депрессия, высокий уровень общего иммуноглобулина E, эозинофилия, поливалентная сенсибилизация. Назначены наружная терапия, эмоленты, ТГКС, комбинированные средства, топические ингибиторы кальциневрина. Системную терапию проводили разными методами, включая плазмаферез. Аллергенспецифическая иммунотерапия (АСИТ) клещами домашней пыли – положительный эффект. Ремиссия заболевания продолжалась в течение двух месяцев. В 2013 г. больному проведен курс PUVA-терапии – без эффекта. В том же году пациент получал циклоспорин А в дозе 2,7 мг/кг в течение двух недель, но на фоне его приема развились тяжелые нежелательные явления (интенсивная неконтролируемая головная боль, тошнота, рвота, обострение герпесвирусной инфекции). Дозу циклоспорина снизили до 0,5 мг/кг в течение четырех месяцев – без эффекта. После полной отмены препарата наблюдалось тяжелое обострение АтД. Пациент самостоятельно бесконтрольно применял ГКС для облегчения состояния. В 2014–2016 гг. имело место волнообразное течение АтД, с тяжелыми обострениями до восьми раз в год. Больной получал лечение в стационаре поводу пиодермии и ухудшения течения АтД.
Данный клинический случай наглядно демонстрирует сложность в достижении контроля тяжелого АтД. В подобной ситуации можно использовать таргетную биологическую терапию.
Последние годы особое внимание исследователей приковано к таргетному биологическому препарату дупилумабу, способному воздействовать на ключевые звенья патогенеза АтД.
В обширной программе клинических исследований дупилумаба также участвовали пациенты с тяжелым АтД, резистентным к стандартной терапии.
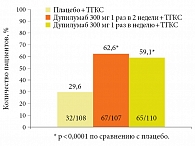
В одном из исследований III фазы CAFE принимали участие 325 пациентов со среднетяжелым и тяжелым течением АтД и различными сопутствующими заболеваниями, с доказанной неэффективностью системной терапии19. Исследователи сравнивали эффективность дупилумаба и плацебо при совместном применении ТГКС у взрослых пациентов с АтД, у которых пероральный прием циклоспорина А не обеспечивал адекватного контроля заболевания, которые не переносили его или которым такое лечение не рекомендовано по медицинским причинам. Пациенты были рандомизированы на группы плацебо, дупилумаба 300 мг один раз в неделю и дупилумаба 300 мг один раз в две недели. Пациенты всех групп получали ТГКС. Период лечения составил 16 недель. Следует отметить, что в исследовании участвовали тяжелые больные с изнурительным зудом, различными коморбидными аллергическими состояниями, в том числе пищевой аллергией, аллергическим конъюнктивитом, БА. При оценке эффективности дупилумаба первичной конечной точкой исследования было улучшение по показателю EASI-75 к 16-й неделе лечения. Она достигнута у 62,6% пациентов, получавших дупилумаб один раз в две недели, и 59,1% пациентов, принимавших препарат один раз в неделю. В группе плацебо подобный эффект отсутствовал (рис. 4).
В течение 16 недель в группе пациентов, получавших дупилумаб, отмечалось значительное улучшение показателей SCORAD (SCORing Atopic Dermatitis – комплексная оценка симптомов и проявлений АтД). Кроме того, на фоне терапии зарегистрировано быстрое и значительное улучшение пикового показателя зуда по шкале NRS в течение 16 недель.
Эффективность терапии у пациентов с АтД оценивали по шкале POEM (Patient-Oriented Eczema Measure), качество жизни – с помощью дерматологического индекса качества жизни DLQI (Dermatology Life Quality Index), шкалы тревоги и депрессии HADS (Hospital Anxiety and Depression Scale). По всем этим показателям было достигнуто существенное улучшение в группах пациентов, получавших дупилумаб (рис. 5).
В заключение О.Г. Елисютина отметила, что появление таргетного биологического препарата дупилумаба позволяет ускорить достижение ремиссии заболевания и повысить качество жизни пациентов с тяжелым АтД.
Тяжелый атопический синдром у подростков
Как отметила заместитель директора НИИ педиатрии по научной работе ФГАУ «Национальный медицинский исследовательский центр здоровья детей» Минздрава России, к.м.н. Елена Александровна ВИШНЕВА, сочетанные проявления кожной и респираторной аллергии у детей, представленные в виде АтД и БА у одного и того же пациента, ранее в практике врача-аллерголога обозначали как дерматореспираторный синдром. Данный термин не входит в рубрику официальной классификации болезней. Однако в структуре заболеваемости именно сочетание у одного пациента аллергических и респираторных проявлений составляет 35–40%.
Атопический фенотип, характеризующийся дерматореспираторными проявлениями, формируется у детей с первых лет жизни. При этом АтД часто развивается первым, предшествуя развитию БА. Наследственная предрасположенность к аллергическим заболеваниям наблюдается у 63,8–70% таких детей. Одной из особенностей дерматореспираторного синдрома у детей является быстрое расширение спектра этиологически значимых аллергенов с формированием поливалентной сенсибилизации к большой группе различных аллергенов, что также обусловливает непрерывно рецидивирующее течение данного фенотипа.
Как известно, эндотип складывается из особенностей патофизиологии и непосредственно проявлений фенотипа, формирующегося под взаимодействием генетических факторов и факторов окружающей среды. На тяжесть течения АтД влияют возраст дебюта заболевания, наличие мультиморбидности – сопутствующих коморбидных аллергических состояний, а также темпы прогрессирования болезни.
Ключевыми факторами риска развития тяжелого АтД считаются раннее начало заболевания, отягощенная наследственность, особенно у обоих родителей, полисенсибилизация, наличие мутаций филаггрина и воздействие факторов внешней среды. АтД с дебютом в детском возрасте характеризуется нарушением барьерной функции кожи. Как следствие – воздействие факторов внешней среды (аллергенов) и активация системы врожденного иммунитета20. Активация Т2-лимфоцитов способствует развитию активного Т2-воспаления кожи. При АтД у взрослых дефекты кожного барьера и системной активации иммунного ответа также приводят к хроническому воспалению21. Активация Т-лимфоцитов происходит как местно – в коже, так и системно. При этом активируются и Th2-лимфоциты, и дополнительные Т-лимфоциты, такие как CD8+ Т-лимфоциты и Th22-лимфоциты22.
Таким образом, функциональная роль Т2-цитокинов при различных аллергических заболеваниях сомнения не вызывает. ИЛ-4, ИЛ-5 и ИЛ-13 активно участвуют в Т2-воспалении и дифференцировке Т-лимфоцитов. Кроме того, в процессе задействованы тучные клетки, которые активизируются под влиянием IgE. Как уже отмечалось, Т2-воспаление – основа патогенеза различных аллергических заболеваний, таких как АтД, хронический полипозный риносинусит, БА, аллергический ринит. Доказано, что дети с АтД имеют очень высокий риск развития БА по сравнению с детьми без АтД. В свою очередь у пациентов с неконтролируемой персистирующей астмой более высокий риск развития заболеваний, в основе которых лежит Т2-воспаление23.
Т2-воспаление при астме характеризуется гиперпродукцией слизи, сокращением гладких мышц бронхов, бронхиальной обструкцией, гиперреактивностью дыхательных путей и рецидивирующим свистящим дыханием. В основе патогенеза БА, аллергического ринита и АтД может лежать как Т2-зависимый, так и Т2-независимый иммунный ответ24.
На текущий момент распространенность симптомов БА среди детей и подростков в возрасте 13–14 лет сохраняется на достаточно высоком уровне. Широкая распространенность – один из факторов, обусловливающих социально-экономическое бремя БА. При этом бремя детской астмы складывается из прямых и непрямых затрат, нематериальных расходов. К прямым относят расходы на амбулаторные визиты, экстренные обращения за медицинской помощью, госпитализацию, диагностику, лечение, к непрямым – потерю продуктивности, пропущенные дни на работе и в школе. Нематериальные расходы подразумевают снижение качества жизни, ограничение физической активности, успеваемости в школе.
Кроме того, тяжесть серьезного экономического бремени обусловлена числом потерянных лет жизни вследствие БА.
Согласно данным исследования, в 2015 г. в мире БА страдало свыше 358 млн человек. Астма привела к потере 26,2 млн лет жизни DALY (Disability Adjusted Life Year – год жизни, измененный или потерянный в связи с нетрудоспособностью), что составляет 1,1% общего бремени всех заболеваний в 2015 г. Таким образом, годы жизни, утраченные в связи с состоянием здоровья, составили 60% от показателя DALY25.
По словам докладчика, внедрение клинических рекомендаций позволяет сэкономить определенный процент расходов здравоохранения на лечение пациентов с БА. Так, в Финляндии общая годовая стоимость лечения БА уменьшилась после реализации Национальной программы по астме. Сократить расходы удалось за счет достижения контроля у пациентов с персистирующей БА, снижения количества госпитализаций и потребности в оказании специализированной помощи, количества амбулаторных визитов и первичных обращений за медицинской помощью26. Однако, несмотря на лечение, у многих пациентов БА остается неконтролируемой. В исследовании REALISE с участием взрослого населения 11 стран Европы в группах пациентов с БА, получавших терапию согласно Глобальной стратегии лечения и профилактики БА (GINA), показано, что 80% больных не достигают полного контроля над болезнью27.
Неконтролируемая персистирующая астма представляет собой наибольшую экономическую нагрузку. В Европе общие расходы на одного пациента с неконтролируемой БА в четыре раза превышают таковые при контролируемой астме28.
Последние годы отмечается некоторое снижение количества смертельных исходов при БА. Наиболее серьезную проблему по-прежнему представляют пациенты с тяжелой персистирующей БА, которые относятся к группе высокого риска летального исхода. Исследователи проанализировали смертельные исходы от БА за 13-летний период в США. Зафиксировано 2535 смертельных исходов в детской популяции. Самая высокая смертность отмечалась у мальчиков в возрасте 10–14 лет, 51% смертей – амбулаторные пациенты29.
К факторам, повышающим риск смертельного исхода от БА, относят неадекватное лечение ингаляционными ГКС, широкое использование бета-2-агонистов, неадекватное наблюдение и неуместное назначение бета-адреноблокаторов и нестероидных противовоспалительных препаратов.
Основными целями лечения БА являются снижение текущих симптомов и будущих рисков. Терапия направлена на достижение контроля заболевания, сопутствующей патологии, улучшение функции легких, функционального состояния и качества жизни пациентов. Цель – снизить количество обострений, визитов за экстренной медицинской помощью, частоту госпитализаций, предотвратить и уменьшить риск развития нежелательных явлений терапии, утяжеления течения болезни, исключить вероятность смертельного исхода от БА.
По клиническим проявлениям и ответу на терапию концепция фенотипирования рассматривает БА как неоднородное заболевание. Определение различных фенотипов БА крайне важно для улучшения терапевтических возможностей и персонифицированного подхода к назначению таргетной терапии. Следует отметить, что достижение оптимального контроля над астмой – циклический процесс, включающий оценку не только тяжести БА, но и ответа на терапию, мониторинг состояния пациента, оценку заболевания и коррекцию лечения.
Для достижения оптимального эффекта и контроля симптомов БА среднетяжелого и тяжелого течения у пациентов детского и подросткового возраста успешно применяют препарат дупилумаб.
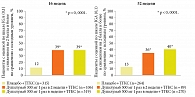
По данным исследования Liberty Asthma QUEST30, дупилумаб уменьшает частоту тяжелых обострений и улучшает функцию легких у подростков с неконтролируемой БА среднетяжелого и тяжелого течения. Исследователи оценивали эффективность и безопасность дупилумаба в подгруппах подростков (12–17 лет) и взрослых (18 лет и старше) с неконтролируемой среднетяжелой и тяжелой БА. Конечные точки, оцененные в течение 52-недельного периода лечения: годовая частота тяжелых обострений, изменение пребронходилатационного значения объема форсированного выдоха за первую секунду (ОФВ1) от исходного уровня.
В исследование была включена группа подростков (107 пациентов) с БА (средний возраст – 14,1 года), преимущественно мальчики. Почти все пациенты имели сопутствующие аллергические заболевания: АтД, аллергический ринит или назальный полипоз.
Частота обострений снизилась в группе подростков, получавших дупилумаб 200 мг каждые две недели, и в группе дупилумаба 300 мг каждые две недели. При оценке показателей функции внешнего дыхания показано, что дупилумаб улучшает показатели ОФВ1 уже в течение первых двух недель приема. Как и у взрослых пациентов, улучшение ОФВ1 у подростков было быстрым и устойчивым на протяжении всего 52-недельного периода наблюдения. Профиль безопасности был сопоставим между группами. Наиболее частыми нежелательными явлениями были единичные вирусные инфекции дыхательных путей. В целом дупилумаб хорошо переносился пациентами.
Таким образом, дупилумаб статистически значимо улучшает функцию легких и снижает частоту тяжелых обострений у подростков со среднетяжелой и тяжелой неконтролируемой астмой.
Новые препараты, действующие на Т2-воспаление, с быстрым терапевтическим эффектом и хорошей переносимостью позволяют контролировать БА и сопутствующую аллергопатологию и тем самым повышают качество жизни пациентов.
Заключение
Сегодня на российском фармацевтическом рынке представлен таргетный препарат дупилумаб. Действие дупилумаба основано на ингибировании альфа-субъединицы рецептора ИЛ-4, благодаря которому цитокины ИЛ-4 и ИЛ-13 осуществляют свою биологическую функцию. В свою очередь они играют важную роль в Т2-воспалении при АтД и БА.
Результаты клинических исследований показали, что применение дупилумаба при АтД и БА способствует достижению контроля заболевания и улучшению качества жизни пациентов при благоприятном профиле безопасности.
