Вакцинация против пневмококковой инфекции в ревматологии: ретроспектива и современность
- Аннотация
- Статья
- Ссылки
- English
В статье проанализированы данные в отношении иммуногенности и безопасности вакцин от пневмококковой инфекции у больных ИВРЗ. Показано, что большинство антиревматических препаратов (кроме анти-В-клеточных и в меньшей степени метотрексата и абатацепта) не оказывают значимого влияния на иммуногенность пневмококковых вакцин. Поствакцинальные реакции развиваются примерно в 1/3 случаев. Согласно данным литературы и личного опыта, указанные реакции являются слабовыраженными и самостоятельно разрешаются в течение одного – трех дней. Обострений фонового ИВРЗ или развития новых аутоиммунных феноменов у вакцинированных больных не наблюдается.
В статье проанализированы данные в отношении иммуногенности и безопасности вакцин от пневмококковой инфекции у больных ИВРЗ. Показано, что большинство антиревматических препаратов (кроме анти-В-клеточных и в меньшей степени метотрексата и абатацепта) не оказывают значимого влияния на иммуногенность пневмококковых вакцин. Поствакцинальные реакции развиваются примерно в 1/3 случаев. Согласно данным литературы и личного опыта, указанные реакции являются слабовыраженными и самостоятельно разрешаются в течение одного – трех дней. Обострений фонового ИВРЗ или развития новых аутоиммунных феноменов у вакцинированных больных не наблюдается.

Введение
Пневмококковая инфекция – группа антропонозных болезней, обусловленных наличием передаваемых воздушно-капельным путем бактерий Streptococcus pneumoniae, способных проникать в обычно стерильные среды организма, вызывая серьезную патологию с высокой летальностью. Различают две формы пневмококковых инфекций – инвазивные (менингит, пневмония с бактериемий, септицемия, септический артрит, остеомиелит, перикардит, эндокардит) и неинвазивные (пневмония без бактериемии, острый средний отит, синусит и т.п.) [1].
Пневмококковые инфекции при иммуновоспалительных ревматических заболеваниях
Пневмонии занимают одно из лидирующих мест в структуре серьезных инфекций у пациентов с иммуновоспалительными ревматическими заболеваниями (ИВРЗ) [2–4]. Согласно результатам исследования, выполненного в Научно-исследовательском институте ревматологии им. В.А. Насоновой (НИИР им. В.А. Насоновой), пневмония была наиболее частой серьезной инфекцией и встречалась у 62,9% больных ревматоидным артритом (РА), 62,5% пациентов с системной склеродермией (ССД) и у 61,9% страдающих системной красной волчанкой (СКВ) [5]. Согласно данным японских ученых, у больных РА доля пневмококковых пневмоний составляла 18,3%, затем следовали пневмонии, ассоциированные с Pseudomonas aeruginosa (14,1%), Haemophilus influenzae (9,9%), Mycoplasma pneumoniae и вирусом гриппа (по 8,5%) [6].
В одномоментном британском исследовании было проанализировано влияние приема базисных противовоспалительных препаратов (БПВП) на частоту развития инфекций нижних дыхательных путей (ИНДП) у больных РА. В исследование было включено 1522 пациента, которых наблюдали в одной и той же клинике в течение календарного года. В целом годовая частота развития ИНДП, которые потребовали госпитализации, составила 2,3%, а при лечении метотрексатом (МТ) – 2,8% (р = 0,78).
Логистический моновариантный регрессионный анализ выявил следующие значимые факторы риска развития ИНДП: пожилой возраст (р = 0,013), мужской пол (р = 0,022), применение глюкокортикоидов (ГК) (р = 0,041), отсутствие лечения БПВП (р = 0,019). Достоверных данных об ассоциации курения, назначения МТ или иных БПВП с частотой госпитализации или летальностью от инфекций органов дыхания не получено [7].
Согласно результатам наших исследований, к факторам риска развития пневмонии у больных РА относятся:
- высокая активность воспалительного процесса (отношение шансов (ОШ) 15,5 при 95%-ном доверительном интервале (ДИ) 5,3–45,1; р < 0,001);
- хронические болезни легких (ОШ 7,4 (95% ДИ 1,4–39,9); р = 0,01);
- отсутствие приема БПВП (ОШ 5,6 (95% ДИ 2,3–14,1); р < 0,001);
- монотерапия ГК (ОШ 6,4 (95% ДИ 1,8–23,1); р = 0,005).
При этом сочетание первого и третьего факторов повышало риск развития пневмонии до 19,3 раза [8].
Пневмония у больных СКВ развивается часто и является одной из наиболее значимых причин летального исхода. В ретроспективном исследовании, выполненном в Дании, показано, что частота инвазивных пневмококковых инфекций, включая пневмонию, у больных СКВ в 13 раз превышала таковую в общей популяции – 210,0 и 15,6 на 100 тыс. пациенто-лет соответственно. По мнению авторов, это является весомым аргументом в пользу вакцинации против пневмококковой инфекции у всех больных СКВ [9].
R. Narata и соавт. установили, что частота внебольничной пневмонии у больных СКВ составляла 10,3%. Средний возраст пациентов – 38,0 ± 11,5 года, средняя продолжительность СКВ к моменту развития пневмонии – 35,0 ± 54,5 месяца. Более чем в половине случаев пневмония была зафиксирована в первый год заболевания (58,9%), в 11 из них развитие пневмонии совпало с дебютом СКВ, в 22 – средняя продолжительность болезни составила 4,5 ± 3,6 месяца. Основными клиническими симптомами были фебрильная лихорадка (83,9%) и кашель (58,9%), реже встречались одышка (28,6%) и боль в грудной клетке при вдохе (8,9%).
Предикторами смерти от пневмонии при СКВ были большая суточная и кумулятивная дозы ГК, которые в группе умерших пациентов в среднем составили 41,3 ± 16,0 мг/сут и 596,3 ± 232,6 мг соответственно, а также высокая активность СКВ по Mеx-SLEDAI (8,13 ± 6,32 балла) и факт применения искусственной вентиляции легких (ИВЛ). При многофакторном анализе значение сохранили только такие предикторы, как применение ИВЛ (р = 0,024) и прием ГК в дозе 15 мг/сут и более (р = 0,045). Летальный исход наблюдался в 26,8% случаев [10].
В исследовании, проведенном в НИИР им. В.А. Насоновой, среди факторов риска развития пневмонии у больных СКВ отмечены высокая активность воспалительного процесса (ОШ 11,6 (95% ДИ 3,2–41,3); р < 0,001), отсутствие лечения цитотоксиками (ОШ 10,5 (95% ДИ 3,3–43,3); р < 0,001) и прием ГК в дозе более 20 мг/сут (ОШ 11,9 (95% ДИ 7,3–43,3); р < 0,001). Сочетание первого и второго факторов приводило к четырехкратному увеличению риска развития пневмонии (ОШ 48,0; р < 0,001) [8].
Как свидетельствуют результаты многоцентрового исследования EUSTAR, у больных ССД наиболее частой (11,1%) серьезной инфекцией была пневмония, которая в 4% случаев стала причиной летального исхода [11].
Согласно данным исследования EUVAS, включавшего 524 больных васкулитами, ассоциированными с антинейтрофильными цитоплазматическими антителами, инфекции были наиболее частой причиной летального исхода (71%), ИНДП – наиболее частым серьезным осложнением (24%) [12].
В ретроспективном когортном исследовании, выполненном британскими учеными, установлено, что риск инвазивной пневмококковой инфекции, включая пневмонию, значимо возрастал у госпитализированных больных РА (ОШ 2,47 (95% ДИ 2,41–2,52)), СКВ (ОШ 5,00 (95% ДИ 4,6–5,4)), узелковым полиартериитом (ОШ 5,00 (95% ДИ 4,0–6,0)), ССД (ОШ 4,2 (95% ДИ 3,8–4,7)), синдромом Шегрена (ОШ 3,2 (95% ДИ 2,9–3,5)), анкилозирующим спондилитом (АС) (ОШ 1,96 (95% ДИ 1,1–3,3)) [13].
Таким образом, в современных условиях необходимость вакцинации против пневмококковой инфекции у больных ИВРЗ не вызывает сомнений.
Пневмококковые вакцины
В настоящее время с целью специфической профилактики заболеваний, вызванных пневмококком, у взрослых применяются вакцины двух типов: полисахаридная 23-валентная (ППВ-23) и полисахаридная конъюгированная адсорбированная 13-валентная (ПКВ-13). Ранее широко использовавшаяся пневмококковая конъюгированная 7-валентная вакцина (ПКВ-7) в настоящее время не выпускается.
ППВ-23 содержит высокоочищенные капсульные полисахариды 23 серотипов пневмококков (1, 2, 3, 4, 5, 6В, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F) в качестве антигенов, которые активируют В-лимфоциты, что запускает клональную экспансию последних и продукцию иммуноглобулинов (Ig) классов М и G. Основу действия ППВ-23 составляет Т-независимый иммунный ответ. Иммунитет приобретается через 10–15 дней после однократного введения вакцины и сохраняется пять лет и более.
ПКВ-13 содержит полисахариды 13 серотипов пневмококка (1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F, 19А и 23F), конъюгированных с белком – носителем CRM197 и адсорбированных на фосфате алюминия. Белковый конъюгат является генно-модифицированной нетоксичной формой дифтерийного анатоксина. В основе действия конъюгированных вакцин лежит Т-зависимый ответ.
Вакцинация пациентов с иммуновоспалительными ревматическими заболеваниями
В 2019 г. эксперты Европейской антиревматической лиги (Еuropean League Against Rheumatism, EULAR) опубликовали обновленные рекомендации по вакцинации взрослых больных ИВРЗ. В них указано, что вакцинация позволяет существенно уменьшить потери, связанные с инфекционной патологией, в первую очередь снизить частоту госпитализаций, обусловленных инфекциями, включая инвазивные формы. По мнению экспертов, данная популяция повсеместно страдает от недостаточного (субоптимального) охвата вакцинацией, отчасти из-за низкой частоты направления на нее. Это подчеркивает необходимость дальнейших мероприятий, нацеленных на распространение информации о вакцинации в ревматологическом сообществе и среди врачей смежных специальностей [14].
Несмотря на имеющиеся рекомендации международных и национальных медицинских ассоциаций, многие практикующие врачи по-прежнему продолжают рассматривать ИВРЗ как противопоказание для вакцинации. В качестве ведущих причин такого подхода называются опасность рецидива фонового заболевания и снижение эффективности вакцины при получении активной иммуносупрессивной терапии.
Ниже будут проанализированы данные, посвященные иммуногенности и безопасности вакцинации от пневмококковой инфекции у больных ИВРЗ.
Иммуногенность пневмококковых вакцин
Следует отметить, что истинная клиническая эффективность рассматриваемых вакцин, как и любых других вакцин, заключается в уменьшении инвазивных заболеваний и летальности от пневмококковой инфекции среди больных ИВРЗ как в целом, так и в зависимости от проводимой терапии. Она может быть оценена только в ходе проспективного, вероятно, многоцентрового, выполненного по единому протоколу исследования, включающего тысячи пациентов. Данное условие выполнимо лишь с привлечением больших человеческих и материальных ресурсов.
Действительно ли вакцинация снижает истинную частоту инфекционных осложнений у больных РА? Это вопрос адресован будущим исследованиям [15].
На сегодняшний день в качестве мерила эффективности вакцины предложен такой суррогатный маркер, как способность инициировать и поддерживать защитные (протективные) уровни пневмококковых антител, то есть иммуногенность. Однако, как подчеркивают эксперты EULAR, следует признать, что иммунные ответы in vivo не всегда четко коррелируют с клинической эффективностью [16]. Кроме того, протективные концентрации пневмококковых антител могут варьироваться в зависимости от популяции, серотипа и клинической конечной точки [17].
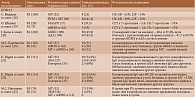
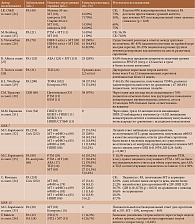
В таблице представлены данные в отношении исследования иммуногенности пневмококковых вакцин при различных ИВРЗ [15, 18–39].
Согласно данным метаанализа, у пациентов с ИВРЗ, получавших различные иммуносупрессивные препараты (МТ, ингибиторы фактора некроза опухоли α (иФНО-α), ритуксимаб (РТМ)), иммунные ответы на ПКВ-13 и ППВ-23 были снижены по сравнению с контролем. При этом уменьшение поствакцинального ответа на ПКВ-13 было выражено в большей степени. Среди пациентов, получавших РТМ, относительный риск отсутствия сероконверсии (неспособности достигнуть двухкратного увеличения концентрации антител после вакцинации) варьировался от 4,91 (95% ДИ 2,32–10,40) до 13,06 (95% ДИ 2,39–71,34) в зависимости от серотипа пневмококка. Несколько меньшим было влияние на иммунный ответ МТ, для которого указанные показатели колебались от 2,0 (95% ДИ 1,06–3,77) до 5,41 (95% ДИ 2,09–13,98) в зависимости от пневмококкового серотипа. Ингибиторы ФНО-α действовали на поствакцинальный ответ в наименьшей степени, при этом максимальное значение относительного риска составляло 0,65 (95% ДИ 0,29–1,44) [40]. Известно, что иФНО-α более избирательно влияют на иммунную систему, уменьшая миграцию дендритных клеток, ингибируя активацию Т-клеток и уменьшая выживаемость клеток памяти [41]. Этим может быть объяснено менее выраженное влияние иФНО-α на поствакцинальный ответ по сравнению с другими БПВП.
Точная интерпретация данных исследований по влиянию абатацепта (АБА) на постиммунизационный ответ осложняется сопутствующим назначением МТ и/или отсутствием контрольных групп. В неконтролируемом исследовании с участием вакцинированных ППВ-23 пациентов, получавших АБА подкожно, большинство из которых также принимали МТ, у 74% был достигнут достаточный иммунологический ответ [27]. Однако в другом исследовании, включавшем 17 пациентов, получавших АБА внутривенно и вакцинированных ПКВ-7, 13 из которых одновременно получали МТ, было выявлено снижение частоты случаев достижения более чем двухкратного увеличения поствакцинального титра пневмококковых антител по сравнению с пациентами, получавшими тоцилизумаб (ТЦЗ), или пациентами контрольной группы [33]. Наконец, в исследовании P. Nived и соавт. бустерная стратегия (ПКВ-13, затем через восемь недель и более ППВ-23), примененная у получавших АБА 23 пациентов, половина из которых принимала МТ, привела к улучшению поствакцинального ответа, который, однако, был ниже по сравнению со здоровым контролем [42].
Ингибиторы янус-киназ, по‑видимому, оказывают умеренное влияние на частоту положительных ответов на пневмококковые вакцины.
В плацебо-контролируемом исследовании, включавшем пациентов с РА, вакцинированных ППВ-23 после четырехнедельного приема тофацитиниба (ТОФА), отмечалась меньшая частота удовлетворительного ответа по сравнению с плацебо (45,1 против 68,4%), особенно при одновременном применении с МТ (31,6%). Прекращение приема ТОФА на одну неделю до и после вакцинации несколько улучшило ответ на ППВ-23 по сравнению с больными, принимавшими препарат без перерыва, но различия были статистически незначимы – 84,6 и 75,0% [29].
В исследовании K. Winthrop и соавт. с участием 106 больных РА, получавших барицитиниб (БАРИ), 89% из которых также принимали МТ, и вакцинированных ПКВ-13, доля ответивших на вакцину составляла 68% [38]. Этот результат был аналогичен таковому в другом исследовании, в котором оценивался ответ на ПКВ-13 у здоровых лиц и пациентов с РА, не принимавших БПВП [39].
Глюкокортикоиды в низких дозах, принимаемые одновременно с другими базисными противовоспалительными препаратами или генно-инженерными биологическими препаратами (ГИБП), не влияют на уровень поствакцинальных пневмококковых антител [38, 43], в то время как повышение дозы ГК может оказывать ингибирующий эффект. Среди пациентов с ИВРЗ, иммунизированных ППВ-23, 57% не ответивших на вакцинацию принимали преднизолон в дозе более 20 мг/сут. Доля «ответчиков» составила 22% (p = 0,07) [44].
В упомянутом выше исследовании по барицитинибу (БАРИ), в котором примерно 30% участников одновременно принимали ГК в низких дозах (в среднем 6,2 мг/сут), частота ответа на ПКВ-13 была сходной с таковой у пациентов, не получавших ГК, – 71 и 67% соответственно [38]. Среди больных, принимавших МТ с инфликсимабом (ИНФ) или без него, сопутствующие низкие дозы ГК (менее 10 мг/сут в пересчете на преднизолон) не оказывали неблагоприятного воздействия на вакцинальный ответ [26].
Согласно результатам исследования, проведенного в НИИР им. В.А. Насоновой, терапия ГК в дозах 5–30 мг/сут (в пересчете на преднизолон) у больных СКВ не влияла негативно на показатели иммунного ответа в отношении ППВ-23. Через год после вакцинации в 58% случаев сохранялось значимое повышение (в два раза и более) уровня антипневмококковых антител [30].
Таким образом, основные группы антиревматических препаратов не оказывают значимого влияния на иммуногенность пневмококковых вакцин. Тем не менее, по мнению ряда авторов, для достижения оптимального иммунного ответа у больных ИВРЗ вакцинацию следует проводить до назначения ГИБП. Эксперты EULAR считают возможным назначение вакцинации на фоне терапии как БПВП, так и иФНО-α. В то же время анти-В-клеточные препараты (РТМ, окрелизумаб) обладают выраженным ингибирующим влиянием на концентрацию постиммунизационных антител, поэтому больным ИВРЗ, которым планируется данная терапия, вакцинация должна быть назначена до начала лечения. Если же такое лечение уже проводится, вакцинацию необходимо выполнить как минимум через шесть месяцев после очередного введения анти-В-клеточного препарата, но не менее чем за четыре недели до следующего курса. В случае невозможности выполнения этих условий вакцинацию можно назначить на фоне анти-В-клеточной терапии, принимая во внимание возможный субоптимальный (недостаточный) уровень постиммунизационного ответа.
Безопасность пневмококковых вакцин
Безопасность пневмококковых вакцин изучалась на протяжении более чем 30-летнего периода в различных популяциях. Серьезные нежелательные реакции, в частности анафилактические, регистрировались крайне редко, а связь неврологических осложнений с введением пневмококковой вакцины (синдрома Гийена – Барре) не доказана.
В метаанализе девяти рандомизированных контролируемых исследований нетяжелые местные реакции, такие как болезненность в месте введения инъекции, эритема и отек, наблюдались примерно у трети пациентов в отсутствие выраженной лихорадки и анафилактоидных реакций [45].
С приведенными выше данными полностью согласуются результаты исследований, проведенных в НИИР им. В.А. Насоновой. Так, частота нежелательных реакций не превышала 35%. Эти реакции рассматривались как типичные поствакцинальные и саморазрешались в течение одного – трех дней. Определенная связь данных реакций с проводимой терапией не отмечена. Каких-либо значимых изменений лабораторных параметров функции костного мозга, печени и почек не зафиксировано [46].
Как указывалось выше, одной из причин негативного отношения ряда врачей к вакцинации пациентов ревматологического профиля является то, что вакцины могут сыграть роль триггера и соответственно стать причиной обострения основного ИВРЗ. У наших пациентов какого-либо негативного влияния пневмококковых вакцин на течение основного заболевания не выявлено.
Вакцинация не является триггером ни аутоиммунных воспалительных заболеваний, ни их обострений [47].
Основываясь на потенциальных рисках обострения процесса после иммунизации у «нестабильных» больных с ИВРЗ, эксперты EULAR рекомендуют проводить вакцинацию в неактивную фазу заболевания.
Однако наличие больных ИВРЗ со средней и высокой степенью активности процесса на исходном этапе нашего исследования, а также продемонстрированная значимая положительная динамика индексов активности патологии свидетельствовали о безопасности пневмококковой вакцинации, выполненной не только в неактивной стадии болезни, но и в активной.
Следовательно, среди поставленных экспертами EULAR ключевых вопросов на два из них («Влияет ли активность болезни на эффективность вакцинации у пациентов с ревматическими заболеваниями?» и «Влечет ли активность болезни значимые отрицательные последствия вакцинации у таких больных?») мы вправе дать отрицательные ответы.
В соответствии с рекомендациями Консультативного комитета по практике иммунизации США [48], Федеральными клиническими рекомендациями [1], вакцинацию взрослых больных, получающих иммуносупрессивную терапию, необходимо начинать с ПКВ-13, после которой не менее чем через восемь недель может быть введена первая доза ППВ-23, вторая доза – через пять лет. На наш взгляд, подобный подход к вакцинопрофилактике пневмококковых инфекций у взрослых пациентов ревматологического профиля весьма неоднозначен, он требует дальнейшего изучения и подтверждения целесообразности в соответствующих клинических исследованиях. В частности, остается неясным вопрос об иммуногенности пневмококковых конъюгированных вакцин у больных ИВРЗ на фоне проводимой терапии. Так, по имеющимся на сегодняшний день данным, назначение ПКВ-7 больным РА не обеспечивает должного поствакцинального ответа через полтора года после иммунизации. Кроме того, МТ, являющийся препаратом выбора при РА, значимо снижает уровень гуморального ответа у этих пациентов после иммунизации ПКВ-7 и ПКВ-13 [33, 35].
Голландскими учеными показано, что иФНО-α, являющиеся препаратами выбора из группы ГИБП для больных РА и АС, подавляют индукцию Т-зависимого иммунного ответа и таким образом блокируют путь реализации профилактического эффекта всех конъюгированных вакцин, включая ПКВ-7 и ПКВ-13. При этом Т-независимый гуморальный ответ, в том числе на ППВ-23, блокируется в значительно меньшей степени [49].
Отсутствие значимого ингибирующего влияния иФНО-α на иммуногенность ППВ-23 у больных РА подтверждено другими авторами [22].
Французскими исследователями продемонстрирована безопасность последовательного применения ПКВ-13 и ППВ-23 у больных СКВ, однако это не обеспечило преимуществ в отношении иммуногенности по сравнению с таковой при назначении ППВ-23 в отдельности [50].
Наконец, в ходе пятилетнего проспективного наблюдения, выполненного в НИИР им. В.А. Насоновой, отмечена достаточная и длительная иммуногенность ППВ-23 у больных РА. Значимое повышение коэффициента поствакцинального ответа сохранялось у 68,3% пациентов [51].
Вопрос о длительности поддержания протективного эффекта пневмококковых вакцин и сроках ревакцинации у пациентов с РА и другими ИВРЗ остается открытым и требует решения в дальнейших исследованиях.
Заключение
В настоящее время вакцинация от пневмококковой инфекции является общепризнанной процедурой при курации пациентов с ИВРЗ, особенно тех, кто получает иммуносупрессивную терапию. Пневмококковая вакцинация необходима даже для тех больных, у которых ожидается субоптимальный ответ. Несомненно, что в целях отработки более четких показаний для вакцинации, определения временных интервалов для ревакцинации, оценки эффективности и безопасности новых пневмококковых вакцин, а также изучения влияния на результаты иммунизации различных антиревматических препаратов у больных ИВРЗ необходимы дальнейшие многоцентровые крупномасштабные исследования.
Исследование выполнено в рамках научно-исследовательской работы ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», № государственного задания 1021051503137-7.
Исследование не имело спонсорской поддержки.
Конфликт интересов отсутствует.
B.S. Belov, MD, PhD, N.V. Muravyova, PhD, G.M. Tarasova, PhD, M.M. Baranova
V.A. Nasonova Research Institute of Rheumatology
Contact person: Boris S. Belov, belovbor@yandex.ru
Pneumonia occupies one of the leading places in the structure of serious infections in patients with immuno-inflammatory rheumatic diseases (IIRD). One of the methods to combat these complications is pneumococcal vaccination. Despite the existing recommendations of international and national medical associations, many practitioners still continue to consider IVR as a contraindication for vaccination. The leading reasons for this approach are the risk of recurrence of the background disease and the decrease in the effectiveness of the vaccine against the background of active immunosuppressive therapy.
The article analyzes the data on the immunogenicity and safety of vaccines against pneumococcal infection in patients with IIRD. It has been shown that most antirheumatic drugs (except anti-B-cell and, to a lesser extent, methotrexate and abatacept) do not have significant effect on the immunogenicity of pneumococcal vaccines. Post-vaccinal reactions develop in about 1/3 of cases. According to the literature and personal experience, these reactions are weakly expressed and resolve themselves within one to three days. There are no exacerbations of background IIRD or the development of new autoimmune phenomena in vaccinated patients.
