Взаимосвязь между уровнем антител к рецептору тиреотропного гормона, полиморфизмом гена глюкокортикоидного рецептора и ответом на глюкокортикоидную терапию у больных эндокринной офтальмопатией
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование включены 28 больных ЭОП, у которых взяты образцы крови для определения уровня АТ к рТТГ в сыворотке крови и молекулярно-генетического исследования (МГИ) с определением полиморфизма гена рецептора ГК (РГК) NR3C1. Сформированы группы пациентов и рассчитан показатель встречаемости полиморфизмов гена рецептора ГК в зависимости от уровня АТ к рТТГ, эффекта от проведенного лечения и наличия в анамнезе ГКТ.
Результаты. Полученные данные отрицают связь между уровнем АТ к рТТГ и наличием полиморфизмов гена РГК. Результаты МГИ показали отсутствие связи между уровнем АТ к рТТГ, наличием полиморфизмов гена РГК и ответом на проводимую ГКТ (р > 0,05). Наличие полиморфизма NR3C1 39739G>A/rs6189 у пациентов без эффекта от впервые проведенной ГКТ может указывать на первичную резистентность. Наличие полиморфизмов NR3C1 40761A>G/rs56149945 и NR3C1 41503C>G/rs41423247 у пациентов с положительным эффектом от очередной ГКТ может свидетельствовать о повышенной чувствительности к ГК.
Выводы. Не отмечено взаимосвязи между уровнем АТ к рТТГ, полиморфизмами РГК и ответом на проведенную ГКТ. Не выявлено роли полиморфизма гена рецептора ГК в патогенезе развития ЭОП. Вместе с тем требуется дальнейшее изучение полиморфизмов гена РГК для определения причин повышенной чувствительности или резистентности к ГК.
Материал и методы. В исследование включены 28 больных ЭОП, у которых взяты образцы крови для определения уровня АТ к рТТГ в сыворотке крови и молекулярно-генетического исследования (МГИ) с определением полиморфизма гена рецептора ГК (РГК) NR3C1. Сформированы группы пациентов и рассчитан показатель встречаемости полиморфизмов гена рецептора ГК в зависимости от уровня АТ к рТТГ, эффекта от проведенного лечения и наличия в анамнезе ГКТ.
Результаты. Полученные данные отрицают связь между уровнем АТ к рТТГ и наличием полиморфизмов гена РГК. Результаты МГИ показали отсутствие связи между уровнем АТ к рТТГ, наличием полиморфизмов гена РГК и ответом на проводимую ГКТ (р > 0,05). Наличие полиморфизма NR3C1 39739G>A/rs6189 у пациентов без эффекта от впервые проведенной ГКТ может указывать на первичную резистентность. Наличие полиморфизмов NR3C1 40761A>G/rs56149945 и NR3C1 41503C>G/rs41423247 у пациентов с положительным эффектом от очередной ГКТ может свидетельствовать о повышенной чувствительности к ГК.
Выводы. Не отмечено взаимосвязи между уровнем АТ к рТТГ, полиморфизмами РГК и ответом на проведенную ГКТ. Не выявлено роли полиморфизма гена рецептора ГК в патогенезе развития ЭОП. Вместе с тем требуется дальнейшее изучение полиморфизмов гена РГК для определения причин повышенной чувствительности или резистентности к ГК.





Введение
Эндокринная офтальмопатия (ЭОП) считается потенциально опасным для зрения хроническим аутоиммунным заболеванием мягких тканей орбиты, тесно связанным с аутоиммунными заболеваниями щитовидной железы (ЩЖ), и характеризуется развитием отека ретробульбарной клетчатки и экстраокулярных мышц с последующим возникновением фиброза [1].
Не всегда удается достигнуть желаемого результата при лечении пациентов с ЭОП, поскольку патогенетические механизмы развития болезни до конца не изучены. Внутривенное введение глюкокортикоидов (ГК) в высоких дозах – основной метод лечения тяжелой, активной стадии ЭОП [2]. У ряда пациентов эффект от глюкокортикоидной терапии (ГКТ) отсутствует или слабо выражен, что делает актуальным изучение патогенеза заболевания с целью разработки новых эффективных схем лечения.
Цель – изучить наличие взаимосвязи между уровнем антител к рецепторам ТТГ, наличием полиморфизма гена рецептора ГК и эффектом от ГКТ у больных ЭОП.
Материал и методы
В исследование включены 28 больных ЭОП (20 женщин и восемь мужчин), у которых взяты образцы крови для определения уровня антител к рецептору тиреотропного гормона (АТ к рТТГ) в сыворотке крови и молекулярно-генетического исследования (МГИ). Всем пациентам проведено клинико-инструментальное обследование в отделе офтальмоонкологии и радиологии ФГБУ «НМИЦ глазных болезней им. Гельмгольца» Минздрава России. Активность течения ЭОП оценивали по шкале CAS (Сlinical Аctive Score) 1989 г.
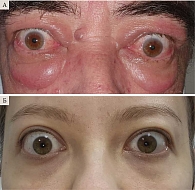
Пациентов разделили на две группы. Первую группу составили восемь пациентов (16 глаз) – пять женщин и трое мужчин в возрасте от 28 до 54 лет (43,0 ± 7,07 года) с нормальным уровнем АТ к рТТГ. У двух пациентов имела место активная стадия ЭОП (CAS – 3 и 4 балла), у шести – неактивная (CAS – от 0 до 2 баллов). Во вторую группу вошли 20 пациентов (40 глаз) – 15 женщин и пять мужчин в возрасте от 24 до 67 лет (50,0 ± 4,95 года) с высоким уровнем АТ к рТТГ. У 14 пациентов отмечалась активная стадия ЭОП (CAS – 5 ± 1,0 балла), у шести – неактивная (СAS – от 1 до 2 баллов) (рисунок). Исследование крови на АТ к рТТГ проводили до начала ГКТ ЭОП.
В обеих группах рассчитывали показатель встречаемости полиморфизма гена глюкокортикоидного рецептора (РГК), оценивали эффект от проведенной ГКТ.
Для оценки эффекта ГКТ из тех же пациентов сформированы две другие группы в зависимости от наличия (группа А) или отсутствия (группа В) в анамнезе ГКТ на момент обращения. В группу А включены 20 пациентов (40 глаз) – 14 женщин и шесть мужчин в возрасте от 24 до 64 лет (45,2 ± 14,14 года), в группу В – восемь пациентов (16 глаз) – шесть женщин и двое мужчин в возрасте от 32 до 67 лет (54,0 ± 0,0 года).
МГИ проводили в НИИ общей патологии и патофизиологии методом ПДРФ-анализа лейкоцитов периферической крови, исследуя наличие полиморфизмов гена рецептора ГК (NR3C1 40761A>G/rs56149945, 41503C>G/rs41423247, 39739G>A/rs6189, 39741G>A/rs6190). Определяли наличие мутаций в гене РГК по типу замены единичного нуклеотида.
Во всех группах рассчитан показатель встречаемости полиморфизма гена РГК, оценен эффект от ГКТ.
Для обработки данных между двумя группами, проверки достоверности различий средних значений использовали точный критерий Фишера для малых выборок. Различия считались достоверными при p < 0,05 с доверительным интервалом 95%.
Результаты и обсуждение
Патогенез аутоиммунных заболеваний, в том числе ЭОП, может быть обусловлен наличием мутаций различных генов в организме, что приводит к изменениям работы иммунной системы и выработке аутоантител к рецепторам ТТГ. Считается, что механизм патогенеза ЭОП многофакторный: при наличии генетической предрасположенности и неблагоприятного воздействия внешней среды запускается каскад реакций в иммунной системе, приводящий к поражению ретробульбарной клетчатки и экстраокулярных мышц за счет аутоагрессии [1]. Предполагают, что механизмы потенциального прогрессирования ЭОП могут быть связаны с активацией аутоиммунных процессов в орбитальных тканях на фоне высокого уровня АТ к рТТГ [3]. Антитела к рецепторам ТТГ гетерогенны по своему характеру, антитела первого типа – стимулирующие, подобно ТТГ, связываются с тиреоидными клетками и стимулируют их, антитела второго типа – тормозящие, блокируют стимуляцию ЩЖ. Но в целом преобладают антитела стимулирующего действия. Причиной развития болезни Грейвса является аутоиммунный процесс с образованием именно стимулирующих антител к рецептору ТТГ. Патогенетическая роль данных антител впервые была доказана в 1956 г., когда D.D. Adams воспроизвел клиническую картину болезни Грейвса путем инъекции плазмы от больного. Поскольку рецептор ТТГ располагается не только на клетках щитовидной железы, но также на фибробластах, адипоцитах и лимфоцитах, одним из экстратиреоидных проявлений считается ЭОП, что обусловлено связыванием антител с указанными клетками в ретробульбарной клетчатке и экстраокулярных мышцах. Высокий титр антител к рецептору ТТГ (> 10–15 МЕ/л) коррелирует с тяжестью и неблагоприятным течением болезни. По мнению H.A. Drexhage, ЩЖ и орбитальные ткани имеют одинаковые антигены, а ЭОП может развиться вследствие перекрестного реагирования антител к антигенам ЩЖ с тканями орбиты [4]. Посредством антител аутоиммунная активация фибробластов орбиты приводит к усиленному адипогенезу, избыточному синтезу гидрофильных глюкозаминогликанов и экспрессии иммуномодуляторов в орбите. Как следствие – отек и увеличение в объеме мягких тканей орбиты с развитием экзофтальма, нарушение подвижности глаз, компрессия зрительного нерва и изъязвление роговицы [5].
Из 28 обследованных пациентов у 20 (71%) уровень АТ к рТТГ составил от 2,23 до 180,0 МЕ/л (25,94 ± 1,54 МЕ/л), что соответствует данным других исследований [1, 6]. Так, в исследовании Н.А. Петуниной и соавт. антитела к рТТГ оказались положительными у 87,7% пациентов с ЭОП [6].
У 16 пациентов диагностирована ЭОП в активной стадии (CAS – от 3 до 7 баллов). У 14 из них уровень АТ к рТТГ составил от 2,7 до 180,0 МЕ/л (в среднем 19,9 ± 1,54 МЕ/л), и только у двух больных он составил 0,6 МЕ/л и 0,7 МЕ/л, что соответствует норме. По мнению Н.Ю. Свириденко и соавт., уровень АТ к рТТГ и частота их выявления у пациентов с активной фазой ЭОП существенно выше, чем у пациентов с неактивной фазой (при тиреотоксикозе – 21,2 и 7,5, гипотиреозе – 11,6 и 4,6, эутиреозе – 12,3 и 6,6 соответственно, для всех сравнений p ≤ 0,0001) [7], что отмечалось и в данном исследовании.
Из 12 пациентов с неактивной стадией ЭОП у шести уровень АТ к рТТГ превысил норму (7,3 ± 4,18 МЕ/л), у шести находился в пределах нормы (0,6 ± 0,26 МЕ/л), что также соответствует результатам более ранних исследований (табл. 1) [1, 6, 7].
В настоящее время область применения ГК чрезвычайно широка. ГК – самые мощные и универсальные противовоспалительные средства с выраженной иммуномодулирующей активностью. Благодаря ГК достигнут значительный прогресс в лечении многих аутоиммунных и аллергических заболеваний. При системной склеродермии, системных васкулитах, ЭОП, ревматической полимиалгии, дерматомиозитах и полимиозитах, гигантоклеточном артериите, диффузном эозинофильном фасциите ГК признаны препаратами выбора. ГК действуют на клетки-мишени в основном через внутриклеточные рецепторы и регулируют экспрессию разных генов. Однако ГК не всегда эффективны из-за резистентности клеток-мишеней. Резистентность может быть обусловлена множеством причин как функционального, так и генетического характера [8].
Как известно, ГК, будучи активными иммунодепрессантами, являются золотым стандартом лечения ЭОП. ГК в высокой концентрации тормозят иммунологический ответ организма, влияют на процессинг антигена макрофагами, выработку антител В-лимфоцитами, супрессорную и хелперную функции Т-лимфоцитов и метаболизм антител. Иммунодепрессивный эффект достигается за счет снижения количества Т-лимфоцитов (хелперов) в крови и уменьшения их влияния на выработку иммуноглобулинов и содержания В-лимфоцитов [9, 10].
Считается, что действие ГК реализуется посредством рецепторов ГК и гена NR3C1, кодирующего данный рецептор, который может быть представлен в виде различных полиморфизмов. Описаны несколько полиморфизмов гена РГК, связанных с изменением чувствительности к ГК. Наиболее распространенными и изученными являются полиморфные варианты гена NR3C1 40761A>G/rs56149945, 41503C>G/rs41423247, 39739G>A/rs6189, 39741G>A/rs6190. Наличие полиморфизмов 40761A>G/rs56149945, 39739G>A/rs6189, 39741G>A/rs6190 связывают со снижением чувствительности ГК вплоть до резистентности, а полиморфизм 41503C>G/rs41423247 – с повышенной чувствительностью к ГК [11, 12]. В исследовании О.С. Тороповой полученные результаты фармакогенетического тестирования по гену NR3C1 (полиморфного варианта rs6190) не позволяют достоверно подтвердить влияние полиморфизма исследуемого гена на эффективность ГКТ у больных ЭОП [12].
Данные Национального института здоровья США свидетельствуют о наличии 2571 полиморфизма гена NR3C1 по типу замены единичного нуклеотида (single nucleotide polymorphism, SNP). Некоторые из полиморфизмов гена нарушают структуру белка, приводя к развитию семейных генерализованных форм глюкокортикоидной резистентности [11].
Несмотря на активное изучение, многие звенья патогенеза ЭОП до настоящего времени детально не изучены. В связи с этим в данном исследовании проанализирована встречаемость некоторых полиморфизмов гена NR3C1 в зависимости от уровня АТ к рецептору ТТГ до начала лечения и ответа на ГКТ.
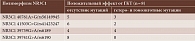
При изучении полиморфизмов гена NR3C1 считали, что дикий вариант – наиболее распространенный полиморфизм в природной популяции фенотипа, то есть аллель, который чаще встречается в свободноживущей популяции, с отсутствием мутаций. Для полиморфизма гена NR3C1 40761A>G/rs56149945 дикий тип обозначается АА, недикий – АG и GG.
У 27 пациентов обеих групп полиморфизм гена NR3C1 39741G>A/rs6190 представлен без мутаций и только у одного пациента из первой группы в виде гетерозиготной мутации. Полиморфизмы гена NR3C1 40761A>G/rs56149945 и NR3C1 41503C>G/rs41423247 также чаще регистрировались в обеих группах преимущественно в диком типе. Полиморфизм РГК NR3C1 39739G>A/rs6189 во второй группе встречался в основном без мутации, в то время как в первой группе частота дикого и недикого типов того же полиморфизма РГК NR3C1 была одинаковой (табл. 1). В обеих группах, с высоким и нормальным уровнем АТ к рТТГ, при расчете показателя встречаемости типов полиморфизмов гена РГК не выявлено статистически достоверных различий (р > 0,05). Таким образом, полученные данные отрицают связь между уровнем АТ к рТТГ и наличием полиморфизмов гена РГК, что позволяет предположить отсутствие роли полиморфизмов гена РГК в патогенезе ЭОП.
Всем больным проведено лечение ЭОП, которое включало только ГКТ. У 26 пациентов отмечалась положительная динамика от проводимой ГКТ: у всех пациентов первой группы (восемь пациентов с нормальным уровнем АТ к рТТГ) и 18 пациентов второй группы (с повышенным уровнем АТ к рТТГ). У двух пациентов второй группы эффекта от лечения не зафиксировано (табл. 2 и 3). Результаты МГИ подтвердили отсутствие связи между уровнем АТ к рТТГ, наличием полиморфизмов гена РГК и ответом на проводимую ГКТ (р > 0,05). Однако обращают на себя внимание восемь пациентов второй группы (высокий уровень АТ к рТТГ) с выявленным недиким типом полиморфизма гена NR3C1 39739G>A/rs6189. Установленные различия позволяют предположить актуальность дальнейшего исследования данного полиморфизма на большей выборке пациентов.
Основную роль в реализации эффектов ГК играют внутриклеточные рецепторы, которые представляют собой цитозольные белки, способные связываться с ДНК, из семейства лигандчувствительных регуляторов транскрипции. К этому же семейству относят рецепторы минералокортикоидов, тиреоидных гормонов, ретиноидов и витамина D [13]. В геноме человека внутриклеточные рецепторы регулируют экспрессию 10–20% генов. ГК проникают в клетки-мишени, связываются в цитозоле с внутриклеточными рецепторами и образуют гормонрецепторные комплексы. Эти комплексы поступают в ядро, связываются с гормончувствительными элементами определенных генов и активируют либо подавляют их транскрипцию, что приводит к функциональным и морфологическим изменениям в клетках-мишенях [14]. В некоторых клетках обнаружены и рецепторы ГК на плазматической мембране. Показано, что такие рецепторы опосредуют быстрые, внегеномные эффекты ГК. Негеномный противовоспалительный эффект ГК связывают со стабилизацией лизосомальных мембран, уменьшением проницаемости клеточных мембран, снижением капиллярной проницаемости и локального кровотока в участках воспаления, уменьшением набухания эндотелиальных клеток, снижением способности иммунных комплексов проникать через базальную мембрану, торможением роста фибробластов, подавлением синтеза коллагена и мукополисахаридов, сужением сосудов в очаге воспаления и понижением их проницаемости (частично за счет ингибиции синтеза простагландинов), уменьшением в очаге воспаления количества моноцитов и мононуклеарных клеток, а также воздействием на полиморфноядерные лейкоциты [15]. У разных людей внутриклеточные рецепторы функционируют по-разному и иногда их функция нарушается. По этим причинам ГК в ряде случаев оказываются неэффективными. В процессе изучения причин неэффективности ГК у некоторых больных сформировалось понятие рефрактерности к ГК [8]. По данным литературы, выделяют две формы рефрактерности к ГК – геномную и негеномную. В основе геномной (первичной) рефрактерности лежит снижение чувствительности к ГК, отсутствие эффекта от их применения обусловлено генетической вариабельностью, в том числе полиморфизмом на уровне гена глюкокортикоидного рецептора NR3C1 [16]. При вторичной рефрактерности (ятрогенной) пациенты отмечают незначительный, непродолжительный положительный эффект от терапии ГК при их многократном бессистемном назначении в неадекватных дозах, в том числе на фоне декомпенсации функции ЩЖ [17].
По мнению А.И. Дядык и соавт. (2010 г.), наиболее мощный иммунодепрессивный эффект in vitro демонстрируют метилпреднизолон и бетаметазон, промежуточный – дексаметазон, преднизолон, гидрокортизон, наименьший – преднизолон. Безусловно, в зависимости от характера, остроты и тяжести заболевания, а также вовлечения в патологический процесс жизненно важных органов и систем разнятся как пути введения ГК, так и их дозы [15]. Прерывистые схемы применения ГК можно считать наиболее перспективными – за счет увеличения суточной дозы препарат принимается не каждый день. Наиболее эффективной представляется внутривенная пульс-терапия максимальными дозами [18].
Среди 28 пациентов, включенных в исследование, 20 больным ранее проводили лечение ЭОП ГК (группа А), восемь пациентов не получали ГКТ до момента обращения в НМИЦ глазных болезней им. Гельмгольца (группа В). Показатели встречаемости полиморфизмов гена РГК в этих группах приведены в табл. 4.
В группе А пульс-терапию ГК получали 11 пациентов, пероральные ГК – десять пациентов, локальное введение ГК – десять больных с использованием различных режимов, комбинаций методов введения ГК и доз. Современная ГКТ отличается многообразием форм: системное (пероральное или парентеральное) введение препаратов, локальная терапия (пара-, ретробульбарно) или местная (мазь, капли). Важным этапом на пути повышения эффективности ГКТ стало внедрение в клиническую практику метода пульс-терапии, под которым подразумевают внутривенное введение высоких доз ГК. Большой интерес представляют полученные данные об эффектах ГКТ в зависимости от доз [19]. В низких концентрациях (> 10–12 моль/л) ГК реализуют свое действие за счет так называемых геномных эффектов, в средних концентрациях (> 10–9 моль/л) – за счет как геномных, так и рецепторопосредованных. В высоких концентрациях (> 10–4 моль/л) наряду с перечисленными выше эффектами определенную роль играет способность ГК влиять на физико-химические свойства биомембран клеток-мишеней. Эти данные в определенной степени позволяют объяснить различия в противовоспалительной и иммуномодулирующей активности ГК при назначении больным в низких (< 10 мг/сут), средних/высоких (~ 1 мг/кг/сут) дозах или пульс-терапии (1 г/сут).
В последние годы особое внимание исследователей привлекает проблема резистентности к ГК. Полагают, что частота резистентности в популяции достаточно высокая и затрагивает не менее 25% здоровых индивидуумов. В основе резистентности к ГК лежат разнообразные, пока еще недостаточно изученные механизмы, регистрируемые на клеточном, молекулярном и рецепторном уровнях [20].
В группе А среди ранее получавших ГКТ у 15 пациентов отмечалась положительная динамика на фоне лечения. У пяти пациентов не зарегистрировано эффекта от терапии, проведенной на базе НМИЦ глазных болезней им. Гельмгольца. При анализе результатов достоверной разницы (р > 0,05) между обеими группами не выявлено. Во всех полиморфизмах гена РГК преобладал дикий тип, в том числе в полиморфизме гена NR3C1 39741G>A/rs6190 – 100% случаев (табл. 5).
В группе В (ранее не получавших ГКТ) у пяти пациентов отмечался положительный ответ на проведенное лечение, у троих эффекта от лечения не зафиксировано. При анализе полученных данных (табл. 6) статистически значимых различий между двумя группами А и В не выявлено (р > 0,05). У трех пациентов группы В без эффекта от лечения можно предположить наличие первичной рефрактерности к ГК. У этих пациентов полиморфизмы гена РГК NR3C1 40761A>G/rs56149945, 41503C>G/rs41423247, 39741G>A/rs6190 встречались только в диком типе, а полиморфизм 39739G>A/rs6189 представлен и в гетерозиготном типе. Возможно, такой полиморфизм играет роль в развитии первичной резистентности к ГК. Следует отметить, что у пяти пациентов группы А с отсутствием эффекта от ГКТ может иметь место вторичная резистентность к ГК. Однако у 15 пациентов группы А, получавших ранее ГК, наблюдался положительный эффект от терапии, а МГИ подтвердило наличие полиморфизмов гена РГК NR3C1 40761A>G/rs56149945 и 41503C>G/rs41423247 (встречались исключительно в диком типе у пациентов с отсутствием эффекта от ГКТ в группе В), что может свидетельствовать об их роли в повышенной чувствительности к ГК.
Выводы
Результаты предварительных исследований позволяют утверждать, что уровень АТ к рТТГ и частота их выявления у пациентов с активной фазой ЭОП существенно выше, чем у пациентов с неактивной фазой ЭОП. При этом взаимосвязи между уровнем АТ к рТТГ, полиморфизмами РГК и ответом на проведенную ГКТ не выявлено. Исходя из анализа полученных результатов, можно предположить, что наличие полиморфизма гена рецептора ГК (NR3C1 40761A>G/rs56149945, 41503C>G/rs41423247, 39739G>A/rs6189, 39741G>A/rs6190) не является одним из возможных звеньев патогенеза ЭОП. Вместе с тем требуется дальнейшее изучение полиморфизмов гена РГК (NR3C1 40761A>G/rs56149945, 41503C>G/rs41423247, 39739G>A/rs6189) для определения причин повышенной чувствительности или резистентности к ГК.
O.G. Panteleyeva, PhD, F.Kh. Batyrbekova, S.V. Saakyan, PhD, Prof., A.Yu. Tsygankov, PhD, O.S. Sirmays, PhD, A.M. Burdenny, PhD, V.I. Loginov, PhD, N.S. Martirosyan, PhD, N.A. Petunina, RASci Corr.-Mem., PhD, Prof.
Helmholtz National Medical Research Center of Eye Diseases
Institute of General Pathology and Pathophysiology
I.M. Sechenov First State Medical University
Contact person: Fatima H. Batyrbekova, juldus07@mail.ru
Purpose – to study the relationship between the level of antibodies to TSH receptors, the presence of glucocorticoid (GC) receptor gene polymorphism and the effect of glucocorticoid therapy (GCT) in patients with Grave's ophthalmopathy.
Material and methods. The study included 28 patients with Grave's ophthalmopathy. Blood samples were taken to determine the level of antibodies to TSH receptors in the blood serum and a molecular genetic study (MG) to determine the polymorphism of the GC receptor of NR3C1 gene. Patients were divided into groups and the incidence of GC receptor gene polymorphisms was calculated depending on the level of antibodies to TSH receptors, the effect of the treatment, and the presence of GCT.
Results. The obtained data deny the relationship between the level of antibodies to TSH receptors and the presence of GC receptor gene polymorphisms. The results of MG confirmed the absence of a relationship between the level of antibodies to TSH receptors, the presence of GC receptor gene polymorphisms, and the therapeutic response to GCT (p > 0.05).
The presence of the NR3C1 39739G>A/rs6189 polymorphism in patients without effect from the first GCT may indicate primary resistance. The presence of the polymorphism NR3C1 40761A>G/rs56149945 and NR3C1 41503C>G/rs41423247 in patients with a positive effect from the next GCT may indicate an increased sensitivity to GC.
Conclusion. There was no correlation between the level of antibodies to TSH receptors, GC receptor gene polymorphisms and the response to GCT. The role of GC receptor gene polymorphism in the pathogenesis of Grave's ophthalmopathy development was not revealed. At the same time, further study of the GC receptor gene polymorphisms is required to determine the causes of increased sensitivity or resistance to GC.

