Новый подход к ведению пациентов с псориазом кожи и аксиальными поражениями: ранняя диагностика и ускоренная терапия
- Аннотация
- Статья
- Ссылки
- English
Результаты исследования. В нашем исследовании распространенность аксиальных поражений у больных псориазом кожи, согласно критериям воспалительной боли ASAS, составила 36,1%. По данным ретроспективного анализа, ранними проявлениями аксиальных поражений у пациентов с псориазом кожи являются ноющая, тянущая боль в спине (37,2%) или шее (22,1%), а также чувство скованности в спине (46,3%) или шее (38,9%). По результатам МРТ, у 95,4% пациентов с псориазом кожи и воспалительной болью в спине (ВБС) выявлен активный сакроилеит. Выявлена значимая ассоциация между наличием ВБС и активным сакроилеитом (p < 0,001). На основании опросников выявления псориатического артрита (PEST, mPEST, SiPAS, ToPAS) нами был разработан возможный универсальный скрининг ранних проявлений псориатического артрита у пациентов с псориазом кожи с учетом аксиальных поражений. Клиническая часть исследования заключалась в назначении блокатора ИЛ-17 (нетакимаб) пациентам с псориазом и ранними проявлениями ПсА. В результате наблюдений не отмечено прогрессирования структурных повреждений на рентгенограмме шейного отдела позвоночника. Применение ингибитора ИЛ-17А приводило к снижению выраженности не только аксиальных проявлений заболевания, но также энтезита и дактилита. Все пациенты сообщили об уменьшении воспалительной боли в спине на 12, 24 и 52-й неделях со средним значением BASDAI 5,9 (SD = 2,3), 4,1 (SD = 1,3) и 2,7 (SD = 0,9) соответственно.
Результаты исследования. В нашем исследовании распространенность аксиальных поражений у больных псориазом кожи, согласно критериям воспалительной боли ASAS, составила 36,1%. По данным ретроспективного анализа, ранними проявлениями аксиальных поражений у пациентов с псориазом кожи являются ноющая, тянущая боль в спине (37,2%) или шее (22,1%), а также чувство скованности в спине (46,3%) или шее (38,9%). По результатам МРТ, у 95,4% пациентов с псориазом кожи и воспалительной болью в спине (ВБС) выявлен активный сакроилеит. Выявлена значимая ассоциация между наличием ВБС и активным сакроилеитом (p < 0,001). На основании опросников выявления псориатического артрита (PEST, mPEST, SiPAS, ToPAS) нами был разработан возможный универсальный скрининг ранних проявлений псориатического артрита у пациентов с псориазом кожи с учетом аксиальных поражений. Клиническая часть исследования заключалась в назначении блокатора ИЛ-17 (нетакимаб) пациентам с псориазом и ранними проявлениями ПсА. В результате наблюдений не отмечено прогрессирования структурных повреждений на рентгенограмме шейного отдела позвоночника. Применение ингибитора ИЛ-17А приводило к снижению выраженности не только аксиальных проявлений заболевания, но также энтезита и дактилита. Все пациенты сообщили об уменьшении воспалительной боли в спине на 12, 24 и 52-й неделях со средним значением BASDAI 5,9 (SD = 2,3), 4,1 (SD = 1,3) и 2,7 (SD = 0,9) соответственно.

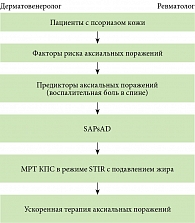
Введение
Псориаз (ПсО) – распространенное, генетически детерминированное иммуновоспалительное заболевание, поражающее около 125 млн человек (1–2% населения) во всем мире [1]. В 2014 г. Всемирная организация здравоохранения назвала псориаз одним из серьезнейших неинфекционных заболеваний. Все чаще сообщается об увеличении случаев торпидных, резистентных к стандартной терапии, тяжелых форм псориаза, необратимых повреждений суставов, что приводит к значительному снижению качества жизни, инвалидизации [2, 3].
Поражение костно-суставной системы при псориазе приводит к развитию псориатического артрита (ПсА). Распространенность ПсА в популяции за период 2011–2018 гг. увеличилась на 11%. Ранним проявлением ПсА у пациентов с псориазом могут быть аксиальные (осевые) поражения (АксП). Данных о распространенности аксиальных поражений у больных псориазом практически нет [4, 5]. Поражения позвоночника встречаются у 25–70% пациентов с уже диагностированным ПсА [5]. Изменения позвоночника при ранних формах ПсА часто протекают клинически малосимптомно [6]. Около 20% пациентов с ПсА не проявляют выраженных симптомов аксиальных поражений, а в 25% случаев вовсе не испытывают боли (латентное течение). Большинство пациентов с ПсА и АксП имеют предшествующий ПсО. Около 15% могут не иметь поражения кожи на момент диагностирования поражений позвоночника [5].
Несвоевременность обнаружения признаков АксП приводит к более позднему назначению лечения, развитию необратимых повреждений суставов, инвалидизации, ухудшению качества жизни больных [7]. При ПсА часто регистрируются случаи нетрудоспособности – пациенты либо имеют сложности на работе, либо вынуждены не работать вовсе. При проведении опроса по поводу возникших ограничений на работе у 107 пациентов с ПсА было выявлено, что производительность труда снизилась на 6,7%, более половины пациентов отметили выраженную утомляемость. В реестре Corrona Psoriasis Registry также сообщали о значительном влиянии АксП на трудоспособность и физическую активность [8]. Пациенты с АксП имели более высокий процент упущенного по болезни рабочего времени, сниженное качество выполняемой работы по сравнению с пациентами без аксиального вовлечения. Нетрудоспособность при АксП приводит к снижению производительности труда и нагрузке на систему здравоохранения. Согласно обзору, проведенному системой здравоохранения США за четырехлетний период, хроническая боль в спине занимала одно из первых мест по минутам ежедневной потери производительности и годовым затратам на человека (1920 долл. США). В недавнем исследовании, проведенном в США, общая стоимость лечения для пациентов с болью в спине в течение 12 месяцев после диагностирования АксП составила 1,8 млрд долл. США.
Помимо необратимых изменений в суставах, прогрессирование ПсА повышает риск развития тяжелых депрессивных состояний, что еще раз подчеркивает необходимость точной идентификации и ранней диагностики боли в спине у таких пациентов. Кроме того, эффективная терапия может предотвратить сердечно-сосудистую смертность, главным образом инфаркт миокарда и инсульт. Первые данные, полученные в ретроспективных когортных исследованиях, свидетельствуют о том, что соответствующая терапия может значительно снизить риск инфаркта миокарда [9].
Паттерны экспрессии генов в пораженной коже людей с псориазом значительно отличаются от паттернов экспрессии в непораженной, клинически нормальной коже. Разрешение эпидермальной реакции при псориазе после успешного системного лечения не сопровождается полным исчезновением воспаления, что определяется экспрессией ключевых цитокинов и хемокинов [10, 11]. Данный феномен остаточной геномной экспрессии был предварительно охарактеризован как «молекулярный рубец». Это может привести к субклиническому воспалению, ответственному за ранний рецидив заболевания. Следовательно, эффективная стратегия лечения псориаза должна быть нацелена на эту дисфункцию и учитывать генетическую основу, которая сохраняется, несмотря на клинически эффективную терапию.
В механизме развития и поддержания воспалительных реакций при псориазе участвуют различные популяции Т-лимфоцитов и провоспалительные цитокины [12, 13]. При первичном контакте антигена с наивными Т-клетками возникает большое количество различных субпопуляций короткоживущих эффекторных клеток, часть из которых подвергается клеточной гибели, а часть выживших Т-клеток остается в организме и формирует иммунологическую память [14, 15]. Долгоживущие Т-клетки памяти во время вторичного воздействия антигена начинают интенсивно пролиферировать, что приводит к формированию более сильного агрессивного иммунного ответа [16]. Сохранение Т-клеток памяти после дебюта псориаза объясняет его неизлечимость и рецидивирующее течение [16–18]. Резидентные CD4+-Т-клетки продуцируют провоспалительные цитокины интерлейкин (ИЛ) 17 и ИЛ-22 и вовлекают кератиноциты в каскад воспалительных реакций, а CD8+-клетки памяти усиливают воспаление в очагах поражения, привлекая в кожу другие иммунные клетки [17, 19]. Кроме того, с увеличением длительности течения псориаза увеличивается и количество клеток памяти как у взрослых, так и у детей [20, 21]. Также имеется прямая зависимость со степенью тяжести кожного процесса – чем тяжелее течение псориаза, тем больше клеток памяти формируется [16]. В исследованиях было показано, что количество эффекторных и терминально-дифференцированных эффекторных CD4+- и CD8+-клеток памяти зависит от типа терапии: наименьшее количество этих клеток выявлено после системной терапии [20]. Данные факты также подтверждают концепцию раннего начала терапии для предотвращения прогрессирования заболевания.
Характеристика аксиальных поражений при ПсА остается плохо изученной, так как в настоящее время проведено мало исследований данной патологии, нет данных о распространенности АксП у пациентов с ПсО, не сформированы алгоритмы диагностики АксП при ПсА. Поздняя диагностика ПсА также ассоциируется с существенным ухудшением эффективности терапии. Лучшее распознавание воспалительной боли в спине (ВБС), АксП при ПсА на доклинических стадиях может способствовать раннему началу лечения и предотвращению инвалидизации. Необходимо формирование междисциплинарных стандартизированных протоколов ведения таких пациентов. Таким образом, возрастает роль дерматовенерологов в выявлении данных поражений и своевременном направлении пациентов на ревматологическое обследование [22–24].
Факторы риска аксиальных поражений при ПсА
АксП при ПсА, по данным литературы, проявляются в основном в возрасте 30–40 лет. Клиническими факторами риска аксиальных поражений являются тяжелые формы псориаза кожи, молодой возраст начала псориаза, тяжелый периферический артрит, дистрофия ногтей, рентгенологически поврежденные суставы, периостит, повышенные острофазовые реагенты, большая продолжительность заболевания, HLA-B27-позитивность. Согласно исследованиям, эрозии периферических суставов чаще встречались у пациентов с аксиальными поражениями. Считается, что значимым фактором риска аксиальных поражений при ПсА является наличие HLA-B27. Однако пациенты с аксиальным поражением могут и не иметь данного генетического маркера. Тем не менее распространенность осевых поражений у пациентов с HLA-B27 значительно выше, чем без HLA-B27. Так, HLA-B27 был предложен в качестве генетического маркера АксП при ПсА. В*08:01:01–С*07:01:01 и входящие в его состав аллели ассоциированы с деформациями и сращениями суставов, асимметричным сакроилеитом и дактилитом. HLA-B*08:01:01-C*07:01:01 и HLA-B*37:01:01-C*06:02:01 также были связаны с самой высокой оценкой предрасположенности к тяжелому ПсА. Однако ген HLA-B27 экспрессируется у 8% населения в целом. Считается, что положительная реакция на HLA-B27 или отсутствие положительной реакции на HLA-B27 не может рассматриваться как диагностический признак [5].
Предикторы аксиальных поражений при псориатическом артрите
Основным ранним признаком аксиальных поражений является ВБС. При целенаправленном опросе ВБС выявляется у 65% больных ПсА. ВБС предполагает воспаление крестцово-подвздошных сочленений (КПС) и нижней части позвоночника. Патогенез возникновения ВБС связан с действием различных медиаторов воспаления в осевых суставах и развитием каскада провоспалительных изменений. Данный процесс приводит к реактивному циклу несбалансированного ремоделирования костей, связанному с потерей костной массы, возможным сращением костей, что может привести к анкилозу КПС и образованию синдесмофитов в позвоночнике. ВБС нередко (в 60% случаев) носит преходящий, эпизодический характер. Данные факты являются причиной ее недостаточной диагностики. Кроме того, при хронических болевых состояниях, в том числе при ПсА, боль возникает не только из-за множественных механизмов, включающих центральную сенсибилизацию, усиление нейрональных сигналов, что приводит к гиперчувствительности к боли. Следует учитывать, что у пациентов с ПсА также может возникать и механическая боль в спине (МБС), связанная с травмой и/или нарушением анатомической структуры в нижней части позвоночника. Важно дифференцировать ВБС и МБС с целью назначения подходящего лечения. Боль в спине очень распространена среди населения в целом и является одной из наиболее распространенных причин обращения к врачу во всем мире. Примерно 80% людей испытывают ее в той или иной форме хотя бы раз в жизни. ВБС при аксиальных поражениях у пациентов с ПсА, как и боль в спине у населения в целом, может сильнее влиять на производительность труда, социальные и психические аспекты, а также качество жизни, чем у пациентов без АксП. Прогрессирование процесса приводит к развитию структурных повреждений, включая рентгенологический сакроилеит, синдесмофиты и анкилозы [5].
Диагностика аксиальных поражений
Рентгенологические признаки аксиальных поражений при ПсА появляются спустя годы от начала заболевания, поэтому отмечается несвоевременная диагностика ранних проявлений спондилита или сакроилеита. Чаще всего пациенты обращаются к ревматологам, когда уже имеется выраженная клиническая картина и активный сакроилеит при МРТ [25]. Выделяют различные критерии выявления ВБС: критерии Калина, Берлина и ASAS. Чаще всего используются критерии ASAS, согласно которым боль в спине считается воспалительной, если у пациента с хронической болью длительностью более трех месяцев присутствуют четыре из пяти следующих признаков: начало в возрасте до 40 лет; постепенное начало; ночная боль (с улучшением после пробуждения); улучшение после физических упражнений; отсутствие улучшения после отдыха. ВБС при целенаправленном опросе выявляется у 65% больных ПсА. Критерии ASAS для ВБС имеют чувствительность и специфичность 77 и 91,7% соответственно. Кроме клинического осмотра, существенная роль в диагностике аксиальных поражений должна принадлежать скрининговым опросникам и МРТ-визуализации [25, 26]. Однако имеющиеся скрининговые опросники не позволяют комплексно оценивать все формы псориатического артрита с учетом их ранних проявлений и возможных аксиальных поражений. Ранее существующий и наиболее часто используемый в РФ опросник для выявления псориатического артрита mPEST включает в себя графическую схему, где пациенты могут отмечать область болезненных суставов [27]. В реальной клинической практике пациенты редко связывают боль в спине/шее именно с псориатическим процессом без дополнительных уточняющих вопросов, поэтому зачастую не делают отметок на графической схеме. Кроме того, для диагностики ПсА у больных псориазом кожи недостаточно использовать только mPEST по причине высокого процента случаев гипо- и гипердиагностики заболевания [28]. Другой опросник – SiPAS не включает в себя вопрос о наличии псориатического поражения ногтей, а ToPAS/ToPAS 2 содержит большое количество вопросов и несколько сложнее для понимания пациентами и использования в реальной клинической практике [29–31]. Результаты исследования CONTEST показали, что при сравнении опросников PEST, PASE и ToPAS различия в значимости между ними были незначительными. Следовательно, в рутинной практике врачей можно использовать любой из трех скрининговых опросников ПсА. Тем не менее в исследовании CONTEST отмечали высокие показатели ложноположительных результатов при использовании каждого опросника, что часто приводило к выявлению других заболеваний опорно-двигательного аппарата, особенно невоспалительного артрита. Несмотря на высокий уровень ложноположительных результатов, авторы все же рекомендуют использовать данные инструменты, чтобы не упускать из виду пациентов с ПсА и обеспечить своевременное направление к ревматологу. Важно отметить, что, согласно результатам исследования CONTEST, случаи энтезиального и аксиального поражения при ПсА трудно идентифицировать с помощью этих опросников, поэтому необходимы дальнейшие разработки универсальных опросников. Таким образом, окончательного и однозначного суждения о наиболее подходящей скрининговой анкете до сих пор не найдено. Также необходима разработка новых скрининговых опросников, в которых учитывался бы не только сам факт наличия боли в спине, но и ее характер.
Ускоренная терапия
В прошлом традиционная терапия псориатических поражений кожи и суставов включала поэтапный подход, при котором только при неэффективности или непереносимости одного этапа терапии переходили к следующему. Однако с учетом патогенеза псориаза и его иммуновоспалительной природы такой длительный поэтапный подход к терапии может принести больше вреда, чем пользы. Новый подход в лечении псориаза подразумевает раннее назначение высокоэффективных препаратов, поэтому все чаще в согласительных документах делается акцент на раннюю диагностику, раннее эффективное лечение и лечение до достижения цели [32, 33]. Уже имеются данные о том, что и при других иммуноопосредованных воспалительных заболеваниях, таких как ревматоидный артрит, болезнь Крона, таргетное лечение на ранних стадиях может обеспечить высокий уровень эффективности и переносимости, улучшить долгосрочные результаты лечения пациентов (концепция «раннее вмешательство»), уменьшить последующее радиографическое повреждение суставов, а также изменить течение и бремя болезни [34]. На сегодняшний день исследований по изучению раннего вмешательства все еще недостаточно, хотя была предложена возможность изменения течения болезни [35, 36]. Напротив, есть данные о задержке назначения системных и биологических препаратов при псориазе средней и тяжелой степени, которая превышает три года у 50% пациентов [37].
За последние двадцать лет стратегия «лечение до достижения цели» успешно снизила инвалидность у пациентов с РА [38]. В случае ПсА есть несколько причин для принятия аналогичной стратегии в его лечении, в первую очередь – эрозии или необратимое повреждение суставов возникают на ранних стадиях ПсА. В проспективном исследовании у 27% пациентов рентгенографически были обнаружены эрозии в среднем через 10 месяцев после появления симптомов, а через два года у 47% пациентов развилась хотя бы одна эрозия [39]. Задержка диагностики и позднее лечение ПсА связаны с неблагоприятными исходами, включая эрозии суставов, рентгенографические повреждения суставов, мутилирующий артрит, сакроилеит и меньшую вероятность безмедикаментозной ремиссии [40, 41].
Результаты
Факторы риска, предикторы и клиническая характеристика аксиального поражения у пациентов с псориазом кожи
В нашем исследовании распространенность аксиальных поражений у больных псориазом кожи, согласно критериям воспалительной боли ASAS, составила 36,1%. По данным ретроспективного анализа, ранними проявлениями аксиальных поражений у пациентов с псориазом кожи являются ноющая, тянущая боль в спине (37,2%) или шее (22,1%), а также чувство скованности в спине (46,3%) или шее (38,9%). По результатам МРТ, у 95,4% пациентов с псориазом кожи и ВБС выявлен активный сакроилеит (АСИ).
При проведении сравнительного анализа критериев ASAS было выявлено:
- медиальное значение возраста дебюта псориаза кожи составило 26 лет в группе пациентов, которые удовлетворяли ASAS (29 лет в группе не удовлетворявших ASAS);
- медиальное значение длительности псориаза кожи было выше в группе пациентов, которые удовлетворяли критериям ASAS (12 лет), чем в группе пациентов, которые не удовлетворяли критериям ASAS (семь лет);
- если пациент жаловался на боль в любых суставах, то шансы того, что такие пациенты будут удовлетворять и критериям ASAS по воспалительной боли в спине, были выше в 31,209 раза по сравнению с пациентами, которые не жаловались на боли в суставах;
- те пациенты, которые когда-либо отмечали припухлость пальцев, статистически значимо чаще удовлетворяли критериям ASAS, чем те, кто не отмечал подобных симптомов. Шансы наличия припухлости пальцев в группе пациентов, удовлетворяющих ASAS, были выше в 2,744 раза по сравнению с теми, кто не удовлетворял ASAS;
- пациенты с болью в шее статистически значимо чаще удовлетворяли ASAS. Шансы наличия боли в шее в группе пациентов, удовлетворяющих ASAS, были выше в 6,456 раза по сравнению с пациентами, которые не удовлетворяли ASAS;
- пациенты с наличием скованности в шее статистически значимо чаще удовлетворяли ASAS. Шансы наличия скованности в шее в группе пациентов, удовлетворяющих критериям ASAS, были выше в 6,658 раза по сравнению с пациентами, которые не удовлетворяли ASAS;
- пациенты с болью в спине статистически значимо чаще удовлетворяли ASAS, чем пациенты без боли в спине. Сам факт наличия боли (без уточнения ее характера) статистически значимо повышал шансы того, что такие пациенты будут удовлетворять критериям ASAS, в 13,725 раза;
- пациенты со скованностью в спине статистически значимо чаще удовлетворяли ASAS. Шансы наличия скованности в спине в группе пациентов, которые удовлетворяли критериям ASAS, были выше в 10,407 раза по сравнению с теми, кто не удовлетворял критериям ASAS;
- пациенты с ноющей/тянущей/сковывающей/давящей болью в спине/шее, проходящей после разминки, зарядки, статистически значимо чаще удовлетворяли ASAS;
- пациенты, которые сообщали о боли в спине/шее в покое или в ночное время, статистически значимо чаще удовлетворяли критериям ASAS при дальнейшей диагностике;
- при наличии боли в покое или ночью увеличивались шансы того, что такие пациенты будут удовлетворять критериям ASAS, в 132,385 и 10,517 раза соответственно по сравнению с теми, кто не имел боли в покое/ночью;
- медиальные значения показателя распространенности кожного процесса BSA и степени тяжести PASI у пациентов, удовлетворяющих ASAS, также были выше, что коррелировало с тяжестью течения.
Кроме того, пациенты, удовлетворяющие критериям ASAS, статистически значимо имели медиальное значение SiPAS = 2 (p < 0,001) и mPEST = 2 (p < 0,001), несмотря на то, что диагностическая точка вероятности наличия ПсА в обоих опросниках – три и более баллов.
При определении наличия поражения ногтей нам не удалось установить статистически значимых различий между пациентами, которые удовлетворяли и не удовлетворяли критериям ASAS (p = 0,280). Соответственно, по результатам нашего исследования, поражение ногтей не может являться предиктором воспалительной боли в спине и аксиальных поражений.
Несмотря на то что возраст дебюта боли в спине менее 40 лет является одним из факторов, используемых в ASAS, следует отметить, что АксП развиваются у пациентов с ПсА и в более старшем (более 40 лет) возрасте и что не у всех пациентов с рентгенологическими изменениями могут быть симптомы.
В ретроспективном исследовании с применением множественного оппортунистического скрининга по изучению клинико-инструментальной характеристики аксиальных поражений у пациентов с псориазом кожи независимо от возраста дебюта болей в спине/шее (до 40 лет или старше) нами также были выявлены статистически значимые различия в группах пациентов. Поэтому мы не рекомендуем использовать возрастной критерий дебюта болей в спине/шее в качестве одного из параметров при оценке критериев ASAS по воспалительной боли в спине, а соответственно, по аксиальным поражениям у пациентов с псориазом.
Опросник для выявления ранних проявлений всех форм псориатического артрита SAPsAD
На основании опросников выявления псориатического артрита (PEST, mPEST, SiPAS, ToPAS) нами был разработан возможный универсальный скрининг ранних проявлений псориатического артрита у пациентов с псориазом кожи с учетом аксиальных поражений, который могли бы использовать в своей практике дерматовенерологи, ревматологи и врачи других специальностей, – Screening of Axial Psoriatic Arthritis among Dermatology patients (SAPsAD) (приложение 1). Данный опросник включает в себя пять бинарных («да»/«нет») вопросов с дополнительным категориальным пунктом в вопросе 3 (характер боли, чем купируется боль) с учетом поражения ногтей, возможных дактилитов, энтезитов, спондилита. Согласно рекомендациям Scottish Intercollegiate Guidelines Networks (SIGN), подходящим инструментом скрининга для клинических исследований с большим объемом выборки является опросник, состоящий из пяти пунктов. Положительный ответ на каждый вопрос оценивали в один балл. В вопросе 3 при указании пациентом наличия боли в спине и ее резком/простреливающем характере вопрос оценивали в ноль баллов, так как данный признак в большей степени указывает на механический характер боли в спине. Нами было опрошено 157 пациентов с псориазом кожи. Все пациенты, заполнившие опросник SAPsAD, ответили на каждый вопрос, включая уточняющие параметры, что свидетельствует о простоте его использования. Из всех опрошенных пациентов 121 имел один балл из пяти возможных, 116 – два балла, 87 – три балла, 61– четыре балла, 17 – пять баллов. Из 157 пациентов 38,2% (n = 60) указывали на наличие боли в спине воспалительного характера (боль в покое или ночная; ноющий, тянущий характер боли). Далее все 60 пациентов с подозрением на аксиальные поражения были направлены к ревматологу для прохождения дообследования. С учетом того что возраст начала боли в спине у опрошенных пациентов был менее 40 лет, 88,3% (n = 53) из них удовлетворяли критериям воспалительной боли в спине ASAS. Из этих 53 пациентов 48 (88,7%) имели три и более баллов по опроснику SAPsAD. Следовательно, за контрольную точку, при которой предполагалась высокая вероятность наличия ПсА, считали три и более баллов из пяти возможных по опроснику SAPsAD. Оценка три и более баллов являлась показанием для направления к ревматологу.
У 50 из 53 пациентов, удовлетворяющих критериям воспалительной боли в спине ASAS, по результатам ревматологического обследования был установлен диагноз ПсА, согласно критериям CASPAR. Следует учитывать, что критерии псориатического артрита CASPAR не включают в себя данных по аксиальным поражениям.
С целью выявления признаков АСИ 43 пациентам с подозрением на ВБС была проведена МРТ КПС. По данным МРТ, у большинства пациентов (n = 41; 95,4%) с псориазом гладкой кожи и ВБС был выявлен АСИ. Только у 2 (4,7%) пациентов с псориазом гладкой кожи и ВБС отсутствовали признаки АСИ на момент проведения МРТ. Таким образом, выявлена значимая ассоциация между наличием ВБС и АСИ (p < 0,001).
В настоящее время нет данных о распространенности спондилита при ПсА у пациентов с псориазом кожи и воспалительной болью в спине, удовлетворяющей критериям ASAS. Часть пациентов с псориатическим спондилитом не соответствуют критериям ASAS: не всегда есть воспалительная боль в спине, а дебют спондилита случается без поражения крестцово-подвздошных сочленений. Высокая первичная доля пациентов с ранними признаками ПсА при использовании SAPsAD может объясняться использованием в нашем опроснике критериев ранних проявлений всех форм псориатического артрита (дактилиты, энтезиты, спондилиты, периферические поражения, псориатическая ониходистрофия). Таким образом, опросник SAPsAD может быть полезным инструментом для быстрого и простого скрининга пациентов с псориазом кожи с учетом возможных проявлений аксиальных поражений. Исследование чувствительности и специфичности опросника SAPsAD продолжается.
Ускоренное лечение пациентов с псориазом кожи: открытое проспективное неинтервенционное сравнительное многоцентровое исследование
Проведено открытое проспективное неинтервенционное многоцентровое исследование, в которое был включен 21 пациент со среднетяжелым и тяжелым течением псориаза, у которых на приеме дерматовенеролога была выявлена ВБС и в дальнейшем диагностированы ревматологом аксиальные поражения и ПсА. В качестве генно-инженерных биологических препаратов (ГИБП) использовали ингибиторы ИЛ-17А (нетакимаб) подкожно по причине их положительного влияния на спондилит, дактилиты, энтезиты и важной роли в структурных изменениях при ПсА.
Большинство пациентов, принимающих ингибиторы ИЛ-17А, отметили выраженную положительную динамику со стороны кожного процесса и суставов уже к концу четвертой недели терапии. К 12-й неделе 15 (71,43%) пациентов достигли уровня PASI 75, 13 (61,91%) – PASI 90, 9 (42,85%) – PASI 100. К 24-й неделе дельта PASI 75 отмечена у 18 (85,71%) пациентов, у 14 (66,7%) – PASI 90, у 11 (52,38%) – PASI 100. К 52-й неделе 21 (100%) пациентов достигли уровня PASI 75, 19 (90,48%) – PASI 90, 18 (85,71%) – PASI 100. Помимо этого, у пациентов, имеющих на момент исследования псориатическое поражение ногтей, в ходе терапии было отмечено снижение NAPSI в среднем на 21 балл к 24-й неделе и на 25 баллов к 52-й. Полное исчезновение симптомов (NAPSI 100) отмечалось у 15 (71,43%) пациентов. Также отмечалось выраженное улучшение качества жизни (согласно показателю DLQI < 5) уже к 12-й неделе терапии у 85,71% пациентов. К 24-й и 52-й неделям DLQI < 5 был у 90,48 и 95,24% пациентов соответственно. При проведении МРТ крестцово-подвздошных сочленений в режиме STIR с подавлением жира не обнаружено признаков активного воспалительного процесса. Кроме того, не отмечено прогрессирования структурных повреждений на рентгенограмме шейного отдела позвоночника. Применение ингибиторов ИЛ-17А приводило к снижению выраженности не только аксиальных проявлений заболевания, но также энтезита и дактилита. Все пациенты сообщили об уменьшении воспалительной боли в спине на 12, 24 и 52-й неделях со средним значением BASDAI 5,9 (SD = 2,3), 4,1 (SD = 1,3) и 2,7 (SD = 0,9) соответственно. До терапии отмечалась высокая активность заболевания со средним значением BASDAI 6,6 (SD = 0,8). Установлено, что 19 (90,48%) пациентов достигли ACR 20 к концу исследования (на 54-й неделе). В промежуточной точке оценки результатов (на 12-й неделе) ACR 20 составила 66,7%. У всех пациентов на момент начала терапии наблюдалась высокая активность заболевания, характеризуемая средним значением DAPSA 26,84. Большинство пациентов (18 (85,71%)), получавших ингибиторы ИЛ-17А, достигли ремиссии по DAPSA или низкой активности заболевания по DAPSA через 24 недели терапии. Среднее значение ASDAS перед лечением было 3,5 (SD = 1,2). После терапии ингибиторами ИЛ-17А на 12, 24, 52-й неделях среднее значение ASDAS составляло 3,07 (0,9), 2,2 (1,0) и 2,3 (0,9) соответственно. Установлено, что пациенты хорошо переносили ингибиторы ИЛ-17А при длительном применении. О значительных побочных эффектах не сообщалось. Наиболее частыми нежелательными явлениями, имевшими связь с терапией, были инфекции верхних дыхательных путей и назофарингит.
Заключение
По результатам проведенного ретроспективного исследования с учетом данных опросников, шкал и диагностических критериев (ASAS), приведены данные о распространенности, а также клинико-инструментальная характеристика аксиальных поражений у больных псориазом кожи. Определены факторы риска и предикторы развития псориатического артрита у пациентов с псориазом кожи на основании анализа клинических данных, шкалы и специальных методов исследования. Авторами впервые предложен алгоритм ведения пациентов с псориазом кожи и аксиальными поражениями на основе данных имеющихся публикаций и с учетом результатов проведенного исследования, а также междисциплинарных стандартизированных протоколов ведения таких пациентов (приложение 2). Тем не менее необходимо проведение дальнейших крупномасштабных исследований, направленных на поиск факторов риска, ранних предикторов и изучение эффективности и безопасности раннего назначения ГИБП у пациентов с псориазом кожи и аксиальными поражениями.
L.S. Kruglova, PhD, Prof., N.O. Pereverzina, N.S. Rudneva, PhD
Central State Medical Academy of Department of Presidential Affairs, Moscow
Tula Regional Clinical Dermatovenerologic Dispensary
Tula State University
Contact person: Larisa S. Kruglova, kruglovals@mail.ru
Research relevance. An early manifestation of PsA in patients with psoriasis may be axial (axial) lesions. Spinal lesions occur in 25–70% of patients with already diagnosed PsA. Changes in the spine in early forms of PsA often occur clinically with few symptoms. Clinical risk factors for axial lesions are severe forms of skin psoriasis, young age of onset of psoriasis, severe peripheral arthritis, nail dystrophy, radiologically damaged joints, periostitis, elevated acute phase reagents, long duration of the disease, HLA-B27-positivity. The new approach in psoriasis treatment involves early prescription of highly effective drugs, therefore, there is an increasing emphasis in consensus documents on early diagnosis, early effective treatment and treatment to the goal.
Research results. In our study, the prevalence of axial lesions in patients with skin psoriasis, according to the ASAS inflammatory pain criteria, was 36.1%. According to a retrospective analysis, early manifestations of axial lesions in patients with skin psoriasis are aching, pulling pain in the back (37.2%) or neck (22.1%), as well as a feeling of stiffness in the back (46.3%) or neck (38.9%). According to MRI results, active sacroiliitis was detected in 95.4% of patients with skin psoriasis and inflammatory back pain (IBS). a significant association was found between the presence of IHD and ASI (p < 0.001). Based on the psoriatic arthritis identification questionnaires (PEST, mPEST, SiPAS, ToPAS), we developed a possible universal screening for early manifestations of psoriatic arthritis in patients with skin psoriasis, taking into account axial lesions. The clinical part of the study consisted of prescribing an IL-17 blocker (netakimab) to patients with psoriasis and early manifestations of PsA. As a result of observations, there was no progression of structural damage on the radiograph of the cervical spine. The use of an IL-17A inhibitor led to a decrease in the severity of not only the axial manifestations of the disease, but also enthesitis and dactylitis. All patients reported a reduction in inflammatory back pain at 12, 24 and 52 weeks with a mean BASDAI score of 5.9 (SD = 2.3), 4.1 (SD = 1.3) and 2.7 (SD = 0.9) respectively.
