Афазия при типичной и атипичной (речевой) формах болезни Альцгеймера
- Аннотация
- Статья
- Ссылки
- English


![Таблица 3. Существующие критерии диагностики логопенической первичной прогрессирующей афазии [23]](/upload/resize_cache/iblock/c25/195_350_1/Vasenina6.jpg)

Введение
Болезнь Альцгеймера (БА) является самой частой причиной деменции и самым распространенным нейродегенеративным заболеванием центральной нервной системы. По данным современных эпидемиологических исследований, на долю БА приходится от 60 до 80% всех случаев деменции, что соответствует примерно 36 млн пациентов во всем мире [1].
В России практически отсутствуют данные о реальной распространенности БА. Ориентировочный показатель, рассчитанный по половозрастной структуре отечественной популяции в 2018 г., исчисляется примерно 1,3 млн пациентов [2]. Учитывая продолжающийся прирост пожилых людей в нашей стране, можно предположить, что в 2024 г. данный показатель составит 1,4–1,5 млн.
Критерии диагноза БА прежде всего ориентированы на выявление симптомов, специфичных для данной патологии [3]. Дополнительно определяются патогенетические биомаркеры (амилоид, Aβ-42, гиперфосфорилированный тау-протеин и т.д.), однако вопрос об их чувствительности и специфичности для подтверждения БА остается дискуссионным. Приоритетной остается клиническая картина заболевания [4].
К наиболее типичным проявлениям классической БА относят амнестические расстройства, связанные с ранним двусторонним вовлечением такой стратегически важной для процессов памяти структуры, как гиппокамп [5]. В гиппокампе можно выделить две разные функциональные сети: заднюю сеть (заднюю медиальную систему), представленную связями гиппокампа с вторичными ассоциативными корковыми центрами, и переднюю сеть (переднюю височную систему), которая преимущественно сформирована проводящими путями, соединяющими гиппокамп с префронтальной корой [6].
Согласованная работа двух функциональных сетей обеспечивает процесс запоминания. Получив новую информацию от органов чувств (зрение, слух, тактильные ощущения и т.д.) посредством задней функциональной сети, гиппокамп сохраняет ее в течение 24–48 часов, выступая в роли временного депо воспоминаний. За это время информация сортируется, анализируется, сопоставляется с предыдущим опытом, маршрутизируется и посредством передней функциональной сети встраивается в автобиографическую память [6]. Иными словами, гиппокамп обеспечивает консолидацию информации: переход от краткосрочного запоминания к долгосрочному хранению. Соответственно ключевым проявлением типичной БА, при которой первично в атрофический процесс вовлекаются медиобазальные отделы височных долей, считается дефицит текущей памяти. Пациент утрачивает способность запоминать что-то новое, может забыть о том, что делал вчера, куда ходил, кто приходил к нему. Такой пациент может по несколько раз звонить родным, так как забывает, что уже звонил, задавать одни и те же вопросы, поскольку полученные ответы в памяти не консолидируются. Интересно, что воспоминания о событиях прошлого долгое время могут оставаться сохранными и даже компенсаторно гипертрофироваться, что, вероятно, связано с упрощением поиска в отсутствие пласта актуальной на данный момент информации [7].
Исходя из традиционных представлений, по мере распространения атрофических изменений с более диффузным вовлечением височной доли в патологический процесс у пациентов формируются афазия, которая по сути является вторым наиболее облигатным симптомом заболевания [7]. Однако, несмотря на типичность речевых нарушений, причины, механизмы их развития при БА, классификация и возможности терапии остаются в центре дискуссий.
Нарушение речи как один из симптомов типичной формы болезни Альцгеймера
В отечественной литературе часто упоминается о том, что афатический дефект при БА скорее всего связан с распадом семантических аспектов языка и проявляется прежде всего грубой аномией – нарушением называния предметов. В качестве наиболее подходящего термина для обозначения этого варианта нарушения речи традиционно используются термины акустико-мнестической или оптико-мнестической афазии, а в некоторых источниках встречается понятие аномической афазии, подчеркивающее, что именно трудности с подбором соответствующих названий являются наиболее патогномоничным симптомом данного речевого расстройства.
Последние годы активно обсуждается вопрос о том, что афатический синдром при БА может формироваться вследствие разных причин, а аномия как наиболее облигатное проявление речевых нарушений весьма гетерогенна по механизмам своего развития [8–10].
Действительно, трудности называния могут быть обусловлены как моторными нарушениями, так и невозможностью семантической интерпретации или просто нарушением кодирования текстовой информации. Показано, что на разных стадиях течения БА аномия связана с разными уровнями поражения, хотя клинически может проявляться абсолютно идентичным речевым дефектом [11].
На примере изучения пациентов с легкой и умеренно тяжелой БА продемонстрировано, что трудности называния на начальном этапе связаны с затруднениями на фонологическом уровне, то есть исключительно с невозможностью словесно закодировать хорошо распознаваемый и осознаваемый объект (пациент знает, что это, для чего, но не может подобрать название) [12]. На более тяжелых стадиях ошибки называния связаны с нарушением семантических представлений об объекте: пациент не всегда понимает, что это, поэтому чаще вообще «теряет» название и даже не пытается подобрать какое-либо близкое по значению слово [13]. То есть семантические парафазии (замена слов, близких по категории) являются более облигатными для ранних стадий, а «чистая аномия» без использования замещающих слов более типична для поздних стадий [14].
Кроме того, по мере прогрессирования заболевания добавляются ошибки зрительного восприятия: пациент не воспринимает адекватно картинку (утрачивается способность зрительного распознавания), что служит еще одной причиной трудностей называния [15]. В этом случае причина не столько в нарушении речи, сколько в нарушении зрительно-пространственных функций и зрительного гнозиса, а это совершенно иной уровень поражения, причем клинически будет иметь место та же аномия.
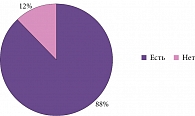
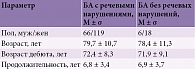
Несмотря на то что афазия часто рассматривается как симптом более развернутой стадии БА, по некоторым данным, трудности называния объектов появляются практически одновременно с нарушениями памяти, а иногда опережают их [16]. К аналогичным выводам пришли и мы в своем исследовании [17]. Проанализировав выборку из 208 пациентов с БА, мы обнаружили значимые нарушения речи у 184 (88%) пациентов (рис. 1). Однако наличие нарушений речи не коррелировало ни с возрастом пациентов, ни с возрастом дебюта болезни и ее длительностью. Сравнение по критерию Стьюдента (t-критерий) не показало достоверных различий в отношении наличия и отсутствия нарушений речи (табл. 1).
Таким образом, речевые расстройства при БА не могут рассматриваться исключительно как симптом, отражающий прогрессирование заболевания [17].
К сожалению, достаточно часто афатический дефект при БА отдельно не оценивается, а рассматривается в общем симптомокомплексе развивающейся деменции. При этом именно речь во многом определяет возможность более длительного сохранения повседневной активности. Наличие вербального общения – необходимое условие участия пациента в когнитивной реабилитации и социальной активности. Возможность адекватной коммуникации позволяет как можно дольше сохранять такие базовые навыки, как поход в магазин и поликлинику. Отсутствие нормального общения значительно увеличивает дистресс родственников, а невозможность адекватного речевого контакта часто приводит к тому, что экстренные состояния, например боль, соматическая патология, у пациента не фиксируются, поскольку он не способен сформулировать жалобы. Конечно, значение нарушений речи и для пациента, и для членов его семьи нельзя недооценивать, а меры по поддержанию и сохранению контакта с пациентом необходимо предпринимать на самых ранних стадиях течения патологического процесса.
Нарушение речи как возможный дебют атипичной формы болезни Альцгеймера (логопенический вариант первично-прогрессирующей афазии)
У ряда пациентов с альцгеймеровской патологией афазия возникает задолго до появления расстройств памяти и может долгое время оставаться единственным симптомом болезни [18]. В этом случае может быть диагностирован синдром первичной прогрессирующей афазии (ППА).
Синдром ППА, согласно критериям M. Mesulam, сформулированным в 2001 г., устанавливают при наличии трех основных критериев в отсутствие критериев, которые исключают диагноз ППА [19].
Резюмируя существующие критерии диагностики, можно констатировать, что синдром ППА выставляется при наличии изолированной афазии (вне других когнитивных симптомов), которая постепенно нарастает в течение двух лет, значимо нарушает качество жизни пациента и не объясняется никакими другими причинами, кроме нейродегенеративной патологии.
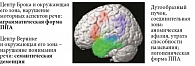
В настоящий момент выделяют три формы синдрома ППА, которые во многом определяются тем, какие речевые зоны преимущественно вовлечены в патологический процесс (рис. 2) [19, 20].
При вовлечении центра Брока и окружающих его зон, как правило, страдают моторные компоненты речевой деятельности. У пациентов появляется замедленность речи. Из-за нарушения формирования структуры слова пациенты часто путают буквы, переставляют слоги, неправильно употребляют предлоги и окончания, что приводит к появлению аграмматизмов, которые могут быть слышны и в произвольной речи, но более заметны при письме. В международной классификации этот вариант ППА называют non-fluent primary progressive aphasia (в дословном переводе «не беглая»), подчеркивая специфичное для данной формы снижение темпа и скорости речи (речь замедленная, тягучая, лишенная модуляций, со значительным ограничением используемых слов) [20]. В нашей стране широко применяется термин «аграмматическая форма», что также отражает одно из наиболее характерных и специфичных проявлений этого варианта ППА [19]. Вовлечение сенсорного центра Вернике и окружающих его зон постепенно приводит к прогрессирующему нарушению понимания речи, различных семантических категорий и смыслового значения слов. Пациенты не могут подобрать объединяющий термин для слов из единой категории (например, не могут понять, что яблоко и груша – фрукты, а трамвай и автобус – транспорт). Такие пациенты не способны определить разницу между собакой и волком, не понимают принадлежности к домашним животным и хищникам. Этот вид ППА получил название семантической деменции, что подчеркивает важную роль распада семантических аспектов языка в ее развитии [19, 20].
Третий вариант – логопеническая форма ППА (логППА) наименее специфична. Она развивается при вовлечении височно-теменного стыка и характеризуется прогрессирующими трудностями поиска и подбора слов со значительными паузами в речи, а также нарушением повторения. Скорость, темп речи и ее модуляция при логППА остаются относительно сохранными (что отличает ее от аграмматической формы), а отсутствие значимого нарушения понимания служит важным дифференциально-диагностическим признаком, позволяющим отличить ее от семантической деменции. Формы ППА представлены на рис. 3.
Развитие аграмматической формы ППА и семантической деменции в 70–80% случаев обусловлено лобно-височной дегенерацией, на долю других нозологических форм приходится небольшой процент [20]. В то же время при логопеническом варианте более чем в 75% случаев выявляется альцгеймеровская патология. Это позволяет рассматривать данную форму ППА как один из возможных атипичных вариантов БА, при котором в роли дебютного симптома выступают не нарушения памяти, а нарушения речи, способные долгое время оставаться единственным симптомом болезни [21]. Ключевой причиной развития подобного речевого варианта БА является распространение патологического процесса не диффузно, а асимметрично, с развитием односторонней атрофии преимущественно в доминантном полушарии [17].
Большинство когнитивных функций у человека задублировано в левой и правой гемисферах. Чтобы сформировались значимые нарушения памяти, необходимо вовлечение как правого, так и левого гиппокампа. Единственный асимметрично представленный в головном мозге когнитивный домен – речь. Речевая функция связана с эволюционно более молодым доминантным полушарием, поэтому нарушение речи может быть отражением очагового поражения, чего нельзя сказать о других когнитивных функциях. При нейродегенеративной патологии атрофический процесс может начинаться фокально, сначала затрагивая только одну гемисферу. В случае первичного вовлечения недоминантного полушария, пока процесс не распространится диффузно, симптоматика практически отсутствует. Если фокальный дегенеративный процесс затрагивает преимущественно доминантную гемисферу, развиваются изолированные расстройства речевой функции вне нарушения других когнитивных функций, что и составляет основу развития синдрома ППА. Подобное течение патологического процесса наблюдается при лобно-височной деменции и приводит к формированию аграмматической формы ППА и семантической деменции, а также при БА, чем объясняется развитие ее атипичного речевого варианта по типу логППА [17, 21, 22].
Критерии логППА, сформулированные в 2009 г. M.L. Gorno-Tempini и соавт., представлены в табл. 3 [23]. Ключевыми симптомами логППА являются нарушения в виде поиска слов, называний и повторений [19].
Следует отметить, что трудности подбора слов, равно как и трудности названия (аномия), характерны почти для всех видов афазии, что не позволяет рассматривать их как специфичный для логППА симптом [19].
Несмотря на существующие критерии, диагноз логопенической формы базируется скорее на исключении других более специфичных вариантов ППА – отсутствие аграмматизмов и нарушений беглости речи (типично для аграмматической ППА) и сохранность понимания (позволяет исключить семантическую деменцию), чем на наличии каких-либо характерных особенностей [19].
Самым необычным и специфичным симптомом логППА является нарушение повторения: пациенты испытывают сложности воспроизведения только что представленной им речевой информации, причем это касается как фраз, так и последовательностей слов и цифр, отдельных слогов и даже букв [24].
Одна из ключевых теорий формирования логППА сводится к нарушению фонологической петли – механизма, участвующего в краткосрочном восприятии и запоминании вербальной информации. Работа фонологической петли в норме подчиняется нескольким ключевым законам: последовательности из разных букв и слогов запоминаются и повторяются лучше, чем одинаковые. Это связано с эффектом обновления информации: при предъявлении последовательности из разных по звучанию букв (например, Д – М – К) каждая из них воспринимается как новая и за счет процессов обновления и переключения запоминается лучше, чем последовательность близких по звучанию (например, Б – Д – П), при которых различий для переключения внимания недостаточно. Схожим механизмом объясняется и то, что короткие слова повторяются лучше, чем длинные. При повторении сложных слов время хранения информации превышает две-три секунды, что и вызывает некоторые сложности в их воспроизведении [17, 19]. Иными словами, фонологическая петля не связана непосредственно с функцией речи, а представляет собой рабочую память, которая является неотъемлемой частью любого когнитивного, в том числе речевого, процесса.
Можно ли расценивать логППА как вариант афазии? Правомерно ли рассматривать дефект фонологической петли как вариант первичного речевого расстройства? На эти вопросы пока нет ответов [25].
Согласно обзору речевых нарушений при нейродегенеративных заболеваниях (2018), логППА характеризуется нарушением в большом количестве тестов, выходящих за пределы нарушенного повторения. Это очевидный и ожидаемый итог, если допустить, что рабочая память – начальный этап любого когнитивного процесса [26].
Вероятно, первичный дефект внимания при логППА находит отражение в наиболее ослабленных функциях. Атрофия в области височно-теменного стыка при БА делает уязвимой именно речевую функцию: возникают трудности с поиском и подбором слов, построением предложений. Как следствие – большие паузы в произвольной речи [27]. Нарушается автоматизированный контроль высказывания: в голове фраза формируется правильно, но в процессе проговаривания теряется обратный контроль ее построения (нарушается обратная фонологическая петля). Этим обусловлены трудности подбора необходимого слова, запинки и паузы. Но поскольку причина – не само расстройство речи, а дефицит внимания и рабочей памяти, возникает закономерный вопрос, насколько логППА специфична для БА [28].
В 2015 г. группой австралийских ученых было выдвинуто предположение, что логППА представляет собой гетерогенную группу состояний с различным клиническим профилем нарушений, а также вариабельными анатомическими зонами [29]. В 2017 г. была опубликована еще одна работа, посвященная гетерогенности логППА и недостаточной чувствительности и специфичности существующих критериев диагностики [30]. На примере 34 пациентов с подтвержденной ППА авторы сопоставили клинический фенотип первичной афазии с патоморфологическими данными и обнаружили гетерогенность как по особенностям речевых расстройств, так и по разнородным данным аутопсии. Было установлено, что только у части пациентов логППА связана с альцгеймеровскими изменениями.
В своей работе нам также удалось выделить различные клинические варианты логППА и связать их с особенностями нейровизуализационных данных [17]. Оказалось, что паттерн атрофии, типичный для БА, был связан только с тем вариантом логППА, при котором наряду с трудностями повторения и паузами в речи имела место явная аномия (логопеническая+) (рис. 4).
Согласно имеющимся данным, предположить, что у пациента с ППА имеет место дебют альцгеймеровской патологии, можно, если:
- пациент удовлетворяет критериям ППА;
- у него нет явной замедленности речи, аграмматизмов, а также нарушения понимания (что позволяет исключить аграмматическую форму и семантическую деменцию);
- имеются трудности подбора слов, длинные паузы в речи;
- выявлена явная аномия.
В пользу БА будет также свидетельствовать характерная атрофия медиобазальных отделов височной доли с вовлечением гиппокампа. Правда, в этом случае она будет грубо асимметрична, вовлеченным окажется только доминантное (чаще левое) полушарие.
Возможности коррекции нарушений речи как при типичном, так и при атипичном варианте болезни Альцгеймера
Как уже отмечалось, нарушения речи, определяющие возможность коммуникации, социализации и значительно влияющие на качество жизни, представляют огромную проблему как для самого пациента, так и для окружающих его людей.
Ограничение общения само по себе может быть фактором риска дальнейшего когнитивного снижения, а также формирования расстройств аффективного спектра и поведенческих симптомов. Поэтому снижение выраженности речевых нарушений – самостоятельная клиническая задача, которая может влиять на выбор базисной терапии и определять необходимость дополнительной симптоматической коррекции. Работ, в которых оценивали эффективность медикаментозных и немедикаментозных подходов к коррекции речевых нарушений у пациентов с нейродегенеративной патологией, немного. В нашей стране практически отсутствуют методы логопедической коррекции у пациентов как с первичными, так и с вторичными расстройствами речи в рамках дегенеративных заболеваний. Адаптировать зарубежный опыт невозможно в силу языковых особенностей. Положительные эффекты транскраниальной магнитной стимуляции, зафиксированные в некоторых исследованиях, пока не нашли окончательного подтверждения, а отечественного опыта практически нет [31, 32].
Из медикаментозной терапии наиболее изучены подходы к ведению пациентов с ППА. Однако лекарственных препаратов, продемонстрировавших какую-либо эффективность, немного. Из средств симптоматического ряда с доказанной эффективностью у пациентов с первичными афазиями характеризуются антидепрессанты из группы селективных ингибиторов обратного захвата серотонина, а также серотонина и норадреналина. Механизм их действия не до конца понятен. Предполагается, что они уменьшают выраженность поведенческих нарушений, снижают тревогу, тесно коррелирующую с речевыми нарушениями [33–35]. При выборе антидепрессанта важно учитывать два момента: препарат должен характеризоваться минимальной холинолитической активностью (назначение трициклических антидепрессантов не рекомендуется), а также хорошим противотревожным эффектом. Препаратами выбора в этом случае могут быть сбалансированные сертралин, циталопрам, венлафаксин или флувоксамин (при явном возбуждении пациента). В качестве основного направления терапии при речевых нарушениях в рамках нейродегенеративной патологии можно рекомендовать модулятор глутаматных рецепторов NMDA-типа мемантин.
Мемантин не только средство базисного ряда в терапии деменции (альцгеймеровской, сосудистой и др.) [36–38], это практически единственный препарат, обладающий убедительной доказательной базой в аспекте улучшения функции речи у пациентов с нейродегенеративной патологией.
По данным систематизированного обзора четырех крупных плацебо-контролируемых исследований с участием 801 пациента с умеренной и умеренно тяжелой БА, на фоне применения мемантина значительно снижается выраженность речевых нарушений даже у пациентов с тяжелой деменцией [39].
Положительное влияние мемантина на речь зафиксировано и при нарушениях речи в рамках ППА. В исследовании N.A. Johnson и соавт. на фоне приема мемантина в отличие от плацебо у пациентов с ППА снижался общий коэффициент выраженности афазии [40]. Положительные результаты лечения отмечались при логопенической и аграмматической формах ППА [41].
Улучшение метаболизма лобно-височных отделов (ключевых речевых зон) у пациентов, получающих 20 мг мемантина, служит дополнительным показателем его эффективности [42].
Кроме того, перспективность применения мемантина при нарушениях речи в рамках нейродегенеративной патологии подчеркивает и тот факт, что в плацебо-контролируемых исследованиях показано достоверное улучшение речевых функций у пациентов с постинсультной афазией, особенно когда медикаментозная терапия сочеталась с логопедическими занятиями [43, 44].
Высокий профиль безопасности и хорошая переносимость мемантина, а также эффективность в коррекции речевых расстройств различного генеза при деменции позволяют рекомендовать его для лечения нарушения речи при типичной и атипичной формах БА, а также нарушении речи в рамках иной нейродегенеративной патологии.
E.E. Vasenina, PhD, O.S. Levin, PhD, Prof.
Russian Medical Academy of Continuous Professional Education
Contact person: Elena E. Vasenina, hel_vas@mail.ru
Alzheimer's disease (AD) is one of the leading neurodegenerative diseases and the most common cause of dementia. Despite the fact that memory impairment is considered the most typical manifestation of AD, speech disorder is an equally important and specific symptom of the disease which significantly affects the quality of life of both patients and their relatives. According to our data, the prevalence of aphasia in AD reaches 88%, is not related to the severity of the disease and can appear in the earliest stages. In cases of unilateral, focal spread of the pathological process with the predominant involvement of the dominant hemisphere, atypical forms of AD with primary progressive aphasia (PPA) syndrome may emerge; the speech disorders manifest at the onset of the disease and may be its only manifestation for a long time. In this review, aphasia is considered both as one of the symptoms of the classical form of AD, and as a symptom of the atypical (language) form of AD of the logopenic PPA variant type. Modern ideas regarding the mechanisms of speech dysfunction development, the specificity of criteria for the diagnosis of atypical forms are discussed, data from our own observations are presented, as well as possible approaches to the correction of aphasia in both AD and other neurodegenerative pathology are discussed in this paper.
