Двойная иммунотерапия в первой линии при распространенном немелкоклеточном раке легкого
- Аннотация
- Статья
- Ссылки
- English


Введение
Рак легкого является одной из ведущих причин смертности в структуре онкологических заболеваний как в мире [1], так и в России [2]. В Иркутской области в 2018 г. впервые рак легкого был диагностирован у 1303 человек. За тот же период от рака легкого умерло 1015 пациентов, показатели заболеваемости и смертности составили 54,05 и 42,10 на 100 тыс. населения соответственно [2, 3]. В 54% случаев диагноз был установлен на IV стадии заболевания, при этом летальность в течение года от момента установки диагноза составила 64% [3, 4]. В Иркутской области среди различных гистологических вариантов рака легкого в 2018 г. чаще встречались: плоскоклеточный рак – 47,9%, аденокарцинома – 26,3% и мелкоклеточный рак – 21,7% [3]. В США и странах Европы в структуре немелкоклеточного рака легкого (НМРЛ) преобладает (55%) аденокарцинома [5].
Несмотря на появление новых методов терапии метастатического НМРЛ, лечение данного заболевания остается актуальной проблемой современной онкологии. Основными задачами лечения являются увеличение продолжительности жизни больных, улучшение качества их жизни (облегчение симптомов заболевания, профилактика и лечение осложнений терапии), сбалансированность терапевтического эффекта с качеством жизни пациентов [6, 7].
Проведенные в 1990-х гг. исследования и их метаанализы убедительно показали улучшение результатов лечения при распространенном НМРЛ на фоне применения химиотерапии платиносодержащими комбинациями по сравнению с поддерживающей терапией. Однако медиана общей выживаемости (ОВ) не превышала 12 месяцев, а медиана времени до прогрессирования составляла 4–6 месяцев [8, 9].
Улучшение результатов лечения стало возможным благодаря внедрению новых молекулярно-направленных препаратов (таргетной терапии), эффективных прежде всего при наличии активирующих мутаций в генах EGFR, ALK, ROS1, BRAF, RET и др. Этот перечень постоянно расширяется. Тем не менее доля пациентов без выявленных терапевтических мишеней остается очень высокой, лечение вызывает существенные трудности. Перспективные возможности в лечении пациентов НМРЛ без драйверных мутаций связаны с иммунотерапией.
Иммунотерапия ингибиторами контрольных точек уже стала стандартом лечения пациентов с распространенным НМРЛ в случае прогрессирования заболевания на фоне платиносодержащей химиотерапии. Показано увеличение эффективности в зависимости от уровня экспрессии PD-L1: чем выше экспрессия, тем больше вероятность опухолевого ответа и улучшения ОВ [11].
На сегодняшний день монотерапия ингибиторами PD-1 в отсутствие противопоказаний считается наиболее благоприятной в отношении переносимости. В соответствии с действующими клиническими рекомендациями, пембролизумаб или атезолизумаб в монорежиме может быть использован у пациентов с высоким уровнем экспрессии PD-L1 (50% и выше) [10]. В исследовании KEYNOTE-024 пембролизумаб показал высокую эффективность при гиперэкспрессии PD-L1, продемонстрировав преимущество перед химиотерапией по показателям выживаемости без прогрессирования (ВБП), ОВ и частоты объективного ответа (ЧОО) [12]. В то же время, как показал подгрупповой анализ в исследовании KEYNOTE-042, у пациентов с уровнем экспрессии PD-L1 от 1 до 49% пембролизумаб не имеет преимуществ перед стандартной химиотерапией в аспекте выживаемости [13].
Схожие данные получены и при изучении PD-L1-ингибитора атезолизумаба в исследовании IMpower 110. Исследователи сравнивали терапию атезолизумабом и платиносодержащую химиотерапию в качестве первой линии у 572 пациентов с положительной экспрессией PD-L1 (TC1, 2, 3/IC 1, 2, 3). Показатели ОВ были значительно выше в подгруппе пациентов с PD-L1 TC3/IC3 (20,2 против 13,1 месяца; p = 0,01). Кроме того, подтверждено отсутствие преимуществ у пациентов с промежуточным уровнем экспрессии (TC1, 2/IC1, 2) [14].
Эффективность иммунотерапии пембролизумабом в комбинации с химиотерапией в первой линии у пациентов с распространенным плоскоклеточным и неплоскоклеточным НМРЛ изучали в исследованиях KEYNOTE-407 и KEYNOTE-189 соответственно. Оба исследования сходны по дизайну, в качестве конечных точек были выбраны ВБП и ОВ, а фактора стратификации – уровень экспрессии PD-L1 (< 1 против ≥ 1%) [15, 16]. В исследовании KEYNOTE-189 у пациентов с неплоскоклеточным НМРЛ ВБП составила 9,0 месяца в группе комбинированной терапии и 4,9 месяца в группе химиотерапии, ОВ – 22,0 и 10,6 месяца соответственно.
Сходные, но более скромные результаты выявлены и в исследовании KEYNOTE-407. При плоскоклеточном НМРЛ ВБП составила 8,0 и 5,1 месяца, ОВ – 17,1 и 11,6 месяца соответственно в группах «пембролизумаб + химиотерапия» и «плацебо + химиотерапия». Эффективность лечения при добавлении пембролизумаба к химиотерапии напрямую коррелировала с уровнем экспрессии PD-L1 в обоих исследованиях. Интересно, что у пациентов с плоскоклеточным НМРЛ в исследовании KEYNOTE 407 в подгруппе PD-L1 < 1% не отмечалось преимущества от добавления пембролизумаба к химиотерапии в отношении ОВ. У пациентов же с неплоскоклеточным НМРЛ подгруппы PD-L1 < 1% подобное преимущество имело место, но эффективность была самой низкой.
Атезолизумаб продемонстрировал эффективность в комбинации с бевацизумабом и химиотерапией в исследовании IMpower 150 у пациентов с неплоскоклеточным НМРЛ по сравнению с комбинациями «атезолизумаб + химиотерапия» и «бевацизумаб + химиотерапия» [17]. При этом эффективность у пациентов с низким уровнем экспрессии PD-L1 также была неудовлетворительной.
В исследовании IMpower 131 у пациентов с плоскоклеточным НМРЛ добавление атезолизумаба к химиотерапии не улучшило результаты лечения [18].
Поиск эффективных методов лечения при метастатическом НМРЛ продолжается. В данном аспекте особый интерес представляют исследования с применением комбинации двух ингибиторов контрольных точек – PD-1 и CTLA-4 (ниволумаб + ипилимумаб). В исследовании CheckMate 227 сравнивали комбинацию «ниволумаб + ипилимумаб» с двухкомпонентной химиотерапией на основе препаратов платины. В исследовании CheckMate 9LA к комбинации ниволумаба и ипилимумаба добавляли два цикла химиотерапии платиновым дуплетом, что улучшило ранний контроль заболевания.
Клинический случай
Диагноз периферического рака верхней доли правого легкого Т2аN0M0 у пациента 1954 года рождения установлен в июне 2019 г. в возрасте 65 лет. Диагноз подтвержден цитологическим исследованием материала, полученного при проведении трансторакальной пункции. Заключение: комплексы клеток немелкоклеточного рака. Стаж курения около 60 пачко-лет, наличие выраженной сопутствующей патологии. На протяжении ряда лет страдает хронической обструктивной болезнью легких, бронхиальной астмой, эмфиземой легких, ишемической болезнью сердца, артериальной гипертензией. При оценке функциональных показателей – значительное снижение функции внешнего дыхания по рестриктивному и резко обструктивному типу, дыхательная недостаточность 2-й степени. С учетом сопутствующей патологии в качестве метода лечения выбрана стереотаксическая лучевая терапия опухоли правого легкого (разовая очаговая доза – 20 Гр, суммарная очаговая доза – 60 Гр). Выполнена в июле 2019 г. Достигнута частичная регрессия опухоли в правом легком. На протяжении двух лет осуществлялось диспансерное наблюдение (рис. 1).
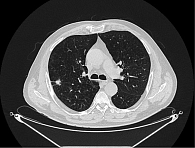
С июня 2021 г. отмечались ухудшение общего состояния, снижение массы тела, увеличение одышки, кашля, появление болей в грудной клетке справа. При обращении в августе 2021 г. общее состояние соответствовало ECOG 2. По результатам мультиспиральной компьютерной томографии (МСКТ) установлено прогрессирование опухолевого процесса, наличие периферической опухоли верхней доли правого легкого с централизацией, распространением на средостение, ростом на костальную плевру и в межреберные промежутки, увеличение медиастинальных лимфоузлов в динамике (рис. 2).
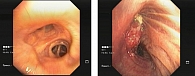
При фибробронхоскопии выявлена опухоль верхней доли правого легкого с распространением на промежуточный и среднедолевой бронхи (рис. 3).
Морфологическое, цитологическое, гистологическое и иммуногистохимическое исследования с использованием антител Р63 и TTF выявили прогрессирование плоскоклеточного рака. Дополнительно по запросу клиницистов выполнено иммуногистохимическое исследование опухоли с использованием набора реагентов Ventana PD-L1 (SP263), Tumor proportion score (TPS) – 0. Заключение: в исследуемом образце опухоли бронхов справа экспрессия PD-L1 не выявлена.
На мультидисциплинарном онкологическом консилиуме опухолевый процесс признан распространенным, неоперабельным и назначена противоопухолевая иммунотерапия комбинацией препаратов ниволумаб и ипилимумаб.
8 сентября 2021 г. начата терапия комбинацией ниволумаба в дозе 3 мг/кг один раз в две недели и ипилимумаба в дозе 1 мг/кг один раз в шесть недель (рост – 170 см, масса тела – 84 кг, S – 2,0 м2, индекс массы тела – 29,1 кг/м2, ниволумаб – 252 мг, ипилимумаб – 84 мг на введение).
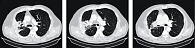
По данным МСКТ при контрольном обследовании 19 ноября 2021 г., отмечалась значительная положительная динамика (рис. 4). На фоне терапии наблюдались улучшение общего состояния, уменьшение слабости, кашля, одышки, болевого синдрома, увеличение веса на 6 кг. Назначенная терапия продолжена.
Очередная контрольная МСКТ от 14 февраля 2022 г. показала нарастание положительного эффекта (рис. 5), восстановление воздушности легочной паренхимы в правом легком, уменьшение первичной опухоли и медиастинальных лимфоузлов. Эффект расценивался как частичная регрессия.
Переносимость терапии хорошая, ухудшения течения сопутствующей патологии нет. Из побочных эффектов зафиксировано снижение уровня тиреотропного гормона при нормальных показателях Т3 и Т4, не потребовавшее какого-либо вмешательства. В настоящее время терапия ниволумабом и ипилимумабом продолжается.
Обсуждение
Лечение пациентов с НМРЛ претерпевает значительные изменения. При наличии определенных драйверных мутаций используются четко прописанные схемы терапии. В настоящее время при немелкоклеточном неплоскоклеточном раке обязательно определяют мутации в генах EGFR, ALK, ROS1, BRAF [10]. Перечень этих мутаций постоянно расширяется. Иначе обстоят дела в ситуациях, когда драйверные мутации отсутствуют, что ассоциируется с худшим прогнозом и ограниченными возможностями лечения. В таких случаях лечение направлено на увеличение продолжительности жизни при сохранении приемлемого качества жизни. До недавнего времени лечение пациентов с НМРЛ в отсутствие драйверных мутаций нередко носило паллиативный характер. Внедрение в клиническую практику иммунотерапии изменило стандарты терапии. При выборе режима лечения необходимо исходить из варианта гистологического типа НМРЛ (аденокарцинома, плоскоклеточный рак легкого). Кроме того, неотъемлемым условием терапии является определение такого биомаркера, как экспрессия PD-L1, наличия или отсутствия противопоказаний к тому или иному методу лечения [11]. Необходимо также оценивать функциональный статус пациента, наличие сопутствующей патологии, выраженность симптомов, объем опухолевой массы и, конечно, статус курения.
Пациенты с плоскоклеточным раком легкого и низкой экспрессией PD-L1, как в представленном клиническом случае, остаются в группе наиболее неблагоприятного прогноза.
Результаты комбинированной иммунотерапии и химиотерапии в исследовании CheckMate 9LA оказались многообещающими при различных вариантах опухоли. В исследовании оценивали эффективность терапии ниволумабом и ипилимумабом в сочетании с двумя или четырьмя курсами химиотерапии. В группе двойной иммунотерапии ОВ была выше – 14,1 и 10,7 месяца (относительный риск (ОР) 0,69), причем преимущество не зависело от статуса PD-L1, а также в подгруппах пациентов с морфологией плоскоклеточного рака (ОР 0,62) и наличием метастазов в головном мозге (ОР 0,38). У больных с негативной экспрессией PD-L1 ОВ составила 16,8 месяца при комбинированном лечении и 9,8 месяца на фоне химиотерапии (ОР 0,62) [19].
В представленном клиническом случае, учитывая выраженную сопутствующую патологию и состояние пациента, мы предпочли двойную иммунную блокаду ингибиторами PD-L1 и CTLA-4 без химиотерапии. Такой вариант комбинации изучали в исследовании CheckMate 227. В данном исследовании пациенты с уровнем PD-L1 ≥ 1% (часть 1а исследования) были рандомизированы в соотношении 1/1/1 в группы ниволумаба и ипилимумаба, монотерапии ниволумабом и стандартной химиотерапии платиновым дуплетом. Пациенты с экспрессией PD-L1 < 1% вошли в часть 1b исследования, где также были рандомизированы на три группы: ниволумаба и ипилимумаба, ниволумаба в сочетании с платиновым дуплетом и только химиотерапии. Продемонстрировано преимущество комбинации ниволумаба и ипилимумаба перед химиотерапией в отношении ОВ как у пациентов с позитивной экспрессией PD-L1 (ОР 0,79), так и у больных с PD-L1 < 1% (ОР 0,62) [20].
Обновленные данные о четырехлетней выживаемости были представлены на ежегодном конгрессе ASCO в 2022 г. [21]. При минимальной продолжительности наблюдения 49,4 месяца преимущество в ОВ отмечалось независимо от гистологического подтипа (плоскоклеточный, неплоскоклеточный) и уровня экспрессии PD-L1. Это соответствует ранее опубликованным результатам.
При анализе пациентов с уровнем PD-L1 < 1% в подгруппах неплоскоклеточного рака медиана ОВ при использовании двойной иммунотерапии составила 17,5 месяца, ниволумаба и химиотерапии – 17,7 месяца, химиотерапии – 13,1 месяца, четырехлетняя выживаемость – 25, 16 и 12% соответственно. При PD-L1 < 1% и плоскоклеточной морфологии медиана ОВ при использовании двойной иммунотерапии достигла 15,9 месяца, на фоне применения ниволумаба и химиотерапии – 11,3 месяца, химиотерапии – 8,5 месяца, четырехлетняя выживаемость – 22, 7 и 5% соответственно.
Заключение
Двойная иммунотерапия ниволумабом и ипилимумабом является эффективной опцией у пациентов с НМРЛ и может применяться у ослабленных больных, пациентов с наличием сопутствующей патологии и противопоказаниями к проведению химиотерапии. Данная комбинация высокоэффективна у пациентов с плоскоклеточным раком, а также у пациентов с неплоскоклеточным и плоскоклеточным НМРЛ при низкой экспрессии PD-L1 и может назначаться в тех случаях, когда определить экспрессию PD-L1 в опухоли не представляется возможным.
D.M. Ponomarenko, D.Yu. Yukalchuk, S.S. Sidorova, Yu.A. Chapygina
District Oncologic Dispensary, Irkutsk
Contact person: Dmitry M. Pnomarenko, ponomarenkodm@gmail.com
Using an example from clinical practice, the issues of treatment of advanced non-small cell lung cancer in the absence of activating mutations are considered.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.