Эффективность дупилумаба при лечении тяжелого атопического дерматита у детей
- Аннотация
- Статья
- Ссылки
- English


Введение
При лечении атопического дерматита (АтД) средней и тяжелой степени, как правило, назначают средне- и сильнодействующие топические глюкокортикостероиды (тГКС). Такое лечение проводится до тех пор, пока обострение не будет купировано [1]. В дальнейшем на ранее пораженные участки кожи рекомендуют наносить топические ингибиторы кальциневрина или тГКС средней и высокой активности (проактивная терапия). В случае недостаточной эффективности такой терапии следующим шагом является назначение системных препаратов, в частности ГКС перорально или парентерально. У госпитализированных больных используют влажные обертывания. Иммуносупрессанты (циклоспорин А, off-label метотрексат, азатиоприн, микофенолата мофетил) имеют возрастные ограничения. Немаловажное значение для оптимального лечения заболевания имеют образовательные программы [1].
В 2017 г. для лечения средней и тяжелой степени АтД у детей с шести лет был разрешен генно-инженерный биологический препарат (ГИБП) дупилумаб. С июня 2023 г. в РФ возрастное ограничение было снижено, теперь препарат можно применять у детей старше шести месяцев.
За прошедшее время накоплен определенный опыт использования дупилумаба, позволяющий судить о его эффективности и безопасности у взрослых и детей не только с АтД, но и с другими Т2-ассоциированными заболеваниями, такими как бронхиальная астма, хронический риносинусит с полипозом носа, эозинофильный эзофагит [1–4].
Однако у некоторых больных, чаще взрослых, описаны случаи недостаточного ответа на дупилумаб. Так, его использование не приводило к достижению контроля над АтД и было ассоциировано с развитием ряда новых побочных реакций [2, 6–8].
С учетом высокой стоимости терапевтических моноклональных антител требуется тщательный отбор пациентов для такого лечения. В то же время использование ГИБП позволяет значительно улучшить качество жизни больных АтД.
В статье рассмотрено несколько критических моментов, которые следует учитывать при оценке эффективности дупилумаба в условиях реальной клинической практики. Кроме того, представлен клинический случай в отношении ребенка шести лет, страдавшего АтД, демонстрирующий эффективность препарата.
Механизмы действия дупилумаба при атопическом дерматите
Дупилумаб ингибирует ключевые цитокины Тh2-лимфоцитов – интерлейкины (IL) 4 и 13, которые играют решающую роль в патогенезе АтД. Они способствуют развитию воспаления, зуда, продукции иммуноглобулина E (IgE) в B-клетках, стимулируют привлечение эозинофилов в ткань, индуцируют выживание и активацию Th2-клеток, воздействуют на дифференцировку кератиноцитов, подавляют выработку филаггрина и молекул клеточной адгезии, обусловливая нарушение кожного барьера, и т.д. [9]. В связи с этим именно IL-4 и IL-13 были идентифицированы как терапевтические мишени при разработке новых препаратов.
Дупилумаб является полностью моноклональным антителом человека, который связывается с субъединицей рецептора IL-4Rα, общей цепочки рецепторов IL-4 и IL-13. Поскольку IL-4Rα экспрессируется на многих воспалительных клетках, участвующих в иммунопатогенезе АтД (например, кератиноцитах, Т-клетках, дендритных клетках и эозинофилах), его блокирование будет сопровождаться мощным противовоспалительным эффектом. При применении дупилумаба улучшаются клинические проявления заболевания, что подтверждается изменениями на клеточно-молекулярном уровне. Препарат значительно подавляет экспрессию генов, связанных с Th17/Th22, но повышает экспрессию генов эпидермальной дифференцировки и барьерных компонентов (например, филаггрина, лорикрина, липидных продуктов) [10]. Частичные изменения этих параметров наблюдались уже через две недели лечения, а полный ответ – через восемь недель [10]. Парадоксально, но при использовании дупилумаба уровни IL-4 и IL-13 в сыворотке крови даже увеличивались. Ингибирование IL-4Rα не влияет на выработку тимического стромального лимфопоэтина и IL-33, которые стимулируют врожденные лимфоидные клетки группы 2 и Th2-клетки [11].
IL-4 и IL-13 также участвуют в сигнальном пути янус-киназ (JAK)/STAT, по которому передаются сигналы от активированных рецепторов этих цитокинов внутрь клетки, что приводит к изменению экспрессии генов и активности многих ферментов [12]. Подавляющее большинство цитокинов, связанных с патогенезом АтД, используют пути JAK1/2, некоторые – JAK2/Tyk2 и JAK1/3.
Данные о влиянии дупилумаба на уровни общего IgE и эозинофилов в периферической крови противоречивы [2, 13]. Чаще отмечалось повышение количества эозинофилов, возможно, за счет влияния препарата на продукцию эотоксинов, а не на миграцию их из костного мозга.
Механизм подавления зуда дупилумабом реализуется следующим образом: определенные нейроны, иннервирующие кожу, экспрессируют IL-4Rα и IL-13Rα1, которые действуют как пруритогены и активируют сначала кератиноциты, затем рецепторы сенсорных нейронов и иммунных клеток [14]. В свою очередь нейропептиды активируют врожденные лимфоидные клетки 2, представленные в коже, для продукции более высокого количества IL-4, который влияет на функцию и активность Th2-клеток, что приводит к еще более выраженному зуду кожи и, как следствие, усилению дисфункции кожного барьера [14, 15].
Дупилумаб уменьшает выраженность зуда кожи, непосредственно блокируя IL-4Rα, хотя снижения количества интраэпидермальных нервных волокон в коже больных не отмечалось [15].
После прекращения лечения концентрация дупилумаба в сыворотке крови постепенно снижается. Полное выведение активного вещества из организма отмечается через восемь – десять недель [16]. При этом две трети пациентов нуждаются в возврате к приему иммуносупрессоров через 40 недель, что связывают с изменением баланса Th2/Th17 и ILC2/ILC3 [17].
Влияние дупилумаба на клинические проявления АтД не зависит от пола, возраста и истории лечения пациентов [2, 5].
Методы оценки эффективности
Степень тяжести АтД клиницисты оценивают в основном по выраженности кожных поражений, зуда и нарушению сна, ежегодной частоте обострений заболевания, ответу на лечение и т.д. Дополнительно используют различные инструментальные методы, предназначенные для измерения степени тяжести заболевания, например индекс распространенности и тяжести экземы (Eczema Area and Severity Index – EASI) и шкалу общей оценки заболевания исследователем (Investigator's global assessment – IGA) (табл. 1) [2, 5, 15].
Не так давно были предложены более простые составные показатели, в частности анкета для пациент-ориентированного измерения экземы (Patient-Oriented Eczema Measure – POEM). Она включает семь вопросов, касающихся симптомов заболевания и частоты их проявления. Анкету еженедельно заполняет родитель или сам пациент [18].
Согласно протоколам исследований, цель лечения АтД считалась достигнутой, если получен клинически значимый ответ на 16-й неделе использования препарата: улучшение кожных симптомов по IGA – ноль или один балл (чистая или почти чистая кожа) (первичная точка), и оптимальной в отсутствие или при легких/минимальных проявлениях болезни через шесть месяцев и один год и/или снижении не менее 75% по EASI по сравнению с исходным уровнем (вторичная конечная точка) [1, 5, 6]. Неуспешным считается ответ, если терапия дупилумабом в течение трех месяцев и более не привела к снижению EASI более чем на 50% или в процессе лечения отмечались выраженные обострения АтД. Параллельно учитывают нежелательные явления, развившиеся на фоне применения препарата.
Доказано, что концентрации препарата или IL-4 и IL-13 в сыворотке крови не могут быть использованы для оценки эффективности или принятия решения о прекращении терапии [15–17].
Эффективность и безопасность у детей с атопическим дерматитом
В мире дупилумаб используют для лечения детей с АтД в возрасте от шести лет с 2017 г., в России – с 2019 г., с июня 2023 г. возрастные ограничения по применению дупилумаба были снижены – его можно назначать детям старше шести месяцев.
Дупилумаб значительно снижает тяжесть течения АтД и связанных с ним симптомов независимо от фенотипа заболевания и уровня общего IgЕ. Согласно результатам ряда исследований, у большинства детей от шести месяцев до 18 лет показатели тяжести заболевания достигли IGA 0–1, EASI-75, улучшилась оценка POEM и зуда кожи, определяемого как снижение на четыре пункта среднего еженедельного значения NRS-pruritus [2, 19–21].
В одной из последних работ E. Kamphuis и соавт. установлено, что среди 61 ребенка в возрасте от шести до 18 лет со средним и тяжелым течением АтД, получавших дупилумаб, на 28-й неделе 75,4, 49,2 и 24,6% достигли EASI-50, EASI-75 и EASI-90 соответственно и 36,1% – IGA 0–1 (почти чистая кожа) [22]. Улучшение на четыре балла и более по POEM и шкале зуда отмечалось у 84,7 и 45,3% детей соответственно. В работе S. Balboul и соавт. отмечено, что у всех 512 детей в возрасте от шести до 11 лет значительно улучшились показатели EASI, SCORAD, P-NRS, IGA и C-DLQI относительно исходных при использовании дупилумаба до шести недель [23].
Доказано, что при лечении дупилумабом ни у младенцев, ни у взрослых не требуется лабораторный мониторинг показателей крови, функции печени, почек и т.д. [24].
Среди нежелательных явлений дупилумаба чаще указывают офтальмологические, например сухость и зуд, конъюнктивит, блефарит, кератит (у 4–27% больных АтД), эритему лица и реакции в месте введения инъекции [2, 5–8, 23, 24].
После семи лет применения дупилумаба появились сообщения о таких парадоксальных осложнениях, как псориазоформный дерматит, в том числе у детей, артриты разной локализации, ангиоотек [2, 7, 8]. Их развитие объясняют тем, что ингибирование Th2-опосредованного пути с помощью дупилумаба может ухудшить Th1/Th17-зависимые иммунные реакции.
Согласно данным пятилетнего ретроспективного исследования, проведенного A. Blauvelt и соавт., лечение дупилумабом не связано с риском развития первичного или рецидивов злокачественного заболевания у больных АтД [25].
Как показывают наблюдения, через несколько недель после прекращения приема дупилумаба симптомы ухудшаются [26] и лишь у половины взрослых после 16 недель монотерапии удается достичь чистой или почти чистой кожи [5, 6, 13]. В работе Р. McKenzie и соавт. из 192 детей, которые получали дупилумаб, 16 прекратили терапию через три месяца и более из-за неадекватного ответа [6].
Перед принятием решения об отмене дупилумаба следует оценить приверженность пациента рекомендациям по базовой терапии и мерам по снижению/удалению триггеров АтД [1, 2], а также исключить наличие заболеваний, имитирующих АтД, прежде всего псориаз, аллергический контактный дерматит, Т-клеточную лимфому, инфекции кожи [27].
Пока не выявлено маркеров, способных предсказать долгосрочную ремиссию после отмены дупилумаба. Возможность временного прекращения приема препарата следует рассматривать примерно через шесть месяцев после достижения ремиссии АтД, состояния, при котором течение заболевания контролируется с помощью проактивной терапии тГКС или ингибиторами кальциневрина. Согласно данным S. Miyamoto и соавт., у трети взрослых пациентов в среднем через 12–15 недель после отмены дупилумаба требовалось возобновление его введения [17]. После 12 недель лечения подростков в возрасте от 12 до 18 лет с недостаточно контролируемым АтД умеренной и тяжелой формы у 57% примерно через 18 недель имел место рецидив АтД, что свидетельствовало о необходимости непрерывного введения препарата в утвержденной дозе два раза в месяц [25]. Неоднородность терапевтического эффекта, в том числе успешности ответа, у больных АтД не связана с концентрацией дупилумаба в сыворотке крови после 16 недель лечения или побочными эффектами препарата [28]. В случае недостаточного эффекта на ГИБП пациенту следует подобрать другие варианты лечения: сочетать дупилумаб с системными препаратами (у взрослых – с циклоспорином А или другими иммуносупрессантами) или назначить ингибиторы янус-киназ аброцитиниб или упадацитиниб, которые разрешены к применению с 12 лет [29].
Клинический случай
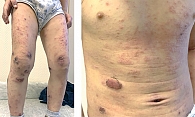
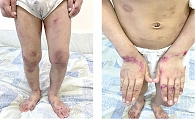
Пациент К. 2016 г.р. Мама ребенка обратилась к аллергологу-иммунологу в «СМ-клинику» (Москва) в ноябре 2021 г. с жалобами на распространенные кожные высыпания, в том числе на конечностях, туловище, лице, периодически в виде мокнутия, образования корочек, сопровождающиеся выраженным и постоянным зудом, нарушением сна (рис. 1). Для лечения сыпи были применены многие средства, включая тГКС, однако кожный зуд и нарушения сна сохранялись. Врач назначил крем, содержащий бетаметазон, гентамицин и клотримазол, который надо было наносить два раза в сутки в течение десяти дней, затем – ингибитор кальциневрина такролимус 0,03%-ный два раза в сутки в течение трех недель, далее – один раз длительно, а также метилпреднизолона ацепонат в виде эмульсии, учитывая большую площадь поражения кожи, которую надо было использовать два раза в неделю на фоне очищения и увлажнения кожи средствами дерматокосметики и рекомендовал ближе к шести годам начать системную терапию Дупиксентом. Через четыре месяца после назначенного лечения отмечено незначительное улучшение состояния (рис. 2).
Для дальнейшего обследования и коррекции лечения 12 февраля 2022 г. ребенок поступил в аллергологическое отделение ФГБУ «Федеральный научно-клинический центр детей и подростков» ФМБА России (ФНКЦ детей и подростков) (Москва).
От мамы пациента было получено информированное согласие.
Анамнез жизни: отягощенная наследственность по аллергическим и дерматологическим заболеваниям – у тети по материнской линии – поллиноз, у отца – псориаз. Ребенок от первой беременности, протекавшей на фоне тромбоцитопении, конфликта по АВ0, первых самостоятельных родов. Раннее развитие по возрасту.
Анамнез заболевания: первые кожные проявления отмечены в три месяца после контакта с березой (березовый веник) в виде генерализованной крапивницы, далее, по словам матери, появились единичные очаги сухости, гиперемии, зуд без четкой связи с чем-либо. С весны 2021 г. состояние кожи резко ухудшилось. На фоне диффузного поражения кожи появились очаги с вторичным инфицированием в виде экзематозных бляшек, мокнутия, корок. Амбулаторное лечение без эффекта. В 2021 г. выявлена сенсибилизация к аллергенам кошки (первый класс), березы (первый класс) (RIDA, Германия). После удаления из дома кошки зафиксировано некоторое улучшение кожных покровов.
Объективный осмотр: состояние неудовлетворительное, отмечаются постоянный зуд, эритематозные пятна и бляшки с лихенификацией на сгибах конечностей, запястьях и лодыжках, умеренные и тяжелые очаги поражения на спине и конечностях, на поверхности мокнутие, местами гиперпигментация, сухость кожи, папулы с геморрагическими корочками, линейные экскориации, дополнительные складки нижнего века (симптом Денни – Моргана) (см. рис. 2). Другие органы и системы без особых изменений.
До посещения ФНКЦ детей и подростков значения POEM составляли около 22 баллов, несмотря на последовательное использование топического ингибитора кальциневрина и тГКС два раза в неделю (табл. 2).
Клинический диагноз: атопический дерматит, распространенная форма, тяжелое, непрерывно-рецидивирующее течение, период обострения.
С учетом постоянно-рецидивирующего течения АтД у ребенка с отягощенным аллергологическим анамнезом, резистентностью к проводимой терапии, недостаточным контролем симптомов на фоне постоянного использования топических противовоспалительных средств принято решение назначить системную терапию. Поскольку на тот момент пациенту К. было пять лет десять месяцев, дупилумаб (препарат Дупиксент) был применен вне инструкции (off-lable) в начальной дозе 600 мг (две инъекции по 300 мг). Препарат вводили каждые четыре недели в дозе 300 мг.
Через месяц от начала терапии у пациента К. заметно улучшился кожный процесс (уменьшился зуд кожи), а также нормализовался сон. Параллельно ребенок получал 0,03%-ный такролимус один раз в день. Данное средство было назначено на длительный срок.
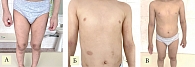
При мониторировании состояния через один, два и три месяца на фоне использования дупилумаба зафиксировано последовательное и все более выраженное улучшение кожного процесса и сохранение положительной динамики в течение длительного времени (рис. 3А и Б). Лечение не сопровождалось какими-либо побочными эффектами, что подтверждено клинически и лабораторно (гемограммы, биохимия крови и общий анализ мочи). Напротив, исходно высокое количество эозинофилов в периферической крови (6%) через месяц нормализовалось и в процессе лечения не увеличивалось. В дальнейшем у ребенка периодически отмечались эпизоды обострения дерматита без выраженного зуда и нарушения сна. В начале июля 2022 г. появились зуд в глазах и ринорея, выраженность которых снизилась на фоне приема антигистаминного препарата. При этом исследование от декабря 2022 г. на специфические IgE к пыльце трав (АлкорБио) было отрицательным. Через 20 недель общая оценка симптомов АтД по РОЕМ составила два балла, что в 11 раз меньше исходного уровня (см. табл. 2).
В течение курса лечения у пациента К. отмечалось последовательное и прогрессирующее разрешение симптомов АтД (см. рис. 3В).
D.Sh. Macharadze, MD, PhD, V.A. Mukhortykh, PhD, H.А. Yanaeva, PhD
G.N. Gabrichevsky Research Institute for Epidemiology and Microbiology
Federal Research Center for Nutrition, Biotechnology, and Food Safety
Federal Scientific and Clinical Center for Children and Adolescents of the Federal Medical and Biological Agency
Republican Dermatovenerological Dispensary, Grosny
Contact person: Valeriy A. Mukhortykh, valera-89@yandex.ru
The article, based on literature data and the example of clinical observation, examines issues related to the effectiveness and safety of the first monoclonal antibody in the treatment of atopic dermatitis (AD) – dupilumab (Dup). Due to age restrictions in the use of immunomodulatory drugs in severe AD, Dup became the first alternative to systemic therapy.
The article also covers the issues of assessing the effectiveness of the drug using various scales (among them the most common are the EASI, IGA, POEM) at baseline and after 16 weeks of treatment, as well as the reasons for the ineffectiveness of Dup. After the start of use of the drug in the treatment of AD in 2017, descriptions of cases of previously unknown adverse events (in particular, Th17-associated diseases such as psoriasiform dermatitis, dupilumab-associated arthritis, facial erythema) appeared in the literature. The clinical observation of a patient with severe AD presents the results of his physical examination, laboratory tests, and the assessment of the clinical effectiveness of DUP was carried out using the POEM scale.
