Экзокринная недостаточность поджелудочной железы при сахарном диабете: выбор оптимального метода диагностики
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – изучить ассоциацию ЭНПЖ с сахарным диабетом и установить оптимальный метод ее диагностики.
Материал и методы. В исследование было включено 114 пациентов с сахарным диабетом (СД) 1 типа, 59 – с СД 2 типа, 17 – с латентным аутоиммунным диабетом взрослых (LADA). Контрольную группу (КГ) составили 25 обследованных.
Лабораторное исследование включало определение ферментов ПЖ (ПЭ-1, амилазы панкреатической, липазы, альфа-амилазы, карбоангидразы 2, желчной соль-зависимой липазы, альфа-амилазы 2).
Результаты. ЭНПЖ, или внешнесекреторная недостаточность ПЖ, определяемая по уровню ПЭ-1 менее 200 мкг/г, статистически значимо чаще выявлялась при СД 1 типа и LADA, чем при СД 2 типа и в отсутствие диабета. Группы СД 1 типа и LADA, СД 2 типа и КГ были сопоставимы по распространенности ЭНПЖ.
Выводы. При СД отмечается высокая встречаемость ЭНПЖ, а ПЭ-1 является одним из наиболее доступных и информативных ферментов для оценки внешнесекреторной функции ПЖ. Для коррекции ЭНПЖ показан панкреатин в минимикросферах в дозе 40 000–50 000 ЕД на основной прием пищи длительно или регулярными курсами.
Цель исследования – изучить ассоциацию ЭНПЖ с сахарным диабетом и установить оптимальный метод ее диагностики.
Материал и методы. В исследование было включено 114 пациентов с сахарным диабетом (СД) 1 типа, 59 – с СД 2 типа, 17 – с латентным аутоиммунным диабетом взрослых (LADA). Контрольную группу (КГ) составили 25 обследованных.
Лабораторное исследование включало определение ферментов ПЖ (ПЭ-1, амилазы панкреатической, липазы, альфа-амилазы, карбоангидразы 2, желчной соль-зависимой липазы, альфа-амилазы 2).
Результаты. ЭНПЖ, или внешнесекреторная недостаточность ПЖ, определяемая по уровню ПЭ-1 менее 200 мкг/г, статистически значимо чаще выявлялась при СД 1 типа и LADA, чем при СД 2 типа и в отсутствие диабета. Группы СД 1 типа и LADA, СД 2 типа и КГ были сопоставимы по распространенности ЭНПЖ.
Выводы. При СД отмечается высокая встречаемость ЭНПЖ, а ПЭ-1 является одним из наиболее доступных и информативных ферментов для оценки внешнесекреторной функции ПЖ. Для коррекции ЭНПЖ показан панкреатин в минимикросферах в дозе 40 000–50 000 ЕД на основной прием пищи длительно или регулярными курсами.






Введение
Поджелудочная железа (ПЖ) относится к железам смешанной секреции и выполняет одновременно эндо- и экзокринную функцию. Между экзокринной и эндокринной частями ПЖ существует тесное анатомо-физиологическое взаимодействие, поэтому нарушение функций одной из них всегда будет отражаться на функциях другой.
При сахарном диабете (СД) большинство исследований посвящены только эндокринному компоненту ПЖ. Работы о внешнесекреторной функции органа разнонаправленны и противоречивы.
Проявления внешнесекреторной недостаточности ПЖ при СД в большинстве исследований обозначены как экзокринная недостаточность ПЖ (ЭНПЖ). Это общее название процесса мальабсорбции, вызванного неадекватной продукцией и сниженной активацией ферментов ацинарных клеток ПЖ, таких как амилаза, липаза и протеаза, необходимых для переваривания пищи [1–3].
Экзокринная недостаточность ПЖ может быть первичной и вторичной. Первичная обусловлена нарушением или утратой функции самого органа, тогда как вторичная – нарушением условий работы ферментов в двенадцатиперстной кишке. При сахарном диабете чаще встречается первичная ЭНПЖ [4].
Экзокринная функция ПЖ может оцениваться с помощью прямых, непрямых и фекальных тестов. В большинстве исследований для определения внешнесекреторной функции ПЖ использовали уровень панкреатической эластазы 1 (ПЭ-1). Анализ уровня данного фермента имеет некоторые преимущества перед другими тестами ввиду отсутствия необходимости поддержания специальной диеты, а также высокой чувствительности при бессимптомных проявлениях патологии [5, 6]. Определение содержания ПЭ-1 возможно и без отмены ферментативной терапии вследствие специфичности по отношению к человеческой эластазе. В связи с этим данный анализ получил большее распространение в клинической практике [6–8].
Диагностируется ЭНПЖ при уровне ПЭ-1 менее 200 мкг/г. Особого внимания требует уровень ПЭ-1 менее 100 мкг/г. Результат может быть ложноаномальным при анализе водянистого кала, поэтому измерение должно проводиться на образце твердого или полутвердого кала.
Важно отметить, что в случае недоступности ПЭ-1 можно оценить нутритивный статус пациента. В него входят антропометрические показатели, клинические маркеры (абсолютное число лимфоцитов, концентрация гемоглобина), а также биохимические маркеры (общий белок, альбумин, преальбумин, трансферрин, железо, магний, цинк, жирорастворимые витамины, В12, фолиевая кислота). В пользу ЭНПЖ может свидетельствовать наличие двух из трех составляющих: жалобы пациента/симптомы мальабсорбции, изменение нутритивных маркеров и снижение фекальной эластазы. Оценка нутритивного статуса также важна для контроля за эффективностью ферментозаместительной терапии [4].
При СД существует несколько возможных причин, способных объяснить возникновение ЭНПЖ, – отсутствие трофического действия инсулина и, возможно, глюкагона, а также соматостатина на ацинарные клетки, аутоиммунное повреждение островковых клеток, вызывающее разрушение как эндокринной, так и экзокринной ткани, жировая инфильтрация ткани ПЖ или снижение экзокринной секреции как осложнение диабетической нейропатии [1, 2].
Материал и методы
Всего в исследование было включено 190 пациентов с СД, из которых 114 – с СД 1 типа, 76 – с СД 2 типа. В соответствии с критериями Всемирной организации здравоохранения (ВОЗ) 1999–2013 гг. диагнозы устанавливали по результатам лабораторных методов исследования и клинической картине.
В ходе предварительного обследования у 17 пациентов с изначальным диагнозом СД 2 типа были выявлены высокие уровни антител (АТ) к компонентам островковых клеток. Течение заболевания, в том числе на основании клинической картины, было идентифицировано как латентный аутоиммунный диабет взрослых (LADA). Согласно действующей классификации ВОЗ по СД, LADA не выделяется в отдельный тип диабета и многими исследователями расценивается как вариант течения аутоиммунного СД 1 типа. Пациенты с LADA (n = 17) не были исключены из исследования, поэтому была сформирована дополнительная группа – группа LADA.
Контрольную группу (КГ) составили 25 здоровых добровольцев без ранее выявленных нарушений углеводного обмена.
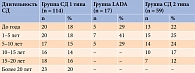
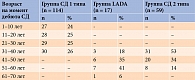
Пациенты были разделены на группы с целью оценки зависимости и влияния длительности и возраста дебюта СД на структурно-функциональные изменения ПЖ (табл. 1 и 2).
Критерии соответствия
Критерии включения и исключения для лиц с СД 1 типа, LADA и СД 2 типа были одинаковыми.
Критерии включения:
- возраст от 18 до 65 лет;
- индекс массы тела (ИМТ) от 18 до 35 кг/м2.
Критерии исключения:
- тяжелая печеночная недостаточность или наличие воспалительных заболеваний ПЖ;
- онкологические заболевания печени и ПЖ в анамнезе;
- период беременности и лактации;
- наличие в диагнозе гастроинтестинальной формы автономной диабетической нейропатии.
Критерии включения и исключения для лиц контрольной группы были следующие.
Критерии включения:
- отсутствие ранее известных нарушений углеводного обмена;
- возраст от 18 до 65 лет;
- ИМТ от 18 до 35 кг/м2.
Критерии исключения:
- тяжелая печеночная недостаточность или наличие воспалительных заболеваний ПЖ;
- онкологические заболевания печени и ПЖ в анамнезе;
- период беременности и лактации;
- уровень АТ к компонентам островковых клеток (АТ к транспортеру цинка 8 (ZnT8), тирозинфосфатазе (IA-2), глутаматдекарбоксилазе (GAD), поверхностным антигенам (ICA)) выше референсного интервала;
- выявленные нарушения углеводного обмена (уровень гликированного гемоглобина (HbA1c) более 6,0% или значения глюкозы венозной крови более 6,1 ммоль/л).
Определение антропометрических показателей
Для всех пациентов проведены оценка антропометрических показателей (рост и масса тела) утром натощак, а также сбор данных о длительности и возрасте дебюта диабета.
Рост измеряли с точностью до 0,1 см, массу тела – с точностью до 0,1 кг. Индекс массы тела рассчитывали по соотношению массы тела, выраженной в килограммах, к квадратному значению роста, выраженному в метрах (кг/м2). Расчет площади поверхности тела (ППТ) осуществлялся по формуле Мостеллера.
Оценка уровня ферментов поджелудочной железы
Лабораторное исследование включало определение уровня ферментов ПЖ (ПЭ-1, амилазы панкреатической (АП), липазы, альфа-амилазы (А-А), карбоангидразы 2 (КА-2), желчной соль-зависимой липазы (ЖСЗЛ), альфа-амилазы 2 (А-А-2)). Взятие образцов проводилось из кубитальной вены строго утром натощак. За весь период работы оборудование, методики и производители реагентов не менялись.
Определение уровня ПЭ-1 осуществлялось методом иммуноферментного анализа с использованием поликлональных антител, распознающих эпитопы эластазы (Bioserv Diagnostics GmbH, Германия). Уровни АП, А-А и липазы измеряли на автоматическом биохимическом анализаторе Architect c8000 (Abbott, США). Уровни А-А-2, КА-2, ЖСЗЛ определяли с помощью коммерческих иммуноферментных наборов Cloud-Clone Corp (Китай).
В норме уровень ПЭ-1 должен составлять не менее 200 мкг/г кала. При легкой степени панкреатической недостаточности наблюдаются значения в диапазоне от 100 до 200 мкг/г, при тяжелой – менее 100 мкг/г. Референсные значения для АП составили 9–53 Ед/л, липазы – 13–60 Ед/л, А-А – 25–125 Ед/л.
Статистический анализ
Статистическая обработка полученных данных проводилась с использованием прикладных программ STATISTICA (StatSoft inc., США, версия 13.0) и вебсайта VassarStats (vassarstats.net). Распределение количественных данных представлено в виде медианы и интерквартильного интервала (Ме [Q1; Q3]). Качественные признаки представлены в виде абсолютных (n) и относительных (%) частот. Частота распределения признаков оценивалась с помощью точного теста Фишера, хи-квадрат Пирсона и теста Фримана – Холтона. Для расчета доверительного интервала (ДИ) применялся метод Уилсона. Сравнение по количественным признакам проводили с использованием критериев Краскела – Уоллиса с тремя группами сравнения и более и U-теста Манна – Уитни для сравнения двух групп. С целью оценки межгрупповых различий применялся критерий Данна. Для установления корреляционной связи проводился ранговый корреляционный анализ Спирмена. Различия признавались статистически значимыми при p < 0,05. В случае множественных сравнений применялась поправка Бонферрони, а значения p в диапазоне между вычисленными и 0,05 интерпретировались как статистическая тенденция. Применялись post-hoc-тесты.
Результаты
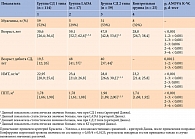
Лица мужского пола преобладали в группах СД 1 типа и СД 2 типа, а женского – в группах LADA и КГ (табл. 3). Статистически значимые различия по возрасту, ИМТ и ППТ выявлены между пациентами с СД 1 типа, LADA, СД 2 типа и относительно здоровыми лицам, а также по возрасту дебюта СД 1 типа, LADA и СД 2 типа.
Пациенты с LADA были статистически значимо старше, чем больные СД 1 и 2 типов, а также лица в КГ. Кроме того, страдающие СД 2 типа оказались статистически значимо старше, чем лица с СД 1 типа и относительно здоровые лица. При сравнении возраста в группе СД 1 типа и КГ статистически значимых различий не обнаружено.
Дебют СД 1 типа приходился на более ранний возраст по сравнению с возрастом дебюта СД 2 типа и LADA. При сравнении возраста дебюта СД 2 типа и LADA статистически значимых различий выявлено не было.
Установлено, что ИМТ у пациентов с СД 2 типа был статистически значимо больше, чем у больных СД 1 типа, LADA и лиц КГ.
Показано, что ППТ у пациентов с СД 2 типа была статистически значимо больше, чем у лиц с СД 1 типа, LADA и КГ. При сравнении значений ИМТ и ППТ при СД 1 типа, LADA и у относительно здоровых лиц статистически значимых различий не обнаружено.
Исследуемые группы были сопоставимы по уровням ЖСЗЛ, КА-2, А-А-2, липазы и А-А (табл. 4). В ходе проведенного анализа выявлены статистически значимые различия значений ПЭ-1 и АП при СД 1 типа, LADA, СД 2 типа и в отсутствие указанной патологии.
Значения ПЭ-1 и АП в КГ были статистически значимо выше, чем таковые в группах СД 1 типа, LADA и СД 2 типа. Статистически значимых различий по уровню ПЭ-1 и АП между группами СД 1 типа, LADA и СД 2 типа не установлено.
При анализе данных обнаружено, что ЭНПЖ, или внешнесекреторная недостаточность ПЖ, определяемая по уровню ПЭ-1 менее 200 мкг/г, статистически значимо чаще встречалась при СД 1 типа и LADA, чем при СД 2 типа и в отсутствие диабета (табл. 5). Группы СД 1 типа, LADA и СД 2 типа, а также КГ были сопоставимы по распространенности ЭНПЖ.
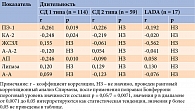
У пациентов с СД 1 типа при ПЭ-1 более или менее 200 мкг/г не выявлено статистически значимых различий уровней других ферментов ПЖ (табл. 6).
Проведенный с целью оценки влияния длительности течения СД на уровень ферментов ПЖ корреляционный анализ показал отсутствие статистически значимой связи, однако наблюдалась статистическая тенденция к корреляции между уровнями ПЭ-1, КА-2, АП и длительностью СД 1 типа (табл. 7).
С учетом выявленной статистической тенденции был проведен межгрупповой анализ данных показателей в зависимости от длительности заболевания, однако статистически значимых различий получено не было (табл. 8).
При СД 1 типа выявлена статистическая тенденция к корреляционной связи между уровнями АП и липазы и возрастом дебюта заболевания (табл. 9).
Уровень АП при возрасте дебюта СД 1 типа от года до десяти лет был статистически значимо ниже, чем при дебюте заболевания с 21 года до 30 лет (табл. 10).
Обсуждение
Причиной отсутствия общего систематизированного подхода к диагностике экзокринной функции ПЖ при СД является недостаточный объем проведенных в нашей стране исследований, посвященных данной проблеме. Подобная ситуация складывается и во всем мире. Так, проведен ряд исследований внешнесекреторной функции ПЖ при СД, однако они разнонаправленны и их результаты противоречивы. Не до конца определены критерии оценки структурных и функциональных изменений экзокринной части ПЖ.
По большей части обследование пациентов с СД ограничивалось определением нескольких ферментов ПЖ и проведением ультразвукового исследования. Однако клиническая симптоматика развивается лишь при снижении экзокринной функции более чем на 90%. Зачастую недостаточное усвоение питательных веществ, вызванное снижением функции ПЖ, может быть причиной нарушения углеводного обмена, а именно развития эпизодов гипогликемии.
За последние пять – семь лет большое количество исследователей по всему миру обращают внимание на проблему нарушения экзокринной функции ПЖ при СД. В большинстве научных трудов термин ЭНПЖ применяется к ситуации, сопровождающейся снижением уровня панкреатической (фекальной) эластазы 1 менее 200 мкг/г кала. Уровень ПЭ-1 более 200 мкг/г исключает ЭНПЖ при СД с высоким отрицательным прогностическим значением, однако уровень менее указанного порога связан с ложноположительными показателями вплоть до 11% случаев [2, 5, 9, 10]. Установлено, что распространенность ЭНПЖ у пациентов с СД 1 типа варьируется от 25 до 59%, при этом у 11–30% уровень ПЭ-1 составляет менее 100 мкг/г, что свидетельствует о выраженной степени внешнесекреторной недостаточности [2, 5, 11–13].
В нашем исследовании снижение значения ПЭ-1 менее 200 мкг/г выявлено у 40% пациентов с СД 1 типа, у 41% – с LADA, у 17% – с СД 2 типа. В КГ нарушений экзокринной функции ПЖ не обнаружено. Уровни ПЭ-1 и АП в группах СД 1 типа, LADA и СД 2 типа также были ниже, чем в КГ, но сопоставимыми между первыми тремя. Однако уровни ЖСЗЛ, КА-2, А-А-2, липазы и А-А при СД были аналогичны таковым в отсутствие диабета.
Последствиями внешнесекреторной недостаточности ПЖ являются нарушение всасывания жирорастворимых витаминов (A, D, E и K), дефицит кальция, фолиевой кислоты, магния, тиамина и цинка, а также более высокая частота эпизодов постпрандиальной гипогликемии по сравнению с пациентами без ЭНПЖ [14, 15].
В целом связь между экзокринной функцией ПЖ и СД 1 типа остается неясной. Распространенность внешнесекреторной недостаточности ПЖ, определяемая прямыми или косвенными функциональными пробами, действительно выше у пациентов с СД 1 типа, чем у относительно здоровых лиц. Однако изменения со стороны экзокринной части ПЖ могут предшествовать возникновению СД 1 типа. Это позволяет предположить, что экзокринная и эндокринная дисфункции могут иметь сходный патогенез [2, 16, 17].
Ацинарные клетки содержат гранулы зимогена, в которых хранятся несколько проферментов, таких как протеазы, липазы и амилазы. После расщепления и попадания в проток поджелудочной железы они достигают двенадцатиперстной кишки в активной форме. Существует мнение, что у пациентов с СД 1 типа нарушен данный физиологический процесс [18]. В одном из исследований сообщалось о связи между ЭНПЖ при СД и изменением состава и разнообразия кишечной микробиоты. Так, Prevotella и Bacteroides чаще обнаруживались у больных со сниженной экзокринной функцией ПЖ в сочетании с СД [19]. Гипотеза о том, что внешнесекреторная недостаточность ПЖ является результатом осложнения микроангиопатии, исследуется с 1960-х гг. [20]. Ряд симптомов, связанных со снижением экзокринной функции ПЖ, схож с проявлениями гастроинтестинальной формы автономной диабетической нейропатии. Такие симптомы, как ощущение переполнения желудка после приемов пищи, тошнота, чередование диареи и запоров, ночная диарея, зачастую могут иметь место и при внешнесекреторной недостаточности ПЖ. ЭНПЖ может быть как причиной, так и следствием диабетической нейропатии [11, 21]. В других работах описана связь между ангиопатиями и наличием ЭНПЖ, определяемой по уровню ПЭ-1 [21, 23].
Корреляция внешнесекреторной недостаточности ПЖ с длительностью СД как подтверждается [24, 25], так и опровергается [26, 27]. Мнение зарубежных авторов также противоречиво в отношении корреляции между значениями ИМТ и ЭНПЖ [2, 25, 27].
Нами отмечена тенденция к обратной корреляции уровней ПЭ-1, КА-2, АП с длительностью СД 1 типа, однако при сравнении данных показателей в группах в зависимости от длительности заболевания статистически значимых различий не получено. В ходе исследования зафиксирована тенденция к снижению уровней АП и липазы с увеличением возраста дебюта СД 1 типа. Уровень АП у пациентов с дебютом СД 1 типа в возрасте до десяти лет был меньше, чем у лиц с дебютом заболевания после 20 лет.
Снижение экзокринной функции ПЖ при СД примерно в два – четыре раза чаще встречается у мужчин, чем у женщин, что, по мнению зарубежных ученых, может быть обусловлено более частым употреблением алкоголя среди мужской когорты и, как следствие, развитием субклинического хронического панкреатита [13, 24, 25]. Однако существует мнение об отсутствии корреляции между развитием внешнесекреторной недостаточности ПЖ и полом пациентов [27]. Некоторые авторы не связывают употребление алкоголя и табака с развитием экзокринной дисфункции у пациентов с СД 1 типа [12, 27].
Необходимость определения при СД нарушений экзокринного компонента ПЖ, для которых наличие сопутствующей клинической симптоматики считается редким и нехарактерным признаком, является задачей не только гастроэнтерологов, но и эндокринологов, диабетологов. Данная необходимость – отражение сложной связи между эндокринными и экзокринными нарушениями, затрагивающими поджелудочную железу и, безусловно, влияющими друг на друга, ведь до конца еще непонятно, какое из этих нарушений является первичным.
Сегодня для коррекции ЭНПЖ показан панкреатин в минимикросферах, менее 2 мм, в дозе 40 000–50 000 ЕД на основной прием пищи и в дозе 10 000–25 000 ЕД на перекус. Длительность терапии определяется типом панкреатической недостаточности. Так, при первичной ЭНПЖ, что наиболее характерно при СД 1 и 2 типов, показана пожизненная терапия минимикросферами панкреатина, при вторичной ЭНПЖ, которая, как правило, отмечается при СД 2 типа, – терапия регулярными курсами от 30 дней. В сложных, неоднозначных ситуациях возможна эмпирическая ферментозаместительная терапия на срок четыре – шесть недель. Ответ на терапию будет являться дополнительным подтверждением диагноза. В этот период будет возможность облегчить состояние пациента и провести всю необходимую диагностику ЭНПЖ. Контроль терапии осуществляется каждые шесть месяцев с оценкой клинической картины и нутритивных маркеров. Денситометрия проводится один раз в год.
Выводы
На сегодняшний день ПЭ-1 является одним из наиболее доступных и информативных ферментов для определения внешнесекреторной функции ПЖ. При сахарном диабете особое внимание следует обращать на экзокринную функцию ПЖ ввиду возможности развития эпизодов гипогликемии после приемов пищи.
Сниженная экзокринная функция поджелудочной железы отмечается не только при длительном течении СД, но и при его стаже менее года. Выявлена также тенденция к более низким значениям ферментов ПЖ у пациентов с дебютом СД 1 типа в более раннем возрасте. При LADA и СД 2 типа аналогичной корреляции не прослеживается.
Источник финансирования
Исследование выполнено на средства гранта Российского научного фонда № 17-75-30035 «Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркеры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация».
Конфликт интересов
Авторы заявляют об отсутствии явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
M.R. Ragimov, PhD, T.V. Nikonova, MD, PhD
Moscow Regional Research and Clinical Institute
National Medical Research Center for Endocrinology
Contact person: Magomedkerim R. Ragimov, tga.endocrine@gmail.com
Exocrine pancreatic insufficiency (EPI) in diabetes mellitus is the general name for the malabsorption process caused by inadequate production and reduced activation of pancreatic acinar enzymes, such as amylase, lipase and protease, necessary for the digestion of meal. Exocrine pancreatic function can be assessed mainly using invasive, non-invasive and fecal tests. Most studies have used pancreatic elastase-1 (PE-1) levels to assess pancreatic exocrine function. EPI is determined when the enzyme level is less than 200 μg/g, and the level of PE-1 is less than 100 μg/g requires special attention.
Objective – to study the association between EPI and diabetes mellitus and to find EPI optimal diagnostic instruments.
Material and methods. The study included 114 patients with type 1 diabetes mellitus (T1DM), 59 with type 2 diabetes mellitus (T2DM), 17 with latent autoimmune diabetes of adults (LADA). The control group (CG) consisted of 25 subjects.
Laboratory examination included the determination of: pancreatic enzymes (PE-1, pancreatic amylase, lipase, alpha-amylase, carbonic anhydrase-2, bile salt-dependent lipase, alpha-amylase-2).
Results. EPI, or exocrine pancreatic insufficiency, defined by the level of PE-1 less than 200 μg/g, was statistically significantly more often detected in T1DM and LADA than in T2DM and in the CG. Groups DM1 and LADA, DM2 and CG were comparable to each other in terms of the prevalence of EPI.
Conclusions. In diabetes, there is a high prevalence of EPI, and PE-1 is one of the most accessible and informative enzymes for determining the exocrine function of the pancreas.
