Комбинированная иммунотерапия при метастатической увеальной меланоме. Опыт одного центра
- Аннотация
- Статья
- Ссылки
- English




Введение
Увеальная меланома (УМ) – первичная внутриглазная злокачественная опухоль, развивающаяся из меланоцитов радужки (3–5% случаев), цилиарного тела (5–8% случаев) или сосудистой оболочки (приблизительно 85% случаев) [1, 2]. Это редкое заболевание с частотой встречаемости примерно 1 случай на 100 тыс. человек в год в Европе или от 5,3 до 10,9 случая на 1 млн человек в год в мире [3]. В то же время УМ является и наиболее распространенной злокачественной первичной внутриглазной опухолью среди взрослого населения. К факторам риска развития увеальной меланомы относят светлую кожу, врожденный меланоз глаз и меланоз [4].
Несмотря на относительно неплохие результаты по лечению первичной увеальной меланомы, почти у 50% пациентов развивается метастатическое поражение. Клинические признаки метастатического поражения обнаруживаются при первичном обращении и диагностике первичной опухоли менее чем в 1% всех случаев [5]. При долгосрочном наблюдении у пациентов, получивших лечение, метастазы обнаруживают в 31% случаев в течение пяти лет, в 45% – в течение 15 лет и почти в 50% – в течение 25 лет [6]. При прогрессировании и появлении отдаленных метастазов общая выживаемость (ОВ) в течение одного года составляет 13–40% [7, 8]. По данным метаанализа, медиана ОВ при метастатической увеальной меланоме составляет от 10,2 месяца до 1,07 года [9, 10].
Чаще всего метастазы УМ обнаруживают в печени (89% всех случаев) [7]. Метастазы в печени часто являются единственным обнаруживаемым проявлением IV стадии заболевания. По причине отсутствия лимфатических сосудов в сосудистой оболочке и склере глаза первичная увеальная меланома распространяется почти исключительно гематогенным путем [11–13].
По данным проспективных рандомизированных исследований, различные локальные методы лечения, такие как хирургическое вмешательство, интраартериальная химиотерапия печени, трансартериальная химиоэмболизация, изолированная химиоперфузия печени и селективная внутренняя радиотерапия (SIRT), не оказывают влияния на ОВ пациентов с метастазами увеальной меланомы [14]. К сожалению, системная химиотерапия при метастатической увеальной меланоме также не влияет на ОВ [15]. Частота объективных ответов (ЧОО) составляет менее 5% [16].
К настоящему времени хорошо известно, что биология опухоли и клиническая картина увеальной меланомы и меланомы кожи различны. Так, примерно в 83% случаев первичной увеальной меланомы наблюдаются мутации в G-протеин-α-субъединице GNAQ или GNA11, что приводит к активации MAPK, PI3K/Akt, YAP и других сигнальных путей [17–19]. Однако попытки воздействия на мишени этих путей пока не принесли положительных результатов. При меланоме кожи наиболее частой мутацией является мутация в гене BRAF. Также, несмотря на различия увеальной меланомы и меланомы кожи, они часто имеют одни и те же специфические антигены (например, тирозиназу и gp100) [1]. Этот факт лег в основу клинических исследований при метастатической увеальной меланоме, например исследования молекулы ImmTAC gp100-202. В 2021 г. на конференции AACR (American Association for Cancer Research) были представлены результаты III фазы клинического исследования по применению тебентофаспа среди пациентов с метастатической увеальной меланомой. Первичной конечной точкой данного исследования была оценка ОВ. Медиана общей выживаемости составила 22 месяца в подгруппе пациентов, получавших тебентофасп, по сравнению с 16 месяцами в подгруппе пациентов, получавших препарат по выбору исследователя (дакарбазин/пембролизумаб/ипилимумаб). Отмечено значимое снижение риска прогрессирования или смерти – на 49%, p < 0,001. Показатель однолетней ОВ составил 73,2% для пациентов, получавших тебентофасп, по сравнению с 58,5% [20] у пациентов из другой подгруппы. Однако данный вариант терапии подходит не для всех пациентов с метастатической меланомой, а только для пациентов с определенным подтипом главного комплекса гистосовместимости HLA (human leukocyte antigens).
В целях улучшения эффективности лечения больных УМ ведутся поиск и исследования новых биомаркеров [13]. Однако пока нет убедительных данных, позволяющих более обоснованно делать выбор терапии для конкретного пациента.
Незадолго до публикации результатов исследования IMC gp100-202 (ClinicalTrials.gov number NCT03070392) были получены впечатляющие для метастатической увеальной меланомы результаты лечения меланомы кожи с использованием комбинации ингибиторов контрольных точек иммунного ответа (ИКТИ).
В 2017 г. M.V. Heppt и соавт. сообщили о результатах лечения 96 пациентов с увеальной меланомой, получивших ИКТИ в режимах монотерапии анти-PD-1 (ниволумаб, пембролизумаб) и комбинированной иммунотерапии с применением ипилимумаба и ниволумаба. Большинство пациентов не получали предшествующего лечения или получали монотерапию ИКТИ (анти-PD-1) в качестве терапии первой линии. Пациенты, получившие комбинированную иммунотерапию (ИТ), были значительно моложе тех, кто получал монотерапию анти-PD-1. В группе монотерапии анти-PD-1-препаратами (ниволумаб или пембролизумаб) наблюдали ЧОО примерно 5%, выживаемость без прогрессирования (ВБП) составила примерно три месяца. Для группы комбинированной иммунотерапии ипилимумабом и ниволумабом ЧОО составила 17% при аналогичной ВБП в течение трех месяцев на фоне комбинированной иммунотерапии и при применении монотерапии анти-PD-1 ниволумабом зарегистрировали два случая частичного ответа (ЧО), а также один случай ЧО при применении пембролизумаба. Полных ответов отмечено не было. В группе лечения пембролизумабом у 4 (7%) пациентов зарегистрировали нежелательные явления (НЯ) 3-й степени и выше (артрит, аутоиммунный гепатит, кардиотоксичность и повышение уровня сывороточной липазы). У 3 (13%) пациентов из группы лечения ниволумабом зафиксировали НЯ 3-й степени и выше (колит, кардиотоксичность, артралгия и усталость). В результате развития НЯ у одного пациента наступила смерть. В группе комбинированной иммунотерапии у 2 (13%) пациентов наблюдались НЯ 3-й степени и выше (гипофизит, колит и тиреоидит) [21].
На конгрессе ESMO (European Society for Medical Oncology) в 2018 г. J.M. Piulats Rodriguez и соавт. представили последние данные промежуточного анализа проспективного открытого несравнительного многоцентрового исследования II фазы Испанской группы по меланоме (NCT02626962). Проанализированы результаты лечения 50 больных УМ с апреля 2016 г. по май 2017 г. Средний возраст пациентов в группе – 59 лет (26–84 года), 48% пациентов составляли мужчины. Группа в количестве 50 пациентов с метастастатической увеальной меланомой получала комбинированную иммунотерапию (ниволумаб + ипилимумаб). Метастатическое поражение печени обнаружили у 76% пациентов, внепеченочные метастазы – у 56%. ЧОО составила 12%, частота контроля заболеваемости (ЧКЗ) – 64%. Авторы отметили, что ВБП составила 3,3 месяца, а медиана ОВ – 12,7 месяца. НЯ 3-й степени или выше были зарегистрированы у 27 (54%) пациентов, включая кожную токсичность, гепатит, колит, неврологические нарушения, анемию, эндокринопатии, что привело к приостановке терапии в 9 случаях [22].
V. Karivedu и соавт. в 2019 г. провели ретроспективный анализ результатов лечения восьми больных метастатической увеальной меланомой. Пациенты получили комбинированную иммунотерапию ипилимумабом (3 мг/кг) и ниволумабом (1 мг/кг) каждые три недели в течение четырех циклов совместно с трансартериальной химиоэмболизацией и последующей поддерживающей терапией ниволумабом (240 мг). У пяти из восьми пациентов со стадией M1a продолжительность жизни с момента постановки диагноза метастатического заболевания до даты смерти/даты последнего наблюдения составила 12, 14, 16, 23 и 24 месяца соответственно. У остальных трех пациентов со стадией M1b продолжительность жизни составила 7, 15 и 30 месяцев соответственно. Из общей группы два пациента достигли ЧО, четыре – стабилизации заболевания, у двух пациентов наблюдалось прогрессирование заболевания. Медиана ОВ (от даты начала иммунотерапии до даты смерти/даты последнего наблюдения), рассчитанная по методике Каплана – Мейера, для восьми пациентов составила 14,2 месяца. У четырех из восьми пациентов наблюдался аутоиммунный колит (50%) [23].
Результаты самой большой ретроспективной когорты пациентов с метастатической увеальной меланомой (89 пациентов из 14 клинических медицинских центров), получивших комбинированную иммунотерапию ипилимумабом и ниволумабом, представили Y.G. Najjar и соавт. в 2020 г. [24].
Средний возраст пациентов на момент постановки диагноза составлял 53 года, а на момент начала лечения – 60 лет. Большинство пациентов (79%) были европейцами. На момент постановки диагноза у 93% пациентов не было обнаружено метастатического поражения. Пациенты получили в среднем три цикла комбинированной терапии ипилимумабом и ниволумабом. 37 (42%) пациентов получили четыре цикла ипилимумаба с ниволумабом, 18 (20%) – три цикла, 20 (22%) – два цикла и 14 (16%) пациентов – один цикл комбинированной иммунотерапии. Медиана наблюдения составила 9,2 месяца. 51 (57%) пациент прервал лечение: 29 – из-за токсичности, 18 – из-за прогрессирования, данные по четырем пациентам отсутствовали. 29 пациентов получали в дальнейшем поддерживающую терапию: 26 пациентов – ниволумабом, два – пембролизумабом и один – ипилимумабом. Среднее число курсов ниволумаба составило семь (диапазон 1–29 доз). Из 89 пациентов в этом исследовании у 1 (1%) пациента был достигнут полный ответ (ПО), у 9 (10%) – частичный ответ (ЧО), у 21 (24%) – стабилизация заболевания (СЗ) и у 55 (62%) – прогрессирование заболевания (ПЗ). Данные о результатах проведенного лечения не удалось получить для трех пациентов. ЧОО составила 11,6%, контроль заболеваемости – 36,0%. Медиана длительности ответа составила в среднем 6 (3,0–10,3) месяцев. 20 (22%) пациентов из общей когорты оставались без прогрессирования в течение шести месяцев. Длительный клинический эффект, определяемый как полный ответ, частичный ответ или стабилизация заболевания в течение шести месяцев или более, достигнут у 10 (11%) пациентов. Медиана ВБП – 2,7 месяца. При средней продолжительности наблюдения 9,2 месяца медиана ОВ с момента начала применения ипилимумаба с ниволумабом составила 15,0 месяца.
Интересно отметить отсутствие статистически значимой разницы в ОВ у пациентов, которые завершили три-четыре цикла терапии ипилимумабом в комбинации с ниволумабом, по сравнению с пациентами, получившими один-два цикла этой терапии. Также не было получено разницы в ВБП и ОВ между пациентами, которым ранее проводили локорегиональное (или системное) лечение либо применяли терапию стероидами по поводу развившегося НЯ.
Таким образом, анализ результатов лечения больных УМ показал, что использование ИКТИ может приводить к развитию НЯ и токсичности. Частота нежелательных явлений выше при комбинированном лечении ингибиторами PD-1 и CTLA-4 по сравнению с частотой возникновения побочных эффектов для любого из этих препаратов, используемых в режиме монотерапии. Но при этом комбинированная иммунотерапия на сегодняшний день – одна из самых эффективных опций для пациентов с метастатической увеальной меланомой, несмотря на свои скромные результаты. Эти результаты являются одними из лучших на сегодняшний день для данной категории пациентов.
Материал и методы
Данное исследование является опытом одного центра (НМИЦ онкологии им. Н.Н. Блохина) и представляет собой ретроспективный анализ результатов лечения с использованием комбинированной иммунотерапии ипилимумабом с ниволумабом среди пациентов с метастатической увеальной меланомой за период с 2019 по 2021 г. За этот период комбинированную иммунотерапию ипилимумабом и ниволумабом получили 38 пациентов с метастатической увеальной меланомой, из них в окончательный анализ эффективности были включены 33 пациента.
Режим лечения предусматривал проведение комбинированной иммунотерапии по схеме: ипилимумаб 3 мг/кг + ниволумаб 1 мг/кг один раз в 21 день в/в капельно с последующей терапией анти-PD-1 – ниволумаб 3 мг/кг или 240 мг один раз в 14 дней в/в капельно.
Статистический анализ и визуализация полученных данных проводились с использованием среды для статистических вычислений R 4.1.0 (R Foundation for Statistical Computing, Вена, Австрия).
Описательные статистики для количественных переменных представлены в виде среднего (стандартное отклонение) и медианы (первый и третий квартили), для качественных переменных – в виде наблюдаемого числа наблюдений (относительная частота). Анализ выживаемости проводился с использованием метода Каплана – Мейера.
Результаты
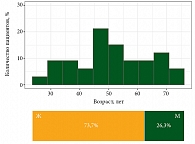
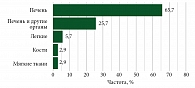
Средний возраст пациентов составил 51 год, медиана возраста – 51,2 (40,0‒60,6) года. Среди участников было 28 (73,7%) женщин, 10 (26,3%) мужчин (рис. 1). 35 (92,1%) пациентов имели метастатические проявления на момент включения в исследование. На рис. 2 показана локализация метастатических очагов.
Медиана наблюдения от момента первичного лечения по поводу увеальной меланомы составила 45,7 (31,2‒69,3) месяца.
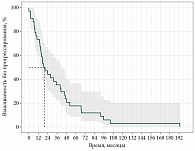
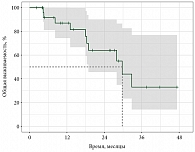
Медиана времени до прогрессирования составила 19,8 месяца (95% доверительный интервал (ДИ) 15,5–41,0) (рис. 3).
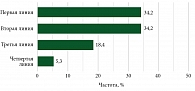
Из 38 пациентов, включенных в анализ, 13 (34,2%) получили комбинированную иммунотерапию в рамках первой линии терапии. Как видно из табл. 1, другими опциями первой линии терапии были химиотерапия (12/31,5%), монотерапия анти-PD-1 (5/13,1%) и др. Данное разнообразие еще раз подчеркивает отсутствие стандартов терапии первой линии для пациентов с метастатической УМ.
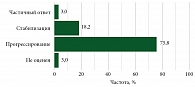
Оценить эффективность первой линии терапии удалось у 33 пациентов (данные для оценки эффективности были доступны в медицинской документации). Частичный ответ был зарегистрирован у 3%, стабилизация заболевания – у 18,2%.
На рисунке 4 представлены результаты оценки эффективности терапии в первой линии (n = 33).
Медиана ОВ от момента прогрессирования составила 29,7 месяца (нижняя граница 95% ДИ – 18,9) (рис. 5, табл. 2).
Дополнительно была проведена оценка эффективности в зависимости от варианта терапии, и в данном случае мы видим преимущество комбинированной иммунотерапии. Комбинированная иммунотерапия позволила добиться контроля над заболеванием у трети пациентов – 30,8%, включая один частичный ответ (табл. 3).
В таблице 4 представлены результаты оценки эффективности терапии среди пациентов, получавших комбинированную иммунотерапию в первой линии.
По данным первичной медицинской документации была проведена оценка безопасности терапии. Оценить развитие НЯ удалось среди семи пациентов, у одного пациента не было зарегистрировано НЯ, у трех пациентов были описаны явления 1–2-й степени в виде повышения температуры тела, общей слабости, лейкопении 1-й степени и нейтропении 2-й степени. У трех пациентов зарегистрирована токсичность 3–4-й степени – два случая аутоиммунного гепатита и один случай аутоиммунного колита, при этом индукционная фаза была завершена у всех трех пациентов.
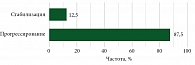
Во вторую и последующие линии комбинированная иммунотерапия была использована у 22 пациентов, у шести пациентов оценить клинический эффект не удалось в связи с проведением первого-второго циклов иммунотерапии и отсутствием данных по оценке эффективности в медицинской карте пациента (рис. 6).
В большинстве случаев (87,5%) было зарегистрировано прогрессирование заболевания, и лишь у 12,5% пациентов удалось достичь стабилизации заболевания.
Распределение пациентов в зависимости от линии терапии, в которую назначалась комбинированная иммунотерапия, представлено на рис. 7.
Как мы видим, наиболее часто данный режим лечения используется в рамках первой и второй линий терапии (68,4%) с примерно сопоставимыми результатами эффективности терапии.
Обсуждение
Метастатическая увеальная меланома по-прежнему характеризуется плохим прогнозом. Очевидно, иммунотерапия изменила парадигму лечения метастатической увеальной меланомы, но показатели выживаемости остаются неизменными на протяжении десятилетий.
Наша работа демонстрирует, что эффективность комбинированной иммунотерапии значительно ниже, чем для меланомы кожи. Это подтверждают данные других исследователей [21–24]. Иммунотерапия значительно улучшила прогноз у пациентов с меланомой кожи, но аналогичного клинического эффекта не наблюдается при метастатической увеальной меланоме. Ретроспективные исследования иммунотерапии у пациентов с УМ показали ЧОО в диапазоне 10–21% при комбинации ипилимумаба и ниволумаба, 3,6% при использовании анти-PD-1 и 5% при монотерапии ипилимумабом. Однако эффективность комбинированной иммунотерапии выше, чем при использовании других вариантов лекарственной терапии (монотерапии анти-PD-1, химиотерапии и др.) при увеальной меланоме. Вопрос о лекарственной терапии этих пациентов открыт в настоящее время, изучаются различные режимы и комбинации иммунотерапевтических препаратов, однако все еще не удалось добиться значительных успехов. Даже при использовании тебентафаспа удается достичь ЧОО лишь в 20%. Но данный вариант лечения доступен не во всех странах и не для всех пациентов, а только при определенном подтипе HLA.
В конце 2020 г. были представлены результаты исследования II фазы, куда вошли 35 пациентов, получавших комбинированную ИТ в рамках любой линии терапии. ЧОО составила 18%, включая один подтвержденный полный ответ и пять частичных ответов. Медиана ВБП составила 5,5 месяца (95% ДИ 3,4–9,5), а медиана ОВ – 19,1 месяца (95% ДИ 9,6 – до настоящего времени). У 40% пациентов были зарегистрированы НЯ 3–4-й степени. Эти показатели эффективности являются удручающими по сравнению с результатами исследования ChechMate 067 (комбинация ипилимумаба и ниволумаба у пациентов с метастатической меланомой кожи), в котором удалось достичь впечатляющей медианы ОВ – 72,1 месяца и ЧОО – 58%, а самое главное, значимого увеличения продолжительности жизни. Более 50% пациентов с метастатической меланомой кожи переживают шесть и более лет [25, 26].
В наше исследование вошли 38 пациентов, ЧОО вне зависимости от линии терапии составила 7,7%, медиана ВБП – два месяца (95% ДИ 1,1–3,1) и медиана ОВ – 28,3 месяца (нижняя граница 95% ДИ – 17,7). При сравнении с исследованием, представленным выше, несмотря на более низкие ЧОО и ВБП, в нашем исследовании мы наблюдаем более высокую ОВ, что подчеркивает важность применения ИКТИ у пациентов с УМ.
M.S. Pelster и соавт. удалось достичь даже одного полного ответа [27]. Но мы видим, что при использовании комбинированной иммунотерапии у пациентов с метастатической увеальной меланомой улучшились количественные показатели ОВ (при сравнении с историческими данными выживаемости пациентов с метастатической увеальной меланомой, не получавших ИКТИ).
Сегодняшние данные позволяют предположить, что наличие мутации SF3B (Splicing Factor 3 Subunit B1 (SF3B1)) может быть предиктором ответа на иммунотерапию. Приблизительно 25% всех УМ содержат драйверные мутации в гене, кодирующем фактор сплайсинга SF3B1, и хотя у пациентов с мутациями SF3B1 обычно наблюдается промежуточный риск развития метастатического заболевания, у трети из них развиваются ранние метастазы в течение пяти лет после постановки диагноза [28].
В недавнем многоцентровом ретроспективном анализе оценивались пациенты с мутациями SF3B1 после проведения иммунотерапии ингибиторами контрольных точек [29]. 58 пациентов с мутациями в гене SF3B1 получали иммунотерапию: монотерапию PD-1 – 15 пациентов, монотерапию CTLA-4 – четыре пациента, комбинированную иммунотерапию получили 15 пациентов. Среднее время от постановки первичного диагноза до метастазирования составило 6,1 года, у 29% пациентов была отмечена внепеченочная локализация метастатического процесса. 27% пациентов ранее получали системную терапию, а 35% пациентов была выполнена локальная терапия по поводу метастатического поражения печени. Медиана ОВ и однолетняя опухоль-специфическая выживаемость численно превосходили исторический контроль. Медиана ОВ для всех пациентов с момента метастазирования составила 3,9 года, а однолетняя ОВ с момента метастазирования – 94% [29]. Таким образом, представленные в этом исследовании данные позволяют сделать вывод о том, что пациенты с мутацией SF3B1, получающие ИКТИ, имеют более высокие показатели выживаемости. В подтверждении этому J. Bigot и соавт. продемонстрировали, что мутации SF3B1 генерируют общие неоантигены, которые уникально экспрессируются клетками УМ, что приводит к распознаванию и уничтожению специфическими CD8-T-клетками [30]. Это потенциально может объяснить более длительные показатели выживаемости при иммунотерапии и в целом у пациентов с мутацией SF3B1.
Заключение
Согласно имеющимся данным, комбинация ипилимумаба и ниволумаба представляет собой схему терапии, которую следует рассматривать как одну из основных опций среди доступных вариантов лечения пациентов с метастатической увеальной меланомой. При метастатической УМ отмечается невысокий уровень экспрессии PD-L1 и мутационной нагрузки и, соответственно, эти показатели могут играть лишь минимальную роль в качестве биомаркеров при выборе терапии. Возможно, наличие опухоль-инфильтрирующих лимфоцитов и статус мутации SF3B1 могут быть предикторами большей эффективности комбинированной иммунотерапии.
V.V. Nazarova, PhD, K.V. Orlova, PhD, I.A. Utyashev, PhD, A.A. Yarovoy, PhD, V.A. Yarovaya, PhD, I.G. Markina, PhD, G.Yu. Kharkevich, PhD, I.Zh. Shubina, PhD, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Center of Oncology
Hadassah Medical Moscow
S.N. Fedorov National Medical Research Center ‘Eye Microsurgery’
Contact person: Valeria V. Nazarova, jezerovel@gmail.com
Uveal melanoma (UM) is the most common intraocular tumor. Despite satisfactory results in the treatment of primary uveal melanoma, almost 50% of patients develop a metastatic lesion. Overall one-year survival in patients with metastatic uveal melanoma reaches 13–40%. Different survival rates are due to the clinical and biological features of uveal melanoma and different prognosis. There is still no standard therapy for metastatic uveal melanoma. Despite all the success achieved in the treatment of patients with metastatic skin melanoma, uveal melanoma is characterized by low sensitivity to drug therapy (whether it is modern immunotherapy with immune checkpoint inhibitors (ICTIs) or targeted or chemotherapy). However, despite the lower efficacy of combined immunotherapy in UM compared with the results for patients with skin melanoma, in recent years its positive role has been noted for UM patients, as well. According to various authors, despite the one-year survival rate of 30-50%, to date, the combination of ipilimumab and nivolumab is recognized as the most effective scheme among other ineffective therapy options. The paper presents the authors’ experience of combined immunotherapy in patients with metastatic uveal melanoma (n = 33) who were treated at the N.N. Blokhin National Medical Research Center of Oncology from 2019 to 2021.
